КЛАССИФИКАЦИЯ ВИЧ-ИНФЕКЦИИ
Проф. Е.С.Белозеров, д.м.н. Е.И.Змушко
Уже через год после появления заболевания было сформулировано определение болезни, основанное на клинических проявлениях, выявленных у больных гомосексуалистов. Заболевание включало ряд состояний, вызванных условнопатогенными возбудителями, что указывало на дефект в иммунной системе, лежащий в основе болезни в целом. В 1985 году определение болезни было пересмотрено в связи с расшифровкой этиологии заболевания. Тогда же эксперты ВОЗ для экономически слаборазвитых стран, не имеющих возможности широко внедрить этиологическую расшифровку болезни, разработали клинические критерии для постановки диагноза. Они включали: а) большие признаки: потеря массы тела > 10% от исходной, хроническая диарея в течение > 1 месяца, длительная лихорадка в течение > 1 месяца (постоянная или интермиттирующая); б) малые признаки: упорный кашель > месяца, генерализованный зудящий дерматит, герпес зостер в анамнезе, ротоглоточный кандидоз, хроническая прогрессирующая или диссеминированная, герпетическая инфекция (herpes simplex), генерализованная лимфаденопатия.
В 1987 году были внесены очередные изменения, к этому времени уже четко было определено, что заболевания, вызванные условнопатогенными возбудителями ассоциируются с последней стадией СПИДа. Определение 1987 года включает 23 СПИД-ассоциируемые заболевания. Группа экспертов ВОЗ предложила среди СПИД-индикаторных заболеваний выделять заболевания 1-й и 2-й категории (табл. 1). Если СПИД-индикаторные болезни первой категории позволяют диагностировать СПИД без лабораторного подтверждения, то при выявлении заболеваний второй категории СПИД можно лишь предполагать, но окончательно диагноз может быть подтвержден лабораторными тестами.
Таблица 1. СПИД-индикаторные заболевания
Заболевания I группы*
Заболевания II группы**
Примечания:
* для постановки диагноза СПИД не требуется лабораторное подтверждение
** для постановки диагноза требуется лабораторное подтверждение
В вопросе клинической классификации, оценке стадии болезни, определении понятий “СПИД-ассоциируемые заболевания”, “СПИД-индикаторные болезни”, “Стадия СПИД” много остается спорного, неоднозначно трактуемого и условного. К примеру, нет единства в определении состояний, расцениваемых как фаза “СПИД” и фаза “Пре-СПИД” или “СПИД-ассоциируемый комплекс”. Так у женщин шеечная дисплазия, тазовые воспалительные процессы и восходящие кандидозные вульвовагиниты, у наркоманов легочной туберкулез, эндокардит, сепсис и бактериальная пневмония обычно у инфицированных ВИЧ ассоциируют с глубоким иммунодефицитом и их правильнее расценивать как больных СПИДом, а не как ВИЧ-связанные состояния и уровень CD4+ лимфоцитов, превышающий показатель 200 клеток/ мм не должен довлеть в постановке диагноза. CDC (США) выступает против добавления новых ВИЧ-ассоциируемых состояний в определение понятий “СПИД”, так как по мнению специалистов Центра наиболее объективный критерий - количество Т-хелперов, а не клинические критерии, ибо многие из этих состояний часто встречаются у лиц, не инфицированных ВИЧ. В 1991 году Центр предложил расширить список СПИД-ассоциированных заболеваний и определил, что постановка диагноза СПИД может быть в случаях, если: а) у инфицированного имеется одно из 23 СПИД-ассоциированных состояний или б) он ВИЧ-инфицирован и имеет менее 200 СD4+ клеток/мм.
Одна из первых классификаций, рекомендованных ВОЗ (1988), рассматривала 4 стадии болезни и все классификации более позднего времени, практически модернизируют ее, сохраняя основные положения. Эта классификация выделяла стадии: 1.Начальная (острая) ВИЧ-инфекция; 2.Персистирующая генерализованная лимфаденопатия; 3. СПИД-ассоциированный комплекс – преСПИД; 4. Развернутый СПИД.
В странах СНГ получила распространение классификация (табл. 2), предложенная В.И.Покровским (1989).
В I стадии (инкубация) диагноз может носить только предположительный характер, так как основывается исключительно на эпидемиологических данных: половой контакт с инфицированным ВИЧ партнером, переливание крови серопозитивного к ВИЧ донора, использование нестерильных шприцев при групповом введении наркотиков и т.п.
Инкубационный период при инфицировании ВИЧ продолжается от 2-3 недель до нескольких месяцев или даже лет. Клинических проявлений болезни нет, сохраняется нормальная активность, антитела к ВИЧ не определяются. Но уже в этот период возможно выявление вируса методом полимеразной цепной реакции.
Таблица 2. Клиническая классификация ВИЧ-инфекции
( по В.И.Покровскому (1989)
I. Стадия инкубации.
II. Стадия первичных проявлений:
А - острая лихорадочная фаза
Б - бессимптомная фаза
В - персистирующая генерализованная лимфаденопатия
III. Стадия вторичных заболеваний:
А - потеря массы тела менее 10%, поверхностные грибковые, бактериальные, вирусные поражения кожи и слизистых оболочек, опоясывающий герпес, повторные фарингиты, синуситы;
Б - прогрессирующая потеря массы тела более 10%, необъяснимая диарея или лихорадка более 1 мес., повторные или стойкие бактериальные, грибковые, протозойные поражения внутренних органов (без диссеминации) или глубокие поражения кожи и слизистых оболочек, повторный или диссеминированный опоясывающий лишай, локализованная саркома Капоши;
В - генерализованные бактериальные, грибковые, вирусные, протозойные, паразитарные заболевания, пневмоцистная пневмония, кандидоз пищевода, атипичный микобактериоз, внелегочный туберкулез, кахексия, диссеминированная саркома Капоши, поражения центральной нервной системы различной этиологии.
IV. Терминальная стадия
II стадия (первичных проявлений): IIA стадия - острая лихорадочная. Она же начальная (острая) ВИЧ-инфекция. У части зараженных спустя 2-5 мес. после проникновения вируса в организм может развиться острое заболевание, протекащее нередко с повышением температуры тела, выраженной интоксикации, тонзиллитом и мононуклеозоподобным синдромом. Помимо лихорадки в этой фазе болезни часто встречаются кореподобная или краснухоподобная сыпь на коже, миалгия, артралгия, язвы в горле, реже в ротовой полости. Иногда заболевание протекает по типу острой респираторной инфекции, в этих случаях больных беспокоит кашель. У части больных развивается полиаденопатия с увеличением 2-3 групп лимфатических узлов. Увеличение поверхностных лимфатических узлов чаще начинается с затылочных и заднешейных, затем уже увеличиваются подчелюстные, подмышечные и паховые. При пальпации лимфатические узлы эластичные, безболезненные, подвижные, не спаяны между собой и окружающей тканью, размерами от 1 до 5 см, чаще 2-3 см в диаметре. Иногда этим явлениям сопутствуют немотивированные утомляемость, слабость. Кроме того, регистрируются переходящие нарушения деятельности ЦНС - от головных болей до энцефалита.
В крови больных в этот период выявляется лимфопения, но количество CD4+ лимфоцитов более 500 в 1 мкл. К исходу второй недели в сыворотке крови могут быть обнаружены специфические антитела к антигенам ВИЧ. Продолжительность этого лихорадочного состояния - от нескольких дней до 1-2 мес., после чего лимфаденопатия может исчезнуть и болезнь переходит в бессимптомную фазу (IIБ).
Длительность IIБ фазы от 1-2 мес. до нескольких лет, но в среднем около 6 мес. Никаких клинических проявлений заболевания не отмечается, хотя вирус остается в организме и размножается. Иммунный статус при этом сохраняется в пределах нормы, количество лимфоцитов, в том числе CD4+, нормальное. Результаты исследований в ИФА и иммуноблоттинге положительны.
IIВ фаза - персистирующая генерализованная лимфаденопатия. Единственным клиническим проявлением болезни в этой стадии может быть только увеличение лимфатических узлов, сохраняющееся месяцы и даже годы. Увеличиваются почти все периферические лимфатические узлы, но наиболее характерно увеличение заднешейных, надключичных, подмышечных и локтевых лимфатических узлов. Особенно характерным и настораживающим врача следует считать увеличение подчелюстных лимфатических узлов при отсутствии патологии полости рта. Нередко увеличиваются мезентериальные лимфатические узлы, которые при пальпации болезненны, иногда симулируя картину “острого” живота. Но лимфатические узлы, увеличенные размером до 5 см в диаметре, могут оставаться безболезненными, с тенденцией к слиянию. В 20% у больных выявляются увеличенными печень и селезенка.
В этой фазе болезнь необходимо дифференцировать с острым токсоплазмозом, инфекционным мононуклеозом, сифилисом, ревматоидным артритом, системной красной волчанкой, лимфогранулематозом, саркоидозом.
При иммунологическом обследовании в этой стадии болезни общее количество лимфоцитов выше 50% региональной и возрастной нормы, количество CD4+ лимфоцитов более 500 в 1 мкл. Трудовая и половая активность больных сохранена.
III стадия (вторичных заболеваний) характеризуется развитием бактериальных, вирусных и протозойных заболеваний и/или опухолевого процесса, чаще лимфомы или саркомы Капоши. IIIA фаза является переходной от персистирующей генерализованной лимфаденопатии к СПИД-ассоциированному комплексу. В этот период иммуносупрессия выражена стойкой и глубоко: в сыворотке крови нарастает содержание гаммаглобулинов (до 20-27%), растет уровень иммуноглобулинов, преимущественно за счет класса IgG, снижена фагоцитарная активность лейкоцитов, снижается РБТЛ на митогены. Количество CD4+ лимфоцитов падает ниже 500 и на протяжении этой и следующей фаз до 200 клеток в 1 мкл. Клинически выявляются признаки вирусной интоксикации, лихорадка с повышением температуры тела до 38о С носит постоянный или перемежающий характер, сопровождается ночными потами, слабостью и быстрой утомляемостью, диареей. Потеря массы тела до 10%. В этой фазе еще нет присоединения выраженной оппортунистической инфекции или инвазии, не развиваются еще и саркома Капоши или друге злокачественные опухоли. Но тем не менее СПИД-маркерные инфекции уже налицо в виде инфекции, вызванной вирусом простого герпеса, токсоплазмоза, кандидозного эзофагита. На коже процесс в виде кандидоза, лейкоплакии, кондилом. Так как фаза IIIA по сути неосложненная генерализованной инфекцией или злокачественным опухолевым процессом форма, некоторые клиницисты полагают, что она может под влиянием адекватной терапии завершиться выздоровлением и считают целесообразным выделение ее в самостоятельную форму. Некоторые клиницисты обозначают эту фазу как продромальный период СПИД.
IIIБ фаза по клиническим проявлениям близка к понятию СПИД-ассоциированный комплекс. Именно в этой фазе появляются симптомы выраженного нарушения клеточного иммунитета: отсутствие реакции ГЗТ на три из четырех кожных проб (внутрикожное введение туберкулина, кандидина, трихофитина и др.). Клиника характеризуется лихорадкой длительностью более 1 мес., упорной необъяснимой диареей, ночными потами, сопровождается интоксикацией, снижением массы тела свыше 10%. Персистирующая лимфаденопатия приобретает генерализованный характер. Лабораторно выявляется снижение коэффициента CD4/CD8, нарастает лейкопения, тромбоцитопения, анемия, в крови растут циркулирующие иммунные комплексы, идет дальнейшее снижение показателей РБТЛ, угнетение ГЗТ. В этой фазе наличие двух из характерных клинических проявлений и двух лабораторных показателей, особенно с учетом эпидемиологии позволяет с высокой степенью достоверности диагностировать ВИЧ-инфекцию.
IIIВ фаза клинически представляет развернутую картину СПИДа. За счет глубокого поражения иммунной системы (количество СД4+ лимфоцитов менее 200 в 1 мм ) оппортунистическая инфекция приобретает генерализованный характер, развиваются или наслаиваются на инфекционный процесс новообразования в виде диссеминированной саркомы и злокачественной лимфомы. Из инфекционных возбудителей чаще всего встречаются пневмоцисты, кандида, вирусы герпетической группы (вирус простого герпеса, герпес зостер, цитомегаловирус, вирус Эпштейна-Барр). Инфекционный процесс также вызывают микобактерии, легионеллы, кандида, сальмонеллы, микоплазмы, а также в южном регионе токсоплазмы, криптоспоридии, стронгилоидии, гистоплазмы, криптококки и ряд других возбудителей. В зависимости от преимущественной локализации очага выделяют ряд клинических форм: а) с преимущественным поражением легких (до 60% случаев), б) с поражением желудочно-кишечного тракта, в) с церебральными поражениями и/или психоневрологическими проявлениями, г) с поражением кожи и слизистых оболочек, д) генерализованные и/или септические формы, е) недифференцированные формы, в основном с астеновегетативным синдромом, длительной лихорадкой и потерей массы тела. В целом заболевание характеризуется развитием гнойных осложнений, астенией, больной более половины времени вынужден находиться в постели. В процессе болезни этиологические факторы могут меняться.
IV (терминальная) стадия протекает с максимальным развертыванием клиники, развивается кахексия, держится лихорадка, выражена интоксикация, больной все время проводит в кровати. Развивается деменция. Нарастает вирусемия, содержание лимфоцитов достигает критических величин. Болезнь прогрессирует и больной погибает.
За рубежом нашла применение классификация, предложенная ВОЗ в 1991 году (табл. 3).
Таблица 3. Классификация ВИЧ-инфекции (ВОЗ,1991)
|
Клиническая стадия
|
Клинические проявления
|
Соматическое благополучие |
|
I
(бессимптомная, генерализованная лимфоаденопатия) |
1.Отсутствие симптомов |
Нормальная активность |
|
II
(ранняя или слабовыраженная) |
1. Потеря массы тела <10% |
Нормальная активность |
|
III
(промежуточная) |
1.Потеря массы тела > 10% 2.Необъяснимая диарея > 1 мес. 3.Необъяснимая
лихорадка > 1 мес. 4.Кандидоз полости рта 5.Лейкоплакия ротовой полости 6.Легочной туберкулез в течении 1 года 7.Тяжелые бактериальные инфекции ( пневмония и др.) |
Прикован к постели менее 50% дней в течении последнего месяца |
|
IV
собственно СПИД (поздняя, выраженная клиника) |
1.Вэйстинг-синдром 2.Пневмоцистная пневмония 3.Церебральный токсоплазмоз
4.Криптоспороидоз с диареей 5.ЦМВ-ое поражение органов, кроме печени,селезенки,
лиматических узлов 6.Герпетическое поражение кожи, слизистых оболочек >
1 мес или висцеральные герпетические поражения независимо от длительности
7.Прогрессирующая многоочаговая лейкоэнцефалопатия 8.Любой диссеминирующий эндемичный микоз 9.Кандидоз пищевода, трахеи, бронхов и легких 10.Атипичный диссеминированный микобактериоз 11.Нетифозная сальмонеллезная септицемия 12.Экстрапульмональный туберкулез 13.Лимфома 14.Саркома Капоши 15.ВИЧ-энцефалопатия |
Прикован к постели менее 50% дней в течении последнего месяца |
В США с 1993 года стала применяться классификация, разработанная CDC на основании вышеприведенной классификации ВОЗ, рассчитанная на взрослых и подростков (табл. 4).
Таблица 4. Классификация стадий ВИЧ-инфекции и расширенное определение случая СПИДа у взрослых и подростков.
| Число (%) CD4+ Т-лимфоцитов в мкл |
Клинические категории
|
||
|
|
A
Бессимптомная острая (первичная) или ПГЛП |
B
Манифестная ни A ни C |
C
СПИД - индикаторные заболевания |
|
1. > 500 (>29%)
|
A1
|
B1
|
C1*
|
|
2. 200-499 (14 - 28 %)
|
A2
|
B2
|
C2*
|
|
2. < 200 ( <14%) = индикатор СПИДа
|
A3*
|
B3*
|
C3*
|
|
Симптомы в подгруппах: А: Острый ретровирусный синдром В: Синдромы СПИД-ассоциированного комплекса С: Собственно СПИД |
|||
* Категории А3,В3,С1,С2,С3 являются определяющими для случая
СПИД и подлежат в США учету как больные СПИДом
Примечание - ГЛАП - генерализованная лимфаденопатия
Последняя классификация вобрала все лучшее, что было накоплено клинической мыслью за десятилетие работы с больными и наиболее адекватно отражает связь патогенеза болезни с клиникой.
В категорию А входят бессимптомная ВИЧ-инфекция, острая ВИЧ-инфекция и персистирующая генерализованная лимфаденопатия (ГЛАП) в случаях подтвержденного диагноза лабораторно. Категория В включает все те клинические варианты ВИЧ-инфекции, которые нельзя включить в категории А и С, в классификации В.И.Покровского она соответствует IIIA - стадии болезни, т.е. переходной от ГЛАП к СПИД-ассоциируемому комплексу, не отяжеленному генерализованной инфекцией или опухолевым процессом. Сюда относятся ротоглоточный кандидоз, бациллярный ангиоматоз, диарея или лихорадка длительностью свыше месяца, волосатая лейкоплакия языка, опоясывающий или простой герпес. К категории С подпадают все те случаи, когда хотя бы однократно выявлялось одно из 12 СПИД-индикаторных заболеваний, включенных в официальный перечень.
Из существующих классификаций нетрудно убедиться, что ВИЧ-инфекция не имеет своего собственного, клинически очерченного статуса, ее клиника в развернутой фазе болезни - это клиника тех, преимущественно оппортунистических инфекций или опухолей, которые наслаиваются на иммунологически дефицитный организм. Поэтому сформировалось понятие “СПИД-ассоциируемые заболевания”, куда входят те наиболее часто развивающиеся инфекционные, паразитарные, грибковые или неопластические процессы, которые чаще всего являются клиническим проявлением ВИЧ индуцированного вторичного иммунодефицита.
Разработка клинической классификации позволила с одной стороны унифицировать подходы к клинической оценке болезни, она же определила тот спектр болезней, которые наиболее часто и наиболее характерно отражают манифестную форму ВИЧ-инфекции, представить в едином целом схему фаз течения болезни, классифицировать состояния, наблюдаемые наиболее закономерно (табл. 5).
Таблица 5. Схема фаз течения ВИЧ-инфекции
| Инкубация, 1 мес - 1 год (до 3-10 лет) | Начальная фаза, 1 мес - 5 лет | СПИД, клинически выраженный период до 3-х лет | |
| СПИД-ассоциированный комплекс | СПИД | ||
| Нет клиники |
Симптомы:
|
|
|
К Л И Н И К А
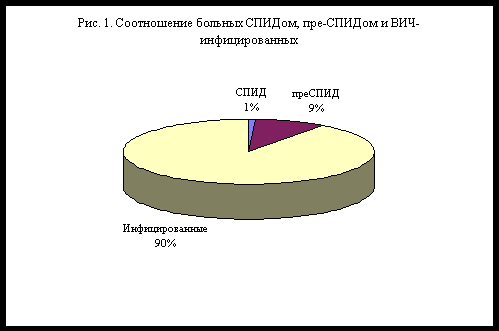
Инфицированные ВИЧ лица в большинстве случаев в течение длительного времени не имеют каких-либо клинических проявлений болезни, у части инфицированных имеется слабо выраженная клиническая картина и лишь у небольшой части клиника проявляется ВИЧ-зависимыми заболеваниями или СПИДом (рис. 1).

Клиническую картину ВИЧ/СПИД определяют в основном группа инфекционных болезней, и в первую очередь ряд оппортунистических инфекций. Описывая клинику ВИЧ-инфекции M.S.Saag (1997) выделяет несколько последовательных фаз и составляющих клинику патологических состояний и нозологических форм. Стадии болезни, основные нозологические формы супенринфекций и органопатологию демонстрирует табл. 6.
Таблица 6. Стадии, СПИД-ассоциированные заболевания и органопатология при ВИЧ-инфекции
1. Стадии болезни
- Начальная (синдром острой сероконверсии)
- Ранние проявления болезни
- Промежуточная стадия
- Поздняя
- Предтерминальная
- Терминальная стадия
2. Основные виды суперинфекции
Паразитозы:
- Токсоплазмоз
- Изоспоридиоз
- Криптоспоридиоз
- Микроспоридоз
- Циклоспороз
- Чесотка
- Висцеральный лейшманиоз
- Стронгилоидоз
- Бластомикоз
Микозы:
- Пневмоцистоз
- Кандидоз
- Криптококкоз
-Гистоплазмоз
- Кокцидиоидоз
- Аспергиллез
Бактериальная инфекция
- Туберкулез
- Сальмонеллез
- Атипический микобактериоз
- Бактериальная инфекция респираторного тракта
а)стрептококковая пневмония
б)Haemophilus influenzae - инфекция
в)синегнойная инфекция (Pseudomonas aeroginosa)
г)Бартонеллез
Герпесвирусная инфекция
- HSV-инфекция
- CMV-инфекция
- HZV-инфекция
- EBV-инфекция
- HV6 и HV7-инфекция
- HV8-инфекция
Папиллома-вирусная инфекция и вирусный гепатит
у больных ВИЧ-инфекцией
Эпидемическая саркома Капоши
Лимфома и другие злокачественные опухоли
3. Органопатология:
Поражения центральной и периферической нервной системы
Поражение ротовой полости
- грибковая инфекция
- вирусная инфекция
- опухоли
Поражение желудочно-кишечного тракта:
а) виды поражений
- грибковые заболевания
- вирусные заболевания
- бактериальная инфекция
- опухоли
б) клинические синдромы
- диарея
- болезни ано-ректального тракта
Неинфекционные органо-специфические заболевания
при ВИЧ-инфекции
а) болезни кожи
- себорея
- псориаз
- Рейтер-синдром
- приобретенный ихтиоз
- папулезная и фолликулярная сыпь
б)ВИЧ-связанные аутоиммунные и гипериммунные состояния
в) эритродермия
г) анулярная гранулема
Неинфекционные заболевания легких и
дыхательных путей:
а) опухоли
- саркома Капоши
- Неходжкинская лимфома
- бронхогенная карцинома
б) интерстициальная пневмония
в) лимфоцитарный бронхиолит
г) облитерирующий бронхиолит
д) легочная гипертензия
Почечные осложнения у больных ВИЧ/СПИД
- водно-электролитные нарушения
- острая почечная недостаточность
- инфекционные поражения мочевыводящих путей
и интерстициальный нефрит
Гематологические осложнения у больных ВИЧ-инфекцией
- специфические цитопении
- анемия
- нейтропения
- тромбоцитопения
Как видно из данных таблицы, ВИЧ-инфекция не имеет своих строго очерченной клинической картины, ибо она представлена рядом СПИД-ассоциируемых и некоторых заболеваний, преимущеcтвенно в виде суперинфекции, вызываемых условно-патогенными возбудителями. Поэтому в связи с развитием пандемии ВИЧ-инфекции значительно выросло число ряда ранее редко встречающихся, заболеваний, таких как пневмоцистная пневмония и саркома Капоши, цитогегаловирувная инфекция и простой герпес, криптококкоз и.атипический микобактериоз.
Структура и время появления тех или иных СПИД-ассоциируемых заболеваний в динамике ВИЧ-инфекции в определенной степени зависят от региона (табл. 7).
Таблица 7. Профиль и временная последовательность манифестации СПИД-ассоциируемых инфекций в 3-х регионах мира ( по Лысенко А.Я. и соавт., 1996)
|
Западная Европа, США
|
Южная Америка
|
Африка, Карибская зона
|
| Герпетическая инфекция | Кандидоз | Туберкулез |
| Кандидоз | Туберкулез | Криптоспоридиоз |
| Туберкулез | Токсоплазмоз | Изоспориоз |
| Пневмоцистоз | Криптоспоридиоз | Токсоплазмоз |
| ЦМВ-инфекция | Пневмоцистоз | ЦМВ-инфекция |
| Атипичные микобактериозы | ЦМВ-инфекция | Пневмоцистоз |
При всей полиморфности клинической картины ВИЧ-инфекции, характерна определенная, наиболее часто встречающаяся органная патология или нозология: лимфаденопатия (100%), поражение кожи (84%), пневмоцистная пневмония (50%), саркома Капоши (25%), поражение ЦНС (30%).
Вместе с тем, за время пандемии в связи с вндрением активной анттиретровирусной терапии и профилактики оппортунистических инфекций прослеживается изменение удельного веса отдельных нозологических форм СПИД-ассоциируемой патологии у больных ВИЧ-инфекцией. Так, в США за период 1981-1989 гг. частота пневмоцистной пневмонии практически не изменилась, саркома Капоши, встречавшаяся в первые годы пандемии у половины больных, снизилась в 5 раз, с 1986 года начался подъем цитомегаловирусной инфекции, а цитомегаловирусный (CMV) ретинит вырос с 0,2 до 2,4%.
Синдром острой сероконверсии. Первичная ВИЧ-инфекция (синдром острой сероконверсии, начальная стадия) клинически манифестирует острым ретровирусным синдромом, который традиционно охарактеризован как мононуклеозоподобная болезнь с лихорадкой, фарингитом, лимфаденопатией и сыпью. Позже было установлено, что она имеет ряд других проявлений, включая оппортунистические инфекции. Первичное инфицирование ВИЧ-1 знаменует начало инфекционного процесса, у одних протекающего как асмптомная первичная инфекция, а у других в виде острого ретровирусного синдрома. В дальнейшем у одних больных процесс приобретает характер длительного непрогрессирующего течения, у других быстро развертывается клиника тяжелейшей болезни со смертельным исходом.
Первичная ВИЧ-инфекция характеризуется интенсивной вирусной диссеминацией, ВИЧ-специфическим клеточным и гуморальным иммунным ответом и более чем у половины больных характерной клинической картиной – синдромом острой сероконверсии.
С тех пор как распознали наличие первичной ВИЧ-инфекции, были изучены особенности клинических проявлений, вирусологических, иммунологических и прогностических особенностей синдрома острой сероконверсии, причем выводы обосновывались не только по данным ретроспективого анализа, но и непосредственным наблюдением за больными, выявленными в период первичной ВИЧ-инфекции. Так было установлено, что у больных первичной ВИЧ-инфекцией с клиникой синдрома острой сероконверсии быстрее идет прогрессирование в СПИД. Те больные, у которых в период сероконверсии вывявляется высокая вирусная нагрузка на плазму и низкие показатели CD4+ лимфоцитов также характеризуются прогрессирующим течением заболевания.
Внедрение активной антиретровирусной терапии позволило сформировать идею, что ВИЧ-инфекцию можно перевести в форму хронической вирусной инфекции.
Синдром острой сероконверсии (СОС) по наблюдениям различных авторов развивается у 53-92% больных. Такой широкий диапозон регистрации частоты СОС обусловлен тем, что используемые для характеристики его подходы весьма варьируют. Более критический подход к оценке клиники в различных группах риска (мужчины-гомосексуалисты, наркоманы, рецепиенты крови и трансплантатов, мдицинские работники, поранившиеся иглой для инъекций, гетеросексуалы), тщательное сопоставление проявлений болезни с контрольной группой серонегативных лиц позволил считать, что СОС имеет место у 34-53% инфицированных ВИЧ.
Анонимный автор первым в 1984 году в журнале Lancet сообщил о симптомах, ассоциированных с сероконверсией у инфицированных ВИЧ, а D.D. Ho et al. (1985) и D.A. Cooper et al. (1985) описали клинику синдрома острой сероконверсии. Когда Центр поконтролю зха болезнями США (CDC) в 1986 году представил классификацию ВИЧ-инфекции, то острую фазу обознеачил как “мононуклеозиподобный синдром с или без асептического менингита, связанный с сероконверсией на HTLV-III/LAV-антитела” (CDC, 1986). Со временем более тщательное наблюдение за начальной фазой ВИЧ-инфекции позволило заключить. что клинические проявления первичной ВИЧ-инфекции характеризуются многообразием вариантов и могут включать не только реакцию организма на сероконверсию, но и развитием супериринфекции, обусловленной группой условнопатогенных возбудителей. Поэтому понятие “мноноуклеозоподобный синдром” нуждался в расширении и постепенно в практику вошло понятие “синдром острой сероконверсии”.
После инфицирования ВИЧ инкубационный период длится примерно 2-6 недель, после чего у части больных манифестирует клиника первичной инфекции, которую лабораторно позволяет подтвердить в этой фазе методами ИФА или иммунного блота (выявление IgG-антител), можно также диагноз уточнить, используя методы выявления специфических IgM – антител, р24-антигена, уровня ВИЧ-1 ДНК и РНК в полимеразной цепной реакции (ПЦР), выделением вируса в культуре клеток. В типичных случаях антитела вывявляются через 1-2 мес. после инфицирования.
Острый синдром сероконверсии обычно длится 1-6 недель и как правило проходит самостоятельно без специфического лечения.
К наиболее характерным симптомам острой сероконверсии относятся лихорадка, ночной пот, артралгия, недомогание, головная боль, тошнота, рвота, диарея и анорексия, а также фарингит, сыпь, потеря массы тела, лимфаденлопатия, лейкопения, тромбоцитопения, у части больных - менингит, нейропатии и энцефалопатии . Сыпь при СОС выявляется более чем у половины больных и чаще это макулопапулярные высыпания, преимущественно на верхней половине туловища, шее и лице. Она не шелушится и обычно исчезает в течение 2-3 недель. Реже по характеру сыпь розеолезная или везикулярно-папулезная. Гистологически сыпь идентична высыпаниям, индуцированным другими вирусами или лекарствами .
Неврологическая симптоматика СОС включает лимфоцитарный менингит, энцефалопатию. Уже в первые годы наблюдения у больных в стадии СОС описан энцефалит с судорожным синдромом, позже описаны такие неврологические проявления СОС, как синдром Guillain-Barre, неврит плечевого сплетения, ганглионеврит, вызявающий атаксию-нейропати.
В период острой сероконверсии клинику могут дополнять суперинфекции, развивающиеся в результате глубокой иммуносупресии, в частности оральный кандидоз и кандидозный эзофагит, пневмоцистная пневмония, цитомегаловирусый колит, церебральный токсоплазмоз и туберкулез. В виде отдельных наблюдений в этой фазе возможно развитие острой пневмококковой пневмонии, лимфоцитарного альвеолита , апластической анемии, васкулита и в виде единичных наблюдений – нефроз, острая почечная недостаточность.
Kinloch-de Loes et al. (1993) описывая клинику 31 наблюдения за больными в стадии СОС нашли у 43,3% больных язвы на слизистых ротовой полости или гениталий (очевидно, заразившихся половым путем). Так как в наблюдениях авторов 5 больных ВИЧ-инфекцией наркоманов не имели этих слизисто-кожных изъязвлений, авторы высказывают предположение, что язвы вызваны прямы действием ВИЧ. В пользу этого свидетельствуют данные электронномикроскопического исследования ткани, взятой из эзофагальных язв, проведенного Rabeneck L. et al. (1990) и обнаруживших вирусные частицы в биопрепаратах.
M.S.Saag (1997), обобщивший наблюдения многих клиницистов, приводит данные по частоте основных симптомов острого ретровирусного синдрома (табл. 8).
Таблица 8. Симптомы острого ретровирусного синдрома
|
Симптомы
|
Частота, %
|
| Лихорадка |
57
|
| Фарингит |
73
|
| Сыпь |
70
|
| Миалгия |
58
|
| Артралгия |
58
|
| Диарея |
33
|
| Головная боль |
30
|
| Изменение психического статуса |
3
|
| Нарушения чувствительности |
8
|
При лабораторном обследовании у больных чаще выявляется транзиторная лейкопения, лимфопения, тромбоцитопению, инверсию соотношения хелперы/супрессоры. У части больных повышается активность трансфераз, анализ спинномозговой жидкости выявляет плеоцитоз и повышение уровня белка.
Наблюдения большинства авторов показали, что наличие клиники синдрома острой сероконверсии характеризует быстрое прогрессирование болезни с неблагоприятным исходом в ближайшие 2-3 года. Среди наиболее прогностически неблагоприятных симптомов синдрома острой сероконверсии, ассоциированных с быстирым прогрессированием ВИЧ-инфекции в СПИД различные авторы отмечают лихорадку свыше 38° С, лимфоцитарный менингит, острsй энцефалит, среди последних у 42% СПИД развивался в ближайшие 4 года, а среди не имевших эти проявления СОС – в 18%, у лиц без клиники СОС – в 8% (Boufassa F. et al., 1995).
Ко-факторами быстрого прогрессирования ВИЧ-инфекции является цитомегаловирусная инфекция. Описан случай перехода ВИЧ-инфекции в СПИД у медицинского работника, случайно инфицировавшегося через укол иглой и заразившегося одновременно ВИЧ и вирусом гепатита С (Ridzon R. et al., 1997). Хотя клииники СОС у него не наблюдалось, но имело место замедленное развитие сероконверсии как на HIV, так и на HCV: на ВИЧ через 9,5 мес., на НCV – через 13,5 мес. Кстати, это наиболее продолжительный срок сероконверсии из известных. В дальнейшем у больного наблюдалось быстрое развитие печеночной недостаточности и смертельный исход через 28 мес. после заражения.
Как отмечает большинство авторов, клинические проявления СОС могут быть неспецифическими, чрезвычайно вариабельными.
Характерно для ВИЧ-инфекции, что чем старше возраст к коменту сероконверсии, тем быстрее болезнь прогрессирует в СПИД. Так, при оценке влияния пола, возраста и способа инфицирования на скорость прогрессирования ВИЧ-инфекции G.Rezza et al.(1992) в течение 7 лет наблюдали 780 больных. Авторы показали, что возраст свыше 25 лет к моменту сероконверсии был единственным фактором, влияющим на скорость прогрессирования болезни. Та же закономерность наблюдалась у больных ВИЧ-инфекцией больных гемофилией, гомосексуалов, бисексуалов и гетеросексуалов, во всех этих группах фактор возраста был единственным показателем риска в момент сероконверсии для быстрого прогрессирования болезни. В то же время установлено, что риск манифестации клиники СОС более высок у гомосексуалов по сравнению с гетеросексуалами и у гомосексуалов по сравнению с гемофиликами. СОС чаще наблюдалась у лиц, заразившихся половым путем по сравнению с людьми, заразившимися гематогенно.
В период клинических проявлений СОС IgM к ВИЧ обнаруживаются методами иммунофлюоресценции в течение первых 5 суток и IgG – в течение 11 суток, а антитела в ИФА и иммунном блоте на 20 дней позже. Пик IgM приходится на 3-5 неделю, затем уровень антител снижается к 2-3 месяцу. В течение первых 2 недель после начала СОС с помощью ИФА выявляются антиген р24, а р24-антитела могут быть обнаружены в иммунном блоте в период 2-3 недели, т.е. по мере снижения уровня антигена.
D.A.Cooper et al. (1993) выделили 4 фазы изменения клеточного иммунитета при ВИЧ-инфекции в стадии СОС: 1-я – снижение общего числа лимфоцитов, 2-я – инверсия соотношения CD4/CD8, связанная с повышением числа CED8+ клеток, 3-я – максимальное повышение уровня CD8+ клеток с максимальным пиком к 33 дню, 4-я – снижение числа CD4+ и CD8+ клеток с сохранением показателя CD4/CD8.
Во время сероконверсии высокий антительный ответ на р24 сочетается с более низкой скоростью прогрессирования болезни. Бессимптомное течение сероконверсии характеризуется высоким уровнем анти-ВИЧ-1 антител и низким показателем уровня РНК-ВИЧ-1, что свидетельствует о контроле иммунной системой степени виремии. Более высокие уровни ВИЧ-специфических цитотоксических Т-клеток сочетается с низким уровнем вирусной нагрузки на плазму и более медленным прогрессированием болезни. Более того, при медленно прогрессирующем варианте ВИЧ-инфекции несмотря на отсутствие антивирусной терапии характерно повышение пролиферации ВИЧ-1-специфических СD4+ клеток, а лимфоцит-пролиферативный ответ на антиген р24 характеризуется обратной зависимостью от вирусной нагрузки.
Вирусологический статус в период сероконверсии весьма варьирует. Во время острого СОС вирусная нагрузка на плазму часто довольно высокая, уровень ее выше 200 000 копий/мл и коррелирует с уровнем выявляемых у больных клинических проявлений болезни. С появлением ВИЧ-специфических антител уровень вирусной нагрузки падает и одновременно исчезает клинические проявления СОС. J.Mellors (1995) при обследовании 62 мужчин-гомосексуалистов с клиникой СОС выявил, что при уровне РНК ВИЧ-1 в плазме выше 100 000 копий/мл имеет место более высокий темп прогрессирования болезни в СПИД вне зависимости от уровня CD4+ лимфоцитов в этот период. T.W.Schacker et al. (1998) также установили, что высокий уровень вирусной нагрузки на плазму между 120-365 днями после заражения ВИЧ коррелирует с ускоренным снижением CD4+ клеток, в то время как высокий уровень копий РНК до 120 дня – не коррелирует.
В период клинически выраженной острой сероконверсии ВИЧ выделяется из плазмы, мононуклеаров периферической крови, спинномозговой жидкости. Очевидно, часть клинических проявлений СОС индуцирована непосредственно ВИЧ, что также зависит от дозы инфекта, вирулентности штамма, его тропизма и лекарственной устойчивости. Так, у реципиентов, получивших ВИЧ-инфицированную кровь от доноров, у которых развился СПИД вскоре после донорства, быстрее развивалась клиника СОС и заболевание в целом быстрее прогрессировало в СПИД. Синцитий-образующие и быстро реплицирующие штаммы определяют более форсированную клинику, у больных слабо выражен начальный иммунный отвеет. C. Nielsen et al. (1993) наблюдали, что у больных в стадии острой сероконверсии, у которых выделены синцитий-образующие щтаммы, имели более более длительный лихорадочный период и быстрее развивался иммунодефицит. T.Lee et al. (1994) полагают, что установившаяся концентрация вируса во время сероконверсии в последующем меняется очень мало и коррелирует с течением болезни.
Не однозначен вопрос терапевтической тактики у больных с синдромом острой сероконверсии. Так как высокие уровни виремии в стадии синдрома острой сероконверсии являются предвестниками прогессирующего течения ВИЧ-инфекции, теоретически вроде бы выгодно проводить антиретровирусную терапию в этот период. Однако, N.D. Russell et al. (1998) полагают, что есть аргументы и против использования интенсивной антиретровирусной терапирпии в этой фазе болезни:
Ранняя стадия болезни. Раннюю фазу ВИЧ-инфекции характеризует содержание CD4+ клеток свыше 500 в 1 мм3. Среди клинических проявлений болезни наиболее характерна лимфаденопатия. Выявляются увеличенные затылочные, заднешейные, аксилярные, надключичные, кубитальные лимфоузлы, которые в норме не пальпируются. Увеличиваются периаортальные и медиастинальные лимфатические узлы. Значительное увеличение группы торакальных или абдоминальных лимфоузлов обычно свидетельствует о присоединении оппортунистической инфекции, распространенном туберкулезе, атипическом микобактериозе, гистоплазмозе или лимфоме.
Таблица 9 демонстрирует наиболее типичные причины лимфаденопати у человека.
Таблица 9. Типичные причины генерализованной лимфаденопатии
|
Заболевание
|
Тесты
|
|
Инфекции
|
|
|
Бактериальные
|
|
|
сифилис
|
серология
|
|
бруцеллез
|
серология
|
|
Вирусные
|
|
|
инфекционный мононуклеоз
|
серология, ПЦР
|
|
ЦМВ-инфекция
|
серология, ПЦР
|
|
краснуха
|
серология
|
|
ВИЧ-инфекция
|
серология, ПЦР
|
|
Протозойные
|
|
|
токсоплазмоз
|
серология
|
|
Опухоли
|
|
|
лейкоз
|
гемограмма, миелограмма
|
|
лимфомы
|
биопсия лимфоузлов
|
|
Прочие
|
|
|
саркоидоз
|
клиника
|
Дерматологические проявления болезни в этот период довольно характерны и чаще проявляются в виде себореи, псориаза, ихтиоза, эозинофильного фолликулита, распространенной чесотки.
Оральная патология протекает в виде афтозного стоматита, но встречается редко - у 2-5% больных. Хотя поражения, вызванные вирусом простого герпеса (HSV) свойственны более поздним стадиям болезни, иногда появляются и в ранней фазе. Весьма характерна для оральных поражений Эпштейна-Барр (EBV)-инфекция в виде лейкоплакии, для которой характерно появление белых полос по краям языка, ее приходится дифференцировать с кандидозом полости рта. Лейкоплакия не часто встречается в ранней фазе ВИЧ-1 инфекции, ибо она редка при количестве CD4+ клеток > 500 в 1 мм3 и ее появление свидетельствует о прогрессирующем течении болезни.
Возможность продукции в ранней фазе вирионов в количествах от 100 млн. до 1 биллиона определяет необходимость проведения противоретровирусной терапии, ибо отсутствие терапии ведет к быстрому падению уровня CD4+ клеток.
Промежуточная стадия . Для промежуточной стадии ВИЧ-инфекции характерно снижение уровня CD4+ клеток в пределах 200-500 в 1 мм3 . В отличии от ранней стадии в этой фазе болезни выше риск развития оппортунистической патологии, хотя часто заболевание протекает в субклинической или слабо выраженной клинически форме. У больных при наличии кожных и оральных патологических процессов они прогрессируют дальше или же появляются впервые. Чаще всего выявляется HSV-инфекция, опоясывающий герпес (HZV-инфекция), диарея, периодические подъемы температуры тела, немотивированное снижение массы тела, умеренно выраженный оральный или вагинальный кандидоз. Довольно часто наблюдаются миалгия, артралгия, головная боль и усталость. Изредка наблюдается прогрессирующее поражение почек в виде почечной недостаточности с высокой протеинурией. Поражения респираторного тракта протекают по типу бронхита или пневмонии и обычно обусловлены стрептококком, микоплазмой pneumoniae, H. influenzae, Moraxella catarrhalis.
Антиретровирусная терапия, классическим показанием к применению которой является снижение уровня CD4+ клеток < 500 в 1 мм3, в этой стадии проводится в США зальцитабином, диданозином и др. Без ретровирусной терапии заболевание в 20-30% прогрессирует в СПИД.
Поздняя стадия болезни. Для этой фазы ВИЧ-инфекции характерно снижение CD4+ клеток в пределах 50-200 в 1 мм3 . Согласно CDC классификации при этом количестве CD4+ лимфоцитов заболевание следует расценивать, как стадию СПИД.
В клинике доминирует оппортунистическая инфекция в виде пневмоцистной пневмонии, токсоплазмоза, криптоспоридиоза, изоспориоза, туберкулеза, а также В-клеточной лимфомы, саркомы Капоши, энцефалита, кандидозного эзофагита. Эти виды патологии сопровождаются миалгией, артралгией, высокой лихорадкой. Развивается неврологическая патология в виде мононевритов, поражения черепно-мозговых нервов и периферических нервов, миелопатии. Цитомегаловирусная патология характерна для этой фазы, но в виде ЦMВ-ретинита, она развивается в основном при снижении СD4+ клеток менее 50 в 1 мм3. Возможно развитие рака шейки матки и прямой кишки, вызванные папиллома-вирусом. Изменения функции гормональной системы у женщин проявляются гипогонадизмом, нарушением менструального цикла. У больных возможны развитие гипо- или гипертиреоидизма и, как следствие поражения оппортунистической инфекцией надпочечников, развивается надпочечниковая недостаточность.
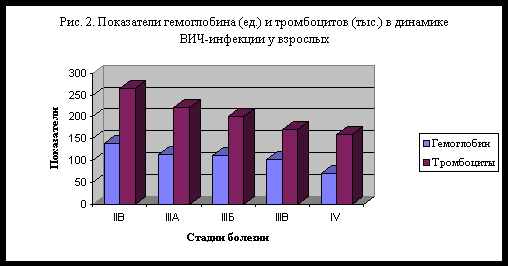
Гематологические изменения характеризуются анемией, нейтропенией, идиопатической тромбоцитопенией (рис. 2). У больных постепенно снижается уровень общего белка, повышается уровень сывороточных глобулинов, особенно g -глобулиновой фракции.
Предтерминальная стадия болезни. В этой стадии болезни характерно снижение CD4+ клеток ниже 50 в 1 мм3. Глубокий иммунодефицит обусловливает тяжело протекающую оппортунистическую инфекцию в виде атипического микобактериоза, криптококкового менингита, ЦMВ-ретинита, распространенного аспергиллеза, прогрессирующего мультиформного лейкоэнцефалита, диссеминированного гистоплазмоза, кокцидиомикоза, бартонеллеза. Совокупность патологии нивилирует клиническую индивидуальность каждой формы инфекции, приводит к быстрому истощению организма. Поражение вещества мозга полиома-вирусом ведет к нарушению двигательной функции и изменению психики в виде деменции.
В этой фазе выражена немотивированная потеря массы тела, что в определенной степени зависит от потери больным аппетита, развития малабсорбции, обусловливающих диарею.
Проведение противовирусной терапии снижает риск развития у больных атипического микобактериоза, криптококкоза, CMV- ретинита. Антивирусная терапия и проведение медикаментозной профилактики оппортунистической инфекции существенно продляет жизнь больным.
Терминальная стадия болезни. Клинически трудно определить, когда заболевание из развитой стадии переходит терминальную. Логически под терминальной стадией понимается состояние неуправляемости течения болезни, невозможности остановить прогрессирующее течение патологического процесса с ближайшим неблагоприятным исходом. Больной в терминальной стадии перестает бороться с болезнью, теряет веру в выздоровление.
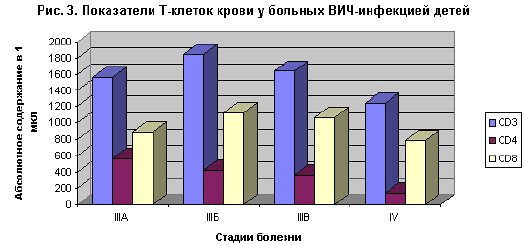
Как в целом клиника ВИЧ-инфекции, так и патология терминальной стадии четко коррелируют с выраженностью падения уровня CD4+клеток (рис. 3). Поэтому непосредственной причиной смерти чаще всего служат оппортунистические инфекции и саркома Капоши, а у больных ВИЧ/СПИД наркоманов еще и туберкулез.
Прогноз. В среднем от начала инфицирования до терминальной стадии ВИЧ-инфекция, нося перемежающий характер, длится 10-15 лет и четко коррелирует с уровнем виремии. Но в одних случаях заболевание трансформируется в СПИД в течение месяцев, в других - многих лет. Можно выделить 3 типа течения болезни: типичное прогрессирование, быстрое прогрессирование и отсутствие прогрессирования .
Наблюдения за больными позволили выделить ряд факторов риска прогрессирования болезни. Так, среди лиц, заразившихся вследствие переливания крови прогрессирование выше, чем среди гомосексуалистов. По данным М.Melbye et al. (1987) у лиц с лимфаденопатией прогрессирование в СПИД в ближайшие 2 года было в 22%, при наличии в клинике лейкоплакии - в 42%, а у больных с органическими поражениями - в 100%.
Среди возможных лабораторных тестов прогнозирования ВИЧ-инфекции определение уровня CD4+ лимфоцитов относится к наиболее распространенным и доступным показателям. Так, было установлено, что снижение уровня CD4+ клеток до 7% в течение первого года наблюдения в СПИД болезнь переходит в 35 раз чаще, чем среди больных, имевших стабильный уровень этих клеток (Burcham J. et al.,1991). Именно поэтому в клиниках внедрена система обследования больных на уровень CD4+ лимфоцитов в крови через каждые 3-4 месяца. Выраженное их снижение является показанием к проведению противовирусной терапии и профилактике пневмоцистной пневмонии и других оппортунистических инфекций.
В последние годы внедрение методов определения вирусной нагрузки на плазму методами количественной полимеразной цепной реакции, определения РНК ВИЧ-1 или bДНК позволило в более ранние сроки установить начало прогрессирования болезни и своевременно проводить противовирусную терапию.
ОРГАНОПАТОЛОГИЯ ПРИ ВИЧ-ИНФЕКЦИИ
К основным клиническим проявлениям ВИЧ/СПИД относятся поражения кожи, нервной системы, желудочно-кишечного тракта, диссеминированные варианты суперинфекции и онкопатология. Среди возбудителей суперинфекций чаще заболевания обусловливают условно-патогенные микроорганизмы, в том числе длительно персистирующие в организме человека, не вызывая патологических процессов в условиях нормального функционирования иммунной системы, а при СПИДе приобретающие злокачественное, рецидивирующее течение (табл. 10).
Таблица 10. Основные виды патогенов, вызывающие органопатологию у больных ВИЧ-инфекцией
|
Простейшие
|
Вирусы
|
Грибы
|
Бактерии
|
|
Кнриптоспоридии
|
CMV
|
P. carinii
|
Атипические микобактерии
|
|
Токсоплазмы
|
HSV
|
Candida
|
М. туберкулеза
|
|
Изоспоридии
|
HZV
|
Нокардии
|
Сальмонеллы
|
|
Лямблии
|
EBV
|
Кокцидии
|
Легионеллы
|
|
|
Паповавирус
|
Криптококки
|
Haemophilus
|
Поражение нервной системы
Нервная система постоянно вовлекается в патологический процесс при ВИЧ-инфекции, поражение вещества мозга варьирует от незначительных изменений до тяжелых прогрессирующих, но в 30% клинические проявления патологии центральной нервной системы выражены ярко. Чаще всего оппортунистическая инфекция определяет локальный или диффузный патологический процесс: криптококки, токсоплазмы, Candida, CMV, очаговое поражение бывает обусловлено лимфомой. Наиболее характерен ряд симптомокомплексов: менингизм, энцефалит, менингит, гемипарезы, мозжечковая атаксия, судорожный синдром, СПИД-дементный комплекс.
Неврологические проявления поражения головного мозга проявляются в одних случаях преимущественным вовлечением в процесс головного мозга, в других - спинного мозга, в третьих - оболочек, а в четвертых - периферических нервов и корешков (табл.11). В каждом конкретном случае клиника характеризуется свойственной данному виду патологии симптомами. Так, для вакуолярной миелопатии характерны парастезии и слабость в ногах, а при оценке неврологического статуса выявляются парапарез, мышечная спастичность, атаксия. Периферическая невропатия характеризуется парастезиями, слабостью и дистальной атрофией. Клинике СПИД-деменции свойственны ранние и поздние проявления (табл.12).
Больных обычно беспокоит головная боль, тревога с депрессией, нарушение равновесия, снижение остроты зрения, нарушение памяти.
Таблица 11. Неврологические проявления поражения нервной системы (по Price R.W., Brew B.J.,1997)
|
Топика поражения
|
Характер поражения
|
|
Головной мозг
|
|
|
а) преобладающие не очаговые
|
|
|
б) преобладающе очаговые
|
|
|
Спинной мозг
|
|
|
Оболочки мозга
|
|
|
|
|
|
Мышцы
|
|
Таблица 12. Клинические проявления СПИД-деменции
Ранние проявления
Симптомы:
1. Познавательная (умственная) способность:
- снижена концентрация
- снижение, потеря памяти
- умственная заторможенность
2.Двигательная сфера:
- шаткая походка
- слабость в ногах
- нарушение координации
- изменение почерка
- тремор
3. Поведение:
- апатия, замкнутость, депрессия
- говорливость, агрессивность, галлюцинации
Признаки:
1.Умственный статус
- психомоторная заторможенность
- психоз
2. Неврологическое обследование:
- появление патологических рефлексов(хоботковый,
хватательный)
- снижение согласованности движений - атаксия
- гиперрефлексия
- тремор
- слабость ног
Поздние проявления
Умственный статус:
- общая деменция
- психомоторная заторможенность( замедление ответа на устный
вопрос, умеренный или абсолютный мутизм, рассеянный взгляд,
бессознательное состояние, расторможенность)
- возбуждение, дезориентация,
- психоз
Неврологические изменения:
- слабость( ног > рук)
- атаксия
- пирамидные спастические параличи, гиперрефлексия,
- недержание мочи, стула
- миоклонус
Поражение желудочно-кишечного тракта
Желудочно-кишечный тракт вовлекается в патологический процесс при ВИЧ-инфекции постоянно и может поражаться в различные сроки болезни, так как некоторые клеточные образования его являются мишенью для вируса. Вирус обнаруживается в различных клетках не только слизистой оболочки прямой кишки, особенно у гомосексуалистов, но и во всех отделах кишечника, в клетках, не имеющих CD4 рецепторов. Очевидно, проникновение вируса в ткани происходит при межклеточном обмене, минуя свободное существование. Сам вирус обусловливает дегенеративные изменения крипт, частично атрофию микроворсинок, в силу чего нарушается пристеночное пищеварение и всасывание. Происходит не только морфо-функциональное нарушение стенки кишечника, но и снижение его резистентности, развитие дисбактериоза и развитие инфекционного процесса, склонного к упорному течению и рецидивированию. Характер поражения может как диффузным, так и локальным в виде стоматита, эзофагита, дуоденита, некротизирующего энтерита, язвенного и псевдомембранозного колита, проктита и др.
Диарея - одно из наиболее характерных клинических проявлений поражения желудочно-кишечного тракта при ВИЧ-инфекции, она наблюдается у 70% больных. К наиболее характерным симптомам поражения желудочно-кишечного тракта относятся:
1. Жалобы больного
- диарея длительностью свыше 1 мес,
- дисфагия, болезненность при глотании,
- вздутие живота,
- эпигастральные, колитические боли,
2. Объективно со стороны желудочно-кишечного тракта могут быть
- лейкоплакия,
- кандидозные бляшки,
- эрозии и язвы на слизистой пищевода,
- изъязвления в перианальной области,
- саркома Капоши толстой кишки,
- гепато- спленомегалия.
Среди возбудителей, вызывающих поражение желудочно-кишечного тракта чаще
всего выявляются грибы Кандида, сальмонеллы, шигеллы, вирусы простого герпеса и цитомегаловирус, криптоспоридии и изоспоры (табл. 13).
Таблица 13. Энтеропатогены, встречающиеся при ВИЧ-инфекции
|
Место нахождения
|
ВИЧ-инфекция с диареей
|
|
Рот
|
|
|
Пищевод
|
|
|
Тонкая и толстая кишки
|
|
|
Аноректальная зона
|
|
Поражения кожи и слизистых оболочек
Поражения кожи и слизистых оболочек при ВИЧ-инфекции относятся к постоянным проявлениям клиники, они имеют место у 84% больны. Из 12 СПИД-индикаторных болезней 5 относятся к патологии кожи. В динамике ВИЧ-инфекции поражения кожи и слизистых оболочек носят рецидивирующий характер, с периодами обострений и ремиссий, а в далеко зашедших фазах болезни преобретают тяжелые, не свойственные их клинике варианты. Этиологически разнообразные виды патологии кожи и слизистых у больных имеют определенную географическую зависимость. Среди патологий кожи наиболее часто встречаются вирусные (простой герпес, опоясывающий герпес, волосатая” лейкоплакия рта, вызванная вирусами Эпштейна-Барр экзантема, остроконечные кондиломы, вызванные вирусом папилломы, кореподобная и краснушноподобная экзантема), бактериальные (пиодермия шанкриформная, стрепто- стафилодермия, кожно-слизистые язвы, бактериальные абсцессы, фурункулез, фолликулит, импетиго, экзема, микобактериальная инфекция, актиномикоз, атипический сифилис, синдром "обожженной кожи"), микотические (кандидоз, дерматомикозы, криптококкоз, гистоплазмоз, отрубевидный лишай) паразитарные (чесотка) инфекции, сосудистые поражения (васкулиты, телеангиэктазии, геморрагии, тромбоцитопеническая пурпура), опухоли (саркома Капоши, лимфома, плоский рак, миелома), папулосквамозные дерматозы (себорейный дерматит, псориаз, розовый лишай). Группу характерных для ВИЧ-инфекции патологий слизистых оболочек входят ангулярный стоматит, афтоз,простой и некротический гингивит.
Наряду с кожей и слизистыми оболочками нередко у больных выявляется павтология волос и ногтей в виде истончения волос, гипертрихоза, очаговой алопеции, деформации ногтей, изменение их цвета.
Патология кожи и слизистых обусловлена как формирующимся иммунодефицитом, так и непосредственным эффектом ВИЧ.
Примером прямой зависимости поражения кожи от ВИЧ-инфекции может служить папилломавирусная инфекция кожи и слизистых. Насчитывается свыше 85 типов папилломавирусов, но возможность их вызывать клинически манифестные формы болезни во многом определяется возрастом человека, состоянием иммунной системы организма. Поэтому у больных ВИЧ-инфекцией частота поражения папилломавирусом значительно возрастает. Обследование ВИЧ-инфицированных женщин в США, Европе, Африке и Южной Азии методами гибридизации ДНК и ПЦР позволило выявить генитальный тип папилломавируса у 8-49% серонегативных и у 37-78% ВИЧ-серопозитивных проституток, потребительниц внутривенных наркотиков. Напримр, в США среди потребительниц внутривенных наркотиков проституток, не инфицированных ВИЧ папилломавирус обнаружен в 7%, а среди ВИЧ-серопозитивных – в 32% (Van Dournum G.J.; 1993; Kiviat N.B.,1997). Среди потребительниц внутривенных наркотиков США, обусловленные папилломавирусом внутриэпителиальные опухоли встречаются в 31% в группе ВИЧ-инфицированных и лишь в 4% у ВИЧ-негативных женщин (Feingold A.R.,1990).
Поражения кожи и слизистых оболочек, как суперинфекция у больных ВИЧ/СПИД приобретают клиническое течение мало характерное для них у больных без иммунодефицита и плохо поддаются лечению.
В клинической диагносьтике ВИЧ-инфекции наибольшее значение имеют следующие виды патологии кожи и слизистых: микотическая инфекция (кандидоз, дерматормикозы, кератомикозы, криптококкоз), вирусная инфекция (опоясыывающий герпес, пузырькоавый лишай, "волосатая" лейкоплакия, контагиозный моллюск, вульгарные бородавки) бактериальная инфекция кожи, паразитозы кожи (чесотка), себорейный дерматит, пмсориаз, саркома Капоши, лимфома.
Моче-половые проявления СПИД
Поражение моче-половой системы при ВИЧ-инфекции обусловлено как непосредственно вирусом, так и является следствием вторичных осложнений инфекционного процесса. Простата имеет собственный механизм защиты от бактериальной инфекции, включающий спермин, спермидин, антибактериальный фактор простаты. Но у больных ВИЧ-инфекцией местный иммунодефицит, в частности снижение бактерицидных свойств простатической жидкости, по-видимому, является причиной развития бактериальной инфекции.
Атрофия тестикул чаще всего наблюдается у больных ВИЧ/СПИД, занимая второе место у больных. Опухоли яичек занимают третье место из наиболее распространенных СПИД-ассоциируемых опухолей, следуя за саркомой Капоши и неходжкинской лимфомой.
Документально передача вируса через слезы, мочу или предъякулят не доказана. Более высока концентрация вируса в семенной жидкости, чем в вагинальных секретах. Поэтому передача вируса во время полового акта от мужчины женщине примерно в 2 раза выше, чем от женщины к мужчине. Вагинальный эпителий - барьер для вируса, пока на нем нет язв или повреждений. Шейка матки наиболее вероятный путь проникновения вируса, особенно во время месячных или вскоре после них. Антиспермициды, часто используемые для предотвращения беременности и защиты от вируса могут в действительности повысить передачу вируса, раздражая вагину.
Передача вируса от женщины к мужчине наиболее вероятно происходит во время месячных, при анальном половом акте или инфекционный процесс у женщины далеко зашел и характеризуется высокой виремией. Оральный секс – невысокий риск передачи вируса, так как в слюне концентрация вируса мала, значительно уступая ей в половых секретах, если только слизистые барьеры не повреждены ни у партнера, осуществляющего оральный секс, ни у реципиента. Среди гомосексуалистов пассивный партнер во время анального полового акта имеет более высокий риск инфицирования, чем активный. Ссадины анального канала и/ или прямое воздействие на слизистую повышают риск инфицирования пассивного партнера.
Miles et al. (1996) нашли в 16% поражение половой системы и в 17% мочевыводящих путей у больных ВИЧ-инфекцией. Дисфункция мочевыводящих путей обусловливает стаз мочи с последующим развитием инфекции моче-половой системы. В ј случаев инфекция обусловлена E. coli, в 1/3 – P. aeruginosa и проявляется дизурией, частыми позывами и часто гематурией. Помимо E. coli, наиболее типичных возбудителей простатита, у больных ВИЧ-инфекцией воспалительный процесс также вызывают Stap. aureus, Klebsiella pneumoniae, Р. aeruginosa, Serratia marcesxens, S. typhi, а также вирусы и грибы. Большинство грам-отрицательных бактерий вызывают простатит, забрасываясь из инфицированной мочи в простатические ходы. Stap. aureus распространяется гематогенно или через инструментарий.
Микобактерии туберкулеза и атипические осложняют ВИЧ-инфекцию не редко с локализацией процесса в легких, но они также могут вызывать простатит.
Вирусы, включая ВИЧ, цитомегаловирус также обусловливают развитие простатита. Так как цитиомегаловирус располагается внутриклеточно и мало поддается терапии, у больных процесс приобретает рецидивирующий характер.
Cреди грибов Cryptococcus neoformans и Histoplasma capsulatum чаще всего вызывают простатит у больных ВИЧ-инфекцией. даже после успешной терапии первичной грибковой инфекции в простате сохраняются эти возбудители в виде персистирующих субклинических фокусов, со временм обусловливая рецидив.
Проблемой у больных в развитой стадии ВИЧ-инфекции являются также абсцессы простаты, особенно если у больных имеются такие предрасполагающие факторы, как сахарный диабет, ранее проводившаяся катетеризация мочевыводящих путей, инструментальное обследование, обструкция мочевых путей. Рост заболеваемсти типичными и атипичными формами воспалений мочевыводящих путей, простатита, абсцессами простаты, отмечаемый в настоящее время, связан с пандемией ВИЧ-инфекции.
У здоровых людей острый бактериальный простатит по данным клинических проявлений, пальцевого ректального обследования и результатов бактериологического исследования мочи обнаруживается в 1-2%, у асимптоматических больных ВИЧ-инфекцией – в 3%, а у больных СПИДом – в 14% (Staiman V.R. et al., 1997).
Хотя поражение вызвано микроорганизмами, выделить культуру из мочи удается не всегда, так как больные СПИДом получают антимикробные препараты с целью профилактики суперинфекций или лечатся по поводу пневмонии или диареи. Легче выделить возбудитель из секрета простаты или получить уринокультуру после массажа простаты, так как чаще при бактериальном поражении моче-половой системы у больных ВИЧ-инфекцией возбидители локализуются именно в простате.
У многих больных ВИЧ-инфекцией, даже не имеющих симптомов поражения моче-половой системы обнаруживается микроскоопически гематурия. Так, Сеspades et al. (1996) нашли микрогематурию у ј из 1326 обследованных больных, но у большинства из них явления прошли самостоятельно, больные не нуждались в лечении у уролога, если до того у больных не было поражений почек или урогенитальной системы.
Наиболее типичное проявление абсцесса простаты – острая задержка мочи, лихорадка, дизурия, частые мочеиспускания, боль. Клинически выявляется увеличение размеров простаты у 75% больных. Бактериологические исследование мочи чаще не дает результатов. При выделении возбудителя наиболее типичны – Enterobacteriaceae и другие грамм-отрицательные микробы. грибы. Лечение длительное, но не предотвращает от рецидивов. Так как антимикробные препараты плохо проникают в ткань простаты, хирургический дренаж в сочетании с антимикробной терапией наиболее оправдан.
Атрофия тестикул – наиболее частое нарушение тестикул у больных ВИЧ/СПИДом. Частота развития атрофии коррелирует с длительность ВИЧ-инфнекции, глубиной иммунодефицита, длительностью лихорадки, истощением больного. Гистологичечки обнаруживается перитубулярное интерстициальное воспаление, интерстициальный фибюроз, гиалинизация туберкулярных мембран, сосудистые нарушения, ведущие к ишемии и последующей атрофии. Значительно уменьшается сперматогенез, созревание сперматозоидов останавливается на стадии сперматоцитов.
Наиболее частое СПИД-ассоциируемое эндокринное нарушение – нарушение гипофизаро-гипоталямо-тестикулярной оси, встречающееся у ј-1/3 больных. Атрофия тестикул может быть следствием гипогонадизма. ВИЧ сам по себе оказывает цитопатический эффект на герминативную ткань и Сертолиевы клетки, что также может быть причиной атрофии яичек.
ВИЧ также связывают с причиной втортичных поражений яичек. Такие условнопатогенные возбудители, как CMV, атипические микобактерии, вызывая поражение тестикул, ведут к их атрофии. По данным литературы у 14-26% больных ВИЧ-инфекцией имеют цитомегаловирусное поражение яичек. CMV передается половым путем и локализуется интратуберкулярно, в интерстициальной ткани, в эндотелии, вызывая орхит, гранулематозные изменения, сосудистые нарушения, в конечном итлоге приводя к атрофии тестикул. Примерно у 15% больных ВИЧ-инфекцией и у 30-40% больных в стадии СПИД в течение их жизни развивается карцинома.
Опухоли яичек занимают третье место после саркомы капоши и неходжкинской лимфомы. В популяции людей, не инфицированных ВИЧ они встречаются в 0,004%, а у больных ВИЧ-инфекцией – в в 0,2%, т.е. частота возрастает в 50 раз. В общей популяции опухоли яичек связаны с крипторхизмом, паховой грыжей, орхитом. В общей популяции среди опухолей 40% приходится на семиномы, а у больных ВИЧ-инфекцией чаще встречаются опухоли не семиномной природы. Терапия обычно включает хирургические лечение, облучение и химиотерапию, больные умирают быстрее от основного заболевания, чем разовьется рецидив опухоли.
Лимфома яичек встречается примерно у 5% больных (тестикулярная неоплазма), чаще у лиц стране 50 лет.
У 60% больных снижено либидо, у 1/3 развивается импотенция. Импотенция чаще связана с психотравмой и нейрогенными факторами, в частности, СПИД-деменцией, а также в связи с суперинфекцией и злокачественными опухолями.
О п у х о л и
Саркома Капоши. В группу СПИД-ассоциируемых заболеваний входит саркома Капоши, которая, в отличие от саркомы не эпидемического характера, поражает лиц молодого возраста и носит прогрессирующий характер.
В 1872 году венгр Мориц Капоши описал заболевание под названием “множественная идиопатическая пигментная гемангиосаркома”. Заболевание в основном проявлялось в виде локализованных узлов коричнево-красного - синюшно-красного цвета с локализацией преимущественно на коже нижних конечностей, чаще у мужчин в возрасте старше 40 лет. Сегодня это классическая форма саркомы Капоши (табл. 14).
Таблица 14. Сравнительная характеристика вариантов саркомы Капоши
|
Вариант
|
Популяция
|
Клиническая характеристика
|
Течение
|
| Классический | Преимущественно европейцы 50-80 лет | Чаще кожа нижних конечностей в виде генерализованных новообразований кровеносных сосудов и расширением капилляров, образующих полости различной формы и величины | Медленное, 10-15 лет, в 1/3 ассоциирует с другими злокачественными опухолями |
| Африканский | Молодой возраст (25-40 лет) негры Центральной Америки | Локализация изменчива, характеризуется обширными агрессивно протекающими экзофитными опухолями или опухоли проникают в кости нижних конечностей (соотношение мужчины/женщины - 3/1) | Медленное, если нодулярная форма, в остальных случаях медленно прогрессирующее течение с неблагоприятным исходом в ближайшие 5-8 лет |
| Дети 2-13 лет | Генерализованный лимфаденоматоз, реже вовлекаются кости (соотношение мужчины/женщины - 3/1) | ||
| При пересадке почек | Чаще евреи и жители средиземноморья, ятрогенное заболевание | Может локализоваться в костях или процесс широко распространен с вовлечением тканей (соотношение мужчины/женщины - 3/1) | Медленно или быстро прогрессирует, летальность 30% |
| Эпидемический | Больные СПИД | Диссеминированный процесс с поражением слизистых оболочек и кожи, вовлечением лимфатических узлов и висцеральных органов, чаще желудочно-кишечного тракта и легких. Часто протекает в ассоциации с оппортунистической инфекцией | Фульминантное течение, менее чем 20% заболевлевших выживает свыше 2 лет |
В ходе пандемии ВИЧ-инфекции прослеживается изменение частоты ее развития у больных. Так, по данным Center for Disease Control and Prevention (CDC), если в первые годы пандемии она встречалась у каждого третьего больного СПИДом, то к 1992 году - у 1 из 10 (табл. 15). Особенно часто саркома Капоши выявлялась у гомо- и бисексуалистов. Редко ее встречали среди больных ВИЧ-инфекцией детей.
Таблица 15. Случаи СПИДа с предполагаемым или точным наличием саркомы Капоши по годам (CDC) на декабрь 1992 года
|
Годы
|
Всего больных СПИДом
|
Больных с саркомой Капоши
|
|
1981-1983
|
2 931
|
32,7
|
|
1984
|
4 510
|
27,8
|
|
1985
|
8 308
|
22,4
|
|
1986
|
13 262
|
19,3
|
|
1987
|
21 276
|
15,5
|
|
1988
|
31 964
|
12,7
|
|
1989
|
35 085
|
12,1
|
|
1990
|
43 336
|
12,0
|
|
1991
|
45 456
|
11,1
|
|
1992
|
47 194
|
9,9
|
|
Всего
|
253 322
|
13,1
|
Этиология. Поиск возбудителя начался задолго до появления ВИЧ-инфекции. В качестве этиологических факторов предполагали CMV, вирус Эпштейна-Барр и другие. В 1995 году Chang and Moore описали новый человеческий герпес-вирус (первоначально названный “с саркомой Капоши ассоциированный герпес-вирус”), позже получивший название человеческий герпес-вирус тип 8 (HHV8). ДНК этого вируса постоянно обнаруживается в ткани СПИД-ассоциируемой саркомы Капоши, в то время как в нормальной ткани соседних участков не выявляется. В последующие годы было установлено, что HHV8 связан со всеми типами саркомы Капоши, включая эндемическую у африканцев, классическую у пожилых людей средиземноморья и трансплантат-связанную. Показано, что за 3-10 лет развитию саркомы Капоши предшествует инфекция, вызванная HHV8. Механизм передачи вируса неивестен. С помощью ПЦР одни авторы вирус обнаруживали в семенной жидкости и сперме, хотя другие этого не подтвердили. HHV8 был выявлен в эндотелиальных клетках, циркулирующих CD20+ лимфоцитах (В-клетки), носовом секрете, бронхоальвеолярной леважной жидкости у больных с легочной локализацией саркомы Капоши.
Сейчас все больше специалистов приходит к мнению, что хотя HHV8 необходим для развития саркомы Капоши, но для ее развития у конкретного человека этого недостаточно. Показано наличие вируса в организме без каких-либо признаком саркомы. Установлено, что распространение HHV8 среди здоровой популяции возрастает в географических зонах, где исторически была высока заболеваемость саркомой Капоши – средиземноморье Европы, эндемические очаги Африки.
Помимо HHV8 множество других факторов влияют на манифестаци. саркомы Капоши, в частности провоспалительные цитокины и другие субстанции, продуцируемые ВИЧ-инфицированными мононуклеарами, как ответ на инфекцию, служат мощным фактором роста клеток саркомы Капоши. Эти факторы включают ИЛ-6, ИЛ-1-бета, основной фибробластический фактор роста, сосудистый эндотелиальный фактор роста, трансформирующий фактор роста-бета и др. Все они могут играть роль регуляторов роста существующих клеток саркомы Капоши. Аналогичную роль играет tat-белок ВИЧ (Levine A., 1998)..
Патогенез. Первоначально предполагалось, что иммунодефицит является предпосылкой развития саркомы Капоши. Так, еще до пандемии ВИЧ-инфекции выявили, что у рецепиентов почек развивается иммуносупрессия и чаще развивается ятрогенная форма саркомы Капоши. После отмены иммуносупрессантов клиническая картина регрессирует. Пандемия, казалось, укрепила эту точку зрения. Но через несколько лет после начала пандемии выявили, что у ряда лиц саркома развивается при отсутствии иммуносупрессии, при нормальной функции иммунной системы. Стало очевидным, что ВИЧ-инфекция может сопровождаться развитием саркомы Капоши без нарушения функции иммунной системы. Следовательно, механизм развития ее не коррелирует с иммунодефицитом. Дальше было установлено, что активация (а не депрессия!) иммунной системы играет существенную роль в патогенезе саркомы Капоши. Это положение первоначально трактовалось справедливым только для классического, эндемического и ятрогенного вариантов саркомы Капоши. Исследования показали, что у больных с классическим вариантом саркомы Капоши высок уровень анти-CMV. Это было расценено, как стимулирующий CMV для развития саркомы. В африканском варианте саркомы Капоши широко распространенные паразитарные и инфекционные заболевания также расценивались, как постоянный источник антигенного стимула, обеспечивающего развитие саркомы. В случаях ятрогенной саркомы Капоши постоянное инфицирование рецепиентов почек CMV, вирусом Эпштейна-Барр, HSV также является источником постоянного антигенного стимула, обеспечивающего развитие саркомы. Этому же способствует действие аллотрансплантата. Затем было установлено, что СПИД-ассоциированную саркому Капоши стимулируют глюкокортикостероиды, такие иммуносупрессоры, как циклоспорин. Следовательно, лекарственные средства, обусловливающие снижение уровня Т-супрессоров и этим активацию иммунной системы, также стимулируют развитие саркомы Капоши.
Гомо/бисексуалисты подвержены хроническому антигенному стимулу за счет постоянного инфицирования половым путем различными грибками, простейшими, бактериями и вирусами. Антигенным стимулом служит и сперма. Постоянное травмирование слизистой оболочки кишечника облегчает проникновение антигенов и иммунизировать организм. Поэтому у ВИЧ-инфицированных гомо/бисексуалистов выше уровень саркомы Капоши . Именно этими обстоятельствами объясняется тот факт, что у больных СПИД-ассоциированной саркомой Капоши не имеет места иммуносупрессия и, наоборот, выявляются признаки иммунной активности. Очевидно, этим объясняется то обстоятельство, что ВИЧ-инфицированные с ранним развитием саркомы Капоши живут дольше, чем те, у кого имеет место дисфункция иммунной системы с развитием оппортунистической инфекции .
Вопрос о генетической предрасположенности к саркоме Капоши также изучался всесторонне. Так, было установлено, что у молодых итальянцев и евреев со СПИД-ассоциированной саркомой Капоши и в определенных регионах Африки при эндемической ее форме имеет место кластерное распределение болезни, что свидетельствует о генетической предрасположенности. Также было показано, что частота саркомы коррелирует с HLA DR5 у итальянцев и евреев и HLA DR2 у других европейцев (Safai B. еt al., 1991). Но число случаев саркомы Капоши среди членов одной семьи не велико и нет менделевского принципа ее наследования на популяционном уровне. Нет на популяционном уровне и зависимости распространения саркомы Капоши с принадлежностью HLA.
Патогенетический цикл развития СПИД-ассоциированной саркомы Капоши состоит из ряда последовательных превращений. Необходима генетическая предрасположенность, иммунная недостаточность (больные ВИЧ, инфекцией, старость при классической саркоме Капоши, малярия или другие хронические инфекции и инвазии у жителей Африки, лекарственная иммуносупрессия после пересадки органов). При наличии иммунодефицита HHV8 активизируется, приводя к серии изменений, приводящих в конечном результате к трансформации нормальных клеток эндотелия сосудов в злокачественные, к опухолевому росту. HHV8 несет несколько вирусных генов (вирусный циклин D ген, вирусный ИЛ-6 и др.) которые теоретически могут вести к нарушению регуляции клеточного цикла.
Эпидемиология. Заболеваемость саркомой Капоши росла драматические в первое десятилетие пандемии, главным образом у мужчин-гомосексуалистов. ВИЧ-инфекции, в последние 5 лет она стала встречаться значительно реже. Снижение ее совпадает с ростом применения комбинации антиретровирусной терапии, в частности внедрения ингибиторов протеаз. В исследованиях, проведенных в Сан-Франциско при обследовании 60704 мужчин-гомосексуалистов Buchbinder et al. (1997) показано, что с внедрением комбинированной высокоактивной антиретровирусной терапии индекс СПИД-диагнозов СПИД на 100 больных снизился с 17,6 в 1993 до 1,7 в 1996 году и одновременно существенно снизилась встречаемость саркомы Капоши с 3 на 100 инфицированных до 0 в 1996 году. Сходные данные получили другие авторы: в 1985 году число больных с саркомой Капоши составило 25,6 на 100 больных, в 1996 году – 7,5 из 5622 больных гомо/бисексуалистов. Следовательно, заболеваепмость саркомой Капоши у больных ВИЧ-инфекцией значительно снизилась и снижение совпадает с масштабами применения высокоактивной антиретровирусной терапии гомо/бисексуалистов.
Клиника. Течение саркомы Капоши подразделяется на несколько стадий (табл. 16). В 92% саркома Капоши проявляется локализацией на коже. Патологический процесс у больных ВИЧ-инфекцией в начальной фазе локализован, но по мере прогрессирования СПИДа саркома приобретает генерализованный характер.
Таблица 16. Клинические проявления при саркоме Капоши
|
Стадия
|
Характер поражения
|
|
Стадия 1
|
Кожные проявления, локализованное торпидное течение
(классическое)
|
|
Стадия II
|
Кожные проявления, локализованное агрессивное течение
с увеличением или без увеличения лимфатических узлов (африканский локализованный
агрессивный вариант)
|
|
Стадия III
|
Генерализованные кожные проявления и/или поражение лимфатических
узлов (африканская лимфаденопатия и эндемический вариант)
|
|
Стадия IV
|
Висцеральные проявления (эпидемический вариант)
|
|
Подтипы:
|
|
Еще до развития пандемии ВИЧ-инфекции J.F.Taylor et al. (1971) предложили классификационные варианты саркомы Капоши, сохранившие свое значение и сегодня (табл. 17). Хотя преимущественно саркома локализуется на коже, но нередко вовлекаются в процесс и другие органы и ткани (табл.18 ).
Таблица 17. Классификация саркомы Капоши по J.F.Taylor et al.(1971)
|
Клинический тип опухоли кожи
|
Характеристика
|
Возраст
|
Вовлечение тип опухоли костей, лимфоузлов, кожи
|
|
Узловая
|
болезненная
|
> 25
|
редко
|
|
Цветущая (экзофитная)
|
локально агрессивная
|
> 25
|
часто
|
|
Инфильтративная
|
локально агрессивная
|
> 25
|
редко
|
|
Лимфаденопатическая
|
распространенно агрессивная
|
< 25
|
постоянно
|
Клинически при саркоме Капоши у ВИЧ- больных в 2/3 случаев поражение кожи носят распространенный характер, у 61% больных имеет место генерализованное вовлечение в патологический процесс лимфатический узлов, в 45% поражен желудочно-кишечный тракт. В стадии СПИДа саркома нередко поражает внутренние органы (рис. 18).
Таблица 18. Топография и проявления саркомы Капоши у больных СПИДом
|
Проявления
|
встречаемость,%
|
| Поражения кожи: | |
| отсутствуют |
8
|
| локализованные |
27
|
| генерализованные |
63
|
| локализованные, прогрессирующие |
2
|
| Вовлечение в процесс лимфатических узлов: | |
| отсутствует |
39
|
| генерализованное |
61
|
| Спленомегалия |
10
|
| Вовлечение в патологический процесс внутренних органов и тканей: | |
| костей |
2
|
| печень |
10
|
| легкие |
10
|
| желудочно-кишечный тракт |
45
|
| Общие реакции: | |
| повышение температуры и падение массы тела |
18
|
| только повышение температуры |
8
|
| только потеря массы тела |
2
|
Прогностическими критериями клинического течения болезни могут быть гематокрит, уровень Т-лимфоцитов и в первую очередь CD4+ клеток, соотношение CD4/CD8, уровень альфа-нтерферона (табл. 19). Наряду с клиникой в оценке прогноза течения саркомы Капоши помогает характеристика Т-хелперной субпопуляции лимфоцитов (табл.20 ).
Таблица 19. Прогностические факторы при эпидемической саркоме Капоши
|
Клинические проявления
|
Показатели
|
| Степень выраженности болезни | Гематокрит |
| Вовлечение в патологический процесс висцеральных органов | Абсолютное содержание Т-хелперов |
| Симптомы общего поражения организма (потеря массы тела, повышение температуры) | Соотношение Тх/Тс |
| Предшевствовавшая или присоединившаяся оппортунистическая инфекция | Альфа-интерферон |
Таблица 20. Показатели Т-клеток у больных саркомой Капоши
|
П р о г н о з
|
Хороший
|
Удовлетворительный
|
Плохой
|
|
Т-хелперы (в 1 мкл) (у выживших более 12 мес.)
|
>300 (85%)
|
300-100
|
<100
|
|
Тх/Тс ( у выживших более 12 мес.)
|
> 0,5 (95%)
|
0,5 - 0,2
|
< 0,2 (25%)
|
Лечение. Сегодня имеется достаточно много химиопрепаратов, рекомендуемых для лечения саркомы Капоши у больных СПИДом (табл. 21), хотя эффект от терапии не всегда удовлетворителен, а главное, на фоне имимиунодефицита даже положительный терапевтический эффект при лечении саркомы не определеяет исход болезни.
Таблица 21. Эффективность терапии эпидемической саркомы Капоши
| Лечение |
Эффект, %
|
| Химиотерапия: | |
| винбластин |
26
|
| этопозид |
76
|
| винкристин |
61
|
| блеомицин |
77
|
| винкристин+винбластин |
45
|
| блеомицин+винбластин |
62
|
| винбластин+метотрексат |
77
|
| доксорубицин+блеомицин+винбластин |
66-86
|
Выбор терапии зависит от формы болезни, локализации процесса, общей характеристики ВИЧ-инфекции. Местное лечение в основном преследует контроль общей эффективности, улучшения внешнего вида больного. В виде местной терапии проводится удаление хирургически путем опухоли, введения в нее винбластина, электрокоагуляции. Радиотерапия при классическом варианте саркомы Капоши применялась часто и используется при СПИД-ассоциированной форме саркомы. Дозы и виды облучения, техника разнообразны от широкопольного облучения при инфильтративной форме саркомы до местного облучения при анатомически неудобных локализациях (лицо, полость рта). Полной регрессии удается добиться в 68 % , только у 9% больных местно процесс прогрессировал (Cooper J.et al., 1991). Но этот вид терапии дорогостоящий и требует длительного времени. Применение винбластина путем введения в опухоль у 190 больных дало положительный эффект в 13%, частичный - у 78% больных (Newmman S.,1988).
Системная химиотерапия раньше использовалась редко, так как классическая саркома Капоши с хорошим результатом лечилась местно. Агрессивный характер СПИД-ассоциируемой саркомы, особенно с вовлечением в процесс лимфатических узлов и висцеральных органов обусловливают необходимость проведения системной химиотерапии. Правда, наличие анемии, оппортунистической инфекции, иммунодефицита ограничивают масштабы и завершенность ее применения у всех нуждающихся больных. Тем не менее она применяется в виде монотерапии при сравнительно умеренно выраженных вариантах клиники и комбинированная химиотерапия - при выраженных. Успех удается добиться у 26-76% больных (Glaspy G. et al., 1986; Schaart F. et al.,1991). Лучшие результаты (88%) получены при применении малых доз адриамицина, блеомицина и винкристина (Gill P.S. et al.,1991). Оппортунистическая инфекция в этой группе развилась в 25% против 61% в группах больных, которым эти лекарственные препараты давали в стандартных дозах.
В последние годы в арсенал терапевтических средств при саркоме Капоши включают иммуномодуляторы. В частности альфа-интерферон и стимуляторы эндогенного интерферона. Эффект лечения зависит от состояния иммунной системы: при низких показателях СD4+ клеток периферической крови эффект часто минимален или отсутствует. Снижает эффективность лечения анемия, при выраженной клинике оппортунистической инфекции.
Получены убедительные данные, что активная антиретровирусная терапия (тритерапия) оказывает лечебный и профилактический эффект и против саркомы Капоши. Весьма эффективны липосомальные антрациклины. Так доксил (липосомальный доксорубицин) вызывает ремиссию у 43% больных при курсе 20 мг/м кв. в вену каждые 2 недели. Дауноксом (липосомальный даунорубицин) вызывает ремиссию у 28% больных при введении в вену по 40 мг/ кв.м. каждые 2 недели. Терапия дауноксом также эффективна, а доксилом более эффективна. чем “золотой стандарт” - адриамицин, блеомицин и винкристин, использунемые в комбинации.
Паклитаксел (таксол) лицензирован в США в 1997 году для лечения рецидивов саркомы Капоши как чрезвычайно эффективный препарат. Лечение проводят инфузионно по 100 мг/ кв.м. с введением каждые 2 недели. У 57% больных имеется частичная ремиссия и у 2% полная ремиссия. Препарат умеренно токсичен: у 61% больных значительная нейтропения, у 87% - анемия (Levine A., 1998).
Единого подхода к терапии больных нет, но предпочтение отдается монотерапии перед политерапией, к последней рекомендуется прибегать после отсутствия эффекта от применения одного лекарственного препарата.
Лимфома. Среди злокачествнных форм поражения лимфоидной ткани выделяются лимфогранулематоз (син. Болезнь Ходжкина) и неходжкинские лимфомы (син: лимфосаркомы). Под лимфомой понимают опухоли, исходящие из лимфоидной ткани, а по типу роста нодулярные и диффузные, причем первые часто трансформируются во вторые. По клеточному составу диффузные лимфомы дифференцируются на небластные, включающие лимфоцитарные, пролимфоцитарные, лимфоплазмоцитарные клетки и бластные, представленные лимфобластами иммунобластами (табл. 22). В последней группе при ВИЧ-инфекции наибольший интерес представляют лимфома Беркитта (африканская лимфома), этиологически связанная с вирусом Эпштейна-Барр, как все бластные лимфомы, характеризующаяся злокачественным течением и быстрой генерализацией.
Таблица 22. Гистологическая характеристика неходжкинских лимфом (по Nadler L.M., 1993)
|
Характеристика злокачественности лимфоцитов
|
Характер клеток
|
Уд.вес клеток, %
|
|
|
В-клетки
|
Т-клетки
|
||
| Слабая степень | |||
| А. малые лимфоциты | Диффузная форма, дифференцированные лимфоциты |
98
|
2
|
| В. фолликулы, в основном из малых лимфоцитов | Узловая форма, недифференцированные лимфоциты |
100
|
|
| С. фолликулы из смешанных малых и больших клеток | Узловая форма, смешанные лимфоциты-гистиоциты |
100
|
|
| Средняя степень | |||
| Д. фолликулы, в основном из больших клеток | Узловая форма, гистиоциты |
100
|
|
| Е. диффузное распространение маленьких лимфоцитов | Диффузная форма, недифференцированные лимфоциты |
80
|
20
|
| Ж. диффузное распространение смешанных маленьких и больших клеток | Диффузная форма, лимфоциты-гистиоциты |
90
|
10
|
| З. Диффузное распространение, большие клетки | Диффузная форма, гистиоциты |
80
|
20
|
| Высокая степень | |||
| И. Большие иммунобласты | Диффузная форма, гистиоциты |
80
|
20
|
| К. Лимфобласты | Диффузная форма, лимфобласты |
10
|
90
|
| Л. Малые незрелые клетки, Беркетта | Диффузная форма, недифференцированные клетки |
95
|
5
|
Лимфома – вторая по частоте опухоль у больных ВИЧ-инфекцией, встречается в 3-4%. Этот вид опухолей – более поздние проявление болезни и примерно 12-16% больных в стадии СПИД умирают от лимфомы. В отличие от саркомы Капоши лимфома не связана с какой-либо группой риска. Из 53 042 больных в стадии СПИДа 21 стран мира лимфома развилась у 2,6% инъекционных наркоманов, 3,2% трансфузионных рецепиентов, 3,4% мужчин-гомосексуалистов, 3,9% больных гемофилией, 2,6% больных, заразившихся при гетеросексуальном контакте (Levine A., 1998).
Есть мнение, что азидотимидин индуцирует развитие лимфомы, хотя нельзя исключить. что под влиянием терапии АЗТ больные чаще доживают до развития лимфомы. Пока не установлено, снижает ли развитие ее активная антиретровирусная терапия.
Этиология и патогенез. Лимфома формируется в результате длительной стимуляции и пролиферации В-клеток. Она может быть индуцирована самим ВИЧ и приводить к поликлональной гипергаммаглобулинемии, хараектерной для ВИЧ-инфекции, так же как и к реактивной лимфаденопатии. При генерализованной лимфаденопатии формируется В-клеточная гиперплазия.
Помимо прямого эффекта на В-клетки ВИЧ может также проявить свои эффекты косвенно, индуцируя синтез цитокинов ВИЧ-инфицированными моноцитами и Т-клетками: продукцию ИЛ-6, ИЛ-10. Последние индуцируют пролиферацию В-клеток. Кроме того эти цитокины функционируют как факторы роста В-клеточной лимфомы, а ИЛ-10 является также мощным аутокринным фактором роста. В результате иммуносупресии развивается суперинфекция, обусловленная вирусом Эпштейна-Барр. В этих условиях возможны также генетические “ошибки”, что ведет к моноклональной В-клеточное лимфомы.
Наиболее вероятной первопричиной иммунобластной лимфрмы является вирус Эпштейна-Барр (EBV), ДНК которого постоянно обнаруживается в клетках опухоли. Установлена способность латентного мембранного белка вируса присоединяться к клеткам, давая сигнал к их делению.
К ко-факторам быстрого прогрессирования лимфомы относятся: число CD4+ клеток < 100 в мкл; возраст старше 35 лет; анамнез инъекционного наркомана; III или IV стадия ВИЧ-инфекции. Средняя продолжительность жизни больных с 2 или 3 такими факторами в среднем составляет 45 недель против 18 недель у больных с 3 и более плохих прогностических факторов.
В 1985 году СDС приводит первые данные о неходжкинской лимфоме у больных ВИЧ-инфекцией. Последующие исследования показали, что риск развития лимфомы у больных СПИДом в 100 раз выше, чем в популяции в целом. Среди факторов, предрасполагающих к высокому риску развития злокачественных лимфома преобладают состояния с иммунодефицитами (табл. 23).
Таблица 23. Заболевания, ассоциирующиеся с высоким риском развития
лимфом
I.Наследственные иммунодефициты
II.Приобретенные иммунодефициты
III.Аутоиммунные заболевания
IV.Химические и другие факторы
V. Вирусы (помимо ВИЧ)
Стадии болезни и локализация лимфомы у больных ВИЧ-инфекцией представлены в табл. 24. Причем первичная лимфома ЦНС встречается у 1-3 % больных ВИЧ/СПИД и обычно развивается при количестве CD4+лимфоцитов менее 50 в мкл.
Таблица 24. Клинические проявления СПИД-ассоциированной лимфомы ( по Levint A.M,1988)
|
Стадии
|
Частота, %
|
Локализация
|
Частота, %
|
|
1
|
4
|
Нервная система |
32
|
|
2
|
25
|
Желудочно-кишечный тракт |
26
|
|
3
|
10
|
Костный мозг |
25
|
|
4
|
63
|
Печень |
12
|
| Почки |
9
|
||
| Легкие |
9
|
||
| Сердце |
6
|
||
| Надпочечники |
6
|
Клинически при лимфоме Беркитта у половины больных выявляется первичное поражение периферических, внутригрудных, забрюшинных лимфатических узлов процесс развивается вне их, чаще в миндалинах, желудочно-кишечном тракте, коже, костях или других органах. Заболевание протекает с явлениями интоксикации, проявляющихся лихорадкой, исхуданием, ночными потами, локальным зудом, а также для клиники характерны аутоиммунная гемолитическая анемия, тромбоцитопения, экзантема.
В случаях поражения лимфатических узлов чаще на шее или надключичной области лимфатические узлы увеличены в размерах, плотноэластической консистенции, подвижны, так как не спаяны с окружающей клетчаткой. При поражении лимфатических узлов средостения развивается синдром верхней полой вены (расширение вен передней грудной стенки). При поражении миндалин появляется ощущение инородного тела в горле, миндалина быстро увеличивается в размерах. При локализации лимфомы в желудке, чаще в его теле или антральной области клиника напоминает рак или язвенную болезнь. Поражение толстой кишки напоминает также клинику рака. Возможны поражения и паренхиматозных органов.
Лечение системной СПИД-связанной лимфомы включает поливалентную химиотерапию даже при относительно локализованной лимфоме. Первоначально использовали стандартную итенсивно-дозовую схему химиотерапии, но плоная ремиссиЯ достигалась редко, а наслоение суперинфекции – частое. Применение низко-дозовой модификации с дополнительным использованием цитозин-арабинозы для защиты ЦНС позволило добиться ремиссии в 50%. Другая схема с использованием инфузии циклофосфамида (750 мг/кв.м.), доксорубицина (50 мг/кв.м) и этопозида (240 мг/кг) в течение 4 дней, повторные курсы каждые 28 дней (всего 6 курсов) позволила добиться ремиссии в 62% (Levine A., 1998). Комбинированное применение поливалентной химиотерапии и активной антиретровирусной терапии (циклофосфамид+диксорубицин+этопозид+саквинавир+ставудин+диданозин) повыщает частоту побочных эффектов: в 3-4 раза увеличивается уровень мукозидов. Однако, смертность снизилась до 13% против 83% не получавших активной антиретровирусной терапии.
Другие варианты опухолей. К СПИД-ассоциируемым опухолям также относится интраэпителиальная опухоль шейки матки и инвазивный рак шейки матки. Этиологически этот аид опухолей связвают с вирусом папилломатоза человека (HPV). На сегодня идентифицировано достаточно много типов HPV, HPV6 и HPV11 ассоциируются с вирусными кондиломами или с легкими диспластическими изменениями (цервикальная интраэпителиальная неоплазия –1) и не способствуют развитию в злокачественную опухоль. В то же время HPV типов 16,18, 31, 33 в большинстве случаев находят в клетках инвазивных карцином, а ДНК вируса интегрирован в ДНК клеток опухоли. HPV типы, вызывающие цервикальный рак, образуют определенные вирусные белки, названные Е6 и Е7, являющиеся фундаментальными в злокачественном преобразовании клеток. Е6 соединяется с р53-супрессорным геном, интактивируя его функцию, а Е7 связывается с другим супессором опухолей – геном ретинобластомы (Rb). В результате и р53 и Rb-белки угнетают атипичных прогрессирование клеточных циклов, инактивация этих белков ведет к дисрегуляции клеточного цикла.
Ко-факторам развития цервикальтной карциномы, обусловленной HPV являются ранняя половая жизнь, большое количество сексуальных партнеров, курение, иммуносупрессия.
У ВИЧ-инфицированных женщин (2015 чел.) HPV в ПЦР выявляются в 58%, в контроле (577 ВИЧ-негативных женщин) – в 28%.
Опухоли шейки матки диагностируются по данным цитологического исследования мазков цервикального канала (атипичные чешуйчатые клетки) или кольпоскопии с биопсией.
Лечение цервикальных интраэпителиальных опухолей зависит от стадии развития цитологических изменений. При I cтадии возможна спонтанная регрессия , но в стадии II и III необходимо лечения в целях предотвращения процесса в инвазивный рак шейки матки. Эффективна комбинированная терапия. включающая криотерапию, лазер, электротерапию тех поражений, которые видны при кольпоскопии и не поражают эндоцервикс. При более обширных поражениях - хирургическое лечение – резекция. У не инфицированных ВИЧ женщин рецидивы через год встречаются в 5-10%, у ВИЧ-инфицированных – в плоловине случаев. Поэтоиму больным дополнительно назначают 5-фторурацил в виде мази и дифторметилорнитин через рот, а также вводят HPV-вакцину.
Инвазивный рак шейки матки у больных ВИЧ-инфекцией женщин протекает более тяжело, чем у ВИЧ-негативных, у них быстрее развиваются метастазы: через 2-3 мес. в 100% возникают рецидивы, а среднее время жизни составляет 9 мес. у больных ВИЧ-инфекцией и 25 мес. у ВИЧ-негативных женщин.
В последние годы возросло не только число ВИЧ-инфицированных с различными опухолями, но и спектр опухолей. В том числе увеличилась встречаемость анальных карцином, болезни Ходжкина, множественной миеломы, семиномы, рака яичек, оро-фаренгиальной карциномы.
[an error occurred while processing this directive]