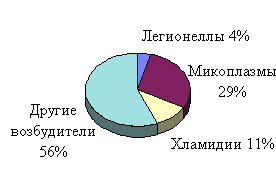 Расширение
антибактериального спектра макролидов нового поколения дало “вторую” жизнь этой
группе препаратов.
Расширение
антибактериального спектра макролидов нового поколения дало “вторую” жизнь этой
группе препаратов. Макролиды широко используются в клинической практике с начала 1950-х годов. Эритромицин - классический представитель антибиотиков группы макролидов - был выделен Ваксманом из Streptomyces erythreus в 1952 году. В конце 50-ых годов сложился взгляд на эритромицин как на антибиотик резерва, назначаемый при лечении стафилококковой инфекции, вызванной устойчивыми к пенициллину и другим антибиотикам штаммами, или в случаях аллергии к пенициллинам [131].
Частое применение эритромицина, особенно по поводу острых респираторных вирусных заболевний (ОРВИ), привело к выделению у больных высокого процента эритромицинустойчивых штаммов стафилококка и к нередким случаям неэффективности антибиотика при лечении стафилококковых инфекций. Кроме того, в эти же годы появилось ряд сообщений о плохой биодоступности таблетированного эритромицина, связанного с его кислотолабильностью и соответствующей инактивацией антибиотика в кислой среде желудочного сока. Это обусловило снижение интереса у врачей к эритромицину и частый отказ от него [7, 8, 131].
“Возрождение” макролидов произошло в середине 1970 - начале 1980 гг в связи с синтезирование новых препаратов этой группы. Особенности спектра действия макролидов и хорошая переносимость определили их место в современной терапии бактериальных инфекций.
Спектр антимикробной активности макролидов включает грамположительные и грамотрицательные кокки, Parvobacteriaceae (Bordetella pertussis), виды Legionella, Chlamydia, Mycoplasma, Ureaplasma urealyticum, Listeria monocytogenes. Макролиды нового поколения: азитромицин и кларитромицин помимо перечисленных выше микроорганизмов также активны против таких бактерий как Mycobacterium avium, Helicobacter pillory, Borrelia burgdorferi, Toxoplasma gondii [131].
Значительный интерес представляет антипаразитарная активность макролидов. Спирамицин оказался эффективным против мышиного токсоплазмоза, и в течение многих лет применяется в Европе с целью предотвратить передачу инфекции от беременных женщин плоду [49, 72]. Исследуется потенциал макролидов для лечения других паразитарных болезней (лямблиоз, изоспороз, амебиаз).Полиеновый антибиотик широкого спектра действия из группы макролидов натамицин оказывает фунгицидное действие, проявляя активность по отношению к большинству патогенных дрожжевых грибов, особенно Candida albicans. Менее чувствительны к натамицину дерматофиты [24, 46, 49, 129].
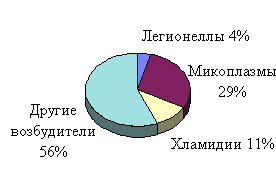 Расширение
антибактериального спектра макролидов нового поколения дало “вторую” жизнь этой
группе препаратов.
Расширение
антибактериального спектра макролидов нового поколения дало “вторую” жизнь этой
группе препаратов.
Антимикробный спектр макролидов подтверждает их применение при инфекциях дыхательных путей, т. к. он включает основные патогенные микроорганизмы, особенно, факультативно/облигатные внутриклеточные микроорганизмы, в отношение которых макролиды считаются препаратами выбора [7, 8, 18, 131].
В последние годы значительно повысилась роль так называемых атипичных возбудителей. В частности, острые пневмонии бывают вызваны Myc. pneumoniae в 29,3% случаев, Chlamydiae - 11,0%, Legionel-lae - 3,7% (рис. 1.1) [7, 8].
Атипичные микроорганизмы развиваются внутри клеток и мало доступны для ряда антибактериальных препаратов. Макролиды способны накапливаться в высоких концентрациях в макрофагах, нейтрофилах и других клетках и воздействовать на внутриклеточные микроорганизмы [8, 49].
Важными являются данные о существующей разнице концентраций макролидов в крови и других жидкостях организма по сравнению с создаваемым в тканях, макрофагах и полинуклеарных клетках. Новые макролиды, накапливаясь как в резервуаре, в клетках ткани обладают пролонгированным действием. При этом создаются концентрации, бактерицидные для внутриклеточно расположенных бронхолегочных патогенов [7, 8, 92].
Полагают, что макролиды являются бактериостатическими. Однако, некоторые авторы отмечали бактерицидное действие при концентрациях в 2-4 раза превышающих величины минимально ингибирующей концентрации (МИК) [125, 131].
Необходимо заметить, что макролиды сравнительно легко всасываются из желудочно-кишечного тракта. Их всасывание происходит, в основном, в тонком кишечнике. Биодоступность при пероральном применении составляет, в среднем, 30-50%. Всасывание макролидов наиболее полно происходит в щелочной среде, а в кислой среде они подвергаются частичному или полному гидролизу1 [55]. Поэтому современные макролиды выпускаются или в виде драже, или покрытыми энтерорастворимыми капсулами. Побочные реакции при применении макролидов наблюдаются редко и, как правило, не бывают серьезными. Описаны диспепсические явления в виде тошноты, тяжести и боли в эпигастрии, рвоты, диареи, что связано со стимуляцией моторики ЖКТ [24, 152].
1 Исключением является кларитромицин, устойчивый к действию соляной кислоты.
Имеются единичные сообщения об аллергических реакциях на макролиды. Препараты группы макролидов не обладают перекрестными аллергическими реакциями с антибиотиками, содержащими b -лактамное кольцо (пенициллины, цефалоспорины), что позволяет их использовать у лиц с аллергическими реакциями на b -лактамные антибиотики [41]. В редких случаях развивается интоксикация, связанная с нарушением метаболизма препаратов в печени [24, 49, 55]. При внутривенном введении препаратов макролидов возможно развитие флебитов, перифлебитов и тромбозов, что требует прекращения введения препарата [30, 49, 55, 131].
Низкая токсичность макролидов позволяет их использовать даже при беременности, лактации и в педиатрии для лечения недоношенных новорожденных и детей более старшего возраста [49, 131]. Даже при длительном применении макролидов редки случаи развития дисбактериоза кишечника (одно из основных осложнений антибактериальной терапии), подавление гемопоэза практически отсутствует. Макролиды новых генераций менее токсичны и лучше переносятся, чем эритромицин [7, 8, 131].
Современные макролидные антибиотики по сравнению с эритромицином имеют лучшие физико-химические и биологические параметры, более устойчивы к гидролизу в кислой среде желудка, поэтому их пероральные формы позволяют получать достоверно более высокие концентрации препаратов в сыворотки крови и тканях [11, 38, 43].Благодаря описанным преимуществам с каждым годом возрастает интерес к макролидам и соответственно - число публикаций об их эффективном использовании в различных областях медицины (табл. 1-1).
Таблица 1.1.
Динамика числа публикаций по антибиотикам-макролидам по данным базы данных MEDLINE (http://www.healthgate.com/HealthGate/MEDLINE/search-adv.shtml).
| 1966-70 | 1971-75 | 1976-80 | 1981-85 | 1986-90 | 1991-96 | 1997 | 1998 | |
| Всего публикаций | 47 (9) | 117 (23) | 198 (40) | 359 (72) | 866 (173) | 2592 (518) | 818 | 1041 |
| Чувствительность | 3 (1) | 18 (3) | 47 (9) | 66 (13) | 206 (41) | 622 (124) | 155 | 238 |
| Резистентность | 14 (3) | 25 (5) | 59 (12) | 127 (25) | 242 (48) | 605 (121) | 202 | 274 |
|
Фармакокинетика |
0 | 1 | 5 (1) | 17 (3) | 74 (15) | 188 (38) | 38 | 51 |
|
Клиническое использование |
0 | 1 | 6 (1) | 13 (3) | 42 (8) | 198 (40) | 48 | 76 |
|
Безопасность |
0 | 0 | 0 | 3 | 18 (3) | 95 (19) | 26 | 36 |
|
Побочные эффекты |
0 | 1 | 6 (1) | 15 (3) | 42 (8) | 126 (25) | 44 | 50 |
Примечание.
В скобках указано среднее число публикаций за 1 год.
Таким образом, макролиды:
· обладают высокой бактериологической активностью по отношению к грам-положительным, некоторым грамотрицательным микроорганизмам, а также внутриклеточным возбудителям;
· способны накапливаться в высоких концентрациях в макрофагах, нейтро-филах и других иммуннокомпетентных клетках;
· обладают пролонгированным действием;
· являются малотоксичными препаратами.
§ 1.1. Механизм действия макролидов
Макролидные антибиотики, относятся к ингибиторам белкового синтеза в клетках микроорганизма. Механизм действия макролидов связан со взаимодействием с 23S РНК компонентом каталитического центра пептидтрансферазы 50S (или 30S для некоторых микроорганизмов) субъединицы мембраноассоциированных рибосом бактериальных клеток. Данное связывание является необратимым ковалентным и, по всей видимости, комплиментарным, что обеспечивает видовую и штаммовую специфичность действия макролидов [103]. Связывание макролидов с рибосомами чувствительных клеток приводит к нарушению пептидилтрансферазной активности и ингибированию реакций транслокации и траспептидации, вследствие этого нарушается нормальный процесс синтеза белка [1, 103].
Механизм действия макролидов обуславливает их активность в отношении большинства клинических штаммов “атипичных” возбудителей и избирательную токсичность для микроорганизмов (поскольку в макроорганизме 50S рибосомные субъединицы отсутствуют). Аналогичный механизм действия характерен для хлорамфеникола, линкозамидов, стрептограминов, поэтому при их совместном назначении суммарный эффект ослабляется [53].
Можно предположить, что рибосомы, с которыми взаимодействуют макролиды отвечают за синтез белка, необходимого для деления клеток, т.к. остановки пластических процессов или их заметного нарушения в бактериальных клетках под действием макролидов не происходит. Однако при действии макролидов на растущую популяцию микроорганизмов происходит прекращение процесса деления бактериальных клеток [24, 55]. Именно поэтому необходима относительно длительная терапия макролидами: при этом бактериальные клетки вначале теряют способность к делению, а потом погибают “от старости”. При этом преждевременное прекращение терапии макролидами может привести к рецидивам заболевания и развитию бактериальной резистентности к макролидам [49].
Макролиды относятся к бактериостатическим препаратам, т.е. ингибируют процесс деления бактериальных клеток, поэтому препараты данной группы эффективны только против быстрорастущих микроорганизмов. Следовательно, использование макролидов может быть эффективным только при лечении острых, а не хронических, затяжных или вялотекущих бактериальных инфекций. Однако, в последнее время появились новые данные [24, 131], свидетельствующие о том, что если плотность обсеменения бактериальными агентами относительно невелика, то макролиды второй генерации могут проявлять бактерицидные свойства и быть эффективными даже против нерастущих штаммов микроорганизмов.
Таким образом, макролиды:
· относятся к ингибиторам белкового синтеза;
· взаимодействуют с 23S РНК компонентом рибосом бактериальной клетки;
· являются бактериостатическими препаратами;
· при увеличении концентрации могут оказывать бактерицидное действие.
§ 1.2. Химическое строение антибиотиков-макролидов
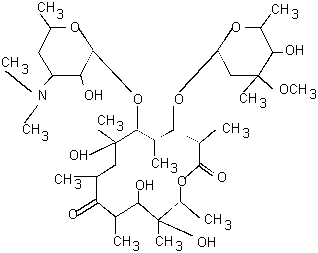
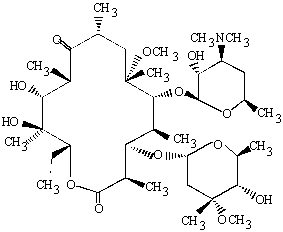
По химической структуре макролиды представляют собой липофильную молекулу с характерным центральным макроциклическим лактоновым кольцом, связанным с различными сахарами. Все макролиды имеют сходное химическое строение [24, 30, 49]. Для примера на рис. 1.2 и 1.3 приведены структурные формулы эритромицина и кларитромицина. В зависимости от химического строения макролидов в состав макролидного кольца могут входить 12-17 атомов углерода.
В настоящее время активно проводятся работы по химической модификации макролидов. Ведутся работы по разработке новых препаратов, обладающих более широким спектром антибактериального действия, эффективных против штаммов, устойчивых к “классическим” макролидам, ведется поиск менее токсичных соединений, обладающих более пролонгированным действием, большей биодоступностью, меньшим латентным периодом и т.д.
В частности, в экспериментах in vitro было показано, что введение полиеновых групп в структуру макролидов обеспечивает их активность против мутантных штаммов стрептококков, устойчивых к “классическим” макролидам. Такие модифицированные макролиды обладают существенно более широким спектром антибактериального действия, чем их аналоги без полиеновых групп. Например, они обладают активностью против практически всех известных видов грибков. Сообщается, что несмотря на широкий спектр антибактериального действия, препараты обладают чрезвычайно низкой токсичностью, не метаболизируются печенью и выводятся из организма экспериментальных животных в неизменном виде [124]. Это позволяет предположить перспективную возможность использования макролидов данного класса у больных с нарушенной функцией печени. Однако данная работа находится только на начальном этапе исследования - и оправдают ли полиеновые производные макролидных антибиотиков возлагаемые на них надежды - мы узнаем не ранее, чем через несколько лет, т.е. уже в следующем тысячелетии.
В работе Gotoh и соавт. (1998) было показано, что введение 3'-метоксигруппы в структуру макролидов обеспечивает их антимикробную активность даже против тех штаммов микроорганизмов, которые обладают резистентностью к “типичным” макролидам [105]. При этом фармакокинетика препаратов практически не меняется. Сообщается, что модифицированные препараты более устойчивы к гидролизу в кислой среде, однако их биодоступность слегка ниже немодифицированных аналогов. Авторами работы сообщается, что получаемые 3'-метоксисоединения на 84% обладают стереоспецифичностью. При этом остается непонятным: обусловлены ли новые свойства стереоспецифичностью или же стереоспецифичность является “побочным продуктом” новых свойств 3'-метокси-антибиотиков-макролидов. Между тем наличие стереоспецифичности может существенно увеличивать вероятность развития аллергических реакций на соединения этого класса. Поэтому необходимы детальные клинические испытания этих препаратов перед тем, как их можно будет использовать в широкой клинической практике.
Другой новый макролид, продуцируемый Nocardia brasiliensis, имеющий рабочее название PC-766B, помимо основного эффекта обладает антиоксидантной активностью [124]. До сих пор ничего не известно о широте антибактериального спектра действия этого антибиотика, а наличие антиокисидантного эффекта навряд ли можно считать за преимущество антибактериального препарата.
Другие макролиды, продуцируемые Stretomyces violaceusniger только-только выделены и в настоящее время подвергнуты детальному анализу физико-химических свойств и структуры [205]. Об их антибактериальных эффектах до настоящего времени ничего не известно.
В завершение хочется отметить, что несмотря на существование высокоэффективных макролидов второго поколения, интерес к поиску новых соединений или к химической модификации старых препаратов не прекращается. Исходя из этого можно ожидать появления в ближайшее десятилетие новых макролидов, разрешенных к клиническому применению. Возможно, что это уже будут препараты третьей генерации.
Таким образом, макролиды:
· являются липофильными соединениями;
· содержат макроциклическое лактоновое кольцо.
§ 1.3. Классификация макролидов
Макролиды делятся на 5 групп [7, 8, 50, 131].
1. С 12-членным кольцом: метимицин, неометимицин, YC - 17, литрин.
2. С 14-членным кольцом. Природные: эритромицин, олеандомицин. Полусинтетические: рокситромицин, диритромицин, кларитромицин, флуритромицин, даверцин.
3. С 15-членным кольцом: азитромицин.
4. С 16-членным кольцом. Природные соединения: джозамицин, китазамицин, спирамицин. Полусинтетические производные: рокитамицин, мидекамицин.
5. С 17-членным кольцом: ланкацидиновый комплекс.
Представители групп с 12- и 17- членным кольцом не находят применения, поэтому в табл. 1.2 представлены препараты трех групп, используемые в клинической практике.
Таблица 1.2.
Наиболее часто используемые макролидные антибиотики [7, 8, 50, 131].
|
14 - членное кольцо |
15-членное кольцо |
16-членное кольцо |
||
|
Природные соединения |
Полусинтетич. соединения |
Азалиды |
Природные соединения |
Полусинтетич. соединения |
|
Эритромицин |
Диритромицин |
Азитромицин |
Спирамицин |
Рокитамицин |
|
Олеандомицин |
Рокситромицин |
Джозамицин |
Мидекамицин |
|
|
Кларитромицин |
||||
К макролидам также относится полиеновый антибиотик натамицин [15, 22, 46].
Согласно международной классификации в Российской Федерации разрешены к применению следующие макролиды [7, 13, 35] (список приведен по действующим веществам):
Азитромицин (9-деоксо-9а-аза-9а-метил-9а-гомоэритромицин А)
Мидекамицин (лейкомицин V 3,4В-дпироноат)
Натамицин (Стереоизомер 22-((3-амино-3,6-дидезокси-бета-D-маннопиразолил)окси)-1,3,26-тригидрокси-12-метил-10-оксо-6, 11,28-триоксатрицикло(22.3.1.0/5,7/)октакоза-8,14,16,18,20-пентаен-25-карбоновой кислоты)
Олеандомицин
Рокситромицин (эритромицин 9-(0-(2-метоксиэтокси)метил)-оксим)
Cпирамицин (9-О-(2,3,4,6-тетрадезокси-4-(диметиламино)-D-эритрогексапиранозил)-лейкомицин V
Эритромицин
1 Эта фирма представляет на российском рынке препарат, выпускаемый Abbott Labo-ratories.
Таким образом, макролиды:
· содержат 12-17 членное лактоновое кольцо;
· могут быть природными или полусинтетическими соединениями.
Спектр антимикробной активности макролидов включает грамположительные и некоторые грамотрицательные микроорганизмы, Bordetella pertussis, виды Legionella, Chlamydia, Mycoplasma, Ureaplasma urealyticum, Listeria monocytogenes. Важной особенностью макролидов является активность в отношении бактероидов и энтеробактерий, хотя она и выражена в слабой степени [7, 8].
Устойчивы к макролидам вирусы, нокардии, бруцеллы [104]. Как правило отмечается перекрестная устойчивость ко всем препаратам этой группы (за исключением олеандомицина: 30 - 70% устойчивых к эритромицину штаммов чувствительны к олеандомицину). Устойчивость к макролидам грамотрицательных бацилл наиболее вероятно связано с непроницаемостью наружной клеточной мембраны для этих гидрофобных соединений. Исключение составляет азитромицин, содержащий азот в лактонном кольце, который активен в отношении грамотрицательных палочек, особенно Haemophilus spp. [32, 131, 141, 143].
Рассмотрим отдельно спектр антибактериального действия наиболее используемых антибиотиков-макролидов.
Эритромицин обладает высокой активностью против b -гемолитического стрептококка группы А, пневмококков, золотистого стафилококка (в том числе пенициллинустойчивых штаммов), Bordetella pertussis (возбудитель коклюша), Corynobacterium diphtheriae (возбудитель дифтерии), Coryneobacterium minutissimum, Moraxella catarrhallis, Listeria monocygenes, Chamydia trachomatis, Mycoplasma pneumoniae, Ureaplasma urealyticum. Относительно низкой активностью препарат обладает против Pasteurella multocida, Eikenella corrodens, Bacteroid fragilis [15, 22, 24, 30, 49, 208].
Следует иметь в виду, что метициллин-резистентные штаммы S. aureus невосприимчивы к эритромицину [66, 144]. Согласно статистике, частота встречаемости этих штаммов достигает 30% клинических случаев, зарегистрированных в США [144]. Поэтому в повседневной клинической практике не следует начинать с эритромицина лечение заболеваний, вызванных S. aureus, если только нет каких-либо существенных причин предпочтения данного препарата другим антибактериальным средствам.
Эритромицин неэффективен против H. influenzae и не влияет на рост и размножение этого микроорганизма, как in vivo, так и в экспериментах in vitro [66, 152]. Также препарат практически неэффективен против Enterobacteriaceae, Pseudomonas spp., Acinetobacter spp, т.к. не проникает через оболочку этих микроорганизмов.
В последние годы было показано, что спектр антибактериального действия эритромицина гораздо шире, чем это предполагалось ранее. Так показана эффективность эритромицина против пенициллин-резистентного штамма Streptococcus pneumoniae [152]. Данная активность была вначале показана в тестах in vitro, а затем подтверждена клинически. Интересным представляется тот факт, что кларитромицин и азитромицин практически неэффективны против данного штамма.
Не так давно открыта антибактериальная активность эритромицина против Campylobacter spp., Legionella spp., Chlamydia species, Toxoplasma gondii, Pneumocytis catarrhalis [206]. При этом активность эритромицина против токсоплазмы несколько ниже, чем у антибиотиков-макролидов второй генерации, а некоторые штаммы легионелл практически не чувствительны к препарату [117].
Необходимо отметить, что комплексный препарат Зинерит, содержащий эритромицин и ацетат цинка, эффективен даже против эритромицин-резистентных штаммов Propionibacterium acne [71, 118].
Эритромицин относится к бактериостатическим препаратам. Бактерицидное действие он оказывает на высокочувствительные штаммы b -гемолитического стрептококка группы А [131]. В отношении других микроорганизмов бактерицидное действие антибиотика обнаруживается в концентрации в 10-20 раз превышающих терапевтические дозы. Антимикробное действие эритромицина направлено, главным образом, на пролиферирующие клетки. На микроорганизмы, находящиеся в фазе покоя, т. е. не размножающиеся, антибиотик действует слабо [83].
Спирамицин. Спектр антимикробного действия спирамицина аналогичен спектру, характерному всему семейству макролидов, и включает грамположительные и грамотрицательные кокки, Legionella spp., Chlamydia trachomatis, Ureaplasma urealyticum, Mycoplasma pneumoniae. Некоторые штаммы S. aureus резистентны к спирамицину [29].
Спирамицин сохраняет активность in vitro против штаммов с приобретенной резистентностью к эритромицину. Важной особенностью спирамицина является его активность в отношении бактероидов и энтеробактерий, хотя она выражена в слабой степени [7, 8]. Спирамицин, как и другие макролиды, действует на микроорганизмы на стадии размножения. Активность спирамицина in vitro не отражает его высокой эффективности in vivo - это так называемый “парадокс спирамицина”. Возможно, это связано с достижением высокой тканевой и внутриклеточной концентрации и постантибиотическим эффектом спирамицина.
Джозамицин. По спектру действия и уровню активности близок к эритромицину. Джозамицин отличается значительной эффективностью по отношению к грамположительным коккам, легионеллам, хламидиям, микоплазме. Препарат обладает малой активностью против энтеробактерий, потому его влияние на естественную бактериальную флору желудочного тракта невелико. Антибактериальная активность джозамицина во многом сходна с эритромицином, при этом препарат эффективен для лечения большинства урогенитальных инфекций, особенно вызванных Chlamydia trachomatis [18, 140, 148].
Азитромицин сходен по спектру антибактериального действия с эритромицином, однако он более активен против следующих грамположительных и грамотрицательных штаммов микроорганизмов: Haemophilus influenzae (включая ампициллин-резистентные штаммы) [141], H. parainfluenzae, Moraxella catarrhalis, Neisseria gonorrhoeae, Borrelia burgdorferi, Chlamydia trachomatis [179, 204], Toxoplasma gondii, Pneumocytis catarrhalis [204], Listeria [117], Streptococcus pyogenes, Streptococcus agalactiae, эритромицин- и пенициллинрезистентных штаммов Streptococcus pneumoniae и мециллин-резистентных штаммов S. aureus [141]. Против S. pneumoniae азитромицин менее эффективен, чем другие макролиды [131, 143].
По влиянию на некоторые грамотрицательные бактерии азитромицин превосходит другие макролидные антибиотики. Энтеробактерии менее чувствительны к азитромицину. Активность азитромицина против токсоплазмы несколько выше, чем у эритромицина [117], а против H. influenzae примерно в 4 раза ниже, чем у кларитромицина [152]. Интересно отметить, что по отношению к H. influenzae азитромицин проявляет и бактериостатические, и бактерицидные свойства [141, 153].
Микроорганизмы, продуцирующие b -лактамазу, обладают резистентностью к азитромицину [179]. Аминогликозид-резистентные штаммы S. aureus невосприимчивы и к азитромицину, и к метициллину и его производным [144]. Препарат неэффективен против некоторых штаммов S. pneumoniae, обладающих резистентностью к пенициллину [152], при этом есть данные, что чувствительность S. pneumoniae к азитромицину, кларитромицину и пенициллину одинакова [141].
Антимикробная активность кларитромицина во многом сходна с эритромицином, при этом спектр антибактериального действия несколько шире. Кларитромицин обладает активностью против многих грамположительных, грамотрицательных бактерий, а также некоторых анаэробных бактерий и небактериальных инфекционных агентов. В отличие от эритромицина, кларитромицин эффективен против следующих быстро растущих микроорганизмов: Bacteroides melaninigenicus, Mycobacterium chelonae, Micobacterium leprae, Micobacterium marinum, Microbcaterium complex, Legionella spp., Helicobacter pilory [117, 142, 180, 181].
Сам кларитромицин менее активен по отношению к H. influenzae, чем его 14-гидрокси-производная (14-ОН кларитромицин), образующаяся при нормальном метаболизме препарата в печени цитохромом Р450 [180]. Следует также заметить, что степень антибактериальной активности кларитромицина и 14-ОН кларитромицина различаются. Однако in vivo нельзя исключить антибактериальных эффектов, обусловленных совместным действием оптимальных концентраций самого препарата и его метаболита.
Активность кларитромицина по отношению к токсоплазме несколько выше, чем у эритромицина [117], по отношению к S. pneumoniaе существенно выше азитромицина [141, 152].
Кларитромицин не эффективен против метициллин-резистентных штаммов S. aureus, пенициллинрезистентных штаммов S. pneumoniae [152].
Мидекамицин сходен по спектру антибактериального действия с эритромицином. В отличие от эритромицина, препарат эффективен против Legionella pneumophila, Mycoplasma hominis, Ureaplasma urealyticum, Chlamydia trachomatis. Препарат неэффективен против Enterobacteriaceae, Haemophilus influenzae, Streptococcus aureus [119].
Натамицин, являясь “нетипичным” антибиотиком-макролидом, оказывает фунгицидное действие на большинство патогенных дрожжевых грибов, в первую очередь Candida albicans [24, 46, 49]. Менее чувствительны препарату дерматофиты. Резистентность к препарату в клинике не встречается и обнаружена лишь в отдельных экспериментах in vitro с модифицированными штаммами чувствительных микроорганизмов [129]1.
1 Эффективность применения препарата рассматривается в § 3.7.
Макролидные антибиотики являются бактериостатическими препаратами, обладая активностью против быстрорастущих штаммов большинства грамположительных кокков, ряда грамотрицательных кокков и некоторых небактериальных агентов [59, 66, 111, 131, 144, 152] (табл. 1.3). Однако некоторые авторы отмечали бактерицидное действие при концентрациях в 2-4 раза превышающих величины МИК [125, 131].
Таблица 1.3.
Сравнительная активность антибиотиков-макролидов in vitro,
МИК 50 (мкг/мл) [59, 66, 111, 131, 144, 152].
|
Штамм |
Препарат |
МПК 50 |
|
S. aureus, метицилин-чувствительный |
Эритромицин |
0.12 |
| Кларитромицин | 0.06 (>128) | |
| Рокситромицин | 0.25 | |
| Азитромицин | 0.12 | |
| Джозамицин | 1 | |
| Спирамицин | 1 | |
| Мидекамицин | 0.25 | |
|
S. aureus, метицилин-резистентный |
Эритромицин |
>128 |
| Кларитромицин | >128 (>128) | |
| Рокситромицин | >128 | |
| Азитромицин | >128 | |
| Джозамицин | >128 | |
| Спирамицин | >128 | |
|
S. epidermidis |
Эритромицин |
8 |
| Кларитромицин | 4 (>35) | |
| Рокситромицин | 4 | |
| Азитромицин | 16 | |
| Джозамицин | 0.5 | |
| Спирамицин | 1 | |
|
S. pyogenes |
Эритромицин |
0.03 |
| Кларитромицин | 0.015 (0.07) | |
| Рокситромицин | 0.06 | |
| Азитромицин | 0.12 | |
| Джозамицин | 0.12 | |
| Спирамицин | 0.12 | |
| Мидекамицин | 0.5 | |
|
S. pneumoniae |
Эритромицин |
0.03 |
| Кларитромицин | 0.015 (0.02) | |
| Рокситромицин | 0.03 | |
| Азитромицин | 0.06 | |
| Джозамицин | 0.06 | |
| Спирамицин | 0.03 | |
| Мидекамицин | 0.12-1 | |
|
Str. agalactive |
Эритромицин |
0.06 |
| Кларитромицин | 0.06 (0.12) | |
| Рокситромицин | 0.12 | |
| Азитромицин | 0.12 | |
| Джозамицин | 0.25 | |
| Спирамицин | 0.12 | |
|
Streptococcus spp. |
Эритромицин |
0.06 |
| Кларитромицин | <0.008 | |
| Рокситромицин | 0.03 | |
| Азитромицин | 0.06 | |
| Джозамицин | 0.12 | |
| Спирамицин | 0.03 | |
|
Enterococcus spp. |
Эритромицин |
0.5 |
| Кларитромицин | 0.5 (>128) | |
| Рокситромицин | 2 | |
| Азитромицин | 2 | |
| Джозамицин | 2 | |
| Спирамицин | 0.25 | |
|
Corynebacterium spp. |
Эритромицин |
1 |
| Кларитромицин | 0.25 (8) | |
| Рокситромицин | 4 | |
| Азитромицин | 16 | |
| Джозамицин | 4 | |
| Спирамицин | 16 | |
|
Listeria monocytogenes |
Эритромицин |
0.5 |
| Кларитромицин | 0.25 (0.5) | |
| Рокситромицин | 1 | |
| Азитромицин | 1 | |
| Джозамицин | 2 | |
| Спирамицин | 4 | |
|
Branсhamella catarrhalis |
Эритромицин |
0.12 |
| Кларитромицин | 0.06 | |
| Рокситромицин | 0.25 | |
| Азитромицин | 0.03 | |
| Джозамицин | 2 | |
| Спирамицин | 2 | |
|
Neisseria gonorrhaeae |
Эритромицин |
0.25 |
| Кларитромицин | 0.25 (1) | |
| Рокситромицин | 0.5 | |
| Азитромицин | 0.03 | |
| Джозамицин | 0.5 | |
| Спирамицин | 1 | |
|
Campylobacter jejuni |
Эритромицин |
0.12 |
| Кларитромицин | 0.25 (1) | |
| Рокситромицин | 1 | |
| Азитромицин | 0.06 | |
| Джозамицин | 0.25 | |
| Спирамицин | 0.5 | |
|
Legionella pneumophila |
Эритромицин |
1 |
| Кларитромицин | 0.12 (0.5) | |
| Рокситромицин | 0.25 | |
| Азитромицин | 0.5 | |
| Джозамицин | 0.5 | |
| Спирамицин | 16 | |
|
Haemophilus influenzae |
Эритромицин |
4 |
| Кларитромицин | 4 ->128(1-3) | |
| Рокситромицин | 4 | |
| Азитромицин | 8 | |
| Джозамицин | 8 | |
| Спирамицин | 8 | |
|
Bacteroides frangilis |
Эритромицин |
2 |
| Кларитромицин | 2 (1) | |
| Рокситромицин | 16 | |
| Азитромицин | 2 | |
| Джозамицин | 8 | |
| Спирамицин | 2 | |
|
Clostridium perfringens |
Эритромицин |
1 |
| Кларитромицин | 0.5 (0.5) | |
| Рокситромицин | 2 | |
| Азитромицин | 0.25 | |
| Джозамицин | 1 | |
| Спирамицин | 2 | |
|
Propionibacterium acne |
Эритромицин |
0.03 |
| Кларитромицин | 0.03 | |
| Рокситромицин | 0.03 | |
| Азитромицин | <0.004 | |
| Джозамицин | 0.12 | |
| Спирамицин | 0.12 | |
|
Chlamydia pneumoniae |
Эритромицин |
0.06 |
| Кларитромицин | 0.5 | |
| Рокситромицин | 0.125 | |
| Азитромицин | 0.06 | |
| Джозамицин | 0.25 | |
| Спирамицин | - | |
| Мидекамицин | 0.5 | |
|
Chlamydia trachomatis |
Эритромицин |
0.06 |
| Кларитромицин | 0.007 | |
| Рокситромицин | 0.03 | |
| Азитромицин | 0.125 | |
| Джозамицин | 0.015 | |
| Спирамицин | 0.5 | |
| Мидекамицин | 0.06 | |
|
Chlamydia psittaci |
Эритромицин |
0.1 |
| Кларитромицин | 0.05 | |
| Рокситромицин | 2 | |
| Азитромицин | 0.02 | |
| Джозамицин | 0.25 | |
| Спирамицин | - | |
| Мидекамицин | 0.4 | |
|
Micobacterium hominis |
Эритромицин |
>32 |
| Кларитромицин | 64 (0.12) | |
| Рокситромицин | 64 | |
| Азитромицин | 2-16 | |
| Джозамицин | 0.5 | |
| Спирамицин | - | |
| Мидекамицин | 0.12 | |
|
Micobacterium pneumoniae |
Эритромицин |
0.01 |
| Кларитромицин | 0.05 (<0.1) | |
| Рокситромицин | 0.03 | |
| Азитромицин | <0.01 | |
| Джозамицин | 0.02 | |
| Спирамицин | 1 | |
| Мидекамицин | 0.0004-0.03 | |
|
Ureaplasma urealyticum |
Эритромицин |
0,12 |
| Кларитромицин | 1 | |
| Рокситромицин | 1 | |
| Азитромицин | 1 | |
| Джозамицин | 1 | |
| Спирамицин | 3 | |
| Мидекамицин | 0.12-0.25 |
Примечания.
1. МИК 50- 50% минимальная ингибирующая концентрация.
2. Здесь и далее для кларитромицина в скобках указаны данные для 14-ОН кларитромицина.
3. - означает, что препарат неэффективен.
Таким образом, макролиды:
· высокоэффективны по отношению грамположительным, некоторым грамотрицательным микроорганизмам и внутриклеточным возбудителям;
· неэффективны по отношению к бруцеллам, вирусам, нокардиям;
· практически не обладают перекрестной резистентностью;
· являются бактериостатическими препаратами, но могут оказывать и бактерицидное действие.
§ 1.5. Резистентность к макролидам
При анализе резистентности к макролидам нельзя не учитывать наличие изначально резистентных (мутантных) штаммов некоторых грамположительных кокков, что в ряде случаев может ограничивать применение некоторых препаратов данной группы. Резистентность к макролидам может быть приобретена с помощью 3 различных механизмов: модификацией клетки-мишени (рибосомальной субъединицы 50 S), инактивацией и активным выведением препарата. Резистентность к макролидам в результате мутации очень редко наблюдается в клинических культурах. Наиболее часто встречающимся механизмом является посттранскрипционная модификация рибосомальной РНК 23S путем моно/диметилирования остатка аденина [24, 49, 103, 131]. В результате нарушается комплиментарность антибиотика-макролида к рибосоме, и препарат не может оказывать свое действие. Данная резистетность является перекрестной с 14- и 15-членными макролидами, стрептограминами, линкосамидами и хлорамфениколом и не является перекрестной с 16-членными макролидами. При этом гены метилаз (ферменты, индуцирующие метилирование) могут наследоваться бактериальными клетками или передаваться через плазмиды [24, 103]. Гены, кодирующие различные метилазы, определяют как эрм (эритромицин резистентная метилаза). Выялено по меньшей мере 8 классов эрм генов [63, 66, 117].
У стафилококков синтез метилаз РНК может быть конструктивным или индуцируемым 14 - членными макролидами или азалидами. 16-членные макролиды являются слабыми индукторами резистентности, и бактерии с индуцируемой резистентностью сохраняют чувствительность к 16-членным макролидам. Однако при индуцировании в присутствии эритромицина бактерии с индуцированной резистентностью нечувствительны и к 16 - членным макролидам. Бактерии, конструктивно резистентные к эритромицину, также резистентны к 16-членным макролидам [66, 152].
Большинство мутантных штаммов микроорганизмов, обладающих приобретенной резистентностью к эритромицину, обладают резистентностью и к кларитромицину [180]. Есть данные, что резистентность к кларитромицину может передаваться за счет плазмиды, кодирующей метилазу. Такие штаммы нечувствительны и к эритромицину [143].
Другие механизмы резистентности включают инактивацию эритромицин-эстеразами и макролидной фосфотрансферазой (E. coli) или неопределенными ферментами (Staphylococcus hominis, S. haemolyticus, S. saprophyticus). Штаммы S. epidermidis обнаружили резистентность к эритромицину из-за непроницаемости для препарата. Такой механизм резистентности, как активный выброс антибиотика, был отмечен для S. epidermidis, в штаммах которого связанный с АТФ белок выполнял функцию откачивающего насоса. В работе Peters и соавт. (1992) было показано, что микроорганизмы, продуцирующие b -лактамазу невосприимчивы к эритромицину и к азитромицину [179]. Возможно, что данная резистентность является приобретенной, а ген, кодирующий b -лактамазу может передаваться между различными штаммами микроорганизмов через плазмиды. Не исключено включение данного гена в микроорганизмы нормальной микрофлоры и сохранение его длительное время у микроорганизмов-сапрофитов. Поэтому, если в анамнезе было установлено наличие инфекционного заболевания, вызванного эритромицин-резистентными микроорганизмами, то применение данного препарата в дальнейшем может быть неэффективным. Возможно, что синтез b -лактамазы является одним из механизмов приобретенной резистентности к эритромицину. Однако данный вопрос требует дальнейшего изучения; в настоящее время имеющиеся литературные данные не достаточно полно охватывают эту проблему и во многом противоречивы.
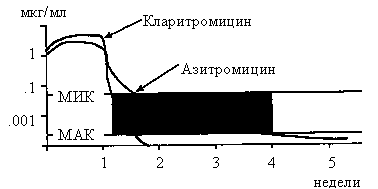
Аминогликозид-резистентные штаммы S. aureus невосприимчивы и к азитромицину, и к метициллину и его производным [144]. Азитромицин неэффективен против некоторых штаммов S. pneumoniae, обладающих резистентностью к пенициллину [152], при этом есть данные, что чувствительность S. pneumoniaе к азитромицину, кларитромицину и пенициллину одинакова [141, 143].
Рис. 1.4. Фармакокинетика азитромицина
и кларитромии-цина после недельной терапии 10 мг/кг per os [123, 143]. МАК-
минимальная активная концентрация. Если концентрация антибиотика больше МАК,
но меньше МИК, то возможно развитие резистентности к препа-рату (закрашенная
область). Видно, что закрашенная область для азитромицина существенно больше,
чем для кларитромицина.
Интересно отметить тот факт, что из-за того, что время полувыведения кларитромицина составляет 5-6 часов, а азитромицина - 35-76 часов (см также гл. 2), частота развития резистености к кларитромицину существенно ниже, чем к азитромицину [127, 143]. Это обусловлено длительной персистенцией азитромицина в организме в низких концентрациях, которые не способны подавлять рост микроорганизмов, но тем не менее могут вызвать мутации, способствующие развитию резистентности (рис. 1.4).
Поэтому, так как спектр антибактериального действия препаратов во многом сходен, обычно кларитромицин предпочтительней азитромицина.
Резистентность к макролидам варьирует во всем мире в зависимости от клинического применения, видов бактерий и других факторов, таких как источник штаммов (больница/общество). Первые резистентные к эритромицину штаммы были обнаружены еще в 1956 г. у стафилококков (фенотип МЛСb) и с тех пор распространились на многие роды бактерий [7, 8].
Во Франции распространенность резистентности фенотипа МЛСb у стафилококков возросла с 1954 г. до 1962 г. и стабилизовалась на уровне около 40% (больница) и 10% (общество). Последующая эволюция резистентного фенотипа МЛСb в больнице развивалась параллельно с эволюцией резистентности к метициллину и отражает появление мультирезистентных форм в больнице. Отмечены большие межбольничные и межпалатные различия. В 1988 г. общая резистентность во Франции составила около 30% (больница) и 20% (общество). В многоцентровом международном эпидемиологическом исследовании более 1000 штаммов S. aureus в Англии 14% штаммов оказались резистентными к эритромицину, против 1,7% одновременно к спирамицину и эритромицину. Применение неиндукторных макролидов вызвало появление структурного фенотипа, который увеличил с 30 до 60% общее число штаммов S. aureus, резистентных к МЛСb. Что касается стрептококков, наблюдаемые различия зависят от штамма. У энтерококков резистентность очень высока (50 - 60%); с 1989 г. отмечалось увеличение процентного содержания эритромицин-резистентных культур у стрептококков группы А с 4% (1981 г.) до 24% (1990 г.) Возникает проблема среди пневмококков; первые резистентные штаммы были обнаружены в 1976 г., а в 1990 г. их частота возрастала до 29% во Франции, до 6,5% в Англии, 60% и 23 % в Испании у детей младшего возраста и у взрослых соответственно. У Bacteroides общая резистентность к МЛСb низкая [59, 74, 83, 92, 102, 125, 141, 144, 152, 164, 167, 194, 198, 208].
Согласно статистическому исследованию, проведенному в США, приблизительно 30% бактериальных инфекций, вызванных S. aureus в этой стране обладает одновременно резистентностью как к атибитикам-макролидам, так и к метициллину и аминогликозидам [144].
Однако появление препаратов нового поколения в значительной степени решило проблему резистентности: штаммы грамположительных кокков, обладающих резистентностью к макролидам первого поколения, чаще всего не обладают резистентностью к препаратам второй генерации [24, 49]. Резистентность к натамицину в клинической практике не отмечена [58, 73, 77, 129, 175].
Частота встречаемости резистентных штаммов при длительном назначении антибиотиков-макролидов in vivo представлена в таблице 1.4.
Таблица 1.4.
Частота встречаемости резистентных штаммов при длительном
назначении
антибиотиков-макролидов in vivo ( в %) [117].
|
Препарат |
Микроорганизм |
Недели | |||||||
|
0 |
1 |
2 |
3 |
4 |
6 |
||||
|
Эритромицин |
Всего Sreptococcus Staphilococcus Другие |
0 0 0 0 |
42 40 40 0 |
42 40 60 0 |
8.3 100 0 0 |
0 0 0 0 |
1.7 100 0 0 |
||
|
Азитромицин |
Всего Sreptococcus Staphilococcus Другие |
0 0 0 0 |
70 36.2 12.8 6.4 |
88 36.2 12.8 6.4 |
82 34.6 11.5 3.8 |
90 20 12 6 |
86 26.9 13.5 5.8 |
||
|
Кларитроми-цин |
Всего Sreptococcus Staphilococcus Другие |
0 0 0 0 |
62 28.5 11.4 2.6 |
72 23.7 11.4 2.6 |
56 16 13.1 10 |
36 11.1 16.7 0 |
18 7.7 23 7.7 |
||
Примечание.
В таблице приведена частота встречаемости резистентных штаммов а при инфекциях
верхних дыхательных путей детей в возрасте от 0.5 до 16 лет (171 человек). Эритромицин
назначали 15 мг/кг в течение 7 дней, азитромицин - 10 мг/кг, 3 дня, кларитромицин
-7.5 мг/кг, 7 дней per os.
Таким образом, резистентность к макролидам может быть осуществлена:
· модифицикацией клетки-мишени;
· инактивацией препарата;
· активным выведением антибиотика.