Современное состояние проблемы лечения острого коронарного синдрома
В.Ю. Козулин
Мысль о золотом веке сродна всем народам и
доказывает только, что люди никогда не довольны
настоящим и, по опыту имея мало надежды на
будущее, украшают невозвратимое минувшее всеми
цветами своего воображения.
А.С. Пушкин
Понятие об остром коронарном синдроме вошло в язык ученых-кардиологов и клиницистов с начала 90-х годов. Возникновение этого термина связано с появлением новых данных о механизмах "обострения" ишемической болезни сердца, синтезом и внедрением в клинику новых групп фармакологических препаратов, изменением взглядов на тактику ведения больных с острой коронарной недостаточностью.
К настоящему времени доказана патогенетическая общность всех острых проявлений коронарной болезни сердца (нестабильная стенокардия, инфаркт миокарда с зубцом Q и без зубца Q): в их основе лежит единый морфологический субстрат - разрыв атеросклеротической бляшки в коронарной артерии с формированием на поверхности разрыва в начале тромбоцитарного, а затем и фибринного пристеночного тромба, обусловливающего весь симптомокомплекс клинических проявлений. При этом определяющим фактором для развития того или иного варианта острого коронарного синдрома - нестабильной стенокардии, инфаркта миокарда, являются исключительно количественные характеристики процесса тромбообразования - продолжительность и степень тромботической окклюзии коронарной артерии. При ограничении коагулогического каскада в рамках начальной, тромбоцитарно-сосудистой стадии, происходит развитие клинико-лабораторного симптомокомплекса нестабильной стенокардии, проявляющейся длительным или рецидивирующим ангинозным болевым синдромом с формированием микроочагов некроза в миокарде, выявляемых только с помощью высокочувтвительных маркеров (тропонины I и Т). В случае последовательной реализации всех стадий тромбогенеза с конечным образованием фибрин-полимера и построением фибринового каркаса тромба острый коронарный синдром, как правило, манифестирует развитием трансмурального (с зубцом Q) инфаркта миокарда. Объединение различных клинических вариантов острой коронарной недостаточности под рубрикой острого коронарного синдрома также обосновано единой концепцией лечения этой категории больных: на стадии нестабильной стенокардии или нетрансмурального инфаркта миокарда, то есть при имеющемся "белом" - тромбоцитарном тромбе в месте разрыва бляшки, необходимо назначение, в первую очередь, антитромбоцитарных препаратов, при сформировавшемся "красном" - фибринном тромбе и развитии трансмурального инфаркта миокарда показано проведение фибринолитической терапии либо выполнение хирургических вмешательств по реваскуляризации миокарда.
ПРЕДПОСЫЛКИ ДЛЯ ВОЗНИКНОВЕНИЯ РАЗРЫВА БЛЯШКИ
Атеросклеротическая бляшка располагается в субэндотелиальном пространстве сосуда и состоит из богатого липидами ядра, отграниченного посредством фиброзной капсулы от так называемой покрышки бляшки, выступающей непосредственно в просвет сосуда. Основным элементом покрышки бляшки является соединительнотканный матрикс, представленный в большей части коллагеном, а также эластином. При этом бляшки, наиболее подверженные разрыву - "ранимые" бляшки имеют свои морфологические особенности: для них характерно преобладание липидного ядра наряду с значительным истончением покрышки. Основным механизмом трансформации стабильных, богатых коллагеном атеросклеротических бляшек, ответственных за наличие симптомокомплекса стабильной стенокардии напряжения I-IV классов в "ранимые", служащие пусковым механизмом развития острого коронарного синдрома, по последним данным, является воспалительный процесс с первичным вовлечением липидного ядра бляшки, а также ослабление покрышки бляшки в результате выделения медиаторов воспаления.
Демонстрацией активной воспалительной реакции внутри бляшки является обнаружение массивной макрофагальной и лимфоцитарной инфильтрации элементов бляшки при выполнении морфологических исследований биоптатов, полученных в ходе прижизненной атерэктомии, а также на аутопсийном материале. Наиболее вероятным механизмом инициации воспалительного процесса является окисление липопротеинов низкой плотности, содержащихся в больших количествах в составе липидного ядра бляшки с последующей активацией макрофагов и Т-лимфоцитов.
Следствием воспаления бляшки и важным предиктором ее разрыва является ослабление покрышки бляшки под влиянием выделяющихся из активированных макрофагов медиаторов воспаления. В норме сохранность соединительнотканного матрикса покрышки бляшки поддерживается постоянным новообразованием коллагена гладкомышечными клетками стенки сосуда. В условиях воспаления происходит подавление экспрессии гена коллагена в гладкомышечных клетках под влиянием цитокинов, в частности, g-интерферона, продуцируемого активированными Т-клетками. Помимо снижения экспрессии гена коллагена к числу эффектов g-интерферона также относится подавление пролиферации гладкомышечных клеток, что также оказывает косвенное дестабилизирующее действие на покрышку бляшки.
Вторым механизмом повреждения покрышки атеросклеротической бляшки является воздействие ферментов из группы металлопротеиназ (коллагеназа, стромелизин, желатиназа В), образующихся в избыточных количествах при инволюции пенистых клеток, Т-лимфоцитов и особенно макрофагов на фоне персистирующего воспаления в бляшке; также продемонстрирована способность гладкомышечных клеток к экспрессии гена коллагеназы в условиях действия воспалительных цитокинов - фактора некроза опухоли, интерлейкина-1. Таким образом, при значительном увеличении активности разрушающих экстрацеллюлярный матрикс ферментов продукция их ингибиторов остается на прежнем уровне, что приводит к явному дисбалансу в сторону разрушения элементов экстрацеллюлярного матрикса коронарной артерии и увеличению риска разрыва покрышки бляшки с последующим тромбозом.
МЕХАНИЗМ ТРОМБООБРАЗОВАНИЯ В РЕЗУЛЬТАТЕ РАЗРЫВА БЛЯШКИ
При возникновении разрыва атеросклеротической бляшки происходит обнажение прокоагулянтных субстанций субэндотелиального пространства сосуда, а также липидного ядра бляшки, в норме изолированных от протекающей крови клетками эндотелия.
Эндотелий помимо чисто барьерной функции активно препятствует адгезии и агрегации тромбоцитов за сцет синтеза простациклина (простагландина I2), эндотелиального релаксирующего фактора, а также активаторов плазминогена тканевого и урокиназного типов, кроме того, на поверхности эндотелиальных клеток обнаружен гликопротеид тромбомодулин, обладающий способностью к связыванию и инактивации тромбина.
Такими субстанциями являются компоненты соединительнотканного матрикса сосуда - главным образом коллаген, а также фибронектин, ламинин, витронектин и др. Высокая тромбогенность липидного ядра бляшки объясняется накоплением в ней в больших количествах тканевого фактора (тканевого тромбопластина), освобождающегося при разрушении пенистых клеток и макрофагов, также тканевый фактор содержится и в эндотелиальных клетках, но в норме им более присущи антитромботические функции.
На начальном этапе коагуляционного каскада происходит адгезия (прилипание) тромбоцитов к месту повреждения эндотелия. Процесс адгезии осуществляется благодаря наличию специфических гликопротеидных комплексов (рецепторов) в мембране тромбоцита, моментально связывающихся со своими лигандами в экстрацеллюлярном матриксе (см. табл. 1). При этом для процесса взаимодействия между лигандом и рецептором мембраны тромбоцита необходимо присутствие фактора Виллебранда, который также синтезируется клетками эндотелия сосудов.
Таблица 1.
Основные гликопротеидные комплексы мембраны тромбоцитов
| Гликопротеидный комплекс | Лиганды | Функция тромбоцитов |
| GP Ia / IIa | Коллаген | Адгезия |
| GP Ic / IIa | Фибронектин | " |
| GP Ic’/ IIa | Ламинин | " |
| GP Ib / IX | Фактор Виллебранда | " |
| GP aV / IIIa | Витронектин, Фибронектин, Фактор Виллебранда, Фибриноген, Тромбоспондин |
" |
| GP IIb / IIIa | Фибриноген, Фибронектин, Фактор Виллебранда, Витронектин, Тромбоспондин |
Агрегация |
Таким образом, в результате адгезии на поверхности разрыва эндотелия формируется монослой тромбоцитов. Связывание рецепторов мембраны тромбоцита со своими лигандами в субэндотелии является пусковым фактором для следующей стадии тромбообразования - стадии агрегации тромбоцитов. При этом тромбоциты изменяют свою форму, становясь из дискоидных сферическими, на поверхности их мембраны появляются псевдоподии. Одновременно происходит высвобождение содержимого плотных гранул тромбоцитов, секретируются индукторы агрегации тромбоцитов - аденозиндифосфат (АДФ) и серотонин, фактор 4 тромбоцитов, тромбоцитарный фактор роста и др. Также происходит повышение активности фосфолипаз А2 и С, которые, расщепляя мембранные фосфолипиды, приводят к высвобождению арахидоновой кислоты. Далее арахидоновая кислота под влиянием циклооксигеназы и тромбоксансинтетазы превращается через промежуточную стадию эндопероксидов в тромбоксан А2. Тромбоксан А2, являясь мощным индуктором агрегации тромбоцитов, также вызывает выраженную вазо- и бронхоконстрикцию.
В результате высвобождения в кровоток многочисленных проагрегантов (АДФ, серотонин, тромбоксан А2, адреналин, тромбин и др.) происходит осуществление механизма положительной обратной связи, проявляющейся в усилении первоначальной агрегации тромбоцитов с одновременным вовлечением в процесс агрегации соседних неактивированных клеток.
Единовременное действие нескольких индукторов агрегации (в противном случае в кровеносном русле постоянно образовывались бы тромбоцитарные тромбы) является стимулом к началу общего финального этапа агрегационного процесса: на мембранах псевдоподий происходят конформационные изменения IIb / IIIа рецепторов, сопровождающиеся многократным увеличением их аффиности к своим лигандам, прежде всего к фибриногену и фактору Виллебранда. Молекулы фибриногена и фактора Виллебранда, являясь мультивалентными, способны взаимодействовать одновременно с большим количеством тромбоцитов, что приводит к образованию многочисленных межклеточных "мостиков".
Таким образом, заключительной стадией процесса активации тромбоцитов является построение тромбоцитарного агрегата, представляющего собой множество активированных тромбоцитов, соединенных между собой с помощью молекул фибриногена и фиксированных к месту повреждения эндотелия посредством фактора Виллебранда .
Однако, активации тромбоцитов и формирования тромбоцитарного тромба недостаточно для развития симптомокомплекса острой коронарной недостаточности (острого коронарного синдрома), более того, большинство разрывов бляшек протекает бессимптомно и обнаруживается на аутопсийном материале у погибших от некардиальных причин больных. Помимо непосредственного разрыва бляшки для развития того или иного варианта острого коронарного синдрома необходимо одновременное стечение многих предрасполагающих факторов: замедление тока крови по сосуду, соотношение между активностью систем свертывания крови и фибринолиза, состояния тромбоцитов. Большое значение в развитии тромбоза имеет освобождение в момент разрыва бляшки тканевого фактора, сосредоточенного главным образом в липидном ядре и эндотелиоцитах покрышки бляшки и являющегося в комплексе с активной формой фактора VII активатором внешнего пути коагуляции. Концентрация фактора VII во время разрыва бляшки оказывает во многом определяющее влияние на дальнейшее развитие коронарного тромбоза и формирование симптомокомплекса острого коронарного синдрома.
Таким образом, помимо активации тромбоцитарного звена гемостаза, для возникновения клинических проявлений острого коронарного синдрома необходимо исходное состояние гиперкоагуляции к моменту разрыва бляшки. В этом отношении особенно показательны данные исследований сывороточной концентрации фибринопептида А (FPA) и фрагмента протромбина 1+2 (F1+2) - маркеров превращения фибриногена в фибрин под действием тромбина и протромбина в тромбин соответственно. У больных с различными клиническими проявлениями острого коронарного синдрома содержание в крови FPA и F1+2 значительно повышено, более того, на сегодняшний день продемонстрировано значение показателей FPA и F1+2 в плане оценки отдаленного прогноза больных после перенесенного эпизода острой коронарной недостаточности. В ходе исследований, наряду с увеличением концентраций FPA и F1+2 в остром периоде, обнаружено сохранение высоких значений F1+2 через 6 месяцев после перенесенного эпизода нестабильной стенокардии или нетрансмурального инфаркта миокарда, что указывает на персистирующую тромбинемию даже у категории относительно "стабилизированных" больных. Учитывая, что тромбин на сегодняшний день является самым сильным из известных индукторов агрегации тромбоцитов, можно предположить, что именно сохраняющаяся (предшествующая?) тромбинемия создает благоприятную почву для развития коронарного тромбоза при возникновении разрыва атеросклеротической бляшки. Эта гипотеза была проверена в ходе многоцентрового клинического исследования GUSTO IIb (см. ниже) с использованием прямого ингибитора тромбина - рекомбинантного гирудина. Однако после подведения итогов лечения более 8 тыс. больных с нестабильной стенокардией и инфарктом миокарда без зубца Q не получено статистических различий в конечных точках (смерть, инфаркт миокарда с зубцом Q, проведение коронарной ангиопластики) между исследуемой и контрольной (аспирин + нефракционированный гепарин) группами больных. Возможно, объяснением этому является низкая доза применяемого гирудина (в исследовании GUSTO IIa продемонстрирован реальный геморрагический эффект полной дозы гирудина) и соответствующее незначительное его влияние на характеристики образования тромбина.
ПРОБЛЕМА ЛЕЧЕНИЯ ОСТРОГО КОРОНАРНОГО СИНДРОМА
Термин "острый коронарный синдром" является объединяющим понятием и отражает единый патогенез большой группы клинических ситуаций в неотложной кардиологии. Возможны следующие варианты манифестации острого коронарного синдрома:
При этом нестабильная стенокардия является самым частым из всех клинических проявлений острого коронарного синдрома и составляет около 75-80% всех эпизодов острой коронарной недостаточности в широком смысле этого слова.
К категории нестабильной стенокардии относят:
В практической деятельности также кроме описанных клинических характеристик принимаются во внимание данные анамнеза, объективного исследования, стандартной ЭКГ в 12 отведениях, лабораторные показатели, главным образом, маркеры повреждения кардиомиоцитов - активность МВ-фракции креатинкиназы сыворотки крови и уровень тропонина I или Т.
С целью обеспечения преемственности между различными исследованиями в рамках нестабильной стенокардии и определения единообразного подхода к этой категории больных рабочей группой экспертов во главе с E. Braunwald была предпринята попытка создания системы объективной оценки тяжести нестабильной стенокардии.
Таблица 2.
Классификация нестабильной стенокардии (E. Braunwald et al., 1989)
| Стенокардия | Вторичная (наличие экстракардиальной причины*) | Первичная | Постинфарктная (первые 2 недели) |
| Впервые возникшая тяжелая, или ускоренно развивающаяся стенокардия напряжения (менее 2 мес) | IA | IB | IC |
| Стенокардия покоя, подострая (в пределах 1 мес, но более 48 ч) | IIA | IIB | IIC |
| Стенокардия покоя, острая (в пределах 48 ч) | IIIA | IIIB | IIIC |
Разработанная этой группой ученых классификация нестабильной стенокардии основывалась на нескольких группах критериев (см. табл. 2):
a) клинические критерии - степень "остроты" состояния;
b) состояния, при которых дестабилизировалось течение ишемической болезни сердца, здесь выделяется так называемая "вторичная" нестабильная стенокардия, при которой нарастание ангинозного болевого синдрома возникает без прогрессирования коронарной обструкции;
c) E. Braunwald рекомендует учитывать изменения на ЭКГ во время приступа стенокардии, что, в случае их наличия указывает на тяжесть заболевания;
d) интенсивность лечения, на фоне которого возникла нестабильная стенокардия.
Эта классификация из-за крайней громоздкости не нашла сколько-нибудь серьезного применения в клинической практике, хотя в научных исследованиях она используется достаточно широко. В то же время для практических целей необходимо выделить тех больных, к которым надо применить наиболее агрессивное лечение, то есть тех, у кого ближайший прогноз хуже.
В этой связи той же группой экспертов во главе с E. Braunwald в 1994 году были выделены три класса больных с нестабильной стенокардией по степени ближайшего риска смерти и инфаркта миокарда, и, соответственно, три различных подхода к таким больным. Надо сказать, что в большинстве случаев такой подход интуитивно используется врачом.
Критериями высокого риска осложнений на госпитальном этапе являются следующие (необходимо наличие хотя бы одного):
- затяжной приступ;
- боль в покое с изменениями сегмента ST более 1 мм;
- признаки сердечной недостаточности и клапанной недостаточности, связанные с настоящим ухудшением.
Больной должен быть отнесен к группе промежуточного риска при наличии хотя бы одного из следующих критериев и отсутствии критериев высокого риска:
- наличие стенокардии покоя;
- приступы стенокардии покоя продолжаются до 20 минут или купируются нитроглицерином;
- приступы стенокардии сопровождаются преходящими изменениями зубца Т;
- ночная стенокардия;
- впервые возникшая стенокардия III или IV классов в течение первых 2-х недель;
- депрессия сегмента ST на 1 мм или более в нескольких отведениях ЭКГ;
- возраст более 65 лет.
К группе низкого риска относят больных, имеющих:
- усиление продолжительности, частоты или силы приступов стенокардии;
- снижение толерантности к нагрузке;
- впервые возникшая стенокардия более чем 2-х недельной давности.
Для стратификации больных по группам риска в последнее время предложено использовать и более сложные методики, общей основой является возможность регистрации сопутствующего повреждения кардиомиоцитов и объема миокарда, подвергающегося ишемии. Во всех случаях обнаружение признаков повреждения кардиомиоцитов (тропонины T и I) соответствует более тяжелому прогнозу. Также имеет большое значение продолжающаяся гиперкоагуляция (высокие уровни FPA и F1+2) как независимый показатель ближайшего и отдаленного прогнозов.
Необходимо отметить, что часть пациентов, имеющие один или несколько из указанных выше критериев нестабильной стенокардии, равноправно могут быть расценены как переносящие инфаркт миокарда без зубца Q. Грань между этими двумя состояниями весьма условна, для пациентов обеих категорий характерны общие механизмы развития и прогрессирования коронарной недостаточности, единый морфологический субстрат заболевания - формирование тромбоцитарного тромба в коронарной артерии. Имеющиеся различия касаются количественных изменений лабораторных показателей, данных ЭКГ, длительности болевого синдрома и т. д. Поэтому при проведении многоцентровых клинических исследований по эффективности вмешательств при остром коронарном синдроме больных с нестабильной стенокардией и инфарктом миокарда без зубца Q, как правило, объединяют в рамках одной клинической группы.
С практических позиций для определения врачебной тактики ведения больного с тем или иным вариантом острого коронарного синдрома принципиально важно наличие элевации или депрессии сегмента ST при первом контакте с больным. Элевация сегмента ST свидетельствует о протекании завершающих стадий развития коронарного тромбоза - формировании фибринного тромба с трансмуральным повреждением миокарда и служит показанием для экстренного проведения тромболитической терапии или коронарной ангиопластики. Другая группа больных - без элевации сегмента ST (without ST-elevation) не нуждается в проведении тромболизиса ввиду его малоэффективности и курируется с использованием антикоагулянтов и антитромбоцитарных препаратов. Такое разделение на сегодняшний день является общепризнанным и используется при планировании и проведении большинства клинических исследований.
Лечение острого коронарного синдрома и его основной клинической формы - нестабильной стенокардии, прежде всего преследует цель предотвращения развития крупноочагового инфаркта миокарда. Именно это событие является основной твердой конечной точкой (наряду с рецидивирующим ангинозным болевым синдромом, необходимостью выполнения коронарной ангиопластики, аортокоронарного шунтирования и случаями внезапной коронарной смерти) при проведении почти всех исследований по эффективности различных методик лечения больных с острым коронарным синдромом (здесь и далее преимущественно рассматриваются формы острого коронарного синдрома без элевации сегмента ST).
Целесообразно выделение следующих направлений в терапии:
В последние годы особенно активное развитие и изучение в клинике получило направление антитромботической терапии, к настоящему времени закончены многочисленные многоцентровые клинические исследования, являющиеся на сегодняшний день основным инструментом для оценки эффективности того или иного вмешательства в условиях доказательной медицины. Освещению аспектов преимущественно антитромботической терапии и посвящен данный обзор.
Основа традиционной терапии всех проявлений острого коронарного синдрома - раннее назначение b-адреноблокаторов, при этом прежде всего следует иметь в виду b1-селективные препараты с липофильными свойствами (метопролол, бисопролол, карведилол) как обладающие кардиопротективным эффектом. Также в ряде исследований продемонстрирован положительный эффект инфузии триметазидина (предуктал, Servier) при выполнении коронарной ангиопластики, постановке стентов - то есть при артифициальных формах острого коронарного синдрома.
АСПИРИН
С начала 80-х годов аспирин является одним из основных средств для лечения больных с нестабильной стенокардией и инфарктом миокарда, а также препаратом для первичной и вторичной профилактики ишемической болезни сердца. Механизм действия аспирина заключается в ингибировании циклооксигеназы и предотвращении таким образом образования одного из проагрегантов - тромбоксана А2, являющегося также сильным вазоконстриктором. Действие аспирина необратимо, его эффект сохраняется на протяжении времени жизни тромбоцита, то есть 9-10 дней.
Наиболее убедительные доказательства благоприятного влияния аспирина на течение и исход острого инфаркта миокарда были получены в одном из крупных международных исследований ISIS-2 (Second International Study of Infarty Survival, 1988г.). В это исследование было включено более 17 тыс. больных с подозрением на острый инфаркт миокарда, госпитализированных не позднее чем через 24 часа после возникновения ангинозного приступа (в среднем через 5 часов). Больные были разделены на 4 группы: больным 1-й группы внутривенно вводили стрептокиназу (1 500 000 ЕД в течение 60 мин); больные 2-й группы получали аспирин в дозе 162,5 мг/сут в течение 1 мес; больным 3-й группы назначали стрептокиназу в комбинации с аспирином; больные 4-й группы не получали ни стрептокиназы, ни аспирина.
По сравнению с контрольной группой 5-недельная смертность в 1, 2, 3-й группах была ниже соответственно на 25, 23 и 42%. Особенно значительным было снижение смертности среди больных, у которых терапию начинали в первые 4 часа после развития инфаркта миокарда, - на 35, 25 и 53% соответственно. При этом лечебный эффект аспирина мало зависел от времени начала терапии после развития заболевания. Таким образом, результаты исследования ISIS-2 дают основание предполагать, что в остром периоде инфаркта миокарда аспирин по эффективности не уступает монотерапии стрептокиназой, но реже вызывает серьезные побочные явления.
4-летнее наблюдение за больными острым инфарктом миокарда, включенными в исследование ISIS-2, показало, что благоприятный эффект терапии в остром периоде заболевания сохраняется в течение нескольких лет (С. Baigent et al., 1993).
В другом исследовании RISC продемонстрирована эффективность аспирина в терапии больных с нестабильной стенокардией или инфарктом миокарда без зубца Q. В этом исследовании больные получали 5-дневный курс терапии аспирином в дозе 75 мг/сут., при этом рандомизация осуществлялась на протяжении 72 часов с момента поступления в стационар (после того, как был полностью исключен инфаркт миокарда), около 19% больных были рандомизированы на протяжении 24 часов. На протяжении первых двух суток терапии разница между группами плацебо и аспирина была незначительной, поскольку эффект такой дозы аспирина проявляется не сразу. В целом на фоне терапии отмечено статистически достоверное (на 53%) снижение случаев смерти и развития инфаркта миокарда с зубцом Q (The RISC Group, 1994).
Статистически достоверное снижение риска смерти, развития инфаркта миокарда с зубцом Q у пациентов с нестабильной стенокардией при терапии аспирином показано в исследовании VACS (Veterans Administrations Cooperative Study, 1983 г). В исследовании приняли участие 1266 мужчин, госпитализированных в стационар с диагнозом нестабильной стенокардии, которые были разделены на группу аспирина (165 мг/сут.) и группу плацебо. При подведении итогов через 12 недель терапии в группе аспирина отмечено уменьшение событий внезапной смерти, фатального и нефатального инфаркта миокарда на 51% по сравнению с группой плацебо.
По данным P. Theroux et al. терапия аспирином больных с острым коронарным синдромом уменьшает риск развития трансмурального инфаркта миокарда в первые 48 часов на 71%, в первые 3 месяца на 60%, в течение 2 лет на 52%.
Мета-анализ 49 контролируемых исследований с участием более 90 тыс. больных с высоким риском (т.е. больных, перенесших инфаркт миокарда или нарушение мозгового кровообрашения) показал, что эффективность малых (менее 160 мг/сут.), средних (160-325 мг/сут.) и высоких (500-1500 мг/сут.) доз аспирина примерно одинакова. (Antiplatelet Trialist' Collaboration, 1994).
Таким образом, аспирин в суточной дозе 325 мг (160-325 мг/сут.) является высокоэффективным средством для лечения всех клинических проявлений острого коронарного синдрома и должен применяться в возможно более ранние сроки от момента начала заболевания (Руководство по диагностике и лечению нестабильной стенокардии NHLBI, 1994). В качестве препарата для вторичной профилактики аспирин может использоваться в суточной дозе менее 165 мг.
ТИКЛОПИДИН
Тиклопидин является также препаратом с антитромбоцитарными свойствами, среди возможных прямых механизмов действия тиклопидина на настоящий момент выделяют следующие:
- тиклопидин является сильным ингибитором опосредованной АДФ агрегации тромбоцитов, при этом практически не влияя на действие других проагрегантов;
- установлено, что под действием тиклопидина уменьшается связывание фибриногена с IIb / IIIa рецепторами тромбоцитов, можно предположить, что тиклопидин влияет на процесс мобилизации IIb / IIIа рецепторов в процессе агрегации тромбоцитов.
Самым серьезным недостатком тиклопидина является постепенное развитие терапевтического эффекта: антиагрегантный эффект тиклопидина обычно проявляется через 24-48 часов после приема внутрь и достигает максимума через 3-5 дней. Для полного подавления АДФ-индуцированной агрегации тромбоцитов необходимо применять тиклопидин в дозе 500 мг/сут. не менее 5 дней. Значительная антиагрегантная активность тиклопидина сохраняется через 72 часа после отмены препарата, а индуцируемая АДФ агрегация тромбоцитов возвращается к исходным значениям черех 4-5 дней после отмены препарата.
Таким образом, фармакодинамические характеристики тиклопидина не позволяют его использовать в неотложной терапии острого коронарного синдрома, на сегодняшний день этот препарат применяется в качестве средства вторичной профилактики у больных высокого риска как альтернатива аспирину при его непереносимости или противопоказаниях к назначению. Эффективность тиклопидина проверена в двух больших клинических исследованиях по профилактике сосудистых эпизодов у больных с цереброваскулярными заболеваниями, где продемонстрировано его преимущество перед плацебо и аспирином (см. таблицу 3).
В исследование CATS (Canadian-American Ticlopidine Study) было включено 1053 больных, которые недавно (в последние 4 месяца) перенесли тромбоэмболический инсульт, исследование TASS (Ticlopidine Aspirine Stroke Study) выполнено с целью сравнения профилактической активности тиклопидина (500 мг/сут.) и аспирина (1300 мг/сут.). По данным исследования TASS тиклопидин продемонстрировал более высокую профилактическую эффективность по сравнению с аспирином при меньшем количестве побочных эффектов.
Таблица 3.
Профилактика основных сосудистых эпизодов в исследованиях с тиклопидином у больных с цереброваскулярными заболеваниями.
| Исследование | N | Период наблюдения, г | Препарат сравнения | Конечные точки | Результат | Р |
| CATS | 1053 | 2 | Тиклопидин 500 мг/сут. vs плацебо | Смерть, инфаркт миокарда, инсульт | Уменьшение риска по конечным точкам на 30,2%; фатальго / нефатального инсульта на 33,5% | 0,006 |
| TASS | 3069 | 2-6 | Тиклопидин 500 мг/сут. vs аспирин 1300 мг/сут. | Смерть от любых причин, фатальный и нефатальный инсульт | Смерть / нефатальный инсульт – 12%; фатальный / нефатальный инсульт – 21% в пользу тиклопидина | 0,048 |
Клопидогрель, как и тиклопидин, является производным тиенопиридина. Механизм антиагрегантного действия клопидогреля и аспирина, по-видимому, одинаковый, но выраженность этого действия более выражена у клопидогреля. В неотложной терапии острого коронарного синдрома ввиду схожих с тиклопидином фармакодинамических показателей клопидогрель также не применяется. Клопидогрель - средство вторичной профилактики у больных с высоким риском сосудистых эпизодов и непереносимостью или противопоказаниями к назначению аспирина. К настоящему времени закончено сравнительное клиническое исследование эффективности клопидогреля как средства вторичной профилактики - CAPRIE (Clopidogrel vs Aspirin in Patients at Risk of Ishaemic Events), в котором на довольно большом клиническом материале (19185 больных) продемонстрировано преимущество клопидогреля перед аспирином (уменьшение риска основных сосудистых эпизодов - ишемического инсульта, инфаркта миокарда, внезапной смерти на 8,7% по сравнению с группой аспирина, p=0.043).
Таким образом, тиклопидин и клопидогрель являются на сегодняшний день высокоэффективными препаратами резерва для вторичной профилактики ишемической болезни сердца у пациентов с непереносимостью или противопоказаниями к назначению аспирина.
НЕФРАКЦИОНИРОВАННЫЙ ГЕПАРИН
Обычный (нефракционированный) гепарин является своеобразным прототипом для всех антикоагулянтов. Антикоагулянтное действие обычного гепарина основано на его взаимодействии с a2-глобулином плазмы антитромбином III с образованием комплекса, способного инактивировать факторы плазменного гемостаза IIa (тромбин), фактор Ха, ХIIа, XIа и IXa. При этом максимальное ингибирующее действие обычный гепарин проявляет в отношении тромбина и фактора Xa. Различные фракции гепарина обладают неодинаковой биологической активностью. В то время как высокомолекулярные фракции гепарина в одинаковой степени тормозят активность как тромбина, так и фактора Xa (в соотношении 1:1), низкомолекулярные его фракции в зависимости от молекулярной массы проявляют ту или иную степень избирательности в отношении фактора Xa (отношение анти-IIa:анти-Xa от 1:2 до 1:4).
Нейтрализуя тромбин, гепарин способен уменьшать и предупреждать агрегацию тромбоцитов, индуцируемую тромбином, однако при этом отмечено усиление агрегации тромбоцитов в присутствии других индукторов (АДФ, серотонин и др.). Способность вызывать агрегацию тромбоцитов менее выражена у гепаринов с низкой молекулярной массой, поскольку в их молекуле отсутствует активный центр для связывания с мембраной тромбоцитов.
На сегодняшний день проведение гепаринотерапии с лечебной целью возможно исключительно путем начального болюсного введения и последующей продолжительной (48-72 часа) внутривенной инфузии гепарина под контролем активированного частичного тромбопластинового времени (АЧТВ). Практиковавшееся ранее прерывистое внутривенное введение гепарина не обеспечивает необходимого терапевтического эффекта ввиду значительных колебаний сывороточной концентрации гепарина и значительно чаще провоцирует возникновение кровотечений.
Нефракционированный гепарин используется при лечении нестабильной стенокардии с начала 90-х годов и относится к числу средств с доказанной эффективностью. Впервые группа ученых под руководством P. Theroux в рандомизированном плацебо-контролируемом исследовании показала преимущество инфузии гепарина, аспирина, а также их комбинации перед плацебо в лечении нестабильной стенокардии. Однако небольшое число больных, участвующих в этом исследовании (479 больных), не позволило организаторам продемонстрировать статистически достоверные различия частоты конечных точек (рефрактерный ангинозный болевой синдром, инфаркт миокарда, смерть) между исследуемыми группами пациентов.
Oler et al. провели мета-анализ шести рандомизированных исследований по сравнению эффективности комбинации гепарин + аспирин и только аспирина у больных с нестабильной стенокардией. Суммарно в исследованиях приняли участие 1353 пациента, из них 698 получали аспирин и гепарин, 655 - только аспирин (75-165 мг/сут.). В пяти из проанализированных исследований использовалась внутривенная инфузия гепарина в течение 2-7 суток с поддержанием показателя АЧТВ в пределах 1.5-2.0 от контроля, в одном - повторные внутривенные введения. Во всех исследованиях, вошедших в мета-анализ, комбинация гепарина и аспирина была эффективнее чем лечение апирином в отдельности. Суммарный относительный риск первичных конечных точек - смерти и развития инфаркта миокарда в группе гепарин + аспирин составил 0.67 (0.44-1.02) по сравнению с группой только аспирина, таким образом, инфузия гепарина в сочетании с терапией аспирином на 33% (статистически значимо) уменьшает количество фатальных и нефатальных коронарных событий при острой нестабильной стенокардии. При анализе вторичных конечных точек получены следующие данные относительного риска: 0.68 (0.40-1.17) - для рецидивирующего ангинозного болевого синдрома; 0.82 (0.56-1.20) - для случаев смерти и развития инфаркта миокарда на протяжении времени от 2 до 12 недель после рандомизации; 1.03 (0.74-1.43) - для случаев коронарной реваскуляризации и 1.99 (0.52-7.65) - для возникновения "больших" кровотечений. Таким образом, инфузия гепарина в сочетании с назначением аспирина является высокоэффективной терапевтической стратегией ведения больных с острым коронарным синдромом, особенно в первые часы от начала развития заболевания.
В руководстве по диагностике и лечению нестабильной стенокардии NHLBI содержится рекомендация применять гепарин следующим способом: первоначально необходимо ввести болюсом 80 ЕД/кг, затем проводить инфузию со скоростью 18 ЕД/кг/час в течение 3-5 дней. Доза (скорость введения) гепарина должна титроваться по уровню АЧТВ с тем, чтобы поддерживать его в диапазоне 1.5-2.5 от контроля на протяжении всего времени инфузии. АЧТВ рекомендуется определять через 6 часов после начала введения гепарина или изменения его дозы (скорости введения), затем каждые 6 часов, пока желаемый показатель (т.е. удлинение АЧТВ в 1.5-2.5 раза) не будет получен в двух последовательных анализах. После достижения терапевтического уровня АЧТВ предлагается измерять 1 раз в сутки. Комбинирование аспирина и обычного гепарина обычно производится по схеме: 325 мг аспирина в сутки на фоне инфузии гепарина в соответствии с рекомендациями NHLBI либо та же доза аспирина и гепарин: 5000 ЕД болюсно и инфузия в течение 3-5 дней в дозе 1000-1300 ЕД/час (24000-32000 ЕД/сут.).
Однако, несмотря на доказанную клиническую эффективность гепарина, ему свойствен ряд недостатков, затрудняющих применение в неотложной кардиологической практике:
- гепарин связывается с белками плазмы крови, адсорбируется на поверхности эндотелиальных клеток, фагоцитируется макрофагами. Эти процессы приводят к утрате биологической активности вводимого гепарина и определяют плохую предсказуемость антикоагулянтного эффекта у конкретного больного;
- при назначении гепарина с лечебной целью необходим тщательный индивидуальный лабораторный контроль, в одном из крупных исследований TIMI 9B было установлено, что во время внутривенного введения гепарина АЧТВ находилось в пределах терапевтических значений только около 30% всего времени в течение суток;
- практически сложно обеспечить как минимум 48 (лучше 72)-часовую непрерывную внутривенную инфузию препарата;
- тромбоцитарный фактор IV способен инактивировать гепарин, помимо этого тромбоциты способны связывать фактор Xa и таким образом защищать его от действия гепарина;
- гепарин, ввиду больших размеров своей молекулы, не способен инактивировать тромбин, связанный с фибрином и субэндотелиальными структурами, таким образом гепарин не может активно противодействовать фибринообразованию в месте разрыва бляшки;
- гепарин способен усиливать агрегацию тромбоцитов под влиянием различных индукторов, кроме тромбина;
- показано, что при нестабильной стенокардии применение гепарина с поддержанием АЧТВ в 2 раза выше контроля сопровождается быстрым снижением уровня фибринопептида А (FPA), однако снижения уровня фрагмента протромбина 1+2 (F1+2) не происходит. Таким образом, уменьшая активность тромбина, гепарин не влияет на его образование и риск тромбоза во время терапии гепарином сохраняется;
- действие гепарина продолжается только в течение его непрерывной внутривенной инфузии, более того, после прекращения гепаринотерапии наблюдается реактивация тромботического процесса с возможным развитием инфаркта миокарда;
- частота иммунной тромбоцитопении на фоне введения гепарина составляет 1-3%, ее возникновение связано с появлением антител к гепарину и компонентам мембраны тромбоцитов, которые активируют тромбоциты и вызывают распространенный тромбоз микрососудов, сама тромбоцитопения носит вторичный характер и образуется в результате потребления тромбоцитов в образующихся тромбах.
Таким образом, на сегодняшний день, нефракционированный гепарин является классическим средством для лечения всех проявлений острого коронарного синдрома и демонстрирует высокую эффективность как при монотерапии, так и особенно в сочетании с назначением аспирина. Однако высокая дороговизна и многочисленные технические сложности в проведении гепаринотерапии заставляет искать реальную альтернативу обычному гепарину.
НИЗКОМОЛЕКУЛЯРНЫЕ (ФРАКЦИОНИРОВАННЫЕ) ГЕПАРИНЫ
Низкомолекулярные гепарины представляют собой продукт ферментативной или химической деполимеризации обычного гепарина и имеют молекулярную массу от 3400 до 6400 Д. Показано, что получаемые в процессе деполимеризации низкомолекулярные фракции гепарина обладают новыми фармакодинамическими свойствами и имеют значительные преимущества при их применении перед обычным гепарином.
Механизм действия низкомолекулярных гепаринов также заключается во взаимодействии с a2-глобулином плазмы антитромбином III и ингибировании таким образом факторов плазменного гемостаза, прежде всего тромбина (фактор IIa) и фактора Ха (см.выше). При этом соотношение ингибирующего эффекта (анти-IIa:анти-Ха), составляющего для обычного гепарина 1:1, у низкомолекулярных фракций гепарина находится в диапазоне 1:2 - 1:6, то есть они обладают способностью блокировать процесс тромбообразования на более ранней, "проксимальной" стадии. Учитывая существование положительной обратной связи на разных ступенях коагуляционного каскада, можно ожидать, что низкомолекулярные гепарины смогут непосредственно противодействовать процессу образования тромбина.
Кроме этого низкомолекулярные гепарины резистентны к инактивирующему влиянию фактора 4 тромбоцитов и не усиливают их агрегацию под влиянием различных индукторов, также при использовании низкомолекулярных гепаринов отмечена значительно меньшая частота развития тромбоцитопении.
К числу преимуществ низкомолекулярных гепаринов, связанных с практикой их применения можно отнести:
- значительно лучшую по сравнению с обычным гепарином предсказуемость антитромботического эффекта ввиду отсутствия связывания с плазменными белками и мембранами эндотелиоцитов, соответственно терапия низкомолекулярными гепаринами не требует столь тщательного индивидуального лабораторного контроля;
- большую биодоступность (до 90% после глубокой подкожной инъекции) низкомолекулярных гепаринов, что позволяет назначать их подкожно не только с профилактической, но и с лечебной целью;
- более продолжительную антитромботическую активность (Т1/2 более 4,5 часов после внутривенного введения против 50-60 мин у обычного гепарина), с возможностью назначения 1-2 раза в сутки.
В настоящее время используется около 10 препаратов низкомолекулярных гепаринов, однако эффективность в лечении острых коронарных синдромов в условиях крупных рандомизированных, с применением плацебо исследований к настоящему времени доказана лишь относительно трех - дальтепарина, эноксапарина и надропарина (ФРАГМИН™, КЛЕКСАН™ и ФРАКСИПАРИН™ соответственно).
Здесь уместно подчеркнуть, что каждый низкомолекулярный гепарин является исключительно самостоятельным препаратом, терапевтический потенциал которого в большей мере определяется технологией его производства.
На настоящий момент закончены клинические исследования эффективности препаратов низкомолекулярных гепаринов при лечении больных с различными клиническими проявлениями острого коронарного синдрома.
Исследование FRISC (Fragmin During Instability in Coronary Artery Disease Study) - первое крупное плацебо-контролируемое рандомизированное исследование эффективности низкомолекулярного гепарина дальтепарина у больных с нестабильной стенокардией и инфарктом миокарда без зубца Q. В исследовании приняли участие 1506 больных, обязательным условием включения в исследование являлись изменения конечной части желудочкового комплекса на ЭКГ. Дизайн исследования предполагал сравнение двух терапевтических стратегий: применение дальтепарина подкожно в дозе 150 МЕ/кг в первые 5-7 дней с интервалом 12 часов и последующим введением фиксированной дозы 7500 МЕ однократно в сутки на протяжении 35-45 дней либо плацебо. Вмешательства в обеих группах выполнялись на фоне терапии аспирином в дозе 75 мг/сут., первая доза 300 мг/сут. Вследствие значительной частоты геморрагических осложнений на начальных этапах исследования при дозе дальтепарина 150 МЕ/кг Комитет по безопасности уменьшил дозу препарата до 120 МЕ/кг, сократив число "больших" кровотечений до приемлемого уровня.
При подведении итогов исследования использовались суммарные конечные точки - общее число случаев смерти, развития инфаркта миокарда, процедур реваскуляризации и внутривенного введения обычного гепарина в каждой из групп больных. Анализ FRISC по результатам первых 6 дней лечения показал высокодостоверное снижение кумулятивной частоты случаев смерти и развития инфаркта миокарда на 63% в группе дальтепарина по сравнению с группой плацебо: в группе дальтепарина частота этих событий составила 1.8%, в группе плацебо 4.8% (p= 0.001). К 35-45 дню положительные эффекты дальтепарина сохранялись, суммарная конечная точка для группы дальтепарина составила 20,5% и 25,7% для группы плацебо (p=0.011). Изолированные показатели частоты смерти и инфаркта миокарда также были меньшими в группе дальтепарина, однако отличия не были статистически значимыми. Снижение дозы дальтепарина и переход к однократному введению 7500 МЕ сопровождались увеличением частоты коронарных эпизодов, что свидетельствует о реактивации стенокардии, а к 4-5 месяцу изучавшиеся показатели существенно не различались между группами.
Таким образом, в данном исследовании дальтепарин продемонстрировал высокую эффективность по сравнению с плацебо при его назначении в полной терапевтической дозе у больных с нестабильной стенокардией и инфарктом миокарда без зубца Q, однако при отмене препарата наблюдается нивелирование достигнутых ранее эффектов лечения.
Исследование FRIC (Fragmin in Unstable Coronary Artery Disease) было первым сравнительным исследованием низкомолекулярного и обычного гепаринов у пациентов с нестабильной стенокардией и инфактом миокарда без зубца Q. В исследование суммарно было включено 1482 больных (первые 72 часа заболевания), протокол предусматривал две фазы исследования: первая (открытая) фаза, в которой на протяжении первых 6 суток заболевания применялся либо дальтепарин (120 МЕ/кг с интервалом в 12 ч), либо внутривенная инфузия нефракционированного гепарина в течение минимум 48 часов с поддержанием АЧТВ на уровне 1,5 от исходных значений и продолжение гепаринотерапии подкожно до 6 суток в дозе 12 500 ЕД дважды в сутки. В обеих группах назначался аспирин в дозе 75-165 мг/сут в зависимости от практики конкретного учреждения, участвующего в исследовании. Во вторую фазу исследования (двойной слепой метод) с 6-х по 45-е сутки нрименялся либо дальтепарин в дозе 7500 МЕ однократно в сутки, либо плацебо.
Сравнение двух режимов антикоагулянтной терапии в острую фазу заболевания не показало каких-либо преимуществ одного перед другим. Так, кумулятивная частота основных коронарных событий - случаев смерти, развития инфаркта миокарда, рецидивов анигинозных приступов в первые 6 дней наблюдения в группе дальтепарина составила 9,3%, в группе обычного гепарина 7,6% (p=0.33). Частота случаев смерти и инфаркта миокарда была одинаковой - 3,9 и 3,6%, а предпринятой реваскуляризации 4,8% и 5,3% соответственно (различия недостоверны). Во второй фазе исследования кумулятивная частота случаев смерти и инфаркта миокарда среди больных, получавших дальтепарин, составляла 4,3%, плацебо - 4,7%. Показатель смертности с 6-х по 45-е сутки в обеих группах составлял 2%.
Таким образом, на основе данных, полученых в исследованиях FRISC и FRIC, можно утверждать о преимуществе терапии дальтепарином в комбинации с аспирином перед терапией только одним аспирином в остром периоде заболевания. При этом первое из проведенных сравнительных исследований (FRIC) не показало различий в эффективности обычного и низкомолекулярного гепаринов по отношению к основным конечным точкам. Однако неудачное планирование и организация исследования FRIC (открытая начальная фаза и др.) затрудняет объективную оценку его результатов.
Исследование ESSENCE (Efficacy and Safety of Subcutaneous Enoxaparin in Non-Q-Wave Coronary Events Study) было проведено с целью изучения сравнительной эффективности другого низкомоекулярного гепарина эноксапарина у больных с острым коронарным синдромом. Под наблюдением находился 3171 больной, рандомизированные в течение ближайших 24 часов от момента возникновения острой ишемии миокарда без элевации сегмента ST на ЭКГ. Дизайн исследования предусматривал сравнение двух терапевтических стратегий: применение эноксапарина из расчета 1 мг/кг подкожно дважды в сутки либо непрерывной внутривенной инфузии обычного гепарина (первоначально болюсом вводили 5000 ЕД) под контролем АЧТВ, которое увеличивали в 2 раза по сравнению с контрольными значениями. Во всех группах применялся аспирин в дозе 100-325 мг/сут. длительность антикоагулянтной терапии колебалась от 48 часов до 8 суток, составляя в среднем 2,6 сут.
При оценке на 14-е сутки кумулятивная конечная точка (случаи смерти, инфаркта миокарда, рецидивирование стенокардии с изменениями на ЭКГ) в группе эноксапарина отмечена в 16,6%, в группе применения обычного гепарина в 19,8% случаев (p=0,019). К 30-м суткам наблюдения этот показатель составил соответственно 19,8 и 23,3% (p=0,016). Реваскуляризация достоверно реже применялась в группе эноксапарина - 27,7%, в то время как в группе обычного гепарина у 32,2% больных (p=0,001). Большие кровотечения отмечены в обеих подгруппах с одинаковой частотой. К настоящему времени готовы и итоги годового наблюдения за больными, участвующими в исследовании ESSENCE: комбинированная конечная точка прослежена у 32% больных из группы эноксапарина и у 35,7% больных (p=0,022), получавших обычный гепарин.
Таким образом, эноксапарин показал значительное, достоверное превосходство в эффективности над инфузией обычного гепарина как в остром периоде заболевания - снижение риска основных коронарных событий на 16,2% к 14-м суткам наблюдения, так и при анализе через 30 дней и 1 год: разница в группах составила соответственно 15,1% и 10,4%.
TIMI 11B (Thrombolysis in Myocardial Infarction 11B Trial) - наиболее крупное из проводимых сравнительных клинических исследований низкомолекулярных гепаринов. В исследовании участвовали 3910 больных с нестабильной стенокардией или инфарктом миокарда, рандомизация выполнялась в первые 24 часа от возникновения заболевания. Протокол исследования был спланирован с целью сравнения эффективности двух терапевтических стратегий: применение обычного гепарина внутривенно болюсно в дозе 70 ЕД/кг с последующей непрерывной внутривенной инфузией (поддержанием АЧТВ на уровне 1,5-2,5 от исходных значений) в течение 3-8 дней (в среднем 3 дня) и низкомолекулярного гепарина эноксапарина. Эноксапарин назначался в "острой фазе" заболевания первоначально внутривенно болюсом в дозе 30 мг, затем подкожно дважды в сутки в дозе 1 мг/кг в течение 8 дней (в среднем 4,6 дней). Амбулаторная фаза лечения эноксапарином предполагала использование его в дозе 40 мг подкожно 2 раза в сутки при массе тела менее 65 кг и 60 мг при массе тела более 65 кг, пациенты группы обычного гепарина в амбулаторную фазу лечения получали плацебо. В обеих группах в течение всего периода наблюдения назначался аспирин в дозе 100-325 мг.
При анализе результатов исследования обнаружено явное превосходство эноксапарина перед обычным гепарином в эффективности предотвращения основных коронарных событий (первичные конечные точки - смерть, развитие инфаркта миокарда, ургентная реваскуляризация) - см. табл.4.
Табл. 4
Результаты исследования TIMI 11B
| Время наблюдения | Препарат | Частота первичных конечных точек | Р |
| 8 ДЕНЬ | НФГ | 14,5% | 0,048 (OR 0.83) |
| Эноксапарин | 12,4% | ||
| 43 ДЕНЬ | НФГ | 19,7% | 0,048 (OR 0.85) |
| Эноксапарин | 17,3% |
Примечание:
OR: odds ratio
Однако в группе эноксапарина отмечено значимое увеличение больших кровотечений по сравнению с плацебо в амбулаторную фазу исследования (2,9% vs 1,5%; р=0,021), в острую фазу по частоте кровотечений группы не различались между собой.
E.M. Antman et al. выполнили мета-анализ эффективности эноксапарина в сравнении с обычным гепарином по данным исследований ESSENCE и TIMI 11B (n=7081). При сравнении совокупных данных продемонстрировано высокодостоверное снижение риска первичных конечных точек более чем на 20% в группе эноксапарина (см. табл.5).
Табл 5.
Данные мета-анализа исследований ESSENCE и TIMI 11B.
| Уменьшение риска | OR | P | |
| 8 ДЕНЬ | 21% | 0,71 | 0,02 |
| 14 ДЕНЬ | 21% | 0,79 | 0,0005 |
| 43 ДЕНЬ | 20% | 0,80 | 0,0006 |
Примечание:
OR: odds ratio
Последнее из завершенных на момент написания обзора рандомизированное сравнительное клиническое исследование низкомолекулярных гепаринов FRAX.I.S. (Comparison of two treatment durations (6 days and 14 days) of a low molecular weight heparin with a 6-day treatment of unfractionated heparin in the initial management of unstable angina or non-Q wave myocardial infarction: FRAX.I.S.) выполнено с целью сравнения трех терапевтических стратегий применения низкомолекулярного гепарина надропарина и обычного нефракционированного гепарина при лечении больных нестабильной стенокардией и инфарктом миокарда без зубца Q. Всего рандомизировано 3468 пациентов в течение первых 48 часов развития заболевания. Больным группы обычного гепарина при включении в исследование внутривенно болюсом вводился гепарин в дозе 5000 ЕД, затем путем непрерывной инфузии в течение 6±2 дней с поддержанием АЧТВ в пределах 1,5-2,5 от контроля. Группа надропарина была разделена на две подгруппы: в одной из них при рандомизации внутривенно вводился болюс надропарина в дозе 86 МЕ/кг, а затем надропарин использовался подкожно дважды в сутки также в дозе 86 МЕ/кг в течение 6±2 дней. В другой подгруппе также в момент рандомизации внутривенно вводился болюс надропарина в дозе 86 МЕ/кг, однако последующее подкожное введение надропарина в дозе 86 МЕ/кг дважды в сутки продолжалось 14 дней. В обеих группах пациенты получали аспирин в дозе 100-325 мг.
При анализе частоты первичных конечных точек достоверных преимуществ надропарина перед обычным гепарином не удалось выявить как через 6, так и через 14 дней терапии (см. табл 6).
Таблица 6.
Результаты исследования FRAX.I.S.
| Группа | Период наблюдения, дни | Частота первичных конечных точек1 | Р |
| НФГ | 6 | 14,9% | Надропарин 6 vs НФГ 0,85 |
| 14 | 18,1% | ||
| НАДРОПАРИН 6 | 6 | 13,8% | |
| 14 | 17,8% | Надропарин 14 vs НФГ 0,24 |
|
| НАДРОПАРИН 14 | 6 | 15,8% | |
| 14 | 20,0% |
В подгруппе НАДРОПАРИНа 14 также отмечена достоверно более высокая частота возникновения больших кровотечений по сравнению с НФГ: 3,5% vs 1,6%; Р=0,0035.
Подводя итог, можно отметить, что низкомолекулярные гепарины на сегодняшний день являются средствами для лечения различных клинических проявлений острого коронарного синдрома с доказанной эффективностью. При этом следует иметь в виду значительную гетерогенность данной группы препаратов, каждый представитель которой обладает уникальным спектром терапевтического действия (см. результаты исследования FRAX.I.S. - при достоверном увеличении количества кровотечений не продемонстрировано значимого клинического эффекта) .
В рандомизированных клинических испытаниях доказано преимущество только эноксапарина, надропарин и дальтепарин могут применяться в комбинации с аспирином наравне с инфузией обычного гепарина как равноэффективные методики.
Существенным является и экономический аспект лечения: согласно проведенным многочисленным фармакоэкономическим исследованиям, терапия низкомолекулярными гепаринами позволяет добиться значительного экономического эффекта за счет лучших исходов заболевания и сокращения затрат на лабораторные исследования, регоспитализации, проведение инвазивных вмешательств.
Перспективной является возможность длительного, включая домашнее, лечения низкомолекулярными гепаринами больных из категории высокого риска, а также пролонгирование лечения на амбулаторном этапе после выписки из стационара.
ПРЯМЫЕ ИНГИБИТОРЫ ТРОМБИНА
Группа прямых ингибиторов тромбина получила свое развитие после разработки ДНК-рекомбинантной технологии получения основного ее представителя - гирудина (лепирудина, CGP 39 393). В отличие от непрямых ингибиторов тромбина - гепарина и его аналогов, для реализации антикоагулянтного действия которых необходимо присутствие в плазме антитромбина III, гирудин обладает уникальной способностью напрямую связываться с активным тромбином и блокировать его биологическое действие.
Резюмировать теоритические преимущества группы прямых ингибиторов тромбина в сравнении с препаратами гепарина и его аналогов можно следующим образом:
- как уже отмечалось, это независимость биологического (терапевтического) эффекта от присутствия и активности плазменных кофакторов, прежде всего, антитромбина III, уровень которого снижен у лиц с наследственным его дефицитом и при ряде других заболеваний и состояний (печеночная недостаточность, длительная предшествующая гепаринотерапия и др.);
- резистентность к действию ингибирующих факторов (фактор 4 тромбоцитов и др.) и плазменных протеинов (гепариназа, a-макроглобулин и др.);
- высокая избирательность биологического действия: гирудин не влияет на активность других факторов коагуляционного каскада и не потенцирует агрегацию тромбоцитов при воздействии отличных от тромбина индукторов, что характерно для гепарина;
- отсутствие связывания с белками плазмы и мембранами эндотелиоцитов, что позволяет легко контролировать и прогнозировать антитромботический эффект гирудина у конкретного больного;
- высокая активность в отношении как свободного, так и связанного с фибрином тромбина, в отличие от гепарина и его аналогов, неспособных к инактивации связанного тромбина.
Последнее положение особенно важно, так как считается, что на стадии образования фибринного тромба именно тромбогенность недоступного для гепарина, связанного с тромбом тромбина, является основным фактором, ответственным за прогрессирование процессов, способствующим нестабильности стенокардии и развитию инфаркта миокарда.
Класс непрямых ингибиторов тромбина представлен следующими препаратами: гирудин, гирулог,олигопептиды (PPACK, аргатробан, тромбостоп, иногатран, эфегатран), гируген.
В рандомизированных клинических испытаниях оценена эффективность, главным образом, гирудина и в меньшей степени гирулога. Гирудин - полипептид, содержащий 65 аминокислотных остатков, с молекулярной массой 7000 Д. Для контроля за гирудинотерапией используется АЧТВ, внутривенная инфузия гирудина сопровождается дозозависимым удлинением АЧТВ с достижением плато-уровня через ~30 мин от начала терапии. Учитывая механизм действия гирудина, наиболее активно на настоящий момент разрабатываются три возможные области его применения в неотложной кардиологии:
- в комбинации с фибринолитическими агентами при лечении инфаркта миокарда (ожидается, что гирудин будет эффективно препятствовать коронарному ретромбозу вследствие высвобождения больших количеств тромбина из лизированного тромба);
- в связи с выполнением коронарной ангиопластики;
- у больных с нестабильной стенокардией и инфарктом миокарда без зубца Q.
После выполнения нескольких пилотных сравнительных исследований гепарина и гирудина, в том числе ангиографического рандомизированного исследования, выполненного группой E. Topol et al. на 166 пациентах с нестабильной стенокардией и инфарктом миокарда без зубца Q, в котором показано достоверное преимущество гирудина перед гепаринотерапией (увеличение уровня перфузии по TIMI на 5-е сутки у 25% в группе гирудина и у 19% в группе гепарина) были спланированы и начаты исследования III фазы - TIMI 9A (Thrombolysis in Myocardial Infarction 9A Trial) и GUSTO IIa (Global Use of Strategies to Open Occluded Coronary Arteries IIa Investigators). Однако, ввиду значительного увеличения количества интракраниальных геморрагий и кровотечений другой локализации у пациентов, получающих гирудин, исследования были прекращены досрочно. Предполагалось включить в исследование TIMI 9A - 3000 пациентов (включено 757), в GUSTO 2A - 12000 пациентов (включено 2564). Клинически значимые спонтанные кровоизлияния в TIMI 9A наблюдались в группе гирудина в 7%, в группе гепарина в 3% (Р=0,02), в GUSTO 2A геморрагические инсульты отмечены в 1,3% при терапии гирудином и в 0,7% при гепаринотерапии. Доза гирудина в обеих исследованиях составила 0,6 мг/кг болюс с последующей инфузией в дозе 0,2 мг/кг/час.
В последнем из завершенных клинических исследований по изучению эффективности гирудина в предотвращении ретромбоза после проведения фибринолиза - TIMI 9B (Thrombolusys and Thrombin Inhibition in Myocardial Infarction 9B Trial) приняли участие 3002 пациента с трансмуральным инфарктом миокарда. Рандомизация проводилась в течение 12 часов с момента появления симптомов заболевания. Дизайн исследования предполагал сравнение двух терапевтических стратегий: внутривенного болюсного введения гепарина в дозе 5000 ЕД с последующей его инфузией в дозе 1000 ЕД/час (n=1491) либо болюсного введения гирудина в дозе 0,1 мг/кг с продолжением инфузии со скоростью 0,1 мг/кг/час (n=1511). Оба вида вмешательства выполнялись непосредственно после введения стрептокиназы или тканевого активатора плазминогена, на фоне терапии аспирином в дозе 100-325 мг/сут. Продолжительность инфузии составила 96 часов, показатель АЧТВ в двух группах поддерживали в диапазоне 55-85 с.
Сравнеие частоты возникновение первичных конечных точек (смерть, повторный инфаркт миокарда, застоиная сердечная недостаточность или кардиогенный шок) через 30 дней наблюдения не выявило достоверных различий между группами (см. табл 7).
Таблица 7.
Результаты исследования TIMI 9B
|
30 ДНЕЙ НАБЛЮДЕНИЯ | ||
| Частота первичных конечных точек | Частота больших кровотечений | Частота интракраниальных кровотечений | |
| ГЕПАРИН | 11,9% | 5,3% | 0,9% |
| ГИРУДИН | 12,9% | 4,6% | 0,4% |
Не было достоверных различий также в частоте возникновения больших и интракраниальных кровотечений.
Таким образом, по данным TIMI 9B гирудин не обладает доказанными преимуществами перед гепаринотерапией при комбинированном лечении инфаркта миокарда. Низкую эффективность гирудина в данном исследовании отчасти можно объяснить недостаточной дозой препарата при болюсном введении.
В настоящий момент проводится исследование с похожим дизайном HERO-2, которое на довольно большом клиническом материале (n=17000) должно ответить на вопрос о эффективности другого представителя прямых антитромбинов - гирулога, результаты пилотного исследования HERO-1 обнадеживают (48% vs 35%, р<0,05).
Место прямых ингибиторов тромбина в лечении нестабильной стенокардии и инфаркта миокарда без зубца Q, то есть основных клинических проявлений острого коронарного синдрома на настоящий момент более определенно.
В исследовании GUSTO IIb (Global Use of Strategies to Open Occluded Coronary Arteries IIb Investigators) был учтен предыдущий опыт и доза гирудина значительно уменьшена. В исследовании участвовали суммарно 12 142 пациента, из них 4131 имели элевацию сегмента ST на исходной ЭКГ, у 8011 на момент рандомизации диагностирована нестабильная стенокардия либо инфаркт миокарда без зубца Q. Согласно протоколу исследования все больные были разделены на группу обычного гепарина и группу гирудина, вводимых путем непрерывной внутривенной инфузии на протяжении 72 часов, первоначально вводилась болюсная доза препарата. В обеих группах вмешательства выполнялись на фоне аспирина 165-325 мг/сут. Результаты этого исследования сведены в табл. 8.
Таблица 8.
Результаты исследования GUSTO IIb
| Длительность наблюдения | Частота первичныхконечных точек | Уменьшение риска | Р | |
| ГЕПАРИН | ГИРУДИН | |||
| 24 ЧАСА2 | 2,1% | 1,3% | 38% | 0,001 |
| 48 ЧАСОВ2 | 3,1% | 2,3% | 26% | 0,001 |
| 30 ДНЕЙ3 | 9,8% | 8,9% | 9% | 0,06 |
По количеству больших кровотечений группы достоверно не различались, терапия гирудином ассоциировалась с большим количеством мелких кровоизлияний и экхимозов в местах инъекций (8,8% vs 7,7%; р=0,03).
Таким образом, в данном исследовании гирудин продемонстрировал высокодостоверное преимущество перед гепарином в острую фазу заболевания. При дальнейшем наблюдении различия между подгруппами нивелируются и остаются на грани статистической достоверности к 30 суткам. Среди причин низкой эффективности гирудина в отдаленном периоде наблюдения можно предполагать низкую дозу препарата, не позволяющую полностью реализовать его антитромботический потенциал. В пользу этого свидетельствуют данные выполненного в рамках GUSTO IIb гематологического подисследования, в котором группой K. Kottke-Marchant et al. отмечен стабильный уровень F1+24 в сыворотке крови несмотря на проводимую терапию гирудином.
На основе полученных данных было спланировано пилотное исследование OASIS -1 (Organization to Assess Strategies for Ischemic Syndromes), основной целью которого было определение оптимальной с точки зрения эффективности и безопасности дозы применяемого гирудина. В исследовании приняли участие 909 пациентов, госпитализированные в стационар с диагнозом нестабильной стенокардии или инфаркта миокарда без зубца Q. Исследование проводилось с помощью двойного слепого метода, дизайн предполагал сравнение трех терапевтических стратегий: больные из группы гепарина получали нефракционированный гепарин в дозе 5000 ЕД болюсом, затем гепаринотерапия продолжалась в форме непрерывной внутривенной инфузии со скоростью 1000-1200 ЕД/час (n=371). Больным второй группы назначался гирудин в низкой терапевтической дозе: 0,2 мг/кг внутривенно болюсом и последующая инфузия 0,1 мг/кг/час (n=271); третья группа пациентов получала гепарин в дозе, близкой к среднетерапевтической: 0,4 мг/кг внутривенно болюсом, дальнейшая непрерывная инфузия препарата со скоростью 0,15 мг/кг/час (n=267). Длительность вмешательств во всех трех группах составляла 72 часа, параллельно назначался аспирин в дозе 100-325 мг/сут.
Результаты проведенного исследования - кумулятивная частота первичных (смерть, инфаркт миокарда, рефрактерная стенокардия ) и вторичных (смерть, инфаркт миокарда, рефрактерная и рецидивирующая стенокардия) конечных точек к 7 дню наблюдения представлены в табл. 9,10, 11.
Таблица 9.
Результаты исследования OASIS-1.
| Частота первичных конечных точек | Частота вторичных конечных точек | |
| ГЕПАРИН | 6,5% | 15,6% |
| ГИРУДИН 0,2/0,1 | 4,4% | 12,5% |
| ГИРУДИН 0,4/0,15 | 3,0% | 9,4% |
Таблица 10.
Сравнение подгрупп больных в исследовании OASIS-1
| По частоте первичных конечных точек | По частоте вторичных конечных точек | |||
| Изменение риска | Р | Изменение риска | Р | |
| ГЕПАРИН vs ГИРУДИН 0,2/0,1 | 32% | 0,267 | 20% | 0,27 |
| ГЕПАРИН vs ГИРУДИН 0,4/0,15 | 54% | 0,047 | 40% | 0,02 |
Таблица 11.
Частота развития инфаркта миокарда в исследовании OASIS-1
| Частота возникновения инфаркта миокарда | Частота случаев коронарной реваскуляризации | |
| ГЕПАРИН | 4,9% | 3,7% |
| ГИРУДИН 0,2/0,1 | 2,6% | 1,1% |
| ГИРУДИН 0,4/0,15 | 1,9% | 4,0% |
| P | P | |
| ГЕПАРИН vs ГИРУДИН 0,2/0,1 | 0,14 | NS |
| ГЕПАРИН vs ГИРУДИН 0,4/0,15 | 0,046 | 0,028 |
Таким образом, в исследовании OASIS-1 показано достоверное преимущество применения гирудина в низкой и средней дозе по сравнению с терапией гепарином. Особенно сильные отличия (уменьшение риска основных коронарных событий на 54%) получены при сравнении средней дозы гирудина и гепарина, при этом они сохранились и через 180 дней наблюдения. По числу больших кровотечений значимых различий между группами не выявлено.
Результаты пилотного исследования OASIS-1 вдохновили организаторов для проведения крупного международного рандомизированного клинического испытания гирудина OASIS-2 (Organization to Assess Strategies for Ischemic Syndromes (OASIS-2) Trial), в котором на большом клиническом материале предполагалось продемонстрировать преимущества гирудина перед применением гепарина. В это исследование был включен 10141 больной с острым коронарным синдромом без элевации сегмента ST на ЭКГ, большую часть составили пациенты с нестабильной стенокардией. Дизайн исследования был спланирован для сравнения двух стратегий ведения больных, в связи с этим все пациенты были рандомизированы на две группы. В группе гепарина (n=5058) применялся нефракционированный гепарин по схеме 5000 ЕД внутривенно болюсом и инфузия со скоростью 15 ЕД/кг/час в течение 72 часов. В группе гирудина (n=5083) использовалась средняя доза гирудина, прошедшая проверку в OASIS-1: 0,4 мг/кг внутривенно болюсом и инфузия в дозе 0,15 мг/кг/час также на протяжении 72 часов. В обеих группах АЧТВ поддерживалось на уровне 1,5-2,5 от исходных значений, оба вмешательства осуществляли на фоне назначения аспирина в дозе 100-325 мг/сут.
При подведении итогов исследования определялась кумулятивная частота случаев смерти и инфаркта миокарда (первичная конечная точка), а также кумулятивная частота случаев смерти, возникновения инфаркта миокарда и рецидивирования стенокардии (вторичная конечная точка) через 72 часа, 7 и 35 дней наблюдения и через 72 часа и 7 дней соответственно (см. табл. 12, 13).
Таблица 12.
Результаты исследования OASIS-2, первичные конечные точки.
| Частота случаев смерти и инфаркта миокарда за период наблюдения | |||
| 72 ЧАСА | 7 ДНЕЙ | 35 ДНЕЙ | |
| ГЕПАРИН | 2,6% | 4,2% | 7,7% |
| ГИРУДИН | 2,0% | 3,6% | 6,8% |
| ИЗМЕНЕНИЕ РИСКА | 24% | 16% | 13% |
| Р | 0,039 | 0,077 | 0,06 |
Таблица 13.
Результаты исследования OASIS-2, вторичные конечные точки.
| Частота случаев смерти, инфаркта миокарда и рецидивирования стенокардии за период наблюдения | ||
| 72 ЧАСА | 7 ДНЕЙ | |
| ГЕПАРИН | 4,0% | 6,7% |
| ГИРУДИН | 3,2% | 5,6% |
| ИЗМЕНЕНИЕ РИСКА | 22% | 18% |
| Р | 0,019 | 0,0125 |
По результатам проведения исследования гирудин показал высокодостоверный клинический эффект, значимо превышающий эффект гепарина. Введение гирудина ассоциировалось со снижением риска основных коронарных событий на 24% в первые 72 часа (p<0,05) и на 16% в течение 7 суток (р>0,05). Также показано существенное уменьшение количества ургентных интервенционных вмешательств (см. табл. 14) и частоты развития декомпенсированной сердечной недостаточности после первых суток заболевания (см. табл.15) в группе гирудина.
Таблица 14.
Частота выполнения ургентных интервенционных5 вмешательств в исследовании OASIS-2 к 7 суткам наблюдения.
| ГЕПАРИН | 8,1% |
| ГИРУДИН | 6,9% |
| ИЗМЕНЕНИЕ РИСКА | 16% |
| Р | 0,016 |
Таблица 15.
Частота развития декомпенсированной сердечной недостаточности у пациентов OASIS-2 через 24 часа от начала терапии.
| ГЕПАРИН | 2,6% |
| ГИРУДИН | 1,8% |
| ИЗМЕНЕНИЕ РИСКА | 30% |
| Р | 0,006 |
При анализе количества побочных эффектов гирудинотерапии в сравнении с применением гепарина (см. табл. 16) и, прежде всего, частоты геморрагических осложнений, обнаружено достоверное увеличение числа пациентов с большими и малыми кровотечениями в группе гирудина. Однако, частота геморрагических инсультов и кровотечений, представляющих опасность для жизни, была одинаковой в обеих группах наблюдения. Большая часть геморрагических осложнений в группе гирудина развивалась в первые 72 часа терапии (гирудин-46 vs гепарин-20), в основном в форме желудочно-кишечных геморрагий6, что свидетельствует о необходимости тщательного мониторинга состояния гемостаза после начального болюсного введения препарата.
Таблица 16.
Число геморрагические осложнений у пациентов в исследовании OASIS-2 к 7 суткам наблюдения.
| Большие кровотечения | Малые кровотечения | Инсульты | Жизнеопасные кровотечения | |
| ГЕПАРИН | 34 | 227 | 14 | 20 |
| ГИРУДИН | 59 | 338 | 14 | 20 |
| Р | 0,01 | <0,01 | NS | NS |
Данные мета-анализа OASIS-1+OASIS-2 также наглядно демонстрируют достоверные различия в эффективности по отношению к частоте первичных7 и вторичных8 конечных точек между группами гирудина и гепарина (см. табл.17), в том числе убедительно показано персистирование преимуществ гирудина в уменьшении смертности к 35 суткам наблюдения.
Таблица 17.
Мета-анализ OASIS-1+OASIS-2.
| 7 ДНЕЙ НАБЛЮДЕНИЯ | 35 ДНЕЙ НАБЛЮДЕНИЯ | |||
| первичные конечные точки | вторичные конечные точки | интервенционные вмешательства | первичные конечные точки | |
| ГЕПАРИН | 4,3% | 6,7% | 8,2% | 7,7% |
| ГИРУДИН | 3,5% | 5,4% | 6,8% | 6,7% |
| ИЗМЕНЕНИЕ РИСКА | 19% | 20% | 17% | 14% |
| Р | 0,039 | 0,005 | 0,009 | 0,04 |
При выполнении комбинированного сравнительного анализа применения гирудина и гепарина по материалам исследований TIMI 9B, GUSTO 2В, OASIS-1 и OASIS-2 (n=26000) также выявлено значительное преимущество гирудина как в качестве самостоятельной терапии в лечении нестабильной стенокардии и инфаркта миокарда без зубца Q, так и при его назначении после выполнения тромболизиса у больных с трансмуральным инфарктом миокарда (см. табл.18).
Таблица 18.
Комбинированный анализ TIMI 9B, GUSTO 2b, OASIS-1 и OASIS-2.
| Случаи смерти и инфаркта миокарда | |||
| < 72 ЧАСОВ | < 7ДНЕЙ | < 35 ДНЕЙ | |
| ГЕПАРИН | 470 | 763 | 1168 |
| ГИРУДИН | 373 | 649 | 1074 |
| ИЗМЕНЕНИЕ РИСКА | 22% | 16% | 10% |
| Р | 0,0004 | 0,002 | 0,016 |
Сравнительный анализ прямых и непрямых антикоагулянтов проводился не только в рамках терапевтических вмешательств при различных клинических проявлениях острого коронарного синдрома. В 1995 году были опубликованы результаты международного европейского исследования HELVETICA , основной целью которого было сравнение эффективности гепарина и двух режимов назначения гирудина с точки зрения возникновения рестенозов после выполнения коронарной ангиопластики у больных с нестабильной стенокардией. Исследование проводилось двойным слепым методом с участием 1141 больного из 30 клиник Европы.
Дизайн исследования был спланирован для сравнения 3 стратегий антикоагулянтной терапии после выполнения коронарной ангиопластики: болюсного (10000 ЕД), а затем инфузионного назначения обычного гепарина в течение 24 часов; болюсного и инфузионного введения гирудина в течение 24 часов, и болюсного введения гирудина с дальнейшим продолжением его инфузии на протяжении 24 часов, а также подкожным введением следующие 72 часа. Таким образом, общая продолжительность вмешательств составила 96 часов, пациенты, не включенные в группу подкожного введения гирудина получали плацебо. Кумулятивной первичной конечной точкой в этом исследовании была суммарная частота смерти, возникновения инфаркта миокарда, процедур реваскуляризации (повторная ЧТКА, АКШ) в течение 30 недель после ангиопластики. Частота указанных коронарных событий также проанализирована через 96 часов терапии. Результаты исследования приведены в табл. 19. Группы пациентов достоверно не различались между собой по частоте возникновения геморрагических осложнений на фоне проводимой антикоагулянтной терапии.
Таблица 19.
Результаты исследования HELVETICA.
| Частота коронарных событий за период наблюдения | ||
| 96 ЧАСОВ | 30 НЕДЕЛЬ | |
| ГЕПАРИН | 11,0% [42] | 32,7% [125] |
ГИРУДИН в/в |
7,9% [30] | 36,5% [139] |
ГИРУДИН в/в и п/к |
5,6% [21] | 32,0% [121] |
| ИЗМЕНЕНИЕ РИСКА | 39% | -2% |
| Р | 0,023 | 0,61 |
Таким образом, в исследовании HELVETICA гирудин продемонстрировал значительное, высокодостоверное преимущество перед гепарином в предотвращении острых коронарных событий в течение первых 4 суток после выполнения ангиопластики. Однако к 30 неделе контрольного периода различия между группами нивелировались, достоверных преимуществ гирудинотерапии перед назначением гепарина не выявлено.
Основываясь на опыте применения гирудина в крупных клинических исследованиях, можно сделать некоторые выводы:
Необходимо учитывать, что широкое применение гирудина и других прямых антикоагулянтов в клинике сдерживается также высокой стоимостью этих препаратов, на несколько порядков превышающей стоимость лечения обычным гепарином.
На сегодняшний день складывается впечатление о гирудине как о альтернативном препарате по отношению к гепарину, имеющем преимущество в "острую" фазу заболевания. Эффективность другого представителя класса прямых антитромбинов - гирулога у больных с нестабильной стенокардией и инфарктом миокарда без зубца Q в настоящее время изучается в рамках исследования TIMI-8.
БЛОКАТОРЫ IIb/IIIa РЕЦЕПТОРОВ ТРОМБОЦИТОВ
Блокаторы IIb/IIIa-рецепторов тромбоцитов являются самой молодой группой из всего класса антитромботических препаратов, используемых в кардиологии. Механизм действия средств этой группы заключается в торможении общего конечного этапа агрегации тромбоцитов - процесса построения тромбоцитарного тромба посредством образования мостиков между соседними активированными тромбоцитами из молекул фибриногена. При этом антиагрегационный эффект IIb/IIIa блокаторов неспецифичен в отношении действия каких-либо индукторов агрегации и теоритически должен превосходить эффект препаратов, препятствующих агрегации тромбоцитов под влиянием одного или группы агонистов.
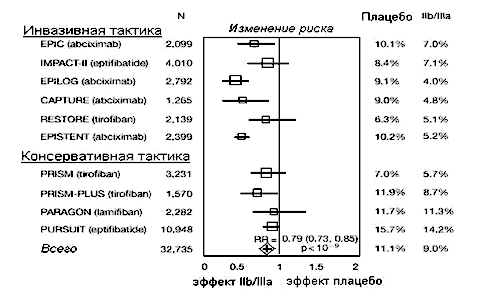
Первым представителем группы IIb/IIIa блокаторов, примененным в терапевтических целях у больных с острым коронарным синдромом был препарат, изготовленный на основе моноклональных антител к IIb/IIIa гликопротеинам мембраны тромбоцитов - абциксимаб (c7E3;ReoPro®, Eli Lilly). В настоящее время группа IIb/IIIa блокаторов представлена несколькими препаратами, имеющими различную структуру, также созданы средства непептидной природы (см. табл. 20).
Таблица 20.
Классификация IIb/IIIa блокаторов ( Meyer BJ, 1998).
| Происхождение | Способ введения | Представители |
| Моноклональные антитела (Fab-фрагменты) к IIb/IIIa рецепторам | парентерально | абциксимаб |
| Вещества животного происхождения (компоненты змеиного яда) | парентерально | - |
| Синтетические пептиды | парентерально | эптифибатид |
| Непептидные IIb/IIIa блокаторы | парентерально | тирофибан ламифибан фрадафибан |
| Пероральные агенты | per os | ксемилофибан орофибан лефрадафибан сибрафибан роксифибан |
Учитывая особенности механизма действия этой группы препаратов - ингибицию тромбоцитарного звена гемостаза на качественно новом уровне, к настоящему времени получили развитие несколько приоритетных направлений применения IIb/IIIa блокаторов в клинической кардиологии, а именно:
- применение совместно с выполнением эндоваскулярных вмешательств - коронарной ангиопластики и стентирования у больных из категории высокого риска развития рестенозов. Роль тромбоцитов в этой ситуации оказывается едва ли не самой главной, поскольку данные манипуляции неизбежно сопровождаются массивной интраоперационной травмой эндотелия и стенки сосуда с высвобождением больших количеств прокоагулянтов из раздавленной атеросклеротической бляшки и обнажением субэндотелиального матрикса;
- применение в "остром" периоде у больных с нестабильной стенокардией и инфарктом миокарда без зубца Q, не выполняя интракоронарных вмешательств;
- назначение IIb/IIIa блокаторов в качестве средств вторичной профилактики больным с высоким риском коронарных и сосудистых событий;
- сочетанное назначение IIb/IIIa блокаторов и тромболитических средств у больных с трансмуральным инфарктом миокарда с целью предотвращения ретромбоза, учитывая, что в процессе тромболизиса происходит массивное высвобождение индукторов агрегации тромбоцитов, а остаточный тромб представляет собой активную тромбогенную поверхность.
Начальные попытки клинического применения препаратов из группы IIb/IIIa блокаторов были выполнены в рандомизированных клинических исследованиях для изучения ближайшего прогноза и возможных осложнений у больных с различными клиническими проявлениями острого коронарного синдрома, подвергнутых инвазивным методикам лечения.
Первое такое исследование - EPIC (Evaluation of 7E3 for the Prevention of Ischemic Complications) было выполнено двойным слепым методом при проведении коронарной ангиографии с последующей направленной атерэктомией или ангиопластикой в группе пациентов высокого риска (рецидивирующая нестабильная стенокардия, развивающийся трансмуральный инфаркт миокарда, сложная морфология поражения коронарного русла). Всего в исследовании приняли участие 2099 больных, из них 22% составили пациенты, госпитализированные в связи с развитием нестабильной стенокардии или инфаркта миокарда без зубца Q. Дизайн исследования был разработан с целью сравнения эффективности двух режимов введения абциксимаба и плацебо на фоне стандартной терапии. Все пациенты методом рандомизации были разделены на три группы, введение абциксимаба или плацебо начинали за 10-60 минут до выполнения инвазивного вмешательства. Первая группа получала болюс плацебо, а затем инфузию плацебо на протяжении 12 часов, второй группе назначалось болюсное введение абциксимаба с продолжением инфузии плацебо также на протяжении 12 часов. Третья группа получала болюс, а затем инфузию абциксимаба. Во всех группах назначался аспирин в дозе 325 мг/сут и инфузия обычного гепарина.
Конечными точками в исследовании являлись случаи смерти, развития инфаркта миокарда, хирургической или повторной чрескожной реваскуляризации, стентирования, необходимости проведения внутриаортальной баллонной контрпульсации ввиду рефрактерной ишемии миокарда в течение 30 дней после ангиопластики или атерэктомии. Результаты исследования представлены в табл. 21.
Таблица 21.
Результаты исследования EPIC.
| Кумулятивная частота конечных точек | |
| СТАНДАРТНАЯ ТЕРАПИЯ | 12,8% |
| АБЦИКСИМАБ БОЛЮС + ИНФУЗИЯ PL | 11,5% |
| АБЦИКСИМАБ БОЛЮС И ИНФУЗИЯ | 8,3% |
Частота больших кровотечений была недостоверно больше в группе болюса и инфузии абциксимаба по сравнению с группами стандартной терапии и только болюсного введения абциксимаба.
Таким образом, в исследовании EPIC показано, что добавление болюса и последующей инфузии абциксимаба к традиционной схеме антитромботической терапии аспирином и гепарином сопровождается значительным, высокодостоверным (на 35%; р=0,008) улучшением ближайшего прогноза у исходно неблагоприятных категорий больных после интракоронарных вмешательств. Дополнение стандартной схемы лечения только болюсным введением абциксимаба также уменьшает частоту основных коронарных событий за период наблюдения, однако обнаруживаемые различия не являются достоверными (10%; р=0,43).
Статистически значимая разница между группами больных, получавших и не получавших антагониста IIb/IIIa -рецепторов тромбоцитов, по числу развивающихся инфарктов миокарда сохранилась и через 3 года.
В другом крупном исследовании EPILOG (Evaluation in PTCA to Improve Long-Term Outcome with Abciximab GP IIb/IIIa Blockade) предпринята попытка сравнения эффективности абциксимаба в комбинации со стандартной и низкой дозами гепарина, либо только стандартной терапии аспирином и гепарином у больных после выполнения элективной или ургентной коронарной ангиопластики. Исследование проведено с помощью двойного слепого метода в 69 медицинских центрах США и было прекращено досрочно по причине явного преимущества абциксимаба, из планируемых 4800 больных реально в исследовании участвовали 2792. Согласно протоколу иследования все пациенты были рандомизированы в три группы: группу применения абциксимаба в комбинации со стандартной дозой гепарина (100 ЕД/кг болюс и последующая инфузия); группу применения абциксимаба в комбинации с низкой дозой гепарина (70 ЕД/кг болюс и последующая инфузия) и группу только стандартной терапии гепарином. Во всех группах назначался аспирин в дозе 325 мг/сут., абциксимаб вводился болюсом с последующей инфузией на протяжении 12 часов после ангиопластики. Конечными точками в этом исследовании были случаи смерти, инфаркта миокарда и ургентной реваскуляризации в течение ближайших 30 дней после коронарной ангиопластики. Результаты исследования приведены в табл 22.
Таблица 22.
Результаты исследования EPILOG.
| Кумулятивная частота первичных конечных точек | |
| PL+ГЕПАРИН | 11,7% |
| АБЦИКСИМАБ+ГЕПАРИН 70 | 5,2% |
| АБЦИКСИМАБ+ГЕПАРИН 100 | 5,4% |
По числу больших кровотечений достоверных различий между группами не выявлено.
Таким образом, в этом исследовании также показано, что добавление абциксимаба к стандартной терапии гепарином и аспирином сопровождается значительным, достоверным (р<0,001) улучшением результатов лечения с применением инвазивных интракоронарных вмешательств. Существенным аспектом является также безопасность сочетания абциксимаба и гепарина, прежде всего, с точки зрения возникновения геморрагических осложнений.
CAPTURE (c7E3 Fab Antiplatelet Therapy in Unstable Refractory Angina) - исследование эффективности абциксимаба у пациентов с нестабильной стенокардией. В это исследование включались больные с рефрактерной формой нестабильной стенокардии, рецидивирующей несмотря на проводимую терапию нитропрепаратами и гепарином. Пациентам выполнялась "спасительная" коронарная ангиопластика, исходно сопряженная с высоким риском тромботических осложнений. Первоначально в исследование планировалось включить 1400 больных, однако в связи с отчетливым преимуществом абциксимаба исследование прекращено досрочно, реально в нем участвовало 1265 пациентов. Все больные были рандомизированы либо в группу абциксимаба, который вводился болюсом 250 мкг/кг массы тела и инфузионно в дозе 10 мкг/кг/мин в течение 18-24 часов до ангиопластики и 1 час после нее, либо в группу плацебо. В обеих группах назначалась инфузия гепарина и аспирин в дозе 325 мг/сут. При анализе результатов исследования использовали суммарную частоту случаев смерти, развития инфаркта миокарда и ургентной реваскуляризации на протяжение 30 дней после ангиопластики. Различия в частоте конечных точек между группами обнаруживались еще до выполнения инвазивного вмешательства. Результаты исследования приведены в табл. 23.
Таблица 23.
Результаты исследования CAPTURE.
| Кумулятивная частота конечных точек | Частота развития инфаркта миокарда | ||
| До ЧТКА | после ЧТКА | ||
| PLACEBO | 15,9% [101] | 2,1% [13] | 5,5% [34] |
| АБЦИКСИМАБ | 11,3% [71] | 0,6% [4] | 2,6% [16] |
| Р | 0,012 | 0,029 | 0,043 |
В группе абциксимаба отмечено достоверно большее число геморрагий: 3,8% (24) vs 1,9% (12); р=0,043.
Исследование IMPACT-II (Integrilin to Minimise Platelet Aggregation and Coronary Thrombosis-II) является наиболее крупным из всех проводимых исследований по применению IIb/IIIa блокаторов при интракоронарных вмешательствах. В общей сложности в нем участвовало 4010 пациентов из 84 медицинских центров США, которым выполнялись различные инвазивные вмешательства на коронарных сосудах9 в плановом или экстренном порядке. Все больные методом рандомизации были разделены на три группы. Первая группа получала болюс и инфузию плацебо (n=1328), второй назначался эптифибатид (интегрилин) в виде болюса в дозе 135 мкг/кг и последующей инфузии со скоростью 0,5 мкг/кг/мин в течение 20-24 часов после вмешательства (n=1349). Третья группа получала болюс эптифибатида 135 мкг/кг с продолжением инфузии в дозе 0,75 мкг/кг/мин также в течение 20-24 часов после выполнения вмешательства (n=1333). Во всех группах введение IIb/IIIa блокатора начинали за 10-60 минут до инвазивной процедуры, все больные получали аспирин в дозе 325 мг/сут. Манипуляции на коронарных сосудах производили на фоне инфузии гепарина и увеличения АЧТВ до 300-350 секунд. Конечными точками в этом исследовании были случаи смерти, развития инфаркта миокарда или ургентной реваскуляризации/стентирования в течение 30 дней наблюдения. Результаты исследования представлены в табл 24.
Таблица 24.
Результаты исследования IMPACT-II.
| Кумулятивная частота конечных точек | Р vs placebo | |
| PLACEBO | 11,4% [151] | - |
| ЭПТИФИБАТИД 135/0,5 | 9,2% [124] | 0,063 |
| ЭПТИФИБАТИД 135/0,75 | 9,9% [132] | 0,22 |
Достоверных различий в частоте малых и больших кровотечений между группами не выявлено.
При анализе числа эпизодов острого закрытия сосуда через 24 часа после выполнения ангиопластики эптифибатид также был эффективнее стандартной терапии: 2,8% и 3,5% для групп 135/0,5 и 135/0,75 соответственно, против 5,1% в группе плацебо. Среди пациентов из группы эптифибатида 135/0,5 к 30 дню наблюдения также отмечено достоверное уменьшение количества конечных точек по сравнению с группой стандартной терапии: 9,1% vs 11,6%; р=0,035, для группы эптифибатида 135/0,75 это различие не достигало статистической достоверности (10,0% vs 11,6%, р=0,18).
Таким образом, в исследовании IMPACT-II также продемонстрировано преимущество перед только стандартной терапией другого IIb/IIIa блокатора, синтетического пептида эптифибатида, который при назначении в дозе 135 мкг/кг болюс + инфузия 0,5 мкг/кг/мин способен уменьшать количество конечных точек как в "острую" фазу после инвазивных манипуляций на коронарных артериях, так и при наблюдении в течение ближайших 30 дней, однако в последнем случае его эффект не достигает степени статистической достоверности.
В другом исследовании RESTORE (Randomized Efficacy Study of Tirofiban for Outcomes and REstenosis) был проверен эффект тирофибана в сравнение со стандартной терапией для предотвращении основных коронарных событий после выполнения коронарной ангиопластики. В исследование включено 2139 больных, рандомизированных в течение 72 часов от момента возникновения клинических симптомов ишемии миокарда (большую часть составили пациенты с нестабильной стенокардией). Протокол предусматривал сравнение эффекта стандартной терапии, включающей назначение аспирина в дозе 325 мг в сутки и инфузии обычного гепарина в течение процедуры ангиопластики с поддержанием показателя АЧТВ в диапазоне 300-400 с и добавления к стандартной терапии тирофибана в дозе 10 мкг/кг болюсом с продолжением инфузии со скоростью 0,15 мкг/кг/мин на протяжении 36 часов. В качестве конечных точек принимались все случаи смерти, инфаркта миокарда, хирургической реваскуляризации ввиду недостаточного эффекта ангиопластики или рецидивирования ишемии миокарда, повторной ангиопластики и стентирования через 30 дней наблюдения. Результаты исследования приведены в табл. 25.
Таблица 25.
Результаты исследования RESTORE.
| Кумулятивная частота конечных точек | |
| PLACEBO | 12,2% |
| ТИРОФИБАН | 10,3% |
| Р | 0,16 |
При анализе через 48 часов после ангиопластики установлено, что добавление тирофибана к стандартной терапии сопровождается уменьшением риска основных коронарных событий на 38% (р<0,005), через 7 дней - на 27% (р=0,022). Причина отсутствия достоверности различий между группами через 30 дней наблюдения вызвана учетом абсолютно всех случаев инвазивных вмешательств у больных в исследовании. При сравнении результатов исследования с учетом только тех вмешательств, которые были выполнены по неотложным показаниям получены следующие данные: 10,5% vs 8%, р=0,052. Уменьшение риска составило 24%.
EPISTENT (Evaluation of Platelet IIb/IIIa Inhibitor for Stenting) является на сегодняшний день последним из исследований IIb/IIIa блокаторов в связи с инвазивными интракоронарными вмешательствами. Под наблюдением находилось 2399 больных из 63 госпиталей США и Канады. Дизайн исследования был спланирован для сравнения нескольких терапевтических стратегий: пациенты, которым в плановом порядке выполнялись баллонная ангиопластика или установка стента были рандомизированы в три группы. Первой группе проводилось стентирование на фоне введения плацебо (n=809), второй группе пациентов стент устанавливался на фоне введения абциксимаба (n=794). Пациентам третьей группы выполнялась баллонная ангиопластика и также введение абциксимаба на протяжении манипуляции (n=796). Всем больным в исследовании назначался аспирин, инфузия гепарина и необходимая гемодинамическая терапия. Конечными точками были случаи смерти, развития инфаркта миокарда и необходимости в проведении ургентной реваскуляризации в течение 30 дней наблюдения. Результаты исследования представлены в табл. 25.
Таблица 25.
Результаты исследования EPISTENT.
| Кумулятивная частота конечных точек | Р vs placebo | |
| STENT + PLACEBO | 10,8% [87] | - |
| STENT + АБЦИКСИМАБ | 5,3% [42] | <0,001 |
| ЧТКА + АБЦИКСИМАБ | 6,9% [55] | 0,007 |
При анализе числа случаев смерти и развития трансмурального инфаркта миокарда их количество также достоверно оказалось наименьшим в группе стентирования на фоне введения абциксимаба: 7,8% в группе плацебо vs 3,0% в группе стент+абциксимаб (р<0,001) vs 4,7% в группе выполнения ЧТКА на фоне введения абциксимаба (р=0,01).
Достоверных различий в количестве геморрагических осложнений между группами не выявлено (2,2% vs 1,5% vs 1,4%; р=0,38).
Таким образом, препараты из группы блокаторов IIb/IIIa рецепторов тромбоцитов к настоящему времени прошли серьезную проверку эффективности во многих клинических исследованиях. Применение средств этой группы в качестве дополнения к стандартным методикам антитромботической терапии при инвазивной тактике ведения больного с острым коронарным синдромом приводит к существенному, достоверному улучшению исходов заболевания. Особенно это характерно для категории больных высокого риска, назначение IIb/IIIa блокатора которым приносит наибольшую пользу.
Однако, успех абциксимаба и других IIb/IIIa блокаторов при инвазивных методах лечения не может быть однозначно экстраполирован на консервативную тактику ведения острого коронарного больного. Роль тромбоцитов при выполнении коронарной ангиопластики, сопровождающейся травмой эндотелия и стенки сосуда, может быть гораздо большей нежели при консервативном подходе.
К настоящему времени закончены крупные рандомизированные клинические испытания эффективности Iib/IIIa блокаторов у больных с острым коронарным синдромом без проведения инвазивных манипуляций на коронарных артериях. Канадское исследование ламифибана (The Canadian Lamifiban Study) было первым из таких исследований. Всего в нем приняли участие 365 пациентов с нестабильной стенокардией или инфарктом миокарда без зубца Q. Методом рандомизации больные были разделены на группу ламифибана и группу плацебо. В группе вмешательства ламифибан назначался в виде непрерывной внутривенной инфузии со скоростью 1, 2, 4 или 5 мкг/мин в течение 72-120 часов (4 подгруппы, n=242). Все больные в исследовании получали аспирин в дозе 325 мг/сут, инфузию обычного гепарина - 28%. Конечными точками были случаи смерти, инфаркта миокарда и ургентной реваскуляризации в период инфузии и через 1 месяц наблюдения. При анализе результатов исследования показано, что ламифибан уменьшил риск конечных точек во время инфузии с 8,1% (плацебо) до 3,3% (р=0,04). Частота конечных точек в подгруппах ламифибана составила соответственно 2,5%, 4,9%, 3,3% и 2,4% . За 1 месяц наблюдения смерть и нефатальный инфаркт миокарда произошли в 8,1% в группе плацебо и у 2,5% пациентов из подгрупп ламифибана в дозе 4 и 5 мкг/мин (р=0,03). Большие кровотечения зарегистрированы соответсвенно в 0,8% и 2,9% (Circulation. 1996;94:899-905).
Таким образом, в этом пилотном исследовании ламифибан продемонстрировал достоверный клинический эффект, превышающий эффект плацебо (т.е. только аспирина) в "острую фазу" заболевания, интересно, что максимальная степень выраженности действия ламифибана отмечена в группах с наименьшей и наибольшей скоростью его введения. Через 1 месяц наблюдения сохранение эффекта ламифибана отмечено только в подгруппах, получавших высокие дозы препарата.
Исследование PARAGON (Platelet IIb/IIIa Antagonist for the Reduction of Acute coronary syndrome events in a Global Organization Network) было спланировано специально для сравнения эффектиности ламифибана и стандартной терапии гепарином у пациентов с нестабильной стенокардией и инфарктом миокарда без зубца Q. Это одно из наиболее крупных исследований IIb/IIIa блокаторов, в нем участвовало 2282 пациента из 273 медицинских центров 20 стран. Дизайн исследования был спланирован с учетом результатов Канадского исследования ламифибана и предполагал сравнение эффекта ламифибана в высокой и низкой дозе со стандартной терапией гепарином. Все пациенты в исследовании были рандомизированы в группу ламифибана или в группу стандартной терапии (плацебо + инфузия гепарина). В обеих группах назначался аспирин в дозе 325 мг/сут. Группа ламифибана разбивалась на две подгруппы, которые получали соответственно инфузию ламифибана в дозе 1 мкг/мин с и без инфузии гепарина и 5 мкг/мин также с и без инфузии гепарина (так называемый дизайн "2?2"). Конечными точками в этом исследовании были приняты случаи смерти и развития инфаркта миокарда за 30 дней и 6 месяцев наблюдения. Результаты исследования представлены в табл. 26.
Таблица 26.
Результаты исследования PARAGON.
| Кумулятивная частота конечных точек | ||
| 30 ДНЕЙ | 6 МЕСЯЦЕВ | |
|
PLACEBO |
11,7% | 17,9% |
ЛАМИФИБАН 1 |
10,6% | 13,7% |
ЛАМИФИБАН 5 |
12,0% | 16,4% |
Количество больших кровотечений достоверно возросло в группе сочетания гепарина и высокой дозы ламифибана (12,1% vs 5,5% у плацебо, р=0,002). Низкая доза ламифибана в комбинации с гепарином не отличалась от плацебо по количеству геморрагических осложнений.
Таким образом, в этом исследовании терапия ламифибаном не привела к достоверным изменениям в частоте конечных точек в "острую" фазу заболевания (р=0,668). К концу 6-месячного периода наблюдения отмечено достоверное преимущество ламифибана в низкой дозе по сравнению с плацебо (р=0,027), ламифибан в высокой дозе не имел достоверных преимуществ перед стандартной терапией (р=0,450).
PRISM (The Platelet Receptor Inhibition in Ischemic Syndrome Management) было первым исследованием, в котором сравнивались отдельные группы IIb/IIIa блокатора и стандартной терапии нефракционированным гепарином. В исследовании приняли участие 3232 пациента с нестабильной стенокардией и инфарктом миокарда без зубца Q, Всем был назначен аспирин в дозе 325 мг/сут. С помощью рандомизации больные были разделены на две группы: первая получала внутривенную инфузию тирофибана в течение 48 часов, вторая - инфузию гепарина также на протяжении 48 часов. Конечные точки в исследовании - случаи смерти, инфаркта миокарда и рецидивирования ишемии миокарда в течение 48 часов и 30 дней. Результаты исследования приведены в табл. 27.
Таблица 27.
Результаты исследования PRISM.
| Кумулятивная частота конечных точек | ||
| 48 ЧАСОВ | 30 ДНЕЙ | |
| ГЕПАРИН | 5,6% | 17,1% |
ТИРОФИБАН |
3,8% | 15,9% |
Р |
0,01 | 0,34 |
Частота больших кровотечений в обеих группах составила 0,4%.
При анализе частоты случаев смерти и инфаркта миокарда на 30 день наблюдения выявлено недостоверное преимущество тирофибана перед группой гепарина (5,8% vs 7,1%, р=0,11). Общая смертность достоверно уменьшилась при терапии тирофибаном: 2,3% vs 3,6%, р=0,02.
Данные, полученные в этом исследовани демонстрируют отчетливое преимущество тирофибана в первые 48 часов заболевания, в более поздние сроки наблюдения отмечен достоверно лучший эффект тирофибана по сравнению с гепарином только по уменьшению смертности.
Логическим продолжением PRISM стало исследование PRISM-PLUS (The Platelet Receptor Inhibition in Ischemic Syndrome Management in Patients Limited by Unstable Signs and Symptoms), в котором были сравнены три группы пациентов с нестабильной стенокардией или инфарктом миокарда без зубца Q: группа изолированного назначения тирофибана, группа гепарина и группа сочетанного назначения тирофибана и гепарина. Все больные получали аспирин в суточной дозе 325 мг. В среднем продолжительность инфузии тирофибана и/или гепарина составила 71,3 часа. Всего в исследовании приняли участие 1915 пациентов, в качестве конечных точек учитывались случаи смерти, инфаркта миокарда и рецидивирования ишемии миокарда в течение 7 дней наблюдения. Исследование было прекращено досрочно по причине резкого увеличения смертности в группе изолированного назначения тирофибана: 4,6% vs 1,15% в группе гепарина. Сравнение частоты конечных точек между группами гепарина и тирофибана + гепарина представлено в табл. 28.
Таблица 28.
Предварительные результаты исследования PRISM-PLUS.
|
Кумулятивная частота конечных точек | Кумулятивная частота смерти и инфаркта миокарда | ||||
| 7 ДНЕЙ | 30 ДНЕЙ | 6 МЕС | 7 ДНЕЙ | 30 ДНЕЙ | 6 МЕС | |
| ГЕПАРИН | 17,9% | 22,3% | 32,1% | 8,3% | 11,9% | 15,3% |
| ТИРОФИБАН + ГЕПАРИН | 12,9% | 18,5% | 28,7% | 4,9% | 8,7% | 12,3% |
| Р | 0,004 | 0,03 | 0,02 | 0,006 | 0,03 | 0,06 |
Большие кровотечения недостоверно чаще встречались в группе сочетания тирофибана и гепарина: 4,0% vs 3,0%, р=0,34.
Последнее из законченных на сегодняшний день клинических исследований - PURSUIT (The participants in the Platelet Glycoprotein IIb/IIIa in Unstable Angina: Receptor Suppression Using Integrilin Therapy) является одним из самых крупных. Протокол этого исследования был разработан с целью изучения эффекта эптифибатида (интегрилина), назначаемого в дополниние к необходимой стандартной терапии у больных с острым коронарным синдромом. Всего в исследовании участвовали 10948 пациентов, которые были рандомизированы в течение 24 часов от момента появления симптомов нестабильной стенокардии или инфаркта миокарда без зубца Q. Критериями включения также были ишемические изменения конечной части желудочкового комплекса ЭКГ без стойкой элевации сегмента ST. Также учитывались изменения уровня MB-фракции креатинкиназы сыворотки крови. Пациенты получали лечение по одной из следующих схем: назначение эптифибатида в дозе 180 мкг/кг болюсом и последующей инфузией со скоростью 2 мкг/кг/мин в течение 72 часов либо назначение плацебо.. Все больные также получали аспирин в дозе 325 мг/сут и инфузию обычного гепарина на протяжении 72 часов. В обеих группах инфузия эптифибатида и/или обычного гепарина продлевалась до 96 часов в случае необходимости проведения коронарной ангиопластики на 3 сутки терапии. Конечными точками в исследовании служили случаи смерти и инфаркта миокарда за 30 дней наблюдения. Количество конечных точек также проанализировано через 96 часов от начала лечения. Результаты исследования представлены в табл. 29.
Таблица 29.
Результаты исследования PURSUIT.
| Кумулятивная частота конечных точек | ||
| 30 ДНЕЙ | 96 ЧАСОВ | |
| ГЕПАРИН | 15,7% | 9,1% |
| ЭПТИФИБАТИД + ГЕПАРИН | 14,2% | 7,6% |
| Р | 0,04 | 0,011 |
Число больших кровотечений было недостоверно большим в группе эптифибатида.
Из приведенных результатов видно, что и в этом, наиболее крупном исследовании назначение эптифибатида (интегрилина) на фоне проведения стандартной антитромботической терапии гепарином и аспирином сопровождается статистически достоверным увеличением эффективности лечения, каждая 1000 пролеченных эптифибатидом пациентов предупреждает смерть или развитие трансмурального инфаркта миокарда у 15 больных.
На схеме представлены результаты основных исследований с участием IIb/IIIa блокаторов.

Таким образом, можно сделать вывод, что включение средств, блокирующих IIb/IIIа рецепторы мембраны тромбоцитов, в схемы стандартной антитромботической терапии приносит реальный доказанный клинический эффект как при инвазивной, так и при консервативной тактике ведения пациентов с острым коронарным синдромом. Препараты этой группы являются одним из компонентов лечения и должны использоваться только в комплексе с инфузией нефракционированного гепарина (введением низкомолекулярных гепаринов?) и назначением аспирина в терапевтических дозах.
Достоверный эффект IIb/IIIa блокаторов в ситуации обострения коронарной болезни сердца создал предпосылки для формирования гипотезы о возможной активности этой группы препаратов в качестве средств вторичной профилактики основных коронарных и цереброваскулярных событий. Исследование EXCITE (Evaluation of Oral Xemilofiban in Controlling Thrombotic Events) было спланировано для оценки эффекта перорального IIb/IIIa блокатора ксемилофибана в качестве средства вторичной профилактики после выполненной коронарной ангиопластики. В нем участвовало 7232 пациента, которые были рандомизированы в группу ксемилофибана и в группу плацебо. Процедуру ангиопластики выпоняли на фоне введения средств традиционной терапии (инфузия гепарина и аспирин), в группе вмешательства за 30-90 минут до манипуляции назначался ксемилофибан в дозе 20 мг. После ангиопластики пациенты получали ксемилофибан в дозе 10 или 20 мг три раза в сутки либо плацебо в течение 6 месяцев (182 дня). Конечными точками в этом исследовании были случаи смерти, развития инфаркта миокарда или ургентной реваскуляризации в течение 6 месяцев. Результаты приведены в табл. 30.
Таблица 30.
Результаты исследования EXCITE.
| Кумулятивная частота конечных точек | Р vs placebo | |
| PLACEBO | 13,5% [324] | - |
| КСЕМИЛОФИБАН 10 | 13,9% [332] | 0,82 |
| КСЕМИЛОФИБАН 20 | 12,7% [306] | 0,36 |
Как видно из приведенных данных ксемилофибан не проявил достоверной профилактической активности. По количеству геморрагических осложнений группы не различались.
В исследовании SYMPHONY (Sibrafiban versus Aspirin to Yield Maximum Protection from Ischemic Heart Events Post-acute Coronary Syndromes) изучалась профилактическая активность другого IIb/IIIa блокатора - сибрафибана в сравнении с аспирином. Включено в исследование 9233 уже "стабилизированных" пациентов после переннесенного острого коронарного синдрома. Все больные были рандомизированы для приема либо аспирина в дозе 80 мг 2 раза в сутки либо сибрафибана в низкой (3; 4,5 мг) или высокой (6 мг) дозе в зависимости от массы тела и клиренса креатинина. Терапия низкими дозами сибрафибана сопровождалась торможением агрегации тромбоцитов ex vivo на 25%, высокой дозой - на 50%. Конечные точки в исследовании - случаи смерти, инфаркта миокарда или повторного инфаркта, рецидивирования нестабильной стенокардии на протяжении 90 дней приема препаратов. При окончании периода наблюдения различий в частоте конечных точек между группами не выявлено (см. табл. 31).
Таблица 31.
Результаты исследования SYMPHONY
| Кумулятивная частота конечных точек | |
| АСПИРИН | 9,8% [302] |
| СИБРАФИБАН 3/4,5 | 10,1% [310] |
СИБРАФИБАН 6 |
10,1% [303] |
Большие кровотечения встречались в 5,7% [171] vs 5,2% [159] vs 3,9% [120] случаев соответственно для высокой/низкой доз сибрафибана и аспирина. Различия статистически недостоверны.
Последнее и самое крупное из законченых исследований профилактической активности IIb/IIIa блокаторов - OPUS-TIMI 16 (Oral glycoprotein IIb/IIIa inhibition with orbofiban in patients with unstable coronary syndromes) проводилось в 888 госпиталях из 29 стран с участием 10288 пациентов. Критериями включения в исследование были продолжительные ангинозные эпизоды за последние 72 часа, сопровождающиеся изменениями конечной части желудочкового комплекса ЭКГ и выявлением маркеров повреждения миокарда в сыворотке. Все больные получали необходимую терапию в острой фазе заболевания и после "стабилизации" были рандомизированы для приема орбофибана в дозе 50 мг 2 раза в сутки на протяжении всего исследования (орбофибан 50/50) или орбофибана в той же дозе в течение первых 30 дней с продолжением приема в дозе 30 мг 2 раза в сутки (орбофибан 50/30), а также группу плацебо. Всем пациентам назначался аспирин. Конечные точки в исследовании - случаи смерти, инфаркта миокарда, инсульта, рецидивирования симптомов ишемии миокарда, требующие регоспитализации, процедуры ургентной реваскуляризации в течение 10 месяцев приема препаратов.
В связи с резким ростом смертности в группе орбофибана 50/30 к 30 дню терапии исследование было прекращено досрочно.
Смертность через 10 месяцев составила (см. табл.):
| Смертность | Р vs placebo | |
| PLACEBO | 3,7% | - |
| ОРБОФИБАН 50/30 | 5,1% | 0,008 |
| ОРБОФИБАН 50/50 | 4,5% | 0,11 |
По кумулятивной частоте конечных точек различий между группами не выявлено: 22,9% vs 23,1% vs 22,8% соответственно. Однако, отмечено уменьшение частоты конечных точек среди пациентов подгрупп орбофибана, которым выполнялись инвазивные интракоронарные вмешательства.
Большие кровотечения достоверно чаше встречались в группе высокой дозы орбофибана 2,0% vs 3,7% (орбофибан 50/30; р=0,0004) vs 4,5% (орбофибан 50/50; р=0,0001).
Таким образом, на основании проведенных исследований длительная пероральная терапия IIb/IIIa блокаторами не может быть рекомендована как средство вторичной профилактики основных коронарных событий. Возможно, более либеральным может быть отношение к категории больных с инвазивными вмешательствами; окончательную позицию по этому вопросу можно будет сформулировать после завершения исследования BRAVO (Design of the blockade of the glycoprotein IIb/IIIa receptor to avoid vascular occlusion), проводимого в настоящее время.
Перспектива применения IIb/IIIa блокаторов в комплексном лечении трансмурального инфаркта миокарда выглядит более оптимистичной. На настоящий момент закончены исследования второй фазы и начаты исследования третьей, заключительной фазы по изучению эффективности препаратов этой группы в комбинации с тромболитической терапией или инвазивными вмешательствами. Данные этих исследований суммированы в табл. 32.
Таблица 32.
Исследования эффективности IIb/IIIa блокаторов у пациентов с трансмуральным инфарктом миокарда.
| Исследование | N | Антагонист | Дизайн | Конечные точки | Результат | Р |
| IIB/IIIA БЛОКАТОРЫ И ТРОМБОЛИЗИС | ||||||
| TAMI 8 | 70 | абциксимаб | ТАПфаза II (неранд.) | Рецидивир. Ишемия | 13% vs 20% | - |
| IMPACT-AMI | 180 | эптифибатид | ТАПфаза II | перфузияTIMI 3 ~ 90 мин | 39% vs 66% | 0,006 |
| PARADIGM | 353 | ламифибан | ТАП, СКфаза II | смерть/ИМ ~ 30 день | NS | |
| Integrilin with SK | 181 | эптифибатид | СКфаза II | перфузияTIMI 3 ~ 90 мин | 53% vs 38% | - |
| TIMI 14A | 450 | абциксимаб | ТАП, СКфаза II | перфузияTIMI 3 ~ 90 мин | 58% vs 73% | 0,02 |
| SPEED | 350 | абциксимаб | РАПфаза II | перфузияTIMI 3 ~ 60 мин | проходит в настоящее время | |
| IIB/IIIA БЛОКАТОРЫ И ЧТКА | ||||||
| GRAPE | 41 | абциксимаб | ЧТКАфаза II | перфузияTIMI 3 ~ 45 мин | 13% vs 18% | - |
| RAPPORT | 483 | абциксимаб | ЧТКАфаза II | смерть/ИМ/УР ~ 6 мес | ~ 30 дней:12% vs 4,6% | 0,005 |
| ~ 6 мес - NS | ||||||
| CADILLAC | 2000 | абциксимаб | ЧТКАSTENTфаза III | смерть/ИМ/УР ~ 6 мес | проходит в настоящее время | |
ЗАКЛЮЧЕНИЕ
К настоящему времени концепция лечения острого коронарного синдрома претерпела существенные изменения. Практиковавшаяся ранее классическая схема терапии с помощью аспирина и длительной инфузии гепарина дополняется новыми эффективными средствами. Наравне с обычным гепарином должны использоваться гепарины с низкой молекулярной массой, среди которых назначение эноксапарина предпочтительнее остальных, так как достоверно улучшает исход заболевания. В качестве альтернативы гепарину можно рекомендовать прямые ингибиторы тромбина, особенно при инвазивной тактике ведения больного.
Схемы антитромботической терапии в инвазивной кардиологии должны быть дополнены препаратами из группы IIb/IIIa блокаторов, особенно это касается проведения процедур высокого риска. При консервативной стратегии применение IIb/IIIa блокаторов прямо показано у пациентов с неблагоприятным ближайшим прогнозом и высокой вероятностью тромботических осложнений.
Место IIb/IIIa блокаторов в комплексном лечении инфаркта миокарда должно определиться в ближайшее время после завершения исследований III фазы.
Таким образом, остается только надеятся на распространение новых методик и в отечественном здравоохранении, где особенно остро ощущается проблема оказания качественной кардиологической помощи всем группам больных.