"Есть больные, которым нельзя помочь, но нет
таких больных, которым нельзя навредить"
E.C.Lambert
По данным эпидемиологических исследований, побочные эффекты лекарственной терапии в США и Канаде выходят на 5–6-е место в структуре смертности [Lazarou J. et al., 1998]. Частота развития их достигает 17 % у госпитализированных больных и 4–6 % у амбулаторных пациентов, 25–30 % всех побочных эффектов обусловлены антибиотиками, которые могут вызвать осложнения лекарственной терапии у 6% госпитализированных и 2% амбулаторных пациентов [Lazarou J. et al., 1998].
Трагедии с опасными для жизни осложнениями лекарственной терапии особенно часты при освоении новых лекарств. Перед выпуском на рынок новые лекарственные средства испытываются на сравнительно небольшом числе людей и информация об эффективности этих средств является гораздо более полной, чем информация о безопасности их применения. Менее известно насколько новые лекарства более эффективны, чем «старые» препараты. Еще меньше информации о побочных эффектах или представляющих угрозу для жизни взаимодействия нового препарата с другими лекарственными средствами. И они не будут выявлены до тех пор, пока не будет накоплен опыт применения у нескольких сотен тысяч больных. А на это уходит минимум пять лет. Поэтому в США придерживаются принципа не принимать лекарственные средства, существующие в практике менее пяти лет, конечно, если это не те лекарственные средства, у которых нет аналогов, а их применение решает проблему, как это характерно для антиретровирусных препаратов, применяемых при ВИЧ-инфекции.
Любое лекарство является химическим веществом, в той или иной мере взаимодействующим с организмом. Одни лекарства более активны, другие менее. При этом чаще всего отмечается закономерность: чем более эффективно лекарство, тем более оно опасно. Например, сердечные гликозиды, очень эффективные средства для лечения сердечной недостаточности, достаточно токсичны. Есть лекарства, практически лишенные токсического воздействия, но даже они могут вызывать проблемы при их бесконтрольном применении. Так, длительное применение сорбентов (активированный уголь, смекта, полифепан) может привести к нарушениям всасывания, запорам; длительное применение бактерийных препаратов (бифидумбактерин, лактобактерин, линекс, примадофилюс) - к угнетению собственных бактерий нормальной кишечной флоры.
Комбинированный препарат всегда более опасен, чем его однокомпонентная альтернатива, т.к. увеличивается риск возникновения негативных реакций организма без увеличения эффективности лечения.
Среди побочных реакций при применении лекарственных средств наиболее часто встречаются эффекты, обусловленные их фармакологическими свойствами при применении препарата в терапевтической дозе. Например, покраснение кожи при применении никотиновой кислоты обычная и нормальная реакция, хотя и является побочной, или трициклические антидепрессанты и хлорпромазин не только оказывают действие на ЦНС, но и вызывают сухость во рту и двоение в глазах.
Для некоторых лекарств вообще невозможно избежать токсических осложнений. К примеру, цитостатики не только подавляют рост опухолевых клеток, но и повреждают все быстро делящиеся клетки и угнетают костный мозг. Поэтому они помимо своего прямого эффекта закономерно ведут к лейкопении.
При увеличении дозы лекарственных средств риск появления побочных реакций повышается, например, развивается лейкопения от приема цитостатиков, повышается седативный эффект антигистаминных препаратов.
Болезни сердечно-сосудистой системы являются определяющей причиной смерти людей, а гипертоническая болезнь в этом играет первостепенную роль. Поэтому миллионы людей находятся на лечении по поводу гипертонической болезни и ишемической болезни сердца. Для терапии в первую очередь используются бета-блокаторы и блокаторы кальциевых каналов. В ходе терапии наблюдается несколько вариантов клинических форм побочных реакций, связанных с фармакологической активностью препарата. Бета-блокаторы, резерпин, метилдопа, клонидин вызывают депрессию. Поэтому пропранолол (анаприлин), особенно часто при приеме которого наблюдается депрессия, не должен использоваться людьми, страдающими от депрессии или страдавших от нее в прошлом. Атенолол и надолол реже приводят к таким побочным эффектам. Быстрая утомляемость часто вызывается бета-блокаторами, резерпином, метилдопой, и клонидином. Бета-блокаторы, метилдопа и ряд других лекарственных средств при лечении патологии сердечно-сосудистой системы вызывают импотенцию и другие виды сексуальной дисфункции. Нередко при приеме антигипертензивных препаратов, особенно гуанитидина, празозина и метилдопы наблюдается головокружение и как следствие - ортостатическая гипотензия при резком подъеме из сидячего или лежачего положения. Это может привести к падениям и переломам. Среди бета-блокаторов лабеталол чаще всего вызывает головокружение, снижение артериального давления, что делает его препаратом второй линии в терапии неосложненной гипертонической болезни. Бета-блокаторы могут вызывать бронхоспазм и провоцировать приступы астмы, поэтому их не следует использовать больным бронхиальной астмой, хроническим бронхитом или эмфиземой.
В 1996 году в США в аннотацию на один из блокаторов кальциевых каналов - быстродействующую форму нифедипина было внесено предупреждение о возможном увеличении риска инфаркта с последующим летальным исходом. Позже было установлено, что наблюдаются и другие побочные эффекты блокаторов кальциевых каналов, такие, как увеличенный риск кровотечений в желудочно-кишечный тракт у пожилых людей.
Иногда побочные эффекты лекарственных средств связаны с тем, что препараты изменяют местный транспорт, биотрансформацию и связывание с неактивными участками ткани других лекарственных веществ. Подобные кинетические изменения относят к фармакодинамическому взаимодействию препаратов, так как они происходят в области специфических рецепторов и тесно связаны с механизмом действия лекарственных веществ. Так, к примеру, характерно изменение активности гипотензивного препарата гуанетидина под влиянием трициклических антидепрессантов. Как гипотензивный препарат, гуанетидин проникает в окончания адренергических нейронов и вызывает высвобождение норадреналина, который разрушается моноаминоксидазой. В результате наступает истощение запасов норадреналина, что приводит к снижению синаптической иннервации сосудов и артериального давления. Одновременно принимаемые трициклические антидепрессанты, блокируя мембранно-транспортную систему, нарушают поглощение гуанетидина симпатическими нейронами и препятствуют его действию.
Прием антидепрессантов часто вызывает "традиционные" побочные эффекты - головные боли, сухость во рту, тошноту. Большинство антидепрессантов приводит к различным формам сексульной дисфункции - от импотенции и отсутствия оргазма как у мужчин, так и у женщин, до полного исчезновения либидо.
В прямой зависимости от фармакологических свойств лекарственных средств зависит развитие дисбактериоза. В результате терапии антибиотиками нарушаются нормальные экологические условия существования естественной микрофлоры организма. При дисбактериозе размножаются ранее отсутствовавшие или ветречающиеся в малом количестве микроорганизмы, а количество представителей нормальной микрофлоры уменьшается либо они исчезают вообще. Нормальная микрофлора кишечника синтезирует ряд различных витаминов а также аминокислот и участвует в обмене кальция, железа и ряда других веществ. Выделяемые витамины являются необходимыми для роста многих видов бактерии. Поэтому их недостаток в содержимом кишечника отрицательно влияет на рост других бактерий и усугубляет дисбактериоз. Оставшиеся микроорганизмы при определенных условиях могут вызывать суперинфекцию. В развитии суперинфекции определенную роль играют также раздражение и повреждение эпителия кишечника антибиотиками тетрациклинового ряда.
В зависимости от формы дисбиотических изменений лидирующим агентом может быть разный условно-патогенный возбудитель, в связи с чем условно выделяют стафилококковый, кандидамикозный, аспергиллезный и др. дисбактериоз. Кандидоз был известен задолго до эры антибиотиков. Но значительное увеличение числа случаев развития кандидамикозов связано с применением антибиотиков, которые не только подавляют нормальную микрофлору, но и могут стимулировать рост дрожжеподобных грибов, вызывать обменные нарушения в организме и другие изменения, способствующие понижению сопротивляемости организма. Эти же процессы вызывает назначение гормонов, иммунодепрессантов, цитостатиков и других препаратов [Грачева Н.М., 1999]. Именно поэтому В.М. Лещенко (1987) совершенно справедливо относит его к современным болезням цивилизации, в числе которых так называемые “болезни от лечения”, ибо первичный кандидамикоз встречается очень редко.
Кандидозное поражение слизистой оболочки желудочно-кишечного тракта в ряде случаев может быть причиной так называемого хирургического кандидамикоза, ибо дрожжеподобные грибы обладают выраженным некротизирующим действием на ткани и могут привести к перфорации слизистой, перитониту и гибели больных. Дрожжевые и плесневые грибы биохимически активны и могут разлагать углеводы, что в отдельных случаях ведет к так называемым «опьянениям», когда после сладкого чая, употребления сладких фруктов и других пищевых продуктов, содержащих углеводы, у больного развертывалась картина опьянения.
Хотя чаще дрожжеподобными грибами поражается слизистая желудочно-кишечного тракта, наблюдаются и висцеральные формы, среди которых
заслуживают особого внимания поражения легких, так как клинически картина нередко бывает нетипичной и вызывает затруднение в диагностике. Чаще кандидамикоз легких протекает по типу интерстициальной пневмонии, причем принимает затяжное течение с частыми рецидивами, трудно выявляется при рентгенологическом исследовании. Иногда клиника кандидамикоза легких напоминала клинику бронхогенного рака, милиарного тубуркулеза, сепсиса, гангрены [Никифоров Н. Ф., 1994; Грачева Н.М., 1999; Змушко Е.И., Белозеров Е.С., 2000]. Кандидамикозный сепсис встречается нечасто, но протекает всегда тяжело и нередко заканчивается смертью больных.
Возможно развитие аспергиллезов вследствие дисбактериоза. Аспергиллез является плесневым микозам, чаще других развиваются пенициллиозы и очень редко мукорозы. В настоящее время описано свыше 300 видов аспергиллов, 15 из них могут вызвать заболевание [Грачева Н.М., 1999]. При аспергиллезе поражаются наружные покровы и внутренние органы человека: ткани мозга, глаз, ухо, придаточные полости носа, бронхи, легкие, мочеполовую систему, лимфатические узлы, кости, все элементы опорно-двигательного аппарата.
Развивается аспергиллез обычно как вторичное заболевание у сильно ослабленных, истощенных больных на фоне общего, чаще всего хронического, заболевания легких, болезней крови, хронических заболеваний желудочно-кишечного тракта в процессе длительного применения антибиотиков и особенно тетрациклина, и является следствием развившегося дисбактериоза и суперинфекции.
Клинически аспергиллез чаще протекает в виде патологии органов дыхания, симптоматика в общем сходна с той, которая наблюдается при поражениях, обусловленных банальными патогенными микробами. Для острого бронхопульмонального аспергиллеза, помимо общих явлений, свойственных пневмонии, появляются повторные кровохарканья по утрам, в мокроте выявляются серовато-зеленоватые комочки, отхаркиваемые при приступах кашля и представляющих собой скопления мицелия и спор плесневого гриба.
Стафилококковый дисбактериоз по большей части также являются следствием лекарственного дисбактериоза, развивающегося на фоне измененной реактивности организма и понижения барьерной функции эндотелиально-макрофагальной системы. Протекает он в виде латентных форм, стафилококковой бактериемии, локализованных поражений кожи и внутренних органов (стафилококковая пневмония, энтероколит и другие), с генерализацией и без таковой, а также развитие стафилококкового сепсиса.
Псевдомембранозный колит в настоящее время большинством авторов рассматривается как острое заболевание, характеризующееся быстрым течением с летальным исходом в 50-75% случаев [Грачева Н.М., 1999]. Нарушение кишечной микрофлоры в процессе лечения антибиотиками, особенно клиндамицином или синтетическим его производным линкомицином, тетрациклинами и другими антибиотиками, аутоиммунные процессы, действие токсинов, вирусов рассматриваются как причина возникновения псевдомембранозного колита.
Развитию суперинфекции при дисбактериозе способствует тот факт, что некоторые антибиотики, в частности левомицетин, обладают иммунодепрессивным действием. Длительное применение таких препаратов приводит к формированию вторичного (приобретенного) иммунологического дефекта, который проявляется обычно в форме снижения абсолютного и относительного количества лимфоцитов, угнетения пролиферативной активности лимфоцитов на митогены и антигены. При этом число В-лимфоцитов может не отличаться от нормального. Уровень сывороточных нммуноглобулинов нормальный или повышенный. Продукция специфических антител в ответ на иммунизацию обычно угнетена. Иногда снижается фагоцитарная активность макрофагов, например, при лечении больных левомицетином. Приобретенные иммунодефекты усугубляют состояние больного. Следовательно, подавление иммуногенеза и фагоцитоза, возникающих в процессе лечения антибиотиками основного заболевания, способствует нарушению симбиоза микрофлоры организма, развитию эндогенных инфекций и формированию дисбактериоза.
Совершенствование уже известных лекарственных препаратов прежде всего направлено на увеличение их специфичности и уменьшение побочных эффектов, связанных с фармакологическими свойствами препарата. К примеру, преднизолон и кортизон обладают одинаковой противовоспалительной активностью, однако, первый в меньшей степени задерживает натрий в организме. Американскими учеными недавно изобретен безвредный аспирин - Poli Aspirin, в котором молекулы кислоты связаны в цепь, поэтому таблетка проходит через желудок не растворяясь и расщепляется уже в кишечнике. Здесь щелочная среда нейтрализует действие кислоты. Поэтому препарат смогут принимать даже больные язвенной болезнью желудка.
. Токсические проявления лекарственных средств могут быть обусловлены передозировкой препарата, что довольно часто встречается в терапевтической практике. Как правило, дозы применения препаратов ориентированы на усредненного человека (60 кг) и не учитываются индивидуальные колебания (от 40 до 120 кг), а схемы предполагают 3-4-х кратный прием медикаментов до или после еды. Симптоматика интоксикации при этом напрямую связана с фармакологическими свойствами препарата.
Нередко передозировка обусловлена осознанным назначением больших доз, например антибиотиков. Нам приходилось назначать больным сепсисом до 300 млн. ЕД пенициллина. В то же время парентеральное введение пенициллина в дозе более 200 млн ЕД в сутки, особенно у больных с почечной недостаточностью, может вызвать летаргию, спутанность сознания, эпилептиформные приступы, что связано с введением большого количества калия, содержащегося в препарате пенициллина, или гипонатриемией. При назначении пенициллинпрокаина могут развиться головокружение, головная боль, галлюцинации, эпилептоидные приступы вследствие быстрого освобождения токсических концентраций прокаина.
В фармакологии в целях оценки токсичности лекарственных средств определяют терапевтический индекс, т.е. разницу между дозами препарата, в которых он оказывает терапевтическое и токсическое действие. Лекарственные препараты, имеющие большую широту терапевтического действия, редко вызывают токсические осложнения при использовании их в терапевтических дозах и наоборот.
Так, среди антибиотиков низкий терапевтический индекс имеют стрептомицин, канамицин, неомицин, в связи с чем при лечении ими очень трудно избежать токсических реакций.
Токсические эффекты от терапевтических доз могут быть связанны с генетически обусловленным замедленным метаболизмом лекарств.
Нередко токсические реакции лекарственных средств обусловлены функциональной недостаточностью печени и почек, что ведет при заболеваниях печени к изменению метаболизма лекарственных препаратов с образованием более токсичных, чем сам препарат радикалов. При болезнях почек нарушается выведение лекарственного препарата из организма, длительное пребывание его или продуктов его метаболизма в организме с развитием токсических эффектов.
Токсические реакции могут быть обусловлены взаимодействием лекарственных средств, связаны с полипрагмазией без учета возможного взаимовлияния.
Для аминогликозидов характерна потенциальная способность вызывать нефротоксические, ототоксические реакции, а также нервно-мышечную блокаду. Нефротоксичность аминогликозидов возникает вследствие поражения эпителия проксимальных почечных канальцев и проявляется замедлением клубочковой фильтрации с формированием неолигурической почечной недостаточности. Частота таких реакций составляет 5–25 % и зависит от особенностей организма больного, препарата и режимов дозирования. Установлено, что применением аминогликозидов обусловлено 50 % всех случаев лекарственно-индуцированной почечной недостаточности [Рафальский В.В., 1999].
При длительном лечении аминогликозидами у 1/4 больных развивается токсическое нарушение функции почек, обычно быстро обратимое и связанное с выраженным накоплением этих препаратов в проксимальных почечных канальцах [Appel G.B., 1998].. У больных вскоре после начала лечения появляется ферментурия за счет выделения ферментов почечных канальцев, особенно дистальной части нефрона. Затем снижается концентрационная функция с появлением протеинурии и цилиндрурии. Нефротоксичность аминогликозидов дозозависима и уменьшается при их однократном применении в сутки [Белозеров Е.С., 1982, 1989; Hatala R. et al., 1996].
У аминогликозидов довольно выражена и именно им характерная ототоксичность, которая проявляется снижением слуха вплоть до полной глухоты, что мы неоднократно наблюдали при лечении большими дозами антибиотиков этой группы детей раннего возраста, больных менингококковой инфекцией. Ототоксичность аминогликозидов связана с дисфункцией вестибулярного аппарата и слухового нерва и в результате их прогрессирующего накопления в лимфе внутреннего уха. Она проявляется вестибуло- и/или кохлеатоксичностью и развивается вследствие поражения VIII пары черепно-мозговых нервов (3–14%). Вестибулотоксичность чаще встречается при использовании стрептомицина и гентамицина и развивается спустя несколько дней и даже недель от начала лечения, проявляясь головокружением, тошнотой, рвотой, нистагмом, нарушением равновесия. Кохлеотоксичность наиболее характерна для неомицина, канамицина и амикацина. Расстройство слуха различной степени вплоть до полной глухоты могут развиваться через несколько недель после лечения. Поражение может быть как одно-, так и двусторонним, первоначально нарушается восприятие звуков высоких частот, вследствие чего больные могут ощущать звон в ушах. При прогрессировании процесса теряется слух на низких частотах и затрудняется процесс общения.
Фторхинолоны относятся к антибиотикам с исключительно высоким соотношением эффективность/безопасность. Частота возникновения побочных реакций составляет 2–8 % [Рафальский В.В., 1999]. Наиболее часты реакции со стороны желудочно-кишечного тракта, при этом наиболее характерны тошнота (5,2 %), диарея (2,3 %), рвота (2,0 %), диспепсия (1,7 %), головная боль (1,2 %), кожные высыпания (1,1 %) [Harrell R.M.1999]. По частоте развития побочных эффектов со стороны желудочно-кишечного тракта фторхинолоны распределяются в порядке флероксацин > спарфлоксацин > офлоксацин. Повышение уровня печеночных трансаминаз встречается у 2–3 % больных. Хотя после отмены препарата, как правило, содержание ферментов быстро нормализуется, описаны случаи холестатической желтухи при применении ципрофлоксацина, норфлоксацина, офлоксацина.
С 1999 г. резко ограничены показания к применению в США и запрещено использование в Европе нового фторхинолона тровафлоксацина в связи с высокой частотой тяжелых поражений печени.
Токсические поражения ЦНС фторхинолонами занимают второе место по частоте развития (1–2 %) и проявляются головной болью, головокружением, оглушенностью, нарушениями сна, очень редко – судорогами. Побочные эффекты возникают обычно в первые дни применения антибиотика и проходят после отмены препарата. При приеме офлоксацина и ципрофлоксацина описаны случаи острого психоза.
Кардиотоксичность наиболее характерна для фторхинолонов III–IV поколения (спарфлоксацин, грепафлоксацин и характеризуется удлинением интервала QT на электрокардиограмме, различные нарушения ритма.. Последний в связи с зарегистрированными случаями летальных нарушений ритма в 1999 г. отозван с рынка фирмой-производителем.
Нефротоксические реакции фторхинолоной составляет 0,2–0,8, а при приеме офлоксацина – 1,3 %. Под влиянием ципрофлоксацина развивается интерстициальный нефрит, а для норфлоксацина характерно прямое токсическое действие. Вместе с тем почечная недостаточность при применении фторхинолонов возникает достаточно редко – 1 : 80 000 среди применявших ципрофлоксацин [18]. При одновременном применении полимиксина В, амфотерицина В, ванкомицина, этакриновой кислоты, цефалоспоринов возможно усиление нефротоксического действия фторхинолонов.
Токсические эффекты лекарственных средств нередко связаны с взаимодействием препаратов между собой, что неизбежно при полипрагмазии. Под лекарственным взаимодействием понимают усиление (синергизм) или ослабление (антагонизм) терапевтического эффекта при одновременном или последовательном введении двух или нескольких лекарственных препаратов.
При проведении комплексной терапии с использованием целого ряда лекарственных препаратов на организм больного оказывает влияние не только каждое из использованных лекарств, но и результат реакций взаимодействия между отдельными препаратами. Частота медикаментозных осложнений растет прямо пропорционально количеству одновременно применяемых лекарственных веществ. Так, изучая осложнения при взаимодействии и одновременном применении нескольких лекарств F. Е. May и соавт. (1977) установили, что при одновременном приеме 8 препаратов, побочные реакции обнаруживаются у 10 % леченых, а при приеме 16 препаратов – у 40 %. Проанализировав за 5 лет у 10518 больных побочные реакции и медикаментозные осложнения, авторы обнаружили для 9 различных групп медикаментов частоту осложнений от 2 до 12 %. Чаще всего медикаментозные осложнения регистрировались среди лиц, получавших гипотензивные препараты и антикоагулянты. Разделив больных с медикаментозными осложнениями по 4 группам (в первой группе лица, получавшие одновременно 1-5 препаратов, во второй – 6-10, в третьей – 11-15 и в четвертой – 16-20 лекарственных средств), авторы установили наличие осложнений соответственно у 4, 10, 28 и 54 % леченых.
Е. Ariens, A. Simonis (1977), Watkins V.S. et al. (1997) классифицируют взаимодействие лекарственных препаратов по конечному качественному результату, количественному результату и клиническим эффектам.
По качественному результату: 1) взаимодействие лекарств, приводящее к патологическим реакциям (к побочным лекарственным реакциям) — чрезмерный терапевтический эффект, токсический эффект, ослабление или устранение терапевтического эффекта лекарств; 2) взаимодействие лекарств, приводящее к желаемому терапевтическому результату (усиление терапевтического либо ослабление токсического действия или других побочных эффектов).
По количественным результатам различаются следующие реакции: 1) кооперативное взаимодействие, в результате которого эффект двух применяемых вместе препаратов выше эффекта от каждого препарата в отдельности; при этом суммарное влияние лекарств является или эффектом простого сложения действия каждого из двух препаратов или же возникает эффект, превышающий их суммарное действие; в последнем случае говорят о синергизме лекарственных препаратов; если же суммарный эффект превышает терапевтическое действие каждого препарата в отдельности, но ниже их предполагаемого эффекта, говорят об аддитивном действии лекарств; 2) антагонистическое действие лекарств возникает в случаях, когда эффект комбинации двух препаратов меньше эффекта каждого из них в отдельности.
По клиническим проявлениям взаимодействие лекарств классифицируется по фазам действия: 1) фармацевтическая фаза, в процессе которой выявляется несовместимость препаратов по физико-химическим свойствам или по результатам их фармакологического действия (нарушение всасывания одних лекарств в связи с изменением моторики кишечника, вызываемым другими, одновременно принимаемыми препаратами); 2) фармако-кинетическая фаза, в которой реакции взаимодействия возникают в процессе всасывания, распределения, вытеснения из белковых связей или смещения из точек связывания с рецептором, метаболизма (ферментативная индукция или ингибиция), экскреции и т. п.; 3) фармакодинамическая фаза, в которой нарушаются возникновение и реализация фармакологического эффекта лекарств. В этой фазе различается ряд процессов, определяющих взаимодействие лекарств: а) изменение кинетики одного лекарства в органах-мишенях, вызываемое другим лекарством, в результате чего нарушается распределение первого лекарства в органах-мишенях вследствие изменения его местного транспорта, превращения, связывания;. б) изменение одним лекарством преобразующих процессов, включая стимулы, вызванные взаимодействием второго лекарства с рецепторами, нарушение высвобождения, мобилизации или образования биологических медиаторов; в) изменение одним лекарством функции эффекторных клеток или органов, существенно влияющее на действие другого лекарства; г) физиологическое взаимодействие двух лекарств, вызывающее эффект, не зависящий от органов-мишеней, на которые они действуют, т. е. развитие вторичных явлений.
Возможность физического или химического взаимодействия делает многие лекарственные вещества несовместимыми, их одновременный прием ведет к инактивации или образованию токсических соединений. Так, бензилпенициллин по своим физико-химическим свойствам несовместим с левомицетином, гепарином, витаминами группы В, витамином Е. Нельзя вводить бикарбонат натрия одновременно с другими бикарбонатными соединениями, аминазином, аскорбиновой кислотой, инсулином, окситетрациклином. Снижается терапевтический эффект тетрациклинов при одновременном пероральном приеме их с солями кальция, магния, алюминия, уменьшающими всасывание антибиотиков из желудочно-кишечного тракта. В силу высокой биодоступности фторхинолонов, которая для некоторых препаратов (в частности, для ломефлоксацина) достигает более 90%, всасывание фторхинолонов снижается при одновременном применении антацидов, содержащих ионы магния и алюминия, с которыми (так же как с цинком, кальцием, железом) фторхинолоны образуют хелатные комплексы. Это же имеет место при одновременном приеме фторхинолонов и препаратов витаминов, содержащих комплекс минералов. В таблице 24 представлены некоторые наиболее характерные эффекты взаимодействия антибактериальных препаратов с другими лекарственными средствами.
Таблица 24
Взаимодействие антибиотиков
|
Антибактериальные препараты |
Взаимодействующие лекарства |
Эффект |
| Аминогликозиды | амфотерицин B | Нефротоксичность |
| циклоспорин | ||
| цисплатин | ||
| ванкомицин | ||
| нестероидные противовоспалительные средства | ||
| этакриновая кислота | ототоксичность | |
| фуросемид | ||
| Доксициклин | антациды | нарушение абсорбции |
| сульфат железа | ||
| циметидин | ||
| барбитураты | Повышение метаболизма в печени | |
| фенитоин | ||
| карбамазепин | ||
| дигоксин | токсический эффект дигоксина | |
| Триметоприм и сульфаметоксазол | варфарин | увеличение антикоагуляцяционных свойств |
| циклоспорин | нефротоксичность | |
| фенитоин | токсичность фенитоина | |
| метотрексат | угнетение костного мозга | |
| глипицид | гипогликемия | |
| Ципрофлоксин | теофиллин | токсичность теофиллина |
Как отмечают С.А. Крыжановский и М.Б. Вититнова (2000), нерациональное комбинированное применение лекарственных средств без консультации с врачом может привести к следующим последствиям:
– ослаблению или инактивации лечебных свойств, присущих данному лекарственному средству;
– появлению у лекарственных средств новой, не свойственной им, биологической активности;
– появлению у лекарственных средств новых свойств, делающих этот препарат токсичным (оказывающим повреждающее воздействие на организм), онкогенным (способным вызывать опухоли), аллергогенным (вызывающим аллергию) и т.д., т.е. появление у препарата суммы свойств, позволяющих рассматривать бывшее лекарственное средство как нежелательный, вредный для организма агент.
Биологическая активность лекарственного средства может изменяться не только в результате взаимодействия с другими лекарственными препаратами, но и претерпевать существенные изменения вследствие взаимодействия между лекарственным средством и пищей и/или биологическими активными агентами, выделяемыми организмом в результате его жизнедеятельности (табл.25). Следовательно, конечную реакцию организма на лекарственное средство или их комбинацию можно рассматривать как многофакторный процесс, возникающих в результате взаимодействия препарата и организма.
Возможна и извращенная реакция организма на лекарственный препарат или его компоненты:
– идиосинкразия: повышенная или извращенная реакция организма на лекарственное средство или сходного с ним химического соединения вследствие индивидуальной несовместимости с организмом. Следует подчеркнуть, что достаточно часто идиосинкразия носит врожденный характер. Исходя из этого, в случае проявления идиосинкразии у одного из членов семьи можно рекомендовать родственникам обратиться в генетическую консультацию с целью выявления у прямых потомков наличия идиосинкразии;
– аллергия: повышенная или извращенная реакция организма на повторный прием лекарственного средства или его компонентов. В отличие от идиосинкразии, аллергия, как правило, носит приобретенный, а не врожденный характер. Необходимо также отметить, что аллергическая реакция организма на лекарственное вещество может проявляться через достаточно длительное время. В литературе описан случай развития тяжелой аллергической реакции на пенициллин через 10-15 лет после его предыдущего приема [Крыжановский С.А., Вититнова М.Б., 2000].
В результате взаимодействия лекарственных средств или их компонентов с пищей их активность может в значительной степени изменяться. Так, например, пища замедляет всасывание феноксиметилпенициллина, оксациллина, ампициллина, тетрациклина, изониазида, рифампицина, сульфаниламидов, нифедипина, а это снижает концентрацию препаратов в крови, следовательно, и их лечебный эффект.
Одновременное применение неодикумарина, фенилина с пищевыми продуктами, содержащими витамин К, такими как листья шпината, белокочанная капуста, приводит к снижению активности этих лекарственных средств.
При лечении детей часто смешивают лекарственные препараты с различными соками или фруктовыми водами, что зачастую приводит к резкому снижению активности лекарственных средств, в частности антибиотиков пенициллинового ряда, эритромицина, тетрациклина, амидопирина, хлорида кальция.
Таблица 25
Примеры влияния продуктов на активность ряда лекарственных препаратов (по Крыжановскому С.А. и Вититновой М.Б., 2000)
|
Лекарственные препараты |
Пищевые продукты |
Результат взаимодействия |
||
| Тетрациклин, тетрациклина гидрохлорид, окситетрациклина дигидрат, оки-стетрациклина гидрохлорид, метациклина гидрохлорид, доксициклина гидрохлорид (антибиотики группы тетрациклина) | Пища, содержащая калий (молоко и молочные продукты) | Нарушение всасывания тетрациклинов вследствие образования нераство римых комплексов |
||
| Ниаламид (ингибитор моноаминооксидазы) | Продукты, содержащие амины (сыр, масло, кофе, копченая сельдь, бобы, бананы, шоколад) | Повышение артериального давления, опасность спазма (резкого сужения просвета) сосудов, гипертонического криза (резкого повышения артериального давления), кровоизлияния в мозг |
||
| Препараты йода, применяемые для лечения заболеваний щитовидной железы | Капуста (содержит прогватрин) | Снижение активности препаратов йода | ||
| Неодикумарин, фепромарон, синкумар, фенилин (антикоагулянты непрямого действия) | Листовые овощи, содержащие филло-хиноны | Снижение эффекта антикоагулянтов | ||
| Гипотиазид, циклометазид, оксидолин (тиазидные диуретики), особенно в сочетании с препаратами наперстянки | Пища с высоким содержанием калия(абрикосовый и морковный соки, персики, чернослив, бананы) | Предотвращение гипокалиемии (понижения содержания калия в крови) , уменьшение токсичности сердечных гликозидов (рекомендуется сочетание лекарственных веществ с высоким содержанием калия) |
||
| Антибиотики, сульфаниламидные препараты, антигельминтные средства | Алкогольные напитки различной крепости (водка, вино, пиво), суррогаты алкоголя | Усиление токсичности лекарственных
веществ, снижение активности лекарственных веществ |
||
| Барбитураты, резерпин, морфин, ами-назин, мепробамат, седуксен | - II - | Усиление токсичности лекарственных веществ |
||
| Амитриптилин | - II - | Усиление токсичности (повреждающего воздействия на организм) лекарственных веществ, возможен смертельный исход |
||
| Инсулин | - II - | Резкое снижение уровня глюкозы в крови (тяжелая гипогликемия) |
||
| Нитроглицерин | - II - | Резкое снижение
артериального
давления |
||
Нарушается уровень ионов калия в организме больных с хронической сердечной недостаточностью, в течение длительного времени применяющих мочегонные средства, особенно гипотиазид, циклометиазид и оксодолин. Обычно такие больные сочетают прием мочегонных средств с сердечными гликозидами, который на фоне снижения уровня калия в крови вследствие действия мочегонных средств может вызвать такие тяжелые осложнения, как развитие грубых нарушений ритма сердца. Поэтому целесообразно рекомендовать прием пищи с высоким содержанием калия и низким натрия, например, кураги, бананов, инжира, морковного сока и следует воздержаться от употребления таких пищевых продуктов, как сардины, молоко, ветчина, соус кетчуп, томатный сок, которые наряду с высоким содержанием калия также содержат высокие концентрации натрия.
Наряду со снижением лечебного эффекта лекарственных средств в результате их взаимодействия с пищей возможны и более тяжелые последствия. Так, при сочетанием применении ниаламида, пиразидола с пищевыми продуктами, содержащими тирамин, например, сыр, брынза, вина Кьянти, Рислинг, Херес, пиво, маринованная и копченая сельдь, кофе, молоко, сливки, бобы может развиться так называемый «сырный синдром» – подъем артериального давления вплоть до гипертонического криза, кровоизлияния в мозг и т.д.
Помимо пищевых агентов активность лекарственных средств в значительной степени могут изменять алкоголь и курение. Употребление алкогольсодержащих напитков приводит к серьезным нарушениям обмена веществ в организме, нарушению всасывания питательных веществ, смещению кислотно-щелочного равновесия в сторону закисления. Поэтому прием лекарственных средств на фоне употребления алкоголя во многих случаях изменяет и/или извращает их воздействие на организм человека. Алкоголь уменьшает ее способность к синтезу белка, что, в свою очередь, замедляет или извращает процессы биотрансформации лекарственных средств в печени. Изменение скорости и интенсивности химических превращений лекарственных веществ в печени во многих случаях сопровождается усилением их токсичности. Поэтому на фоне употребления алкоголя усиливается токсическое действие вплоть до отравлений многих лекарственных средств, особенно нейролептиков, снотворных, транквилизаторов, наркотических и ненаркотических анальгетиков, антидепрессантов, мочегонных средств, инсулина, нитроглицерина, кетотифена, ряда антибиотиков [Крыжановский С.А., Вититнова М.Б., 2000]. Одновременный прием алкоголя и выше указанных групп лекарственных средств достаточно часто сопровождается тяжелыми отравлениями организма вплоть до смертельного исхода. Смерть в этих случаях наступает от резкого угнетения дыхания и сосудодвигательного центров головного мозга.
К резкому подъему артериального давления с опасными для жизни последствиями может привести прием алкоголя на фоне лечения такими лекарственными средствами, как эфедрин, мезатон, теофедрин, нафтизин, галазолин и препаратов близких механизмов действия. Так, при приеме алкоголя на фоне лечения такими антигипертензивными препаратами, как бета-адреноблокаторы, антагонисты ионов кальция, метилдофа, клофелин возможно резкое падение артериального давления.
Прием алкоголя резко усиливает действие непрямых антикоагулянтов и антиагрегантов, широко применяемых для лечения таких заболеваний, как тромбофлебит, для профилактики и лечения нарушений кровообращения. Алкоголь настолько значительно усиливает эффект этих препаратов, что существует реальная возможность развития сильных кровотечений и кровоизлияний в органы и ткани организма, в том числе и мозг. Одновременный прием алкоголя с лекарственными препаратами группы инсулина и пероральными противодиабетическими лекарственными средствами может привести к резкому падению уровня глюкозы в крови, сопровождающемуся потерей сознания и судорогами. У больных, получающих антибиотики, сульфаниламиды, производные нитрофурана, метронидазол прием алкоголя приводит к снижению эффективности лечения, а в ряде случаев развитию симптомов непереносимости алкоголя, так как хронический прием алкоголя снижает всасываемость и усвоение организмом таких необходимых для организма витаминов, как B1, В6, B12, А, РР, С, фолиевая кислота [Крыжановский С.А., Вититнова М.Б., 2000].
Максимальное отрицательное воздействие лекарственных средств на процессы всасывания пищевых продуктов или их компонентов происходит в тех случаях, когда лекарственные препараты принимаются во время или сразу же после приема пиши, тогда как прием лекарственных средств натощак позволяет в значительной мере избежать взаимодействия их с пищей и тем самым в значительной мере уменьшает их нежелательное влияние друг на друга.
При совместном применении двух или более лекарств взаимодействие наступает уже в желудочно-кишечном тракте, в процессе всасывания лекарств. Характер взаимодействия определяется степенью ионизации и растворимости лекарств, способностью их к комплексообразованию, влиянием на бактериальную флору кишечника, участвующую в метаболизме лекарств, а также функциональным состоянием желудочно-кишечного тракта: моторной функцией, характером кровоснабжения слизистой, ее проницаемостью. Так, большинство антибиотиков, особенно широкого спектра действия, подавляя бактериальную флору кишечника, замедляют всасывание салицилазосульфапиридина. Полипептиды нарушают проницаемость слизистой кишечника. Уменьшают моторику кишечника (увеличивая тем самым скорость всасывания) холинолитики, хлорохин, ганглиоблокаторы, иеомицин, трициклические антидепрессанты, опиаты. И наоборот, слабительные средства, холинергические препараты ускоряют моторику желудочно-кишечного тракта, уменьшая всасывание других лекарственных средств.
Значительно нарушается всасывание лекарственного вещества из желудочно-кишечного тракта в тех случаях, когда препарат связывается или становится нерастворимым под влиянием другого препарата. Например, тетрациклины при взаимодействии с некоторыми двух- и трехвалентными ионами образуют комплексы, которые практически не всасываются. Почти полностью подавляется всасывание метациклина и доксициклина сульфатом железа. Также существенно нарушают всасывание антибиотиков тетрациклинового ряда другие препараты железа. Так как многие больные одновременно с антибиотиками принимают антацидные препараты, содержащие двухвалентные ионы, всасывание антибиотиков резко снижается. Так как антациды снижают всасывание пероральных цефалоспоринов в желудочно-кишечном тракте, рекомендуется между приемами этих препаратов интервал не менее 2 ч.
К изменению ионизации молекул лекарственных веществ и их растворимости в жирах, а, следовательно, и к изменению всасывания этих веществ может привести повышение или снижение кислотности содержимого желудка. Через стенку кишечника, являющейся липидной мембраной, наиболее легко проникают неионизированные, хорошо растворимые в жирах вещества. Поэтому антацидные средства, повышая рН желудочного содержимого, увеличивают ионизацию кислых лекарственных веществ, обусловливая снижение их растворимости в жирах и замедление всасывания. Так, антациды подавляют всасывание непрямых антикоагулянтов, некоторых сульфаниламидов, нитрофурантоина, салицилатов, фенилбутазона.
Бикарбонат натрия, изменяя рН желудочного сока, угнетает всасывание тетрациклина. К подобному эффекту приводит и ингибирование секреции желудочного сока под влиянием циметидина, в результате который уменьшает всасывание ампициллина, триметоприма и сульфаметоксазола.
Влияние на всасывание лекарственных средств, особенно медленно или неполностью абсорбирующихся, таких как тетрациклин, могут оказывать препараты, действующие на перистальтику желудочно-кишечного тракта. Подобным эффектом обладают холинолитические, антихолинэстеразные и слабительные средства.
Взаимодействие в месте всасывания делает недопустимым сочетание местноанестезирующих средств с адреналином, гиалуронидазой, карбонатными растворами. Взаимодействуя в рецепторных зонах по механизму конкурентного антагонизма аминогликозиды (стрептомицин, неомицин, канамицин) усиливают эффект миорелаксантов и средств для наркоза. Терапевтический эффект миорелаксантов усиливают также ионы магния – за счет снижения количества высвобождающегося ацетилхолина в окончаниях двигательных нервов. Потенцируют действие миорелаксантов такие диуретики, как фуросемид, тиазиды, ацетазоламид, способствующие развитию гипокалиемии.
В результате взаимодействия в процессе метаболизма несовместимы ингибиторы моноаминооксидазы с антидепрессантами типа барбитуратов, фенотиазинов и симпатомиметическими аминами.
Распределение лекарственных веществ в тканях, биологических жидкостях, а, следовательно, и их фармакологический эффект во многом зависит от способности проникновения через клеточные мембраны. В условиях приема одновременно двух препаратов один из них может ускорять или замедлять всасывание другого, соответственно, усиливая или снижая фармакологический эффект. Такие лекарственные препараты, как гормоны, инсулин, АКТГ, пептиды, увеличивают всасывание лекарственных препаратов, усиливая их терапевтическое действие. Поэтому гинины, продукты распада белков, глютатион получили название «неспецифических активаторов мембранного транспорта».
В акушерско-гинекологической практике исключительно важным является учет активации мембранного транспорта при совместном применении нескольких лекарственных препаратов. Активаторы мембранного транспорта могут усилить проникновение применяемых беременной женщиной лекарств через плацентарный барьер, создавая опасные концентрации в организме плода, оказывая токсическое и тератогенное действие. Так, инсулин ускоряет проникновение через мембраны и увеличивает токсический эффект большинства цитостатиков.
Лекарственные вещества продолжают взаимодействовать и после всасывания из желудочно-кишечного тракта, в частности, в процессе метаболизма в печени. Более 200 лекарственных препаратов способны повышать активность микросомальных ферментов печени, в силу чего эти препараты ускоряют метаболизм других, принимаемых одновременно с ними, лекарственных веществ. У человека особенно активно стимулируют метаболизм медикаментов такие препараты, как барбитураты и 3-метилхолантрен.
С точки зрения медикаментозных осложнений более важной является проблема не ферментативной индукции, а ферментативной ингибиции, так как уменьшение метаболизма лекарственных веществ в печени способствует увеличению токсического действия препаратов. Но этот вопрос в настоящее время лишь начинает изучаться.
Многие лекарственные препараты несовместимы в силу взаимодействия друг с другом в плазме [Gleckman R.A., Borrego F., 1997; Watkins V.S. et al., 1997]. Большинство поступающих в организм лекарств связывается с белками плазмы, в силу чего частично теряет свою эффективность. Но так как этот процесс обратим, некоторые лекарственные препараты способны вытеснять из связи с белками ранее поступившие медикаменты, что ведет к накоплению последних в крови в высоких, иногда опасных дозах.
Совместный прием некоторых лекарственных препаратов нежелателен в связи с тем, что один медикамент зачастую усиливает фармакологический эффект другого, способствуя развитию осложнения. Экспериментальные и клинические наблюдения свидетельствуют о влиянии ацетилсалициловой кислоты и других салицилатов на фармакологическую активность антикоагулянтов. Ацетилсалициловая кислота, даже без антикоагулянтов, вызывает снижение протромбиновой активности, очевидно, за счет угнетения синтеза витамина К и ферментативного расщепления салициловой кислоты. На исход комбинированного применения ее с антикоагулянтами также оказывают влияние способность уже в малых дозах угнетать агрегацию тромбоцитов и ульцерогенное действие препарата.
Взаимодействие лекарственных веществ может продолжаться и на стадии их выведения из организма и прежде всего основных путей выведения лекарственных веществ — почками и с желчью. По своему химическому составу большинство лекарственных препаратов является слабыми электролитами, а их растворимость зависит от степени ионизации. Так как на степень ионизации вещества большое влияние оказывает кислотность раствора, изменения рН, вызываемые другими препаратами, могут существенно изменить выведение лекарственных веществ с мочой. Например, рН мочи повышается при применении бикарбоната натрия и снижается при лечении аскорбиновой кислотой.
Такие лекарственные вещества, как органические кислоты, проходят из крови в мочу через канальцевый эпителий путем активного транспорта и могут конкурировать за этот путь. Например, пробеницид значительно снижает выведение пенициллина и других препаратов этого ряда (амоксициллина, тикарциллина, мезлоциллина), а также отдельных цефалоспоринов. Фуросемид подавляют канальцевую секрецию пенициллинов и цефалоридина, удлиняет период полувыведения и повышает их концентрацию в крови. Он снижает клиренс гентамицина и левомицетина, которые выводятся из организма путем фильтрации в клубочках.
Все эти виды взаимодействия лекарственных препаратов на стадии их выведения из организма могут привести к возникновению побочных эффектов, как системных, так и в почках. Например, фенилбутазон, подавляя выведение оксиацетогексамидина, вызывает развитие гипогликемии. Хлорид аммония, снижая рН мочи больных, получающих сульфадиазин, приводит к образованию ацетилсульфадиазина, который осаждается в кислой среде и вызывает поражение почек.
Среди лекарственных препаратов неконтролируемо широкое распространение получили антибиотики, в силу чего и взаимодействие между ними и другими препаратами, одновременно получаемыми больным, встречается часто и побочные эффекты, ими обусловленные, занимают довольно значительный удельный вес. В табл. 26, заимствованной из литературы, представлены наиболее характерные результаты взаимодействия между группами антибиотиков и некоторых лекарственных средств. Так, одновременное назначение фторхинолонов (кроме норфлоксацина и офлоксацина) с теофиллином, кофеином, непрямыми антикоагулянтами сопровождается повышением концентрации перечисленных препаратов в крови. Антациды, содержащие ионы аллюминия и магния, сукральфат, препараты, содержащие ионы кальция, железа, цинка, висмута, снижают биодоступность фторхинолонов. При применении фенитоина совместно с фторхинолонами повышается риск развития судорог, особенно у пациентов, страдающих эпилепсией. Отмечается антагонизм фторхинолонов с нитрофурантоином, тетрациклином, хлорамфениколом.
Таблица 26
Результаты взаимодействия между антибиотиками и некоторыми лекарственными средствами
| Лекарственное средство или группа лекарственных средств, вступающих во взаимодействие | Результаты взаимодействия | ||
|
Пенициллины |
|||
| Антикоагулянты (прямые и непрямые), тромболитические средства, НПВС, салицилаты | Повышение риска кровотечения (особенно с высокими дозами карбенициллина, уреидопенициллинов) | ||
| Ингибиторы АПФ, калийсберегающие диуретики, препараты калия и калийсодержащие препараты | Гиперкалиемия (при введении бензилпенициллина калиевой соли) | ||
| Аминогликозиды | Взаимная инактивация при смешивании | ||
| Эстрогеносодержащие пероральные контрацептивы | Снижение эффективности контрацепции (особенно с амоксициллином, ампициллином, феноксиметилпенициллином) | ||
| Антигиперлипидемические средства (холестирамин, колестипол) | Уменьшение всасывания пенициллинов | ||
| Метотрексат | Усиление токсического действия метотрексата | ||
| Сульфаниламиды, хлорамфеникол | Ослабление бактерицидного эффекта пенициллинов | ||
| Неомицин | Уменьшение всасывания феноксиметилпенициллина | ||
|
Цефалоспорины |
|||
| Спиртосодержащие препараты, алкоголь | Развитие дисульфирамоподобной реакции (цефоперазон) | ||
| Антикоагулянты (прямые и непрямые) действия, тромболитические средства, НПВС, салицилаты | Повышение риска кровотечения (цефоперазон) | ||
| Аминогликозиды, гликопептиды, петлевые диуретики и другие препараты, оказывающие нефротоксическое действие | Повышение риска нефротоксического действия | ||
|
Аминогликозиды |
|||
| Аминогликозиды, при одновременном или последовательном применении двух препаратов и более | Повышение риска ототоксичности, нефротоксичности, нервно-мышечной блокады | ||
| Гликопептиды | Повышение риска ототоксичности и нефротоксичности | ||
| Капреомицин | Повышение риска ототоксичности, нефротоксичности, нервно-мышечной блокады | ||
| Полимиксин В | Повышение риска нефротоксичности и нервно-мышечной блокады | ||
| Петлевые диуретики, цисплатин | Повышение риска ототоксичности | ||
| Средства для наркоза, наркотические анальгетики, недеполяризующие миорелаксанты | Усиление нервно-мышечной блокады, повышение риска угнетения и остановки дыхания | ||
| Антимиастенические средства | Ослабление действия антимиастенических средств | ||
|
Хинолоны/фторхинолоны |
|||
| Непрямые антикоагулянты | Усиление антикоагулянтного эффекта (особенно с налидиксовой кислотой) | ||
| Алюминий-, кальций- и магнийсодержащие антациды, магнийсодержащие слабительные, препараты цинка, висмута и железа | Ослабление эффекта фторхинолонов при приеме внутрь | ||
| Ксантины (теофиллин, аминофиллин, кофеин) | Повышение риска токсичности ксантинов (особенно с ципрофлоксацином) | ||
| Диданозин | Уменьшение всасывания фторхинолонов | ||
| Циклоспорин | Повышение концентрации циклоспорина в сыворотке крови | ||
| Пероральные противодиабетические средства, инсулин | Гипогликемия или гипергликемия | ||
| НПВС | Повышение риска возбуждения ЦНС и развития судорог | ||
| Фенитоин | Уменьшение концентрации фенитоина в сыворотке крови | ||
|
Макролиды |
|||
| Бензодиазепины (мидазолам, триазолам), сердечные гликозиды (дигоксин), антиаритмические средства (дизопирамид) | Усиление действия данных препаратов | ||
В качестве примера сложных процессов взаимодействия можно рассмотреть взаимодействие макролидов.
Большинство антибиотиков-макролидов метаболизируется в печени при участии цитохрома Р450. При этом эритромицин способен необратимо ингибировать фермент; джозамицин, кларитромицин и мидекамицин обратимо ингибируют его, а спирамицин и азитромицин подвергаются печеночной трансформации лишь в незначительной степени и в связи с этим не влияют на метаболизм других препаратов, осуществляющих через систему цитохрома Р, например, теофиллина. Поэтому отсутствует необходимость в корректировке доз параллельно проводимому лечению при назначении спирамицина или азитромицина.
В случае, если макролид связывается с цитохромом Р450, он способен замедлять метаболизм других препаратов, изменяя тем самым их терапевтические эффекты и повышая риск развития токсических осложнений. Наиболее сильным ингибитором цитохрома Р450 является эритромицин, остальные антибиотики этой группы по силе ингибирования можно расположить следующим образом: кларитромицин > джозамицин > рокситромицин > спирамицин > азитромицин [Watkins V.s. et al., 1997].
Наиболее характерные клинически значимые взаимодействия антибиотиков-макролидов и других препаратов в обобщенном виде приведены в табл. 27.
Таблица 27
Клинически значимые взаимодействия макролидов
|
Препарат |
Антибиотик-макролид |
Результат взаимодействия |
|
Алкалоиды спорыньи |
Эритромицин |
Увеличение концентрации алкалоидов спорыньи в крови, выраженный спазм периферических сосудов с развитием ишемии конечностей и возможностью развития гангрены |
|
Джозамицин |
Выраженный вазоконстрикторный эффект |
|
|
Антациды |
Азитромицин |
Уменьшение всасывания и биодоступности макролидов |
|
Астемизол |
Эритромицин |
Хининоподобный эффект, повышение риска развития желудочковых аритмий |
|
Бензодиазепины |
Эритромицин |
Нарушение метаболизма бензодиазепинов в печени |
|
Эритромицин |
Увеличение концентрации бензодиазепинов в крови, усиление их седативного эффекта |
|
|
Бромокриптин |
Эритромицин |
Увеличение площади под фармакокинетической кривой бромокриптина за счет незначительного увеличения максимальной концентрации и времени полувыведения препарата |
|
Вальпроевая кислота |
Эритромицин |
Увеличение концентрации вальпроевой кислоты в крови, появление сонливости |
|
Варфарин |
Эритромицин |
Усиление гипопротромбинемии |
|
Мидекамицин |
Снижение скорости выведения варфарина |
|
|
Виагра |
Эритромицин |
Повышение концентрации препаратов в крови, увеличение их времени полувыведения, вероятности развития токсических эффектов. Существенное повышения риска развития побочных эффектов виагры. Данное сочетание считается клинически небезопасным, т.к. виагра приводит к накоплению оксида азота, который также метаболизируется цитохромом Р450. |
|
Дигоксин |
Эритромицин |
Увеличение концентрации дигоксина в крови, повышение риска токсичности препарата. |
|
Дизопрамид |
Эритромицин |
Увеличение концентрации дизопрамида в крови, ингибирование метаболизма препарата в печени |
|
Заместительная гормонотерапия |
Эритромицин |
Снижение клиренса эритроцита и гормонов, повышение концентрации гормонов в крови |
|
Карбамазепин |
Эритромицин Кларитромицин |
Повышение концентрации карбамазепина в крови в 2-4 раза, повышение токсичности препарата, нарушение метаболизма препарата в печени |
|
Мидекамицин |
Увеличение времени полувыведения карбамазепина |
|
|
Линкомицин |
Эритромицин |
Снижение терапевтического эффекта макролида |
|
Ловастатин |
Эритромицин |
Отмечены случаи развития тяжелых миопатий |
|
Лосартан |
Эритромицин |
Незначительное повышение концентрации лосартана в крови |
|
Метилпреднизолон |
Эритромицин |
Увеличение площади под фармакокинетической кривой метилпреднизолона, увеличение времени полувыведения препарата и пролонгирование его действия, нарушение метаболизма препарата в печени |
|
Пимозид |
Эритромицин |
Увеличение концентрации пимозида в крови за счет ингибирования метаболизма препарата в печени |
|
Сульфаниламиды |
Эритромицин |
Резкое увеличение вероятности возникновения токсических эффектов при совместной терапии |
|
Теофиллин |
Эритромицин |
Увеличение концентрации теофиллина в крови на 20%, усиление токсического действия препарата на центральную нервную систему и желудочно-кишечный тракт |
|
Джозамицин |
Замедление выведения теофиллина и незначительно - джозамицина |
|
|
Терфенадин |
Эритромицин |
Увеличение концентрации терфенадина в крови, повышение риска развития желудочковых аритмий |
|
Цидовудин |
Кларитромицин |
Уменьшение скорости адсорбции цидовудина |
|
Цизаприд |
Эритромицин |
Риск развития серьезных нарушений сердечного ритма, желудочковых аритмий |
|
Циклоспорины |
Эритромицин |
Нарушение метаболизма циклоспоринов в печени, снижение клиренса препаратов на 50% и более |
|
Циклоспорины |
Эритромицин |
Увеличение концентрации циклоспоринов в крови, повышение нефротоксичности препаратов |
|
Эстрадиол |
Эритромицин |
Снижение на 10% клиренса основного метаболита препарата, этилэстридиола |
Примечание: название препарата взято в скобки, если эффект при совместном применении препаратов слабо выражен.
По причине опасного взаимодействия использование совместно антибиотиков-макролидов с теофиллином, варфарином или карбамазепином может привести к увеличению побочных эффектов последних. По этой же причине циклоспорины не показаны к совместному назначению с эритромицином (и, возможно, с другими антибиотиками-макролидами). Аналогичным образом такие антигистаминные препараты как астемизол, терфенадин и прокинетики (например, цизаприд) противопоказаны к совместному назначению с эритромицином и кларитромицином, т.к. повышается вероятность развития тяжелых нарушений сердечного ритма.
В связи с тем, что антибиотики-макролиды, особенно, эритромицин способны подавлять рост Eubacterium lentum, в норме обитающей в толстом кишечнике и инактивирующей дикогсин, то повышается концентрация этого препарата и увеличивается риск развития токсических осложнений.
Не рекомендуется употреблять одновременно азитромицин с антацидными препаратами, ибо. это резко снижает его биодоступность, а одновременное назначение эритромицина и препаратов, повышающих кислотность желудка, уменьшает биодоступность эритромицина.
Хотя антибиотики-макролиды в целом являются относительно безопасными препаратами при их совместном назначении с препаратами других групп, но в связи с расширением показаний к их применению растет и число публикаций о нежелательных взаимодействиях макролидных антибиотиков с другими препаратами.
Другим примером может быть взаимодействие часто употребляемых в современной терапии нестероидных противовоспалительных средств с другими лекарственными препаратами и их последствия (табл. 28).
Таблица 28Взаимодействия некоторых лекарственных средств в организме
|
Взаимодействие с: |
Последствия |
Индометацин |
|
|
Антикоагулянты: |
Усиление антикоагуляционного действия |
| Салицилаты: Аспрокол Ацетилсалициловая кислота Кальципирин Натрий салицилат Салициламид |
Усиление возможности язвенной болезни, ослабление эффективности индометацина |
| Литий карбонат | Увеличение концентрации лития в крови - усиление токсичности |
| Галоперидол | Усиленные симптомы сонливости и усталости |
| Диуретические средства Гидрохлоротиазид Фуросемид |
Сниженное диуретическое гипотензивное действие |
| Средства, блокирующие бета -
адренорецепторы: Окспренолол пропранолол |
Снижение гипотензивного действия |
|
Пробенецид |
Торможение выделения индометацина |
|
Стероидные средства |
Усиление опасности возникновения язвенной болезни |
Ибупрофен Мефенамовая кислота |
|
| Антидиабетические средства Инсулин |
Усиленное гипогликемическое действие |
| Литий карбонат | Усиливает действие лития |
| Антикоагулянты: Аценокумарол дикумарол |
Усиленное антикоагуляционное действие |
| Салицилаты Аспрокол Ацетилсалициловая кислота Натрий салицилат Салициламид |
Усиление опасности возникновения язвенной болезни |
Пироксикам |
|
| Антикоагулянты:
Аценокумарол |
Усиленное антикоагуляционное действие |
| Бета - адренолитики: Пропранолол |
Снижение гипотензивного действия |
| Психотропные средства: Лития карбонат |
Увеличение уровня лития в сыворотке крови |
Напроксен |
|
| Лития карбонат | Увеличение уровня лития в сыворотке крови |
| Салицилаты | Снижение концентрации напроксена в сыворотке крови |
| Пробенецид | Увеличение концентрации. |
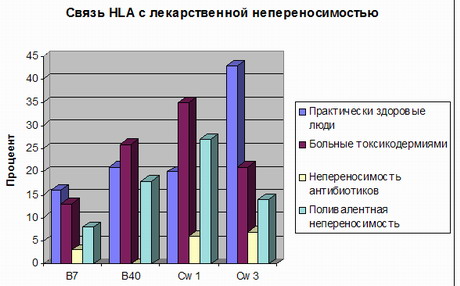
В патогенезе медикаментозных осложнений важную роль играет лекарственная аллергия. Аллергические болезни – во многом удел цивилизации. Уровень распространения аллергозов растет пропорционально экономическому развитию страны, так как с научно-техническим прогрессом растет количество аллергенов. Согласно данным ВОЗ аллергические заболевания входят в число 3-6 ведущих болезней, а такие из них, как анафилактический шок, острый отек гортани, бронхиальная астма нередко являются причиной смерти. От 0,5 до 20% населения различных регионов страдает аллергическим ринитом, а контактный и атопический дерматит встречается у 10% детей (Dessi P. et al. 1988). Разноречивы данные о распространенности пищевой аллергии – от 0,5 до 50% в популяции. А аллергический фон – высокий риск развития лекарственной аллергии.
Аллергия – это измененная форма иммунного ответа, которая проявляется в развитии специфической повышенной чувствительности организма к чужеродным веществам различного состава и происхождения (аллергены) в результате предшествующего контакта с этим веществом. Формированию аллергии способствуют: химизация быта, промышленности, сельского хозяйства; лекарственные средства; большие масштабы иммунопрофилактики; повышение потребления животного белка. Аллергенами могут выступить химические вещества любой природы, которые при попадании в организм вызывают сенсибилизацию к ним. Их подразделяют на экзоаллергены и эндоаллергены. В свою очередь экзоаллергены делятся в зависимости от механизма проникновения в организм на контактные (через кожу), ингаляторные (через дыхательный тракт), алиментарные (через желудочно-кишечный тракт), парентеральные (через кровь). По происхождению экзоаллергены подразделяют на бытовые (пыль, особенно хлопковая), эпидермальные (эпителий, пух, шерсть, перхоть), пыльцевые (пыльца), химические вещества (их более 100 000, такие как лаки, краски, дубильные вещества, растворители, косметика), лекарственные аллергены (антибиотики, сульфаниламидные препараты, вакцины, анальгетики и другие), пищевые (яичный белок, рыба, лактоглобулин, ягоды и фрукты с оранжевым пигментом), бактериальные аллергены, которыми являются микроорганизмы и их части.
Эндоаллергены возникают в организме под действием повреждающих факторов (например, образование комплекса из клеток собственной ткани с чужеродным веществом не антигенной природы).
Иммунный ответ на аллерген – аллергическая реакция, имеет фазовое течение. Первая стадия – сенсибилизации, т.е. переход от нормальной реактивности к повышенной к какому-либо веществу. Она длится от момента первичного попадания аллергена в организм до формирования иммунной реакции на этот аллерген. Формируется сенсибилизация около 2-х недель, но, сформировавшись может сохраняться месяцы, годы и даже всю жизнь. Сенсибилизация бывает активной, когда сам организм вырабатывает механизмы аллергии и пассивной, формирующейся при переливании крови от сенсибилизированных лиц к несенсибилизированным.
Формирование, длительность сохранения сенсибилизации зависят от пути проникновения аллергена (чаще парентерально или ингаляторно), дозы (чаще на небольшие или сверхбольшие количества - сенсибилизирующая доза), природы аллергена (к некоторым аллергенам абсолютная чувствительность), длительности воздействия, от состояния иммунологической реактивности. Следующая стадия аллергической реакции – разрешения. Она возникает в основном на повторное попадание аллергена или иногда на тот аллерген, который сохраняется в организме более 2-х недель. Это стадия клинических проявлений в одних случаях развивается быстро, от нескольких секунд до 6-и часов (гиперчувствительность немедленного типа – ГНТ), или медленно, в течение 24-48 часов (гиперчувствительность замедленного типа – ГЗТ). Заключительная стадия — десенсибилизации, характеризует возврат к нормальной реактивности. Она может происходить спонтанно и наступает сама по себе после устранения действия аллергена или искусственно, после курса введения аллергена в микродозах.
Условием развития лекарственной аллергии являются контакт с лекарственными средствами (сенсибилизация к лекарственным препаратам часто встречается у медицинских работников и работников аптек), а также длительное и частое применение медикаментов (постоянный прием менее опасен, чем интермиттирующий) и полипрагмазия. Частоту лекарственной аллергии повышают наследственная отягощенность, грибковые заболевания кожи, аллергические заболевания, в частности, поллиноз, бронхиальная астма, наличие пищевой аллергии.
Такие препараты, как вакцины, сыворотки, чужеродные иммуноглобулины, декстраны, т.е. вещества белковой природы, являются полноценными антигенами и вызывают в организме образование антител, а затем вступают с ними в реакцию. Но большая часть лекарственных препаратов являются гаптенами - веществами, приобретающими антигенные свойства только после соединения с белками сыворотки крови или тканей, в результате чего появляются антитела, составляющие основу лекарственной аллергии
и при повторном поступлении антигена образуется комплексы антиген-антитело, запускающий каскад реакций.
Аллергическую реакцию могут вызвать любые препараты, в том числе антиаллергические средства и глюкокортикоиды [Белозеров Е.С., 1989]. Способность низкомолекулярных веществ вызывать аллергические реакции зависит от их химического строения и пути введения лекарственного препарата. Вероятность развития аллергических реакций при приеме внутрь лекарственных веществ ниже, риск повышается при внутримышечном введении и является максимальным при внутривенном введении препаратов, он наибольший при внутрикожном введении препаратов. Использование депо-препаратов (инсулина, бициллина) чаще приводит к сенсибилизации. Важную роль играет наследственно обусловленная "атопическая предрасположенность" человека [Горячкина Л.А. и соавт., 1998].
Гиперчувствительность немедленного типа подразделяется на три варианта, в их основе лежит гуморальный иммунный ответ.
I тип – медиаторный, или анафилактический, развивается на экзогенные Т- зависимые антигены. Аллергенами при нем выступают лекарственные, пыльцевые пищевые и бактериальные антигены, проникающие в организм парентеральным, ингаляционным, алиментарным путями. В процессе сенсибилизации на аллерген вырабатываются антитела класса Ig Е, концентрация в крови которых повышается в 20-40 раз. С кровью они заносятся в шоковый орган, а именно, в тот, в который поступил аллерген (эпителий, слизистые, эндотелий, гладкие миоциты), где IgЕ присоединяются к базофилам и тучным клеткам. Это ведет к повышению реактивности шоковой ткани. В случае повторного попадания аллергена наступает стадия разрешения, имеющая фазовое течение:
1-я фаза – иммунологическая, в период которой аллерген соединяется с IgЕ, фиксированном на базофилах и тучных клетках, в результате чего изменяются свойства клеточной мембраны;
2-я фаза – биохимическая, когда происходит дегрануляция тучных клеток и базофилов с выделением большого количества биогенных аминов и медиаторов - серотонин, гистамин, ацетилхолин, кинин, тромбоксан;
3-я фаза - патофизиологическая, проявляющаяся действием медиаторов на эндотелий, миоциты, нервные клетки.
ГНТ анафилактического типа клинически протекает в виде анафилаксии или атопии. Анафилаксия развивается чаще на лекарственные препараты, укусы пчел и характеризуется резким снижением артериального давления, симптомами удушья, судорогами, потерей сознания при анафилотоксическом шоке. В случае местной анафилаксии развиваются те же симптомы, но протекающие по медленному варианту.
Атопия чаще развивается при наследственной предрасположенности, она характерна только для человека. Клиническими вариантами атопии являются: а) бронхиальная астма, б) крапивница (шоковый орган - эпителий кожи и эндотелий сосудов – зуд, повышение температуры), сенная лихорадка (аллергический ринит), чаще развивающаяся на пыльцевые аллергены (поллинозы), для атопии шоковым органом являются эндотелий сосудов носа, гортани, глотки; г) отек Квинке, при котором шоковый орган – подкожная жировая клетчатка, губы, твердая мозговая оболочка; д) детская экзема, развивается она на пищевые продукты.
2 тип – цитотоксический, он развивается на простые химические вещества, компоненты клеточной мембраны, неклеточные структуры. Шоковыми клетками при цитотоксической ГНТ чаще всего являются клетки крови, эндотелий сосудов, гепатоциты, эпителий почек. В результате прикрепления аллергена к этим клеткам поверхность последних становится антигенно-чужеродной, как следствие – развивается гуморальный иммунный ответ, синтезируются IgG, клетки разрушаются. Поэтому этот тип ГНТ получил название антителозависимой цитотоксичности. Клинически проявляется в зависимости от шокового органа. Цитотоксический тип реакции нередко лежит в основе развития лейкопении, тромбоцитопении, гемолитической анемии (аутоиммунная гемолитическая анемия может развиваться при лечении метилдофа). Данный механизм включается при переливании крови в виде аллергических гемотрансфузионных реакций. К подобному типу реакций относят образование антинуклеарных антител с развитием синдрома красной волчанки, гемолитической анемии, лейкопении, тромбоцитопении, гломерулонефрита, поражения печени и сердца при введении гидралазина и прокаинамида.
3 тип – иммунокомплексный, он развивается на большие дозы аллергена при условии недостаточности фагоцитарной активности. При первом попадании аллергена на него вырабатываются IgG и IgA, при повторном происходит взаимодействие аллергена с иммуноглобулинами с образованием циркулирующих иммунных комплексов. Иммунные комплексы адсорбируются эндотелием, превращаясь в фиксированные иммунные комплексы, происходит активация комплемента, образуются фракции C3a, C4a, C5a, которые повышают проницаемость сосудов и являются хемотаксинами для нейтрофилов. Вокруг сосудов образуется очаг воспаления – системный васкулит. При разрушении нейтрофилов выделяются протеазы, которые разрушают сосуды и ткани. Формируются болезни иммунных комплексов:
– “сывороточная болезнь”, для которой характерны отек кожи, подкожной жировой клетчатки, слизистых, повышение температуры тела, сыпь, поражение коллагеновых волокон, поражения суставов;
– феномен Артюса развивается при многократном локальном введении разрешающей дозы антигена, поэтому шоковым органом является место введения; образующиеся антитела формируют иммунные комплексы, последние оседают на эндотелии сосудов, идет активация системы комплемента, повреждается сосуд, развивается ишемия тканей, затем некроз и в итоге развивается стерильный абсцесс;
– гломерулонефрит развивается, если иммунные комплексы не могут отфильтроваться в почечном фильтре, осаждаются на эпителии почечных канальцев;
– ревматоидный артрит;
– системная красная волчанка;
– тиреоидит Хашимото;
– гепатит.
Иммунокомплексный тип аллергии возникает при условии недостаточной элиминации иммунных комплексов в силу превышения скорости образования над скоростью элиминации, образования неэлиминирующихся иммунных комплексов, дефицита системы комплемента, дефицита фагоцитарной системы.
Гиперчувствительность замедленного типа (ГЗТ) представляет собой четвертый тип аллергии, в основе ее лежит клеточный иммунный ответ. ГЗТ чаще развивается на простые химические вещества гаптенной природы, микробные аллергены при хронических процессах, лекарственные аллергены, собственные измененные клетки.
Развитие ГЗТ носит фазовый характер. В первую фазу – сенсибилизации образуется много Т-эффекторов и Т-киллеров. Вторая фаза – разрешения наступает через 24-48 часов. В иммунологическую фазу сенсибилизированные Т- лимфоциты распознают антигены. В биохимическую фазу происходит синтез лимфокинов Т-эффекторами и активация клеток. Среди лимфокинов первостепенную роль играют хемотаксический фактор (привлекает лейкоциты, фибробласты), фактор торможения миграции, фактор проницаемости, фактор активации макрофагов, фактор пролиферации В патофизиологическую фазу развивается воспалительная реакция.
Различают несколько вариантов ГЗТ:
– контактная аллергия, развивается на простые химические вещества, так называемые гаптены. Последние проникают в кожу, соединяются с кератином и превращаются в полноценные антигены, на них образуются Т-эффекторы. В случае повторного поступления в организм аллергена в результате действия Т-эффекторов развивается периваскулярная мононуклеарная инфильтрация кожи и фокальная инфильтрация эпидермиса. В результате образуются фолликулы и везикулы.
– инфекционная аллергия, при которой образуется гранулема, в центре ее находится микроорганизм, а вокруг – вал лейкоцитов и В-лимфоцитарная инфильтрация. На периферии гранулемы расположены фибробласты, продуцирующие коллагеновые волокна. Гранулема выполняет защитную функцию, ограничивая генерализацию инфекции. Но микроорганизмы в гранулеме защищены от действия факторов клеточного и гуморального иммунитета и поэтому могут долго сохранять свою жизнеспособность. Если гранулема распадаеться, а микроорганизм еще жизнеспособен, может возникать рецидив заболевания. При благоприятном исходе гранулемы могут обызвествляться.
В реакции ГЗТ помимо лимфокинов, повреждающее действие оказывают лизосомальные ферменты и кинины. Гистамин, по всей видимости, не играет большой роли в ходе этого типа аллергической реакции, поскольку антигистаминные препараты при этом малоэффективны.
В виде реакции замедленного типа, или клеточно-опосредованные реакции формируются контактный аллергический дерматит и другие неуртикарные кожные реакции. Как полагают, этот иммунологический механизм лежит в основе синдромов Лайелла и Стивенса-Джонсона [Roujeau J. C. et al., 1995].
Один и тот же лекарственный препарат может вызвать различные варианты лекарственной аллергии. Так, при назначении пенициллина могут развиваться реакции всех вышеперечисленных типов: I тип – анафилактический шок или крапивница; II тип – гемолитическая анемия; III тип – сывороточная болезнь; IV тип – контактный дерматит после местного применения.
Причины разных эффектов при назначении одних и тех же препаратов у разных лиц неизвестны. Скорее всего, важную роль играют генетические особенности организма.
Аллергические реакции на лекарственные вещества различаются не только по механизму формирования, но и по скорости развития. А.Д.Адо (1963) подразделяет аллергические реакции, вызываемые различными лекарствами, по скорости их развития на три группы.
Первую группу составляют реакции, вызывающие иногда мгновенно или в течение первого часа после попадания лекарства в организм:
– анафилактический шок,
– острая крапивница,
– отек Квинке,
– бронхоспазм,
– острая гемолитическая анемия.
Ко второй группе относятся аллергические реакции подострого типа, развивающиеся в течение первых суток после введения лекарства:
– агранулоцитоз,
– тромбоцитопения,
– макуло-папулезная экзантема,
– лихорадка.
Третью группу составляют реакции затяжного типа, развивающиеся в течение нескольких суток, недели после введения лекарства:
– сывороточная болезнь,
– аллергические васкулит и пурпура,
– артралгии и полиартриты,
– лимфаденопатии,
– поражения внутренних органов (аллергические, гепатит, нефрит, миокардит и др.).
В настоящее время около 40 % населения развитых стран имеют скрытую или явную аллергию, а заболевания, обусловленные гиперчувствительностью немедленного типа выявляются примерно у 15 % взрослого населения.
Большинство лекарственных препаратов не относятся к истинным аллергенам. Чаще лекарственные вещества – это гаптены, т.е. молекулы, способные становиться истинными антигенами лишь после прочного соединения с собственными белками организма. Гаптенами являются не только сами лекарственные вещества, но и продукты их расщепления в организме, особенно возникающие в результате разрыва молекулярных цепей, размыкания циклов и окислительных реакций.
Для образования полноценного антигена существенно наличие у лекарственного препарата амино-, нитро-, азо- и карбаминогрупп, способных взаимодействовать с карбоксильными, сульфгидрильными радикалами белков, для вторых – присутствие аминогрупп и остатков имидазола, реагирующих с гидроксиламиновыми, карбоксильными, гидроксильными и хиноновыми группировками гаптенов. Так как к образованию конъюгатов особенно способны белки, находящиеся в зоне воспаления, многие лекарства вызывают аллергию в случае внесения их в воспалительные участки кожи.
В результате воздействия полных антигенов с компонентами иммунной системы формируется иммунный ответ с образованием или антител (гуморальный ответ, ГНТ), или лимфоцитов-эффекторов (клеточный ответ, Г3Т).
Степень аллергенности лекарственного препарата оценивают так называемым индексом сенсибилизации, представляющим собой частоту аллергических реакций в процентах. Колеблется индекс сенсибилизации в пределах от 1 до 100 %. Например, для пенициллина он составляет 1-3 %, для антипирина – 8-10%, для стрептомицина – 4-9 %. Фениэтилгидантоин вызывает аллергию почти всегда (индекс сенсибилизации 80-90%) развитие сенсибилизации.
Формируется сенсибилизация чаще при использовании больших доз препарата, она выше, если препарат наносится на инфицированную кожу. Частота формирования сенсибилизации зависит и от способа введения лекарственного вещества. К примеру, при внутримышечном введении пенициллина частота аллергических реакций составляет 1–2 %, при аппликации – 5–12 %, при ингаляциях – 15 %. Наименее опасно введение препарата через рот. Сравнительно чаще аллергизация организма происходит при лечении с интервалами, а также при использовании препаратов пролонгированного действия. Увеличивают степень сенсибилизации лекарства различного рода добавки к препаратам, например, эмульгаторы, растворители.
В некоторых случаях не сам лекарственный препарат, а его метаболиты (например, бензилпенициллоил) отличаются повышенной иммуногенностью, вызывая сенсибилизацию организма, образование антител. Эти антитела образуют иммунный комплекс антиген — антитело. Экспериментальные исследования в большинстве своем свидетельствуют о том, что в плазме крови происходит реакция антител со свободными медикаментами. Образовавшийся иммунный комплекс оседает на поверхности клетки, а присоединение комплемента приводит к ее лизису.
Хотя локализация проявлений аллергической реакции может быть различной, все же чаще она возникает на территории, через которую вводится аллерген в тех органах и тканях, чьи клетки имеют биохимическое сродство к аллергену, и на территориях, где происходит накопление аллергена. Нередко она развивается поочередно на разных органных территориях, поражаются органы, наиболее уязвимые у данного больного.
Сформировавшаяся сенсибилизация к определенному лекарственному препарату не относится к явлениям стабильным и пожизненным. Со временем она может исчезнуть. Например, через 2-3 месяца после аллергической реакции на пенициллин, кожный тест был положителен в 90 % случаев, а через 5 лет – только в 11 %. В то же время возможно пожизненное сохранение сенсибилизации, что диктует в каждом конкретном случае принимать все необходимые меры предосторожности.
Иммунологическое реагирование организма не всегда совпадает с клиническим проявлением аллергии. Сенсибилизация может не проявляться клинически всю жизнь, если не произойдет повторного контакта с антигеном. В настоящее время невозможно полностью охарактеризовать состояние и степень сенсибилизации организма. Чаще о последней судят по наличию свободно циркулирующих в сыворотке крови или фиксированных в клетках антител.
Аллергические реакции на лекарственные средства клинически проявляются в зависимости от механизма развития. Так, I тип реакций, опосредованный lgE антителами, может проявляться в виде немедленных (в пределах от нескольких секунд до 1 часа после введения препарата) или ускоренных реакций - развивающихся в течение 1-72 часов после введения лекарства. ГНТ немедленного типа включают анафилактический шок, аллергическую бронхиальную астму, ангионевротический отек Квинке. Ускоренные реакции лежат в основе развития крапивницы, лекарственной лихорадки, ларингоспазма и гипотензии.
II тип реакций опосредован преимущественно цитотоксическими lgG и lgM антителами и приводит к развитию гематологических реакций, таких, как гемолитическая анемия, агранулоцитоз и лейкопения.
При Ill типе реакций идет формирование иммунных комплексов, состоящих из лекарства и lgG или lgM антител. Эти реакции включают сывороточную болезнь, лекарственную лихорадку, острый интерстициальный нефрит, аллергический васкулит, феномен Артюса.
IV тип реакций опосредован Т-лимфоцитами, является замедленным или поздним и развивается через 48 или более часов после введения препарата. Замедленные гиперчувствительные реакции на лекарства в основном проявляются дерматопатологией.
Среди выделяемых типов аллергических реакций в силу быстротечности особо опасны анафилактические, клиническими эквивалентами которых являются анафилактический шок, аллергический ринит, крапивница, аллергическая бронхиальная астма.
У госпитализированных больных по данным статистики в 15-30% случаев развиваются побочные реакции на лекарства [Wahn U. et al., 1997; Lazarou J. et al., 1998]. По данным Центра по изучению побочного действия лекарственных веществ 70% всех побочных реакций на медикаменты являются аллергическими, и смертность от них достигает 0,005 %. У детей треть (34,1 %) аллергозов составляет лекарственная аллергия. До половины случаев развития крапивницы и отека Квинке связаны с лекарственной аллергией [Paravina M. et al. 1987]. Особенно подвержены лекарственной аллергии медицинские работники, среди которых С. В. Федорович, В. М. Бобер (1990) ее выявили в 59,3 % .
Риск развития аллергических реакций для большинства медицинских препаратов составляет от 1 до 3 % [De Swarte R.D., 1993; Cohen J.S., 1999]. Среди всех побочных эффектов аллергические и другие иммунологические реакции составляют 6-10 %. Летальные исходы встречаются в 1 из 10.000 аллергических реакций. Лекарства служат причиной смерти у 0,01 % хирургических и у 0,1 % терапевтических стационарных больных [Bush W.H. et al., 1995].
Заимствованная из Интернет таблица 29 демонстрирует часто употребляемые лекарственные препараты. которые могут вызывать клинику анафилактического и анафилактоидного шока и их основные механизмы.
Таблица 29
Лекарственные средства, несущие угрозу анафилактической и анафилактоидной реакции и их наиболее вероятные механизмы
|
Механизм |
Препарат |
|
Ig-E-опосредованный |
антибиотики пенициллинового ряда |
|
цефалоспорины |
|
|
альбумин |
|
|
адъюванты к лекарственным веществам (парабены, сульфиты) |
|
|
бензодиазепины |
|
|
сукцинилхолин |
|
|
химопапаин |
|
|
Активация системы комплемента |
рентгенконтрастные вещества |
|
декстраны |
|
|
протамин |
|
|
перфторкарбоны |
|
|
пропанидид |
|
|
альтезин |
|
|
Гистаминолибераторный эффект |
декстраны |
|
рентгенконтрастные вещества |
|
|
альбумин |
|
|
маннитол и другие гиперосмолярные вещества |
|
|
морфий |
|
|
меперидин |
|
|
полимиксин В |
|
|
тиопентал-натрия |
|
|
протамин |
|
|
тубокурарин |
|
|
метокурин |
|
|
атракурий |
|
|
Иные механизмы |
протеиновые фракции плазмы |
|
нестероидные противовоспалительные средства |
Анафилактическая и анафилактоидная реакции чаще развиваются при назначении антибиотиков, местных анестетиков, рентгенконтрастных веществ [ Leape L.L. et al., 1999]. Анафилаксия при использовании антибиотиков опосредуется IgE. Среди антибиотиков по частоте развития аллергии занимает пенициллин. Антитела к пенициллину при контакте с ним формируются у каждого человека. Причем она выявляется не только у тех, кто применял антибиотик, сенсибилизация может развиться при употреблении молока от коров с маститом, для лечения которого применялся антибиотик; при контакте с фрагментами пенициллина, содержащимися в воздухе стационара [Limauro D.L., 1996; . Bottiger L.E., Westerholm B. , 1997]. Частота регистрации аллергии к пенициллину колеблется от 0,7 до 10 %, но, анафилактический шок при использовании препарата встречается редко – в 0,002% случаев [Gait J.E. , 1990; . Garcia Rodrigues L.A.,1996].
Тяжелые аллергические реакции развиваются на большинство b-лактамных антибиотиков (пенициллины, цефалоспорины), при этом возможно формирование перекрестной гиперчувствительности [Pleasants R.A. et al., 1994]. Так, у 2–8% больных с аллергией на пенициллин может наблюдаться перекрестная гиперчувствительность к цефалоспоринам [White T.J. ,1999]. А.В. Мурзич и соавт. (1998) приводят сводную таблицу лекарственных препаратов, в том числе и антибиотиков, дающих перекрестные аллергические реакции (табл.30)
Таблица 30
Лекарственные вещества, дающие перекрестные аллергические реакции
|
Препарат |
Препараты, дающие перекрестные реакции |
|
Пенициллин |
Все природные, синтетические, полусинтетические пенициллины, цефалоспорины, монобактамы |
|
Левомицетин |
Синтомицин |
|
Стрептомицин |
Гентамицин, мономицин, неомицин, канамицин и др. аминогликозиды |
|
Тетрациклин |
Доксициклин, рондомицин, вибрамицин, олететрин, тетраолеан, оксициклозоль и др. тетрациклины |
|
Эритромицин |
Сумамед, макропен, рулид, тетраолеан и др. макролиды |
|
Полижинакс |
Гарамицин, пимафукорт. гентамицин, флуцинар N и др. аминогликозиды |
|
5-НОК |
Квинтер, ципробай, нормакс, спектрама, таривид, невиграмон |
|
Клотримазол |
Леварин, микозолон, низорал, дифлюкан, метронидазол |
|
Метронидазол |
Трихопол, тинидазол, клотримазол, миконазол, низорал, нафтизин |
|
Аспирин |
Цитрамон, амидопирин, анальгин, антипирин, бутадион, реопирин, баралгин, индометацин, капсин |
|
Сульфаниламиды |
Сульфадимезин, бисептол, бактрим, альмагель А, солутан, гипотиазид, фуросемид, триампур, букарбон, манинил, глипизид, новокаинамид, новокаин, анестезин |
|
Пипольфен |
Аминазин, дипразин, терален, нонахлозин, этмозин, метиленовый синий |
|
Бабитал |
Теофедрин, пенталгин, антастман, корвалол. беллатаминал, пульснорма, пирантел |
|
Йод |
Солутан, энтеросептол, раствор Люголя, кардиотраст |
|
Эуфиллин |
Супрастин, аминофиллин, этамбутол |
|
Стугерон |
Циннаризин |
|
Витамин В |
Кокарбоксилаза, комплексные витаминные препараты (ревит и др.) |
|
Резерпин |
Адельфан, раунатин. кристепин, депрессии |
|
Димедрол |
Тавегил, орфенадин |
На рентгенконтрастных веществ реакция формируется не IgЕ-опосредованными механизмами, она связана, во-первых, с непосредственной активацией комплемента альтернативным механизмом; во-вторых, с гистаминолибераторным эффектом препаратов.
Местные анестетики по химической структуре представлены эфирами и амидами. Эфирные производные (новокаин, дикаин) в основном и дают аллергические реакции, в то время как амидные производные (лидокаин тримекаин, прилокаин, мепивакаин, бупивакаин) – редко [Limauro D.L. et al., 1997]. Способность эфирных производных к аллергии связывают с обладающей выраженными аллергизирующими свойствами парааминобензойной кислотой, производными которой они являются. Внутрикожное введение эфирных производных сопровождается положительными кожными реакциями в 30 %. В клинической практике частота развития аллергических реакций при использовании местных анастетиков составляет всего 1 % и менее от суммарной частоты возникновения побочных реакций на них, а 99 % приходится на токсические реакции, развивающиеся в результате быстрой абсорбции из места введения и повышением их концентрации в крови до токсической.
Таким образом, иммунные реакции, сопровождающиеся повреждением собственных тканей организма, называют аллергическими. Среди аллергенов не последнее место занимают лекарственные средства – лекарственная аллергия, или, как классифицируют некоторые клиницисты – лекарственная болезнь. Практически любое лекарство может вызвать один из 4-х типов реакций или комбинацию их.
Выделены факторы риска развития лекарственной аллергии. Больные атопическими заболеваниями, в частности бронхиальной астмой, более склонны к лекарственной аллергии, чем здоровые люди. У детей лекарственная аллергия встречается реже, чем у взрослых. Аллергические поражения кожи на 35 % чаще бывают у женщин, чем у мужчин. У женщин риск развития анафилактоидных реакций на рентгеноконтрастные средства почти в 20 раз больше, чем у мужчин. Прослеживается четкая зависимость развития аллергии как таковой от аллергоанамнеза родителей (табл.31). Половина детей, чьи родители имели аллергию, также страдают аллергическими заболеваниями против 19 % болеющих детей, родившихся от здоровых родителей. У детей с лекарственной аллергией наследственная отягощенность аллергическими заболеваниями встречается в 60-66 %. Поэтому у детей, чьи родители имеют в анамнезе аллергические реакции на антибиотики, в 15 раз чаще развивается аллергия на антибиотики, чем у детей без такой хронологии [Wahn U. et al., 1997; Chandra R.K., 1997].
Предрасполагающими факторами к лекарственной аллергии, являются также переходный возраст, беременность, менструации, климакс, воздействие солнечной радиации, а также различного рода эмоциональные стрессы.
В развитии и течении медикаментозных осложнений, связанных с аллергическими реакциями, играют роль много других факторов. Наибольшее значение в патогенезе медикаментозных осложнений придается измененным формам иммунного ответа организма на воздействие самого лекарства или на возникающие под его влиянием аутоантигены тканей. Многие лекарственные средства способны вызывать иммунодепрессивное состояние. Так, длительное применение кортикостероидных гормонов ведет к лимфопении и угнетению клеточного иммунитета, а иммунодепрессанты (азатиоприн, циклофосфамид и др.) угнетают как антителообразование, так и клеточный иммунитет.
Некоторые иммунодепрессанты (6-меркаптопурин) приводят к развитию специфической иммунологической ареактивности. Другие же препараты (циклофосфамид), напротив, могут обусловить срыв естественной толерантности.
Таблица 31
Риск развития аллергии в зависимости от аллергического анамнеза родителей
| Аллергоанамнез родителей |
Риск развития аллергии у детей |
| Страдают оба родителя | 1 : 2 |
| Страдает один из родителей | 1 : 4 |
| Не страдают оба родителя | 1 : 8 |
Утраченная способность Т-супрессорной активности лимфоцитов на собственные антигены организма приводит к развитию аутоиммунных (клеточных и гуморальных) реакций.
Учитывая недостаточно изученную роль иммуногенетического фактора в формировании лекарственной аллергии, нами проведено исследование [Белозеров Е.С., Тушакова А.А.,1992] взаимосвязи определенных видов лекарственной непереносимости с системой HLA (рис. 2). При этом установлено, что если в популяции лекарственная непереносимость встречается в 8,6 %, то у лиц с инфекционным синдромом иммунологической недостаточности в 19,3 %.

Рис. 2
Среди HLA-антигенов положительно ассоциируют с лекарственной непереносимостью HLA-B40, Cw1 а гаплотипами – А 2В40, А3В40. Наоборот, маркерами резистентности к развитию лекарственной непереносимости являются антигены HLA – A11, A28, B15. У лиц с фенотипом HLA – Cw3, гаплотипом А2В17 увеличивается риск аллергии на антибиотики, а наличие HLA-D7, гаплотипа А9В7 в фенотипе ассоциирует с развитием поливалентной лекарственной непереносимости.
Установлено, что вещества, освобождающиеся при распаде клеток различных тканей, могут также обладать антигенными свойствами. На них вырабатываются специфические антитела, т. е. аутоантитела; аллергический процесс приобретает черты аутоиммунного, он может протекать по типу цепной реакции без дальнейшего участия внешнего фактора. Так, увеличению частоты медикаментозных осложнений при вирусных заболеваниях способствует тот фактор, что часто под действием вируса происходят структурные изменения тканей и органов. Собственные антигены организма в этих условиях приобретают аутоантигенные свойства, обусловливают аутосенсибилизацию, нарушение иммунологического статуса организма, в силу чего растет частота медикаментозных осложнений аллергического характера. Наши исследования (Белозеров Е.С., 1981) показали, что у больных острым и хроническим вирусным гепатитом, бруцеллезом довольно часто в сыворотке крови выявляются антитела к тканям печени, желчевыводящих путей и даже органам иммунокомпетентной системы.
Особенно часто аутоантитела выявляются в сыворотке крови больных тяжелой формой вирусного гепатита, причем к тканям печени они выявляются у всех больных, к тканям тимуса – у 22,2%
Проведенный нами анализ [Белозеров Е.С., Тушакова А.А., 1992] показал отчетливое влияние перенесенных заболеваний (вирусный гепатит, инфекции желудочно-кишечного тракта, гельминтозы) на частоту формирования лекарственной непереносимости (рис. 3).
Формирование иммуносупрессии, донозологических форм иммунных нарушений – синдромов иммунологической недостаточности, в том числе аллергического особенно выражено в зонах высокого экологического стресса. Нами совместно с Ж.О.Абылкасымовой (1992) изучен характер аллергопатологии, потребовавшей вызова скорой помощи в г.Семипалатинске, где 40-летнее использование прилегающей к городу территории как испытательный ядерный полигон обусловило формирование своеобразной техногенной биогеохимической провинции с четко выраженным дозозависимым развитием синдромов иммунологической недостаточности, в том числе аллергического [Белозеров, Е.С., Джасыбаева Т.С.,1993]. Как показали исследования у взрослых в 95,9 % неотложные состояния из группы аллергопатологии приходится на бронхиальную астму, крапивницу и отек Квинке, а у детей в 91,2 % на крапивницу, отек Квинке и поствакцинальный синдром. Было установлено, что формированию аллергических заболеваний способствовали нарушения в иммунном статусе, сопутствующие хронические заболевания и особенно гельминтозы.
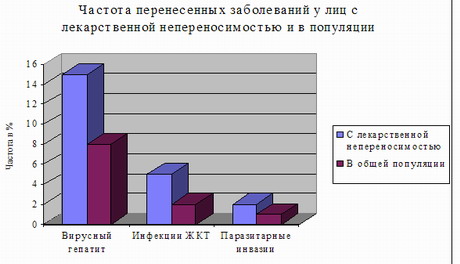
Рис. 3
Нами [Белозеров, Е.С., Абылкасымова Ж.О.,1992] также проведен анализ структуры аллергических заболеваний в г. Семипалатинске. Общая структура обращаемости больных этой группы за скорой медицинской помощью представлена такими клиническими вариантами, как крапивница (41,9 %), бронхиальная астма (35, 3 %), отек Квинке (13,8 %), гипертермический синдром (5 %), атопический и аллергический дерматит (2, 8%), анафилактический шок (0,7 %). Изучение встречаемости аллергопатологии в зависимости от возраста и пола при обследовании 2315 больных выявило преобладание лекарственной аллергии в возрасте старше 20 лет: на долю женщин этой возрастной группы приходится 78,5 %, а мужчин – 61,8 % от всех видов аллергопатологии. Встречаемость пищевой аллергии с возрастом уменьшается, гипертермический синдром в основном наблюдается у детей первых 7 лет жизни, крапивница несколько чаще встречается у детей раннего возраста, а частота анафилактического шока растет с возрастом. При анализе выявлена взаимосвязь вида аллергопатологии с профессиональными вредностями в анамнезе больных.
Исследования выявили формирование в стационарах города Семипалатинска клинически выраженных форм лекарственной аллергии в 5,3-6,5 % в зависимости от вида стационара и лекарственной нагрузки в нем. Эпизоды лекарственной аллергии отмечают в своей жизни 43% населения города.
Среди лекарственных средств чаще всего аллергия была обусловлена антибиотиками, реже - другими препаратами (рис. 4).
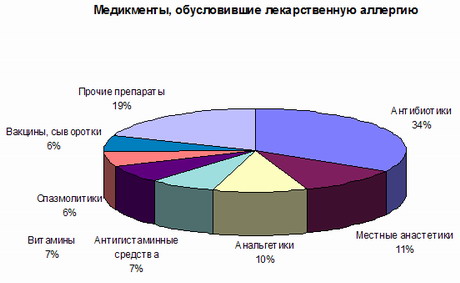
Рис. 4
Чаще всего лекарственная аллергия развивается в случаях приема лекарств внутрь (рис.13), что, очевидно, связано с удельным весом этого пути поступления лекарств в организм. Было также установлено, что неотложные состояния, связанные с лекарственной непереносимостью и потребовавшие вызова скорой медицинской помощи, чаще развиваются вечером и реже – ночью.
Как показали наши исследования (табл. 32) у взрослых в 95,9 % неотложные состояния из группы аллергопатологии приходятся на бронхиальную астму, крапивницу и отек Квинке, а у детей в 91,2 % на крапивницу, отек Квинке и поствакцинальный синдром.
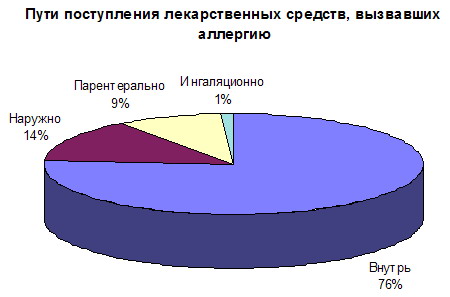
Рис.5
Прослеживается определенная зависимость частоты лекарственной аллергии от возраста (рис. 6): среди всех больных с клиникой лекарственной аллергии почти половину составляют лица в возраксте 20-55 лет. Гипертермический синдром в основном наблюдается у детей первых 7 лет жизни, крапивница несколько чаще встречается у детей раннего возраста,
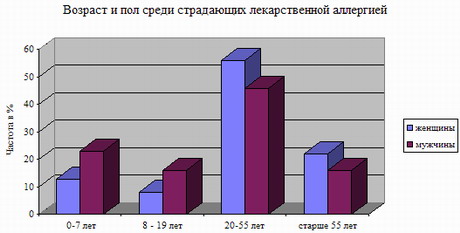
Рис. 6
а частота анафилактического шока растет с возрастом (рис.7). При анализе выявлена взаимосвязь вида аллергопатологии с профессиональными вредностями в анамнезе больных.
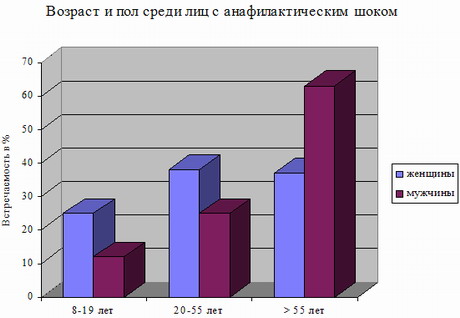
Рис. 7
Исходы лекарственной аллергии. В большинстве случаев (80 %) исходом лекарственной аллергии является выздоровление, т.е. полное исчезновение признаков непереносимости лекарственных препаратов, но в 12-13 % наблюдается переход в хроническое течение, наиболее часто в виде лекарственной бронхиальной астмы, рецидивирующего агранулоцитоза, хронического лекарственного гепатита, хронического интерстециального нефрита. После перенесенной
лекарственной аллергии остаточными явлениями могут быть миокардитический кардиосклероз, пневмосклероз, остеосклероз и др. Примерно в 6 % при развитии лекарственной аллергии больного спасти не удается, чаще всего непосредственной причиной смерти являются анафилактический шок, гипопластические анемии, агранулоцитоз, геморрагический энцефалит, миокардит, васкулиты.
Идиосинкразия - это генетически обусловленная патологическая реакция на определенный лекарственный препарат. Эта реакция характеризуется резко повышенной чувствительностью больного к соответствующему препарату с необычайно сильным и/или продолжительным эффектом. Идиосинкразия в своей основе имеет преимущественно наследственные дефекты ферментных систем. Встречается идиосинкразия реже, чем аллергия.
Примером идиосинкразии является реакция, возникающая при лечении сульфаниламидами или примахином больных с дефицитом глюкоза-6-фосфатдегидрогеназы (Г-6 ФДГ) – у больных развивается гемолитическая анемия.
Злокачественная гипертермия под влиянием наркотиков относится к этой же категории патологических реакций. У больных с дефицитом метгемоглобинредуктазы при лечении нитратами возникает метгемоглобинемия. К такому же эффекту приводит применение нитратов при наличии патологических гемоглобинов и фенацетина при уменьшении дезалкилирования этого препарата. Дефицит гипоксантин-гуанин-фосфорибоксил-трансферазы при лечении подагры аллопуринолом проявляется интенсивной почечной экскрецией пуринов, иногда с образованием камней.
А при усиленной барбитуратами индукции синтетазы e-аминолевулиновой кислоты развивается приступ печеночной порфирии. У детей раннего возраста лечение левомицетином может явиться причиной развития на 2-9-й день осложнения в виде синдрома Грэя, для которого характерны метеоризм, диарея, рвота, цианоз и в дальнейшем расстройства кровообращения, приводящие к смерти. Обусловлено это недостатком в организме глюкуронил-трансферазы и в связи с этим нарушением выделения левомицетина, что и вызывает интоксикацию им. Поэтому применение левомицетина у детей нежелательно.
К реакциям, связанным с биологическим действием лекарственных препаратов относятся возникновение лекарственно-устойчивых штаммов возбудителей, суперинфекция, дисбактериоз, реакция бактериолиза Яриша Герксгеймера, угнетение иммунных реакций, нарушения витаминного обмена.
Дисбактериоз – это качественное и количественное изменение микрофлоры желудочно-кишечного тракта под действием антимикробного препарата. Формируется дисбактериоз при пероральном применении многих антибиотиков, сульфаниламидов и нитрофуранов, особенно при их длительном введении. Нарушенное экологическое равновесие кишечной микрофлоры восстанавливается после прекращения лечения или даже в период его, однако, в редких случаях наблюдают стойкое качественное изменение микрофлоры, приводящее к нарушениям функции желудочно-кишечного тракта. Как следствие дисбактериоза, нарушается витаминный обмен, ибо угнетение нормальной микрофлоры желудочно-кишечного тракта ведет к снижению синтаза витаминов группы В.
Реакция бактериолиза Яриша – Герксгеймера (бактериолиз) характеризуется быстрым ухудшением клинического состояния больного или временной интенсификацией типичных для данной болезни тканевых поражений. Развиваются эти реакции, как правило, в начале лечения и во всех случаях полностью сохраняет специфические патоморфологические особенности соответствующей инфекции. Бактериорлиз обычно наблюдают при введении больших доз бактерицидных препаратов. Они обусловлены быстрым распадом микробов с освобождением значительного количества эндотоксинов. Последние образуют сальмонеллы, эшерихии, синегнойная палочка, протей, пастереллы и некоторые другие возбудители. Предотвратить развитие тяжелых реакций бактериолиза можно при правильном применении антибактериальных препаратов с обязательным использованием средств интенсивной патогенетической терапии.
Действие на иммунную систему. Антимикробнные препараты оказывают определенное влияние на различные стороны взаимоотношений макро- и микроорганизма. Они могут влиять на антигенную структуру возбудителей инфекций, на количество антигенного раздражения, на фагоцитоз, наконец, на органы иммунной системы. Под влиянием этиотропной терапии уменьшается иммунизирующая способность некоторых возбудителей инфекций за счет изменения их антигенной и иммуногенной структуры, но при действии высоких бактерицидных концентраций препаратов, вызывающих быстрою гибель бактерий, существенных изменений в их антигенном составе не обнаруживают. Влияние
антимикробных препаратов на фагоцитоз в значительной степени зависит от дозы и продолжительности применения, а также от свойств используемого лекарственного средства. В большинстве случаев антимикробные препараты, введенные в терапевтических дозах в течение обычно устанавливаемого курса лечения, не оказывает отрицательного влияния на фагоцитарную активность лейкоцитов, а иногда и повышает поглотительную и переваривающую активность фагоцитов, но эти же препараты, использованные в максимальных дозах, угнетают фагоцитоз. Аналогичным образом действуют антибактериальные агенты на функции клеток ретикулоэндотелиальной системы, лимфоидной ткани и других иммунокомпетентных органов.
Следовательно, влияние антимикробных препаратов на иммуногенез зависит от дозы, продолжительности применения и способа введения лекарственного вещества. Лекарственные препараты в терапевтических дозах, особенно при пероральном введении оказывают слабое иммунодепрессантное влияние, а нередко, особенно при коротких курсах и совсем не влияют. Однако, при употреблении антимикробных препаратов в завышенных дозах и в течение продолжительного времени резко угнетаются развитие гуморального иммунного ответа, активность фагоцитов, снижается антигенное раздражение. При правильном применении антибактериальных средств их неблагоприятное воздействие на иммунную систему организма может быть сведено к минимуму или полностью ликвидировано.
Другим видом лекарственных осложнений, возникающих при применении высокоактивных антибиотиков и других противомикробных средств, является изменение нормальной бактериальной флоры организма (табл.32), приводящее к суперинфекции. Развитие ее связано с тем обстоятельством, что действие антимикробных препаратов, введенных в организм, не ограничивается подавлением жизнедеятельности только патогенных возбудителей, а распространяется одновременно и на других, чувствительных к ним представителей разнообразной микрофлоры организма. Значительное уменьшение или даже полное исчезновение чувствительных бактерий в желудочно-кишечном тракте под влиянием антимикробных агентов не приводит, как правило, к изменению общего количества микроорганизмов, так как происходит лишь замена исчезнувших бактерий другими, устойчивыми к действию данного препарата. Эти устойчивые апатогенные или условно-патогенные микроорганизмы начинают усиленно размножаться и в определенных условиях могут стать причиной нового заболевания - суперинфекции, в группе суперинфекций различают экзогенные и эндогенные.
Причиной эндогенных суперинфекций могут служить стафилококки, кишечные палочки, протей, анаэробы, синегнойная палочка, патогенные грибы. Экзогенная суперинфекция может быть обусловлена вторичным инфицированием новым возбудителем или устойчивой микрофлорой того же вида, что и возбудитель первоначальной болезни. К этому типу суперинфекций относятся наиболее распространенные кандидозы, развивающиеся при усиленном размножении дрожжеподобных грибов рода Candida на слизистых оболочках и коже и редко - во внутренних органах, что наблюдается у людей с явлениями иммуносупрессии, получающих такие антимикробные препараты, как тетрациклины или комбинацию лекарственных средств.
При суперинфекции чаще всего поражаются легкие и кишечник. Длительная терапия антибиотиками хронических легочных заболеваний способствует возникновению стафилококковых инфекций. Глюкокортикоиды и иммунодепрессанты оказывают иммуносупрессивный эффект, в результате чего увеличивается риск развития инфекционных заболеваний. Длительное лечение иммунодепрессантами больных после трансплантации почек может осложниться цитомегаловирусной и грибковой инфекциями, приводящими к летальному исходу.
Таблица 32
Резидентная микрофлора организма человека
|
Участок тела |
Микроорганизм |
Встречаемость, % |
|
Кожа |
Staphylococcus epidermidis |
85-100 |
|
Staphylococcus aureus |
5-25 |
|
|
Propionibacterium acnes |
45-100 |
|
|
Аэробные коринебактерии (дифтероиды) |
55 |
|
|
Нос и носоглотка |
Staphylococcus epidermidis |
90 |
|
Staphylococcus aureus |
20-85 |
|
|
Аэробные коринебактерии (дифтероиды) |
5-80 |
|
|
Branhamella catarrhalis |
12 |
|
|
Haemophilus influenzae |
12 |
|
| Полость рта | Staphylococcus epidermidis |
75-100 |
| S.aureus |
Обычно |
|
| Streptococcus mitis и другие альфа-гемолитические стрептококки |
100 |
|
| S. salivarius |
100 |
|
| Peptostreptococci |
Обычно |
|
| Veillonella alca lescens |
100 |
|
| Lactobacilli |
95 |
|
| Actinomyces israelii |
Обычно |
|
| Haemophilus influenzae |
25-100 |
|
| Bacteroides fragilis |
Обычно |
|
| B. melaninogenicus |
Обычно |
|
| B. oralis |
Обычно |
|
| Fusobacterium nucleatum |
15-90 |
|
| Candida albicans |
6-50 |
|
| Treponema denticola и T. vincentii |
Обычно |
|
|
Гортань |
Staphylococcus epidermidis |
30-70 |
|
S.aureus |
35-40 |
|
|
Дифтероиды |
50-90 |
|
|
Streptococcus pneumoniae |
0-50 |
|
|
Альфа- и негемолитические стрептококки |
25-99 |
|
|
Branhamella catarrhalis |
10-97 |
|
|
Haemophilus influenzae |
5-20 |
|
|
H. parainfluenzae |
20-35 |
|
|
Neisseria meningitidis |
0-15 |
|
|
Толстый кишечник |
Грамотрицательные палочки: |
|
|
Bacteroides fragilis, B. melaninogenicus, B. oralis, Fusobacterium nucleatum, F. necrophorum |
100 |
|
|
Грамположительные палочки: |
||
|
Lactobacilli |
20-60 |
|
|
Clostridium perfringes |
25-35 |
|
|
Eubacterium limosum |
30-70 |
|
|
Bifidobacterium bifidum |
30-70 |
|
|
Peptostreptococci |
Обычно |
|
|
Энтерококки |
100 |
|
|
Escherichia coli |
100 |
|
|
Klebsiella spp. |
40-80 |
|
|
Enterobacter spp. |
40-80 |
|
|
Proteus spp. |
5-5 |
|
|
Candida albicans |
15-30 |
|
|
Влагалище и шейка матки |
Lactobacilli |
50-75 |
|
Bacteroides spp. |
60-80 |
|
|
Clostridium spp. |
15-30 |
|
|
Peptostreptococci |
30-40 |
|
|
Дифтероиды |
45-75 |
|
|
Staphylococcus epidermidis |
35-80 |
|
|
Стрептококки группы D |
30-80 |
|
|
Enterobacteriacae |
18-40 |
|
|
Candida albicans |
30-50 |
|
|
Trichomonas vaginalis |
10-25 |
|
Этот тип побочных эффектов лекарственной терапии в отличие от фармакологических, обусловлен энзимопатиями и псевдоаллергиями. Механизм необычных реакций на лекарственные вещества связан с непосредственным прямым действием лекарственных средств на тучные клетки и высвобождением гистамина и других медиаторов. Эффект лекарственных препаратов дозозависимый. К лекарствам, способствующим выделению гистамина не иммунным путем, относятся: - йод содержащие рентгеноконтрастные вещества (возможны реакции через активацию комплемента) - деффаксамин (десферал), тубокурарин, полимиксин В, триметафан и др.
При введении больших доз этих препаратов, особенно внутривенно, появляются крапивница, зуд кожи, гиперемия, головная боль, снижается артериальное давление. Больные, страдающие бронхиальной астмой или аллергическим ринитом, могут отметить обострение ринита, возникновение приступа удушья. Если препарат вводится местно, то на месте инъекции может образоваться отек и гиперемия, сопровождающиеся зудом.
Без участия аллергических механизмов могут развиться отек и гиперемия слизистой носа на прием гипотензивных средств - препаратов раувольфии, допегита, апрессина, фентоламина, пирроксана. Очевидно, эти препараты оказывают неблагоприятное действие через холинэргические эффекты.
Приступ удушья у больных бронхиальной астмой без участия аллергических механизмов вызывают холиномиметики (ацетилхолин, карбохолин), бета-адреномиметики (анаприлин, тразикор и др.). У больных с астматической триадой бронхоспастический эффект аспирина, пиразолонов, бруфена, ортофена и др. нестероидных препаратов связан с нарушением метаболизма арахидоновой кислоты.
Фармакологический эффект вследствие применения лекарственного вещества, как ожидаемый терапевтический, так и побочный, во многом зависит не только от препарата, метода его введения, но и генетически обусловленных особенностей индивидуума. Различные наследственные энзимопатии существенно влияют на фармакодинамику лекарственных средств, в одних случаях повышая активность и токсичность лекарственного препарата, в других — извращая фармакологический эффект. В. Д. Петков (1974) указывает на следующие генетические детерминированные различия в реакции на лекарственные вещества (рис. 8):
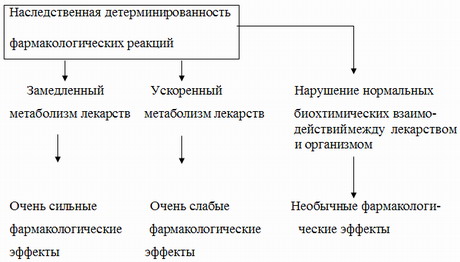
Рис. 8
Так, недостаточность глюкозо-6-фосфатдегидрогеназы в эритроцитах сопровождается сокращением периода полураспада фермента с 62 дней в норме до 13 дней. В результате подобной генетической аномалии зрелые эритроциты человека теряют устойчивость ко многим лекарственным препаратам (сульфаниламиды, фуразолндон, левомицетин и др.), при введении которых развивается гемолиз. Недостаточность холинэстеразы сыворотки крови, встречающаяся у 0,05% населения, определяет необычный терапевтический эффект мышечного релаксанта дитилина. Если в норме дитилин через 5 минут инактивируется холннэстеразой, то у больных с врожденной энзимопатией инактивация осуществляется медленно, остановка дыхания наступает на 2—3 ч.
По данным I. Szorady (1976), при фармакогенетических энзимопатиях можно ожидать три исхода ненормального ответа организма на лекарственный препарат (рис. 9):
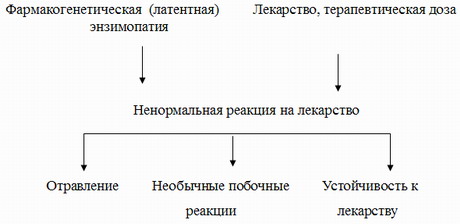
Рис. 9
М. А. Губергриц (1979) различает специфический и неспецифический варианты генетического контроля ферментов (рис. 10):
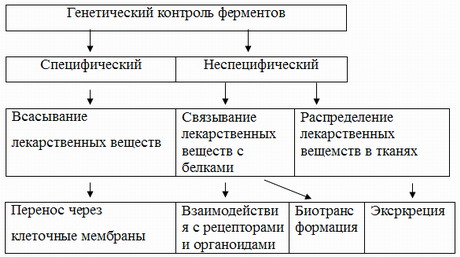
Рис. 10
По мнению автора, сочетание ряда лекарственных препаратов и генетических отклонений определяет некоторые постоянные синдромы как проявления медикаментозных осложнений.
К категории необычных реакций на лекарство относится изменение чувствительности рецепторов. Терапевтический эффект некоторых лекарственных средств обусловлен не непосредственным возбуждением или угнетением ими специфических рецепторов, а влиянием на медиаторы проведения возбуждения. Эффективность таких препаратов существенно изменяется при одновременном приеме лекарственных веществ, оказывающих действие на те же медиаторы. Например, при сочетанном введении резерпина с ингибиторами моноаминоксидазы резерпин высвобождает катехоламины, которые разрушаются моноаминооксидазой. Это приводит к истощению запасов медиаторов. Ингибиторы моноаминооксидазы, замедляя разрушение медиаторов, усиливают и пролонгируют действие эфедрина и других адреномиметических средств.
Некоторые препараты изменяют чувствительность тканей к другим лекарственным средствам. Механизм сенсибилизации рецепторов не всегда вполне ясен. Повышение чувствительности миокарда к адреналину во время циклопропанового или фторотанового наркоза является причиной нарушений ритма сердца. Истощение запасов калия под влиянием диуретических средств повышает чувствительность миокарда к сердечным гликозидам.
Широко используется в анестезиологии антагонизм между курареподобными средствами, которые блокируют рецепторы, чувствительные к ацетилхолину и антихолинэстеразными средствами, блокирующими фермент, катализирующий превращения ацетилхолина. Так, введение прозерина, галантамина и других препаратов из этой группы повышает концентрацию ацетилхолина, что приводит к вытеснению миорелаксантов из рецепторов скелетных мышц и восстановлению нервно-мышечной передачи возбуждения.В литературе накоплено много убедительных доказательств тератогеиного действия медикаментов. Тератогенный эффект лекарственных препаратов особенно интенсивно стал изучаться после талидомидовой трагедии, когда было установлено рождение детей с уродствами вследствие применения женщинами во время беременности талидомида. Четверть века назад появление на свет детей с врожденными уродствами после применения их матерями во время беременности талидомида ужаснуло весь мир. Трагедия заставила кардинально пересмотреть нормы контроля за безопасностью лекарственных средств. Правда, в наши дни талидомид переживает второе рождение и это связано с пандемией ВИЧ-инфекции. В последние годы появились наблюдения, что талидомид может способствовать заживлению мучительных язв слизистой рта и глотки, которые нередко развиваются у ВИЧ-инфицированных больных. Для проверки этих данных исследователями из Масачусетского Института Аллергии было проведено двойное слепое, рандомизированное, плацебо-контролированное исследование, в котором ВИЧ-инфицированные пациенты в течение 4-х недель принимали 1 раз в день по 200 мг талидомида (29 человек) или плацебо (28 человек). Через 4 недели язвы полностью зажили у более чем у половины больных, получавших талидомид и только у 7 процентов в группе плацебо. Кроме ускорения заживления язв талидомид способствовал уменьшению болей, больные смогли нормально питаться [Jacobson J.M. at al., 1997].
Чаще всего тератогенныи и онкогенным эффект оказывают препараты, обладающие цитотоксическим действием. В обзоре по цитопатическому действию лекарственных веществ И. Г. Лаврецкий и А. С. Лонатнн (1976) классифицируют действие медикаментов следующим образом:
Лекарственная патология, связанная с нарушениями функции и структуры гена.
I. Лекарственно-генетические нарушения, представляющие собой варианты фармакогенетической патологии с доказанной возможностью наследования: 1) энзнмопатия, обусловленная дефицитом Г-6-ФД; 2) энзимонатня, обусловленная полиморфизмом ацетнлтрансферазы; 3) энзимонатия, развивающаяся вследствие полиморфизма внутриглазного давления при кортикостероидной терапии; 4} энзимонатия, обусловленная дефицитом метгемоглобинредуктазы; 5) энзимопатия, обусловленная полиморфизмом холинэстеразы; 6) прочие энзимопатии, редко наблюдаемые в популяции.
II. Генетические нарушения, изменяющие чувствительность к лекарствам (подагра, порфирин, периодический паралич, синдром Жильбсра и др.).
III. Состояния, при которых генетические факторы могут изменять реакции на лекарства (энзимопатия, связанная с дефицитом a-антитрипсина, болезнь итаи-итаи, болезнь Минмата и др.). IV. Лекарственный мутагенез.
Лекарственные поражения процессов развития и функционирования клетки.
I. Лекарственный тератогенез:
а) патология, обусловленная медикаментозным угнетением репродуктивной функции мужчины и женщины;
б) медикаментозная эмбриопатия (бластопатия, этапное нарушение эмбриогенеза отдельных органов и систем);
в) медикаментозная фетопатия (ранняя фетопатия, или фетальная незпрелость незрелость и поздняя фетопатия);
г) неонанатальный тератогенез;
д) функциональный тератогенный эффект.
II. Лекарственный канцерогенез.
Различают четыре типа тератогенной патологии: хромосомные нарушения, моногенные наследственные нарушения, полигенные мультифакторные нарушения, экзогенные нарушения. Из этих форм две последние могут быть обусловлены медикаментами, они составляют 70–80% среди всех тератогенных нарушений. Тератогенное действие медикаментов можно сгруппировать по следующим показателям: 1) антагонисты витаминов; 2) антагонисты аминокислот; 3) 6-меркаптоиурин. 6-хлорпурнн, 2,6-диаминопурин, тиогуанин; 4) андрогены, производные 19-тестостерона (прогестерон, АКТГ, кортикостероиды); 5) ан-тимитотические средства (колхицин н др.); 6) антибиотики (стрептомицин, тетрациклин); 7) другие препараты (препараты йода, аминазин, мепробамат, резохин, хлорохин, метронидазол, ноксирон, финилин).
По данным Научной группы ВОЗ (1967), 25 % аномалий развития обусловлено действием генетических факторов, 3 % – хромосомными абберациями, 3–4 % – инфекционными заболеваниями матери, приемом ею лекарственных препаратов или действием радиоактивных веществ. Однако, как считает Научная группа, в 68–69 % аномалий роль этиологического фактора в развитии тератогенных расстройств остается невыясненной. В основном это связано с трудностями идентификации причинного фактора.
Фармакогенетическими исследованиями установлено, что обладающие мутагенным эффектом лекарственные вещества вызывают генные, хромосомные и геномные мутации. При генных мутациях нарушается порядок расположения или изменяется количество азотистых оснований в гене. При хромосомных мутациях изменяется положение, происходит выпадение или вставка участка хромосомы. В случае развития геномных мутаций следует уменьшение или увеличение числа хромосом.
Лекарственные вещества, обладающие тератогенной активностью, по механизму действия разделяются на препараты, оказывающие прямую токсичность на плод, препараты, нарушающие метаболизм фолиевой кислоты, и, наконец, препараты, нарушающие метаболизм гормонов.
В настоящее время установлено, что в плод лекарства попадают в одних случаях в результате пассивной диффузии, в других – в результате активного транспорта с аминокислотами, в третьих – через мембранные фильтры. Так, пассивно диффундируют жирорастворимые вещества с большой молекулярной массой и слабой ионизацией, с аминокислотами транспортируются антиметаболиты, а через мембранные фильтры проникают вещества с низкой молекулярной массой.
Тератогенный эффект медикаментов во многом зависит от того, в какой период беременности женщина их принимает. Действие тератогенных веществ на стадии органогенеза обусловливает развитие эмбриопатии, а действие на более поздних стадиях развития плода вызывает раннюю или позднюю фетопатию. При ранней фетопатии (фетальной незрелости) обнаруживаются гистологическая и функциональная незрелость органов, обусловливающая нежизнеспособность плода. При поздней фетопатии, или врожденной болезни, ткани и органы в эмбриогенезе заложены нормально, но тератогены вызывают их поражения (табл. 33). Поэтому применяемые в первые 2 недели беременности лекарства могут обусловить выкидыш, в период 3—8 недель, когда происходит дифференциация клеток плода, под влиянием медикамента может произойти недоразвитие таких органов, как сердце, конечности, эктопия почек. В связи с тем, что в период 3–4 месяцев беременности идет дифференциация гемопоэтической системы, почек, оформляется гистогенез нервной системы, лекарственные препараты, применяемые в этот период, могут повлиять на развитие этих органов и систем. Cl. Gcntil (1968) считает, что действие тератогенов с 15 по 25 день беременности нарушает эмбриогенез нервной системы, с 20 по 40 день – эмбриогенез сердца, с 24 по 46 день – эмбриогенез конечностей.
Таблица 33
Взаимосвязь между критическими сроками развития плода и приемом матерью лекарственных средств (по Iacobson D., 1976)
|
Аномалия развития |
«Критический» период раз-пития плода, дни |
Срок беременности, дни |
Лекарства, оказывающие тератогениое действие |
|
Анэнцефалия |
24-26 |
70 |
Ампициллии |
|
Атрезия трехстворчатого клапана |
42-40 |
56 |
Кодеин |
|
Транспозиции внутренних органов |
46-47 |
84 |
Антибиотики |
|
Синдром Дауна |
56 |
56 |
Парацетамол |
|
«Волчья пасть» |
56-58 |
70 |
Парацетамол, препараты железа, кальция |
|
Отсутствие диафрагмы, желчного пузыря |
56-63 |
84 |
Диазепам |
|
Сочетйнное недоразвитие ушей и глаз |
|
15 |
Кислота ацетилсалициловая, фенацетин |
|
- II - |
|
49 |
Ненаркотические анальгезирующие средства, препараты кофеина |
Р. Qantin (1977) к препаратам, обладающим тератогенным эффектом, относит противоопухолевые, противосудорожные средства, барбитураты, алкалоиды спорыньи, гормоны, антибиотики, противопаразитарные средства. Действие противоопухолевых медикаментов обусловлено цитостатическим эффектом. Гормональные препараты, особенно андрогены, обусловливают маскулинизацию половых органов женского плода и развитие хромосомных аномалий. Кортикостероиды способствуют развитию у плода недостаточности надпочечников.
На большом фактическом материале (наблюдались 12764 женщины) С. Rumeau и соавт. (1977) провели исследования связи между врожденными уродствами и приемом беременными женщинами лекарственные препаратов. Из общего числа наблюдаемых у 216 женщин родились дети с уродствами. Чаще всего матерями принимались такие фенотиазины, как ацетилпромазин, триме-празин, аминазин, метотримепразин, метоксипромазин, оксомемазин, прометазин, пропиомазин. Уродства имели различную форму: дефекты центральной нервной системы (0,12 % от общего числа находившихся под наблюдением детей), врожденные дефекты сердечно-сосудистой системы (0,23 %), дефекты глотки (0,01%), пищеварительной системы (0,09 %), желчных протоков (0.02 %), мочевой системы (0,02 %), половой системы (0,02%), скелета (0,32%), скелетных мышц (0,05 %), органов чувств (0,02 %), множественные уродства (0,29 %).
N. Newman и соавт. (1977) провели ретроспективный анализ 7933 повторных родов за 1953–1976 гг. с учетом всех лекарственных препаратов, принимавшихся женщинами в первом триместре беременности. Новорожденные делились на две группы: в первой – 2516 детей, матери которых принимали медикаменты, во второй группе – 5417 детей, матери которых медикаментов не принимали. В первой группе тератогенные аномалии выявлялись в два раза чаще (1,39%), чем во второй (0,7%).
Нарушение обмена фолиевой кислоты у плода и формирование аномалий лицевой части черепа вызывают аминоптерин и метотрексат [Shaw, 1972]. Гормональные нарушения плода способны вызвать андрогены, антити-реоидные гормоны, синтетические прогестагены н эстрогены, обусловливающие маскулинизацию детей женского пола. Антитиреоидные средства способствуют развитию у плода базедовой болезни и гипотиреоидизма [Levvy L. еt. аl., 1973].
Под влиянием органических соединений ртути у плода формируются тяжелые неврологические нарушения, тетрациклин способствует развитию гипоплазии и желто-оранжевому окрашиванию зубов у детей, матери которых принимали антибиотик после 5-го месяца беременности [Colin A., Ambotte R., 1972].
По мнению некоторых авторов, выраженным тератогенным действием обладают такие противосудорожные препараты, как триметадион, фенобарбитал, дифенилгидантоин. В результате приема этих препаратов беременными женщинами у детей обнаруживаются различные аномалии развития, особенно часто «волчья пасть», патологические изменения сердца, сходящееся косоглазие, высокое небо, дистальная гипоплазия конечностей, широкий рот, аномалии конечностей, желудочно-кишечного и мочеполового трактов [Zeilweger H., 1974]. При отмене препаратов в последующем у женщин родятся нормальные дети. Примером может быть одно из трех наблюдений, описанных М. Вагг еt .аl. (1974).
Ребенок весом 3175 г родился от nepвой беременности у 20-летней женщины, у которой наблюдались смешанные припадки. В течение беременности женщина получала фенобарбитал и дифенилгидантоин. Первое обследование произведено is возрасте 10 недель: вес 3900 г, длина 56 см, окружность головы 37,5 см. Выявлены систолический шум у левого края грудины, пупочная грыжа диаметром 1 см, 1-я степень гипоспадии и гипоплазия дистальных отделов конечности. На руках и ногах обнаружено отсутствие дистальных фаланг 2-го и 5-го пальцев, ногтей всех пальцев, за исключением больших пальцев рук и ног. В семейном анамнезе указаний на врожденные уродства не было. Рост и развитие ребенка в течение 7 месяцев нормальные. Позднее выявлен бессимптомный дефект межжелудочковой перегородки.
Однако М. Weber (1976) считает, что нет достоверных данных о тератогенном эффекте противосудорожных средств, так как на врожденные уродства могли повлиять и такие факторы, как возраст родителей, эпилепсия или другие заболевания, послужившие причиной назначения противосудорожных препаратов.
В связи с тем, что многие лекарственные препараты из плазмы крови проникают в молоко кормящей матери, встает практически важная проблема функционального тератогенного действия медикаментозных препаратов. Наблюдения показали, что часть медикаментов поступает в молоко в неактивной форме (например, 50% левомицетина), часть препаратов инактивируется в молоке, наконец, многие препараты поступают в молоко в весьма низкой концентрации. Однако часть лекарственных веществ может вызвать опасные осложнения у ребенка, особенно со стороны печени и почек. Среди них наиболее опасны антиметаболиты, аитикоагулянты, атропин, наркотики, препараты спорыньи, тиреостатические препараты, препараты йода и брома. По этой же причине следует с осторожностью прибегать к лечению матерей антибиотиками, барбитуратами, литием, антиконвульсантами, салицилатами, сульфаниламидами, стероидными и синтетическими экстрапрогестативами [Ribera-Calimlin L. , 1977]. Так, длительное применение кормящими матерями стероидов может замедлять рост ребенка и угнетать эндогенную продукцию кортикостероидов. Деградация эндогенных стероидов наступает при лечении барбитуратами вследствие стимуляции микросомальных окислительных ферментов. Большие дозы или длительные приемы салицилатов и антикоагулянтов могут послужить причиной геморрагических явлений у ребенка. Проникновение с молоком матери антибиотиков может вызвать нарушения нормальной кишечной флоры ребенка. Особенно часто подобные эффекты наблюдаются у детей с врожденной ферментативной недостаточностью.
Если вопрос влияния на плод медикаментозных препаратов, получаемых матерью, более или менее изучен и изучается, то тератогенное действие медикаментов, принимаемых мужчинами, почти не изучено. Имеются лишь наблюдения, что при беременности, наступившей на фоне сниженной подвижности сперматозоидов, частота аномального развитие плода достигает 20 % [Ganz М., 1968]. В то же время установлено, что употребление некоторых лекарственных препаратов сказывается на функциональной активности сперматозоидов и сперматогенезе. К таким препаратам относится комбинация циклофосфана с азатиоприном [McEvey J.et. аl., 1982].
Вопрос о канцерогенном действии лекарственных веществ пока находится в фазе накопления отдельных разрозненных фактов. Обусловлено это сравнительно широким распространением опухолей среди населения, не поддающимся учету применением лекарственных препаратов в течение жизни каждым человеком, длительным периодом от момента приема предполагаемого канцерогенного медикамента и до развития опухоли.
Тем не менее определенные сведения о способности медикаментов вызвать опухолевый процесс имеются.
По данным F. Fraumeni и R. Millor (1972), для лекарственных веществ характерна определенная закономерность вызываемой ими патологии. Так, выявлена взаимосвязь между развитием опухолей влагалища у девушек и молодых женщин и применением их матерями в период беременности диэтилстильбестрола.
В американской литературе в последние годы участились сообщения о связи между развитием рака эндометрия и длительным приемом женщинами эстрогенов в период менопаузы. Риск возникновения рака у них возрастает в 4-8 раз.
Приводим данные F. Fraumeni и R. Millor (1972) о медикаментах, вызывающих канцерогенную патологию:
|
Препараты Радиоизотопные средства: Фосфор (Р-32) Радий, мезотонрий Торотрастат Иммунодепрессивны6е средства, используемые при пересадке почек (антиметаболиты, кортикостероиды) Цитостатики Хлорнафтазин Малфалан, циклофосфамид Гормоны Синтетические эстргоены Андрогены, анаболические стероиды Другие препараты: Мышьяк Фенацетин Дифенилидантоин Деготь (мазь) Хлорамфеникол Амфетамины |
Патология
Лейкоз Остеосаркома и карцинома гайморовых пазух Гемангиоэндотелиома печени Ретикулоклеточная саркома Рак кожи, печени Саркома мягких тканей Рак мочевого пузыря Миело-моноцитарный лейкоз Карцинома влагалища и шейки матки Карцинома печени
Рак кожи Рак почечных лоханок Лимфома Рак кожи Лейкоз Болезнь Ходжкина |
Отчетливый канцерогенный эффект оказывают иммунодепрессанты. При анализе 6000 операций по пересадке почек было установлено, что они в 35 раз повышают риск возникновения лимфомы, в 350 раз – ретикулоклеточной саркомы. У этих больных и 4 раза чаще развивается рак кожи губы [Hartwich G., 1973; Hoover P. , Fraumeni F., 1985].
Из цитостатиков чаще всего канцерогенный эффект вызывает циклофосфамид, после приема которого в срок от 14 до 85 месяцев развивается рак мочевого пузыря, грудной железы, желчного пузыря, яичников. Рак мочевого пузыря развивается спустя 3–5 лет после приема хлорафазипа в суммарной дозе 80–100 г [Goursen М., 1970; Harris С., 1971]. Благостомогенный эффект на печень оказывают оральные контрацептивы. Под влиянием эстрогенного компонента этих препаратов в одних случаях наблюдается аденома печени, в других – узелковая гиперплазия.
Все лекарственные средства в период от лаборатории до клинических испытаний изучаются на тератогенное и онкогенное действие. Однако, результаты экспериментов на животных не всегда позволяют оценить возможную тератогенность лекарственного вещества у человека. В этом отношении поучительна история с талидамидом, который в эксперименте оказывал тератогенное действие на плод в дозах, в 100–200 раз превышающих терапевтические. Но именно в терапевтических дозах он вызывал формирование пороков развития у плода человека. В наши дни талидомид переживает второе рождение, найдя широкое применение в онкопатологии).
При определенных условиях любой лекарственный препарат может оказать тератогенное или другое вредное действие на плод, поэтому необходимо строго обосновывать показания к назначению лекарственных веществ беременным женщинам.
Выявление тератогенных свойств у препарата наиболее эффективно тогда, когда врожденные уродства возникают часто, когда они необычны или тяжелы. В то же время лекарственные средства с низкой тератогенной активностью, действие которых реализуется на практике редко или вызывают незначительные нарушения, остаются незамеченными и неучтенными.
В практике используется очень много препаратов, которые потенциально опасны с точки зрения тератогенеза, но их действие может проявляться при наличии определенных благоприятствующих факторов [Chandra R. K., 1997]. Поэтому при назначении лекарства женщинам детородного периода исключительное значение имеет оценка соотношения пользы и риска назначаемого препарата в период беременности. Весьма важным является также исключение беременности при назначении препаратов с тератогенными свойствами.
"Кокаин вызывает... радостное возбуждение и длительную эйфорию"
З. Фрейд
"Каждый раз, когда у меня появляются деньги - $2, $10 или $1000, я все их трачу на снег.
Когда у тебя такая
привычка, все, что ты делаешь, - это снег, снег и снег. У меня целый день снег"
Курильщик крэка.
Люди знакомы с наркотиками уже несколько тысяч лет. Наркотики потребляли во время религиозных обрядов, для восстановления сил, для изменения сознания, для снятия боли и неприятных ощущений. На Ближнем Востоке в 5 тыс. до н.э. существовал "злак радости", скорее всего опиумный мак. В Китае около 2700 г. до н.э. использовали коноплю в виде настоя, как чай. Люди каменного века знали опиум, гашиш и кокаин и потребляли эти наркотики для изменения сознания в ходе религиозных обрядов и при подготовке к сражению.
До начала 20 века практически не существовало ограничений на производство и потребление наркотиков, хотя первый европеец, закуривший табак – спутник Колумба Родриго де Херес - по прибытии в Испанию был заключен в тюрьму, так как власти решили, что в него вселился дьявол. Предпринимались попытки объявить вне закона кофе и чай.
Лекарственная зависимость – состояние, наблюдающееся при наркоманиях и токсикоманиях. Она характеризуется потребностью в приеме психотропного средства, с целью снять или ослабить мучительные явления абстинентного синдрома, возникающие при прекращении приема. Различают лекарственную зависимость психическую, протекающую без явлений абстиненции, лекарственную зависимость физическую, проявляющуюся абстинентным синдромом в случае прекращения приема лекарственного средства.
Под токсикоманиями понимают группу заболеваний, характеризующихся стойким влечением к регулярному употреблению психоактивных веществ с целью получить удовольствие или поддержать состояние психического и физического комфорта. Все токсикомании характеризуются наличием в клинической картине трех "больших наркоманических синдромов", а именно, психической зависимости, физической зависимости и измененной реактивности организма к употребляемому веществу. Группу психоактивных вещество представляют препараты, способные вызывать при однократном приеме эйфорию или другие желательные с точки зрения потребителя психотропные эффекты, а при систематическом приеме - психическую и физическую зависимость.
Под наркоманиями подразумеваются токсикомании к веществам, отнесенным к списку наркотических. Разграничение понятий “токсикомания” и “наркомания” весьма условно и больше имеет юридическую градацию нежели медицинскую. Психическая зависимость представляет собой состояние психического комфорта в токсикоманической интоксикации и болезненное влечение к употреблению психоактивного вещества. В отличие от нее физическая зависимость является состоянием физического комфорта в токсикоманической интоксикации и явления абстиненции (синдром отмены) развиваются при внезапном прекращении употребления вещества. Понятие «абстинентный синдром» включает комплекс психопатологических, вегетативных, неврологических и соматических расстройств, появляющихся вслед за прекращением регулярного употребления психоактивного вещества, причем постоянными симптомами являются психический и физический дискомфорт и выраженное влечение к принимаемому веществу. Абстиненция – это заболевание, ее вызывает прекращение приема наркотика или его уменьшением после того, как организм настолько привык к присутствию в нем наркотика, что не может функционировать без него. Абстинентный синдром вызывают не все наркотики. Симптомы абстиненции могут быть сильнее или слабее в зависимости от индивидуальных характеристик и продолжительности приема наркотика. Частью абстинентного синдрома являются психологические симптомы, такие как раздражительность, депрессия и настойчивое желание наркотика.
Сформировавшаяся токсикомания характеризуется синдромом измененной реактивности организма, который заключается в модификации основных эффектов психоактивного вещества (например, наркотика) и развитии к нему толерантности.. Толерантность проявляется способностью переносить возрастающие дозы наркотика при все возрастающей потребности организма в постепенном увеличении дозы для достижения желаемого эффекта.
В нашей стране токсикомании подразделяются на три стадии:
характеризуется развитием психической зависимости и нарастанием толерантности при минимальной выраженности физической зависимости; формируется ритм наркотизации; в клинической картине преобладают астенические расстройства с заострением личностных черт, эмоциональной лабильностью, раздражительностью, нарушениями сна, повышенной отвлекаемостью, рассеянностью; повторные введения психоактивного вещества купируют эти явления;I стадия
II стадия проявляется "большими наркоманическими синдромами", которые достигают в своем развитии максимальной выраженности: влечение к употребляемому веществу непреодолимое, абстинентный синдром тяжелый, толерантность высокая, ритм употребления психоактивного вещества окончательно сформирован, токсикоманические эксцессы учащаются; у больного меняется форма токсикоманической интоксикации: эйфория и другие, связанные с переживанием удовольствия эффекты существенно ослабевают, достижение психофизического комфорта становится самоцелью наркотизации, астения прогрессирует, появляются отчетливые личностные изменения; появляется соматическая патология, обусловленная злоупотреблением психоактивными веществами;
III стадия проявляется ослаблением толерантности, глубокими необратимыми психическими и соматическими расстройствами, больной резко астенизирован и эмоционально лабилен, употребление психоактивных веществ не обеспечивает психофизического комфорта.
В США разработаны критерии постановки диагноза в зависимости от химических веществ и злоупотребления ими. Каждый критерий применим к определению зависимости и злоупотребления любыми наркотиками и группами наркотиков, используемых не в медицинских целях (табл. 34). Причем зависимость и злоупотребление представляют собой разные диагнозы. Нельзя одному и тому же человеку выставить диагнозы зависимости от какого-то химического вещества и злоупотребления им одновременно, хотя возможно совмещение диагнозов по разным веществам.
Таблица 34
Критерии диагностики злоупотребления психоактивными химическими веществами и зависимости от них (Руководство по диагностике и статистке, США,1994)
|
I. Зависимость от химического вещества |
|
|
Неправильное употребление химического вещества, ведущее к ухудшению состояния или заболеванию, которое требует клинического лечения, о чем свидетельствуют три или более из ниже перечисленных признаков, зафиксированные в 12-и месячный период. |
1.Толерантность, определяемая любым способом из приведенных ниже:
2.Абстиненция, проявляющаяся любым способом из приведенных ниже:
3.Химическое вещество принимается часто и в больших количествах или в течении более продолжительного периода, чем это предписано. 4.Устойчивое желание или неудачные попытки прекратить или сократить прием химического вещества. 5.Тратится очень много времени на действия, необходимые для приобретения химического вещества (например, посещение многих врачей или преодоление больших расстояний), использования его (например, непрерывное курение) или восстановления организма после его употребления. 6.Из-за употребления химического вещества прекращаются или уменьшаются занятия, связанные с общественной или профессиональной деятельностью, а также деятельностью, направленной на отдых. 7.Продолжительное употребление вещества, несмотря на осознаваемые постоянные или регулярные физиологические или психические проблемы, вызываемые, или обостряемые этим веществом (например, постоянное употребление кокаина во время депрессии, несмотря на осознание того, что депрессия вызвана кокаином, или продолжительное потребление алкоголя, несмотря на осознание того, что из-за употребления алкоголя открылась язва). Зависимость наиболее вероятна, если наблюдается физиологическая зависимость: наличие толерантности или абстинентного синдрома (любого из пунктов 1-2). |
|
II. Злоупотребление химическим веществом |
|
|
Неправильное употребление химического вещества, ведущее к ухудшению состояния или заболеванию, требующего клинического лечения, о чем свидетельствует один или более признаков |
1.Периодическое употребление химического вещества, приводящее к невозможности выполнять важные социальные обязательства, как то: учиться, работать или вести домашнее хозяйство (например, систематические случаи неявки на работу, связанные с употреблением вещества, прогулы занятий, продолжительная неявка или исключение из школы, отсутствие заботы о детях или домашнем хозяйстве). 2.Периодическое употребление химического вещества в ситуациях, когда это опасно для жизни (например, вождение автомобиля или работа на станке в состоянии опьянения). 3.Периодические проблемы с законом, связанные с употреблением вещества (например, аресты за противоправные действия, совершенные под влиянием химического вещества). 4. Продолжительное употребление химического вещества, несмотря на постоянные или регулярные социальные или межличностные проблемы, вызываемые или обостряемые этим веществом, например, споры с супругой (ом) о последствиях интоксикации, драки). |
Критерии 3 - 6 определяют привычку к наркотикам, ситуацию, когда главным в жизни человека становится потребление и приобретение наркотиков. Причем, человек употребляет наркотики, несмотря на риск, он не в состоянии отказаться от употребления наркотиков или сократить его на сколько-нибудь значительное время, даже если хочет.
В первые 2 критерия зависимости введены толерантность и абстиненция. Диагноз зависимости может быть поставлен по одному из этих критериев или без них вообще. Для более точного обоснования диагноза нужны, по крайней мере, 3 из 7 приведенных критериев.
В критериях злоупотребления химическими веществами главное место занимают негативные события в семейной и общественной жизни, связанные с употреблением химических веществ. Диагноз злоупотребления можно поставить по 1 из 4 критерий.
Как установлено, в основе механизма развития наркомании лежат психотропные эффекты психоактивных веществ посредством влияния на дофаминергическую систему. Отмена наркотиков ведет сначала к увеличению, а затем падению содержания дофамина, что свидетельствует о наличии общих механизмов в формировании зависимости от психоактивных веществ. В патогенезе участвуют и другие медиаторные системы. Так, межмедиаторные взаимоотношения осуществляются через ионные каналы, вторичные мессенджеры, АТФ/ГДФ - связующие белки, а также с помощью других участников нейромедиации. Серотонинергическая и ГАМК-эргическая системы наделены специализированными функциями регуляции межмедиаторного баланса. О вовлечении межмедиаторных взаимоотношений в патогенез наркотической зависимости свидетельствует то обстоятельство, что психоактивные вещества, будучи лигандами различных медиаторных систем, вызывают сходные нейрофизиологические феномены.
Данные о нейрохимических механизмах действия наркотиков представлены в табл. 35.
Таблица 35
Нейрохимические механизмы действия наркотиков
|
Наркотический эффект производится изменением следующих нейрохимических систем: |
Действие наркотика |
|
Синтез нейромедиатора |
Увеличивает или уменьшает количество вырабатываемых нейромедиаторов |
|
Транспортировка нейромедиатора |
Вмешивается в процесс доставки молекул нейромедиатора к нервным окончаниям. |
|
Накопление нейромедиатора. |
Вмешивается в процесс накопления нейромедиатора в пузырьках нервных окончаний |
|
Выделение нейромедиатора. |
Вызывает преждевременное выделение молекул нейромедиатора в синапс |
|
Распад нейромедиатора |
Влияет на распад нейромедиатора посредством ферментов |
|
Обратное поглощение нейромедиатора |
Блокирует обратное поглощение нейромедиатора в нервные окончания |
|
Активизация рецептора |
Активизирует рецептор благодаря мимикрии |
|
Блокировка рецептора |
Делает рецептор инертным, блокируя его |
ВОЗ (1981) определяет наркотики в широком смысле как "химическое вещество, или смесь веществ, отличное от необходимых для нормальной жизнедеятельности (подобно пище), прием которого влечет за собой изменение функционирования организма и, возможно, его структуры". Наркотики классифицируют:
– по происхождению (например, опиаты - производятся из опиумного мака; героин – полусинтетический наркотик, относиться к группе опиатов);
– по воздействию (марихуана - атропиноподобный наркотик);
– по терапевтическому использованию (амфетамины называются наркотиками, подавляющими аппетит)
– по части организма, на которую действует наркотик (алкоголь - наркотик-депрессант, кокаин – стимулятор)
– по химическому строению (барбитураты - синтетические вещества, полученные на основе барбитуратовой кислоты )
– по механизму воздействия (хотя механизм действия некоторых наркотиков до сих пор неизвестен);
– по названию на сленге, данному в определенной субкультуре или на черном рынке.
Среди наркотических средств наиболее распространены:
- Производные канабиса (гашиш, анаша, марихуана, план, чарс), изготавливаемые кустарно из дикой конопли;
– Опиаты и опиоиды (алколоиды опия и синтетические аналоги морфина: морфин, кодеин, героин, промедол, омнопон, метадон, фентанил), среди них наибольшее распространение получили высокотоксичные препараты кустарного изготовления, содержащие опий-сырец (маковая соломка, ханка) и героин (ангидрированный опий), применяемые внутривенно, ингаляционно (курение) и внутрь; в зависимости от дозы опиаты создают ощущение "невесомости", "легкости", "истомы", которые сменяются эйфорией, благодушием, иллюзией отсутствия каких-либо проблем. При приеме больших доз наркотика развивается сомноленция. Отравления при злоупотреблении опиатами происходят вследствие передозировки или попадания в раствор наркотика веществ общетоксического действия при нарушении технологии его изготовления. Передозировка опиатами, в основном, отмечается у лиц, не имеющих длительного опыта наркотизации, после перенесенного абстинентного синдрома и в случаях комбинации наркотика с алкоголем или другими психоактивными веществами. Для клиники характерны глубокий сопор или кома, резкое угнетение дыхания, миоз, брадикардия, артериальная гипотония. В тяжелейших случаях на фоне брадикардии и гипотонии может быть мидриаз. Передозировка опиатами сопровождается формированием энцефалопатии различной степени тяжести, динамика энцефалопатии имеет три фазы: фазу оглушения со спутанностью, нарушением ориентировки в месте и времени; фазу пробуждения с атаксией, дизартрией, амнестическими расстройствами и аффективными нарушениями; фазу редукции с преобладанием расстройств астенического характера. Толерантность к опиатам высокая, сильно выражены психическая и физическая зависимость, причем, зависимость формируется быстро и может быть вызвана дозами, не превышающими терапевтические. У многих больных сразу после первых инъекций наркотика появляется непреодолимое желание продолжить прием наркотика, стремление достать его любым способом. Абстинентный синдром начинает проявляться через 8 - 16 часов после приема последней дозы, достигает максимальной интенсивности через 2-3 суток, а затем постепенно убывает. Наиболее тяжелые симптомы обычно исчезают в течение 10 дней, но остаточные явления длятся долго. Клинику синдрома абстиненции составляют беспокойство, раздражительность, боли во всем теле, бессонница, насморк, обильное потоотделение, приливы крови к лицу, тошнота, рвота, понос, акатизия, повышение температуры, спазм гладкой мускулатуры кишечника, обезвоживание организма. Внезапное прекращение наркотизации для лиц с выраженной соматической патологией представляет опасность для жизни.
– Производные эфедрина (препараты нелегального изготовления – эфедрон и первитин, отличающиеся высокой токсичностью) применяются внутривенно. Наркоманическая интоксикация клинически характеризуется ярко выраженной эйфорией, возбуждением, речевой, двигательной и сексуальной расторможенностью. Некоторые больные наркоманией склонны вводить эфедрон с интервалом 2-3 часа в течение нескольких суток. При прекращении наркотизации нередко развивается психоз по типу делирия или острого параноида. Отравления вследствие передозировки проявляются психомоторным возбуждением, психотическими явлениями, артериальной гипертензией, пароксизмальной тахикардией, на фоне нарастающей сердечно-сосудистой недостаточности развивается кома. Смерть может наступить от инфаркта миокарда или кровоизлияния в мозг. При злоупотреблении препаратами этой группы возможны гемолитические реакции, так как в технологии изготовления наркотика используется уксусная кислота.
Толерантность к препаратам этой группы высокая, психическая зависимость сильная, но физическая слабо выражена. При внезапном прекращении наркотизации появляются депрессивные с дисфорической окраской состояния и вегетативные нарушения.
– Кокаин (высоко в горном массиве Анд в Перу и Боливии растет невысокий кустарник, который называют деревом или кустом коки -Eryhoxylum coca, из листьев этого растения получают сильнодействующий стимулятор – кокаин). применяется внутривенно или ингаляционно. Употребление восходит к доисторическим временам. Кока была священным наркотиком инков, которые, по всей видимости, переняли обычай жевания листьев коки от индейцев аймара, последние использовали коку, по крайней мере, с III века до н.э. До вторжения испанцев коку употребляли только высшие слои общества. Она была важной частью свадеб, похорон, посвящений и других важнейших обрядов. Психотропное действие кокаина сочетает мощный эйфоризирующий и психостимулирующий эффекты. Вот как это описывает итальянский биолог Мантегацца, который сам, будучи в Перу, жевал коку: "Я смеялся над простыми смертными, обреченными на жизнь в этой долине, в то время как я уносился прочь на крыльях двух листьев коки и пролетал сквозь 77.438 миров, каждый из которых был восхитительнее предыдущего." В Европе история внедрения кокаина в медицинскую практику связана с именем ныне всемирно известного психиатра, а тогда молодого венского врача, которому нужно было какое-нибудь открытие, чтобы получить признание. Зигмунд Фрейд первый свой научный труд посвятил кокаину. Он попробовал кокаин в 1884 году и оценил его возможности в медицине. В своей первой крупной публикации "О коке" он пропагандировал кокаин как местное обезболивающее и лекарство от депрессии, несварения желудка, астмы, различных неврозов, сифилиса, наркомании и алкоголизма. Фрейд переоценил полезные свойства и не имел возможности предвидеть отрицательные эффекты кокаина, что повлекло за собой волну злоупотребления этим наркотиком. Первой жертвой кокаиновой наркомании стал друг Фрейда Эрнст фон Флейшель. Последний страдал хроническими болями и Фрейд взявшись его вылечить, назначил кокаин. Флейшель потреблял наркотик во все возрастающих дозах, избавился от болей, но стал первым кокаинистом в Европе. В результате передозировки у него наблюдались характерные симптомы: параноидальные галлюцинации, которые часто наблюдаются при параноидальной шизофрении и зуд кожи ("мурашки по телу"), при которых человек испытывает ощущения, словно по коже ползают насекомые или змеи. С легкой руки Фрейда началась кокаиновая эпидемия 80-х годов XIX века, чтобы повториться через век.
По мере увеличения числа людей, употребляющих кокаин, стали заметны и его отрицательные эффекты. Кокаиновые психозы, смертельные случаи от передозировок и сильная наркотическая зависимость определили общественное мнение против кокаина. Вот одна из ранних работ, изменивших представление о кокаине – статья Анни Мейер, которая из добропорядочной женщины стала "другом кокаина". Мейер хорошо описала всю силу кокаиновой зависимости, когда у нее кончились деньги и она не смогла получать наркотик. "Я взяла ножницы и расшатала ими свой золотой зуб. Затем я выдернула его, расплющила и помчалась в ближайший ломбард (кровь текла мне по лицу, платье было мокрым от крови), где я продала зуб за 80 центов."
В 1914 году был принят закон Гаррисона о контроле за кокаином. Первоначально закон был призван контролировать распространение опиатов, таких как морфий и героин, но затем в список включили и кокаин.
В начале 70-х годов кокаин было довольно трудно достать, и стоил он весьма дорого (футболист Холливуд Хендерсон приобретал кокаин на 1000 долларов в день). Он стал наркотиком кинозвезд и спортсменов и имел репутацию "шампанского среди стимуляторов". В это время кокаин в основном нюхали в небольших дозах, и редко сталкивались с проблемами, возникающими при внутривенных инъекциях.
Проблему для больных и наркодельцов решило внедрение дешевого кокаина. Его стали употреблять больше людей и в больших дозах. Другим важным фактором эпидемии наркомании явилось распространение крэка. Хотя крэк знали еще в конце 70-х годов, но в 1986 году он стал наркотиком первой величины.
До конца 80-х годов, пока главным способом приема кокаина оставался путь через нос, опастность этого наркотика общественное мнение недооценивало. Потом его стали курить, так как в процессе курения наркотик абсорбируется через легкие полностью и очень быстро, вызывая приятные, но непродолжительные ощущения, за которыми следует сильная ломка. Так как при высокой температуре, необходимой для курения, кокаин в составе солей разрушается, стали получить "свободный кокаин", один из способов - смешать соль кокаина с легковоспламеняющимся эфиром. Так появился "крэк" (от английского "crack" - "треск", так как при нагревании смеси слышен треск, производимый содой, оставшейся в соединении). При курении крэка кокаин быстро попадает в мозг, вызывая настолько быстрый подъем и такие приятные ощущения, что многие наркоманы предпочитают его сопоставимым дозам кокаина, который надо вводить внутривенно. Так как эйфория непродолжительна, уже через 10-20 минут человек испытывает потребность в повторении дозы, причем степень желания принять следующую дозу у людей, курящих крэк, выше, чем у вводящих кокаин внутривенно.
В конце 1980-х годов крэк употребляли миллионы американцев. Осознать ситуацию помогли знаменитости – в течение одной недели от передозировки кокаина погибли сразу два знаменитых спортсмена – Лен Биас и Дон Роджерс. Стало ясно, что кокаин смертелен, особенно в виде крэка. В США в 1990 году было более 80.000 вызовов скорой помощи, связанных с употреблением кокаина (в сравнении с 10.000 в 1985 году и почти полным отсутствием в 1970 году).
Так как крэк дешевле и менее опасен в производстве, чем другие виды "свободного" кокаина, торговцы наркотиками предпочитают распространять именно его. Одновременно крэк настолько сильнодействующий наркотик, что его можно продавать маленькими порциями за 10-20 долларов, следовательно, он сравнительно доступен. В связи с тем, что крэк вызывает очень сильную зависимость, быстро сформировался большой рынок этого наркотика.
Амфетамины – это класс наркотиков, в который входят амфетамин, декстроамфетамин и метамфетамин. Впервые синтезированы в конце 19 века, и, хотя сразу стали доступны для исследований, их медицинское применение началось только в 1920-х годах. Сначала полагали, что они полезны при лечении простудных заболеваний, ожирения, нарколепсии. Но сейчас амфетамины редко используются в медицине. Во время Второй мировой войны амфетамины использовались как стимуляторы. Злоупотребление амфетаминами достигло масштабов эпидемии в Японии, Швеции и некоторых европейских странах. В Америке вплоть до 60-х годов их не считали опасными наркотиками, там их даже врачи стали применять как лекарство от героиновой зависимости (по аналогии, как в свое время Фрейд лечил кокаином от морфинизма), что привело к резкому росту наркомании..
После инъекции человек испытывает короткий, но сильный подъем или "приход". Приятные ощущения после инъекции кокаина или амфетамина часто сравнивают как оргазмические по своему характеру. Так как они длятся не дольше нескольких минут, человек вскоре хочет опять вернуться в состояние наркомании, хотя уровень содержания наркотика в крови еще достаточно высок. Инъекции следуют одна за другой, человек возбуждается все больше и больше, но ему становится сложнее достичь такого же приятного подъема, как в первый раз. Передозировка напоминает острое отравление производными эфедрина, протекает с острым параноидом. Толерантность к амфетаминам высокая, употребляемая доза может превышать первоначальную в сотни раз, сильная психическая зависимость. Прекращение приема ведет к депрессии, которая резко усиливает стремление возобновить прием препарата. Физическая зависимость незначительна.
– Барбитураты представлены барбамилом, фенобарбиталом, этаминалом натрия. Принимаются они внутрь, реже – внутривенно, наркоманическая интоксикация напоминает алкогольное опьянение, но непродолжительная стадия эйфории и возбуждения сменяется оглушенностью, спутанностью сознания, речевыми и двигательными нарушениями, с последующими глубоким сном или сопором. Толерантность относительно невысокая, употребляемая доза может превышать первоначальную в 5-10 раз. При прекращении приема толерантность к барбитуратам быстро исчезает и больные могут стать даже более чувствительными к наркотику, что нередко приводит к тяжелым отравлениям. Психическая и физическая зависимости сильные. При внезапном прекращении наркотизации развивается синдром абстиненции.
– Небарбитуратные успокоительные мепробамат, этхлорвинол и глютехимид были внедрены в 1950-х годах в качестве возможной альтернативы для борьбы с тревожным состоянием и бессонницей. Но, как оказалось, каждый из них обладал побочными эффектами, схожими с эффектами от барбитуратов. В виде замены в 1965 году был внедрен метаквалон. Хотя полагали, что метаквалон будет намного безопаснее, так как это не барбитурат, скоро стало очевидно, что метаквалон в больших дозах весьма токсичен, особенно в комбинации с алкоголем. Зависимость от метаквалона быстро развивается при симптомах абстиненции, которые вызываются алкоголем и барбитуратами. Поэтому в медицинских целях он перестал представлять интерес, но зато приобрел известность под названием "дискотечный бисквит" или "Люде" широко распространился на улице в 1970-х годах, благодаря упомянутому состоянию опьянения и репутации наркотика, улучшающего половые функции.
Исследования показали, что при приеме метаквалона наблюдается большое сходство в действии его с другими депрессантами, такими, как алкоголь.
Сегодня сложилось устойчивое мнение, что недостатки метаквалона и других небарбитуратных успокоительных превосходят практические достоинства, и эти препараты практически не используются для помощи при бессоннице и тревожном состоянии. В списке наркотических веществ метаквалон входит в Группу N1 и не выпускается в медицинских целях. Главной причиной утраты позиций этими препаратами и барбитуратами было широкое распространение бензодиазепинов в качестве альтернативного медикаментозного средства.
– Психотомиметики (галлюциногены, психодизлептики, делиранты) представлены группой психоактивных веществ, вызывающих обратимые психотические нарушения без выраженных соматических растройств. Наиболее широко распространены диэтиламид лизергиновой кислоты (LSD), псилоцибин (у нас имеет место злоупотребление псилоцибинсодержащими грибами), фенциклидин и его производные ("экстези" и др.). Препараты применяются внутрь и внутривенно.В патогенезе психоза, вызываемого LSD и другими психотомиметиками, основное значение придается влиянию на серотонинергические и дофаминергические системы мозга. LSD относится к числу наиболее токсичных препаратов и вызывает у человека острый психоз в дозе 0,0005-0,001 мг/кг, психические расстройства развиваются через 10-30 минут после попадания препарата в организм и сохраняются в течение 5-10 часов. На высоте интоксикации с постоянством отмечаются различные обманы восприятия (гиперестезии, иллюзии, зрительные и слуховые галлюцинации), при этом галлюцинаторные образы отличаются яркой окрашенностью, калейдоскопически сменяют друг друга. При тяжелых отравлениях развиваются явления дереализации и деперсонализации, характерны расстройства восприятия времени.
Экстази является наркотиком со стимулирующим и эйфоризирующим эффектом. Распространен широко, модную маленькую таблетку продают почти во всех дансклубах и дискотеках. Не вызывает сильную психическую зависимость с первого приема. Молодежь подкупает возможность радостно прыгать всю ночь под музыку с ритмом 240 ударов в минуту. На следующий день после того как человек, принявший экстази, проспится, он полностью забывает все события прошедших суток, причем, придя следующим утром на работу или в школу, удивленно узнает, что он прогулял день. Даже обычная доза экстази может привести к резкому обезвоживанию, нарушению сердечного ритма и даже внезапной смерти у людей с патологией сердца. Причем на вскрытии ничего специфического не находят.
По своим терапевтическим эффектам наркотики можно классифицировать на стимуляторы, депрессанты и галлюциногены (табл. 36,37, 38).
Депрессанты включают алкоголь, барбитураты, небарбитуратные успокоительные, бензодиазепины, все они обладают похожим действием при эквивалентной дозировке. и между ними существует перекрестная толерантность. Депрессанты могут усиливать друг друга, существует также перекрестная зависимость, поэтому соответствующая доза любого депрессанта может использоваться для уменьшения абстинентного синдрома, вызванного любым другим. Например, бензодиазепины часто используются для смягчения последствий при отказе от алкоголя.
Таблица 36
Основные стимуляторы
|
Общее название |
Торговое название |
Название на сленге |
|
Кокаин |
Кокс, Снег, База, Быстрый, Coke, Snow, Base, Quick |
|
|
Амфетамин |
Benzedrine |
Беннис, Белый крестик Bennies, White cross |
|
Декстроамфетамин |
Dexedrine, Biphetamine |
Кадиллак, Дексис, Черная красота, Cadillacs, Dexies, Black beauties |
|
Метамфетамин |
Methedrine, Desoxyn |
Спид, Рычаг, Лед, Speed, Crank, Ice |
|
Метилфенидат |
Ritalin Фенметразин Preludin |
Barn |
Депрессанты снимают чувство беспокойства на уровне малых доз, вызывают интоксикацию при умеренных дозах, стимулируют успокоение и сон на уровне больших доз, вызывают общую анестезию в очень больших дозах и, в конце концов, могут привести к коме и смерти. Успокоительные препараты используются в медицинских целях намного чаще, чем другие. Бензодиазепины в настоящее время являются наиболее важным классом препаратов для лечения беспокойств и бессонницы.
Таблица 37
Препараты-депрессанты
| Общее название | Торговое название |
| Гипнотические препараты | |
| Барбитураты | |
| Пентобарбитал | Nembutal |
| Секобарбитал | Seconal |
| Амобарбитал | Amytal |
| Фенобарбитал | Luminal |
| Хлоралгидрат | |
| Метаквалон | Quaaludes |
| Этхлорвинол | Placidyl |
| Золпиден | Ambien |
| Анестетики | |
| Халотан | Fluothene |
| Оксид нитрата | |
| Транквилизаторы | |
| Бензодиазепины | |
| Хлордиазепоксид | Librium |
| Диазепам | Valium |
| Флуразепам | Dalmane |
| Алпразолам | Хапах |
| Лоразепам | Ativan |
| Оксазепам | Serax |
| Темазепам | Restoril |
| Хлоразепат | Tranxene |
| Триазолам | Halcion |
| Небарбитураты, Небензодиазепины | |
| Мепробамат | Equanil |
| Гидроксизин | Vistaril, Atarax |
| Этинамат | Valmid |
| Буспирон | BuSpar |
Галлюциногены – это самая интересная и менее понятная группа наркотиков. Они сильно влияют на настроение, процессы мышления, а также психическую деятельность. Галлюциногены изменяют практически все аспекты психологического функционирования.
Существует более 90 видов растений и еще больше синтетических препаратов, которые обладают галлюциногенным эффектом. По клиническим проявлениям, ими вызываемым, галлюциногены можно подразделить на четыре группы:
– серотонергические галлюциногены, куда входят синтетическое вещество диэтиламид лизергиновой кислоты (LSD) и сопутствующие наркотики, такие как мескалин (добывается из кактуса пейота) и псилоцибин, содержащийся в некоторых грибах. Они вызывают ярко выраженные визуальные галлюцинации, а также другие изменения в сознании. Все они воздействуют на передачу серотонина в мозге.
– MDA и MDMA (экстази), относящиеся к метиловым амфетаминам, вызывают изменения в настроении и сознании и очень мало, или вообще не влияют на сенсорные ощущения. Очевидно, подобно амфетамину и кокаину, они воздействуют на дофаминовые и норадреналиновые синапсы, хотя, как полагают, они так же влияют на серотонин.
– антихолинергические галлюциногены, менее распространенные и включающие такие вещества как атропин и скополамин, содержащиеся в мандрагоре, белене, белладонне и дурмане. Они погружают человека в гипнотический транс, после которого человек не помнит ничего или почти ничего. Эффект связан с действием на холинергические синапсы мозга.
– фенциклидин (РСР или ангельская пыль) и такое соединение как кетамин. Они способны вызывать обезболивание в ходе операции, в то время как пациент не теряет сознания полностью. Очевидно, РСР действует на рецептор, влияющий на активность нейромедиатора глутамина.
Таблица 38
Серотонергические галлюциногены
|
Наркотик |
Ботанический источник |
Распространение |
|
Диэтиламид лизергиновой кислоты (LSD) |
Синтетический, но происходит из гриба спорыньи |
Происходит из Европы |
|
Ибогаин |
Растение Ибога Tabernanthe Iboga |
Африка |
|
Псилоцибин |
Грибы семейства Psylocybe |
По всему миру |
|
Диметилтриптамин |
Дерево Virola calophylla и другие виды |
Южная Америка |
|
Мескалин |
Кактус пейот |
Мексика и юго-запад США |
|
Хармалин, Хармин |
Виноград Banisteriopsis caapi, Banisteriopsis inebrians |
Южная Америка |
|
Ергин, Изоэргин |
Семена вьюнка Rivea corymboza, Ipomoea violacea |
По всему миру |
Существует восемь способов приема наркотических средств, из которых пять стандартных (через рот, три вида парентерального приема и ингаляция) и три менее распространенных - интраназальный (вдыхание), сублингвальный (помещение под язык) и трансдермальный (через кожу).
Среди прочно сформировавшихся наркоманов используется в основном внутривенный способ введения препарата. Людей, регулярно принимающих героин, кокаин или их смесь ("speedball") внутривенно, часто называют "прочно севшими" наркоманами. Они вкалывают наркотик в вену, потому что хотят немедленного и сильного действия. Летальный исход при внутривенном употреблении наркотика – обычное дело в среде наркоманов.
Ингаляция применима к наркотикам, которые можно привести в газообразное состояние. Можно вдыхать вещества, являющиеся компонентами обычных и доступных промышленных продуктов. Можно ингалировать смесь газа и наркотика с мелкими частицами, например, табачный дым и дым крэка. Ингаляция наркотика дает почти полную и быструю абсорбцию.
Наркотик в виде порошка вдыхается через нос. Он абсорбируется через слизистую оболочку носа и носовые пазухи. Обычно таким способом принимают кокаин, героин и нюхательный табак.
Растворение под языком с абсорбцией через слизистую оболочку полости рта используют при приеме никотина в виде табачной жвачки или "сырого" порошка. Таким способом принимают наркотики, которые раздражают желудок и вызывают рвоту. В виде пилюль можно употреблять почти любое вещество с наркотическими свойствами. Но этот способ менее популярен, чем можно было бы ожидать, так как многие наркотики имеют неприятный вкус
Прием наркотиков через кожу является альтернативой приему внутрь через рот, если вещество плохо влияет на пищеварительный тракт. Но многие вещества невозможно принимать этим способом, так как кожа для них сравнительно плохо проницаема.
После абсорбции наркотика его большую часть получают сердце, мозг, почки, печень и другие органы, в которые поступает много крови. До частей тела, в которых кровообращение не столь интенсивно (мышцы, внутренние органы и жировая клетчатка), наркотик доходит значительно позднее. Помимо кровообращения, на характер распространения влияет пропускная способность оболочек и тканей. Ткани с более высокой пропускной способностью получают наркотик быстрее.
На распространение оказывают значительное влияние физико-химические свойства наркотиков, например, растворимость в жирах - чем лучше наркотик растворяется в них, тем легче он проходит через оболочки и быстрее достигает места своего действия. От растворимости вещества в жирах сильно зависит, сколько его попадает в мозг. Если наркотик хорошо растворим в жирах, он легко проходит и через капилляры и через мембраны глиальных клеток
Такие наркотики, как барбитураты, взаимодействуют с определенными белками плазмы. Чем более избирательно наркотик реагирует с элементами организма, тем медленнее он переносится в нужное место. Подобно этому химическое строение некоторых наркотиков делает их предрасположенными к реакции с тканью организма. В этом случае наркотик может освободиться из этой ткани только спустя длительное время. Он может появиться в крови, но его высвобождение из жировой ткани идет настолько медленно, что он оказывает совсем незначительное воздействие на психику. Например марихуана из-за избирательного характера соединения с молекулами организма не разносится по всему телу, и эффект ослаблен. Табл. 39 демонстрирует время выведения различных наркотиков из организма.
Таблица 39
Время выведения из организма и возможного определения употребления наркотиков
| Наркотик | Время выведения | Время определения (сутки) |
| Алкоголь | часы | до 1 суток |
| Кокаин | часы-дни | 2-4 |
| Марихуана | Недели-месяцы | 2-8 14-42 |
| Бензодиазепины | Недели-месяцы | 7-9 |
| Опиаты | Дни-недели | 1-2 |
|
Барбитураты |
Недели-месяцы |
3-14 |
Из организма наркотики выводятся непосредственно или сначала разлагаються на метаболиты, вероятность повторной абсорбции которых мала. Ферменты печени играют в метаболизме наркотиков главную роль. Эти ферменты содержатся и в других органах, таких как почки и пищеварительный тракт. Поэтому принятый внутрь через рот наркотик подвергается частичному разложению ферментами и до нужного места доходит меньше вещества, чем было принято. Некоторые метаболиты наркотика фармакологически активны и способны вызывать, например, побочные эффекты различных лекарств.
Выводятся наркотики из организма главным образом через почки, хотя некоторые наркотики, принятые внутрь через рот, иногда выводятся вместе с фекалиями. Метаболиты наркотика могут удаляться с желчью.
Наркотики поступают в материнское молоко, и хотя выводимое таким образом количество наркотика мало, младенец подвергается серьезному риску наркотизации.
Цель потребления наркотика – получить психическое и физическое удовольствие. Вот описание этого одним из больных наркоманией: "Приход от амфетаминов не сравнится ни с чем. Отсыпаешь порошка, растворяешь в воде, набираешь в баян. Затем перетягиваешь руку ремнем. В это время ты очень возбужден, сердце колотится, потому что ты знаешь, что через пару минут ты будешь счастлив. И вот ты вмазываешься".
При повторных введениях препаратов опия и их синтетических аналогов (например, промедол) развивается наркомания. У большинства людей наркомания развивается при постоянном введении, например, морфина на протяжении 2–3 недель. Если препараты опия вызывают не угнетение, а возбуждение нервной системы, привыкание развивается быстрее. Человек с лекарственной зависимостью к морфину стремится к повторному введению препаратов опия, причем в течение суток он способен воспринять громадные дозы морфина, до 14 граммов, к то время как для человека, не страдающего морфинизмом, смертельной является доза 0,2-0,4 грамма.
Тяга к повторному введению морфина обусловлена своеобразной реакцией больного морфинизмом человека на введение препарата. Наиболее наглядно клинику морфинизма описал Н. В. Вершинин (1952): «…скучный становится веселым, жизнерадостным, молчаливый — словоохотливым, робкий — смелым, слабый чувствует прилив энергии, причем переоценивает
свои силы и способности. Ощущение прекрасного самочувствия и подъем энергии (эйфория), появляющиеся при впрыскивании морфина, больной стремится вызнать повторно... Такой человек становится полным рабом своих страстей. Болезнь неудержимо прогрессирует и доводит его до самого плачевного состояния: развиваются страдания желудочно-кишечного канала (колики, запор, понос, и др.), появляются невралгия, нервозность, дрожание рук, наблюдаются трофические расстройства: ногти рук и ног становятся сухими, теряют блеск и делаются хрупкими, волосы седеют, зубы расшатываются и выпадают, общее питание падает. Ко всем этим явлениям присоединяются изменения со стороны психики: ослабление интеллекта, памяти, деморализация и психозы. Больной становится слабохарактерным, недобросовестным, лживым, неспособным ни к умственной , ни к физической работе, впадает в мизантропию и чуждается всех окружающих, даже самых близких.
Хотя морфин с течением времени перестает оказывать на организм оживляющее действие, больной не может отказаться от него. Дело в том, что в случае прекращения обычных приемов морфина развиваются тяжелые явления, так называемые воздержания (морфинная абстиненция), выражающиеся в беспокойстве, сильной тоске, тошноте, рвоте, дрожании конечностей, в общей слабости и даже коллапсе или, наоборот, в сильном маниакальном возбуждении. Явления эти настолько мучительны, что больной старается всеми способами раздобыть морфин, прибегая к воровству, угрозам и пр.».
Абстиненции синдром, или синдром лишения наркотиков развивается у новорожденных детей, родившихся у матерей, страдающих наркоманией и потребляющих марихуану, героин, кокаин и другие опийные препараты. В зависимости от длительности использования и количества наркотических веществ, принимаемых беременной женщиной синдром абстиненции формируется практическим у всех детей, если мать принимала в течение всей беременности более одного наркотика, у 60-90% детей при употреблении наркотиков в первые два триместра беременности.
У детей синдром характеризуется нарушениями функции нервной системы в виде повышенной возбудимости, избыточной хаотической двигательной активности конечностей, головы, гиперестезии, гиперкаузии (болезненное реагирование на пеленание, попытки взять на руки, резкий звук, яркий свет), пронзительного крика, «судорожной готовности». У этих детей часто повышен мышечный тонус, оживлены сухожильные рефлексы, имеются патологические рефлексы, вегетативные нарушения. Часто наблюдается парез кишечника.
У новорожденных детей с синдромом абстиненции выявляются изменения соматического статуса, в частности внутриутробная гипотрофия с дефицитом массы и роста, иногда выявляются пороки развития внутренних органов (сердца, почек, мягкого неба). В тяжелых случаях синдром клинически напоминает картину таких заболеваний, как сепсис, пневмония, менингит, гастроэнтероколит, перинатальная энцефалопатия гипоксически-травматического генеза.
Клиника синдрома абстиненции чаще всего выявляется в первые 72 часа после родов, реже - в течение 3-4 недель жизни. При приеме наркотиков беременной женщиной ближе к родам время клинических проявлений синдрома у новорожденного более отсрочено, но клиника утяжеляется.
В диагностике синдрома абстиненции у новорожденного помогает триада симптомов: гиперреактивность вегетативной нервной системы, психическое возбуждение и мышечно-суставная болезненность. Лабораторно подтверждается синдром лишения наркотика наличием в моче ребенка и матери наркотиков и их метаболитов.
Выраженное действие на биотрансформацию некоторых лекарственных средств оказывает алкоголь, причем влияние его отличается при однократном и длительном приеме. Даже однократный прием алкоголя вызывает снижение скорости разрушения различных лекарственных веществ в печени и увеличение их эффекта. К таким препаратам прежде всего относят средства, угнетающие ЦНС, в частности бензодиазепины, барбитураты, фенотиазины. При одновременном приеме алкоголя с амитриптилином могут развиться экстрапирамидные расстройства. С другой стороны, сами препараты, влияющие на ЦНС, усиливают действие алкоголя. Алкоголь также повышает эффект оральных противодиабетических средств и непрямых антикоагулянтов.
Под влиянием длительного употребления алкоголя в печени увеличивается активность окислительных ферментов, участвующих в биотрансформации лекарственных средств. Эффективность их при этом снижается, что требует увеличения дозы, например, барбитуратов, бензодиазепинов, парацетамола и др.
Ряд лекарственных препаратов, например, метронидазол, фуразолидон, хлорамфеникол, гризеофульвин вмешивается в биотрансформацию алкоголя и оказывают антабусное действие. Прием таких препаратов сопровождается у больных алкоголизмом головной болью, сердцебиением, тошнотой и может привести к тяжелым нарушениям ритма и снижению артериального давления.
В результате алкогольного поражения печени нарушается биотрансформация барбитуратов, бензодиазепинов, изониазида, фуросемида, пропранолола, ампициллина. Как следствие увеличивается их период полувыведения и клиническое действие. Такие препараты следует применять очень осторожно или заменять их средствами, выведение которых осуществляется почками.
Курения табака также влияет на биотрансформацию лекарственных средств, так как никотин повышает или снижает активность ферментов метаболизма. Например, курение повышает скорость метаболизма фенацетина, пропранолола, теофиллина, имицина, ноксирона, аминазина и диазепама.
Годы жизни прошли не даром…
Гете
При назначении лекарственных препаратов беременным женщинам необходимо учитывать как характеристику назначаемого препарата (применяются только препараты с установленной безопасностью применения при беременности и известными путями метаболизма), так и срок беременности (так как срок окончательного завершения эмбриогенеза установить невозможно, рекомендуется особенно тщательно подходить к назначению медикаментов до 5 мес беременности).
Классифицируют три критических периода эмбриогенеза, когда наиболее опасно воздействие таких неблагоприятных факторов как вирусы, лекарственные препараты или продукта обмена веществ в чрезмерной концентрации. Так, на первой неделе беременности повреждающие факторы вызывают гибель зародыша и прерывание беременности или не оставляют за счет высокой регенераторной способности эмбриона. I критический период приходится на конец первой недели беременности, когда начинается дифференциация клеток, повышается обмен веществ эмбриона и снижается регенераторная способность. Этот период характеризуется повышенной чувствительностью к лекарственным веществам. По завершению имплантации начинается период органогенеза, завершение которого приходится к 3-4-му месяцу внутриутробной жизни. Первые 3-8 недель этого периода (II критический период) являются наиболее чувствительной фазой, именно на этот период приходится тератогенное и эмбриотоксическое действие препаратов, приводящее соответственно к формированию пороков развития и гибели плода. Патология развивается тех органов, которые в этот момент находятся в процессе дифференциации, причем пороки развития зависят от прямого действия лекарственного вещества на эмбриональные органы и ткани.
По завершению органогенеза начинается плодный, или фетальный, период развития, продолжающийся до 40 недель. Эмбриотоксические и тератогенные поражения в этот период практически не формируются за исключением аномалий развития половых органов у плодов женского пола, возникающих под влиянием препаратов андрогенного действия.
III критический период приходится на 18-22-й недели беременности, когда происходят наиболее значительные изменения биоэлектрической активности головного мозга, гемопоэза, продукции гормонов.
Помимо того, что под влиянием лекарственных препаратов на организм матери и плода возможны эффекты, связанные с влиянием самой беременности на фармакокинетику препаратов, в частности на всасывание, распределение и выведение, что обусловливает изменением их эффектов. Например, замедление моторики желудочно-кишечного тракта в последние месяцы беременности может приводить либо к увеличению всасываемости плохо растворимых препаратов, как дигоксин, или к уменьшению всасываемости тех препаратов, которые метаболизируются в стенке желудочно-кишечного тракта (к примеру, хлорпромазин).
В последний триместр беременности на 50% увеличивается объем внеклеточной жидкости, а концентрация белков плазмы падает приблизительно на 20%, концентрация кислого альфа-гликопротеина увеличивается приблизительно на 40%. Поэтому при приеме лекарственных препаратов в последнем триместре беременности содержание одних препаратов в крови значительно увеличивается, а других – снижается, что в конечном итоге изменяет предполагаемый эффект лекарств.
У женщин в конце срока беременности значительно изменяется функция печени и почек, участвующих в выведении и метаболизме препаратов. В результате клиренс одних препаратов может увеличиваться, а других – снижаться, что может послужить причиной серьезных осложнений медикаментозной терапии [Diav-Citrin O. et al., 1999].
Действие лекарственных препаратов на плод продолжается и в период родов, в среднем за этот короткий период около 1/3 плодов получают от матери более 6 лекарственных веществ. Причем, если промедол, применяемый как анальгетическое и спазмолитическое средство, способствует раскрытию шейки матки и не безопасен для матери и плода при нормальном течении беременности, при патологии беременности, асфиксии в родах, недоношенности может вызвать угнетение дыхания у плода и новорожденного. Неингаляционные и ингаляционные средства общей анестезии легко проходят через плаценту, оказывая на ЦНС плода угнетающее действие.
Американская администрация по контролю за лекарствами и пищевыми продуктами (Food and Drug Administration – FDA) придерживается следующих принципов характеристики лекарственных препаратов, используемых для лечения беременных женщин:
А – в результате адекватных строго контролируемых исследований не выявлено риска неблагоприятного действия на плод в I триместр беременности (и нет данных, свидетельствующих о подобном риске в последующих триместрах).
В – изучение репродукции на животных не выявило риска неблагоприятного действия на плод, а адекватных и строго контролируемых исследований у беременных женщин не проведено.
С – изучение репродукции на животных выявило неблагоприятное действие на плод, а адекватных и строго контролируемых исследований у беременных женщин не проведено, однако потенциальная польза, связанная с применением лекарственного средства у беременных, может оправдывать его использование, несмотря на возможный риск.
D – имеются доказательства риска неблагоприятного действия лекарственного средства на плод человека, полученные при проведении исследований или на практике, однако потенциальная польза, связанная с применением лекарственного средства у беременных, может оправдывать его использование, несмотря на возможный риск.
Х – испытания на животных или клинические испытания выявили нарушения развития плода и/или имеются доказательства риска неблагоприятного действия лекарственного средства на плод человека, полученные при проведении исследований или на практике; риск, связанный с применением лекарственного средства у беременных, превышает потенциальную пользу.
В соответствии с этой градацией, характеристика антибиотиков представлена в табл. 40
Таблица 40
Особенности применения антибактериальных препаратов при беременности и грудном вскармливании
|
Препарат |
Официальная информация производителя: Беременность/Грудное вскармливание |
Особенности действия при беременности |
Особенности действия при грудном вскармливании |
||||||
|
Пенициллины |
|
Проникают через плаценту, однако неблагоприятное влияние на плод, как правило, отсутствует. При беременности увеличен клиренс пенициллинов |
Проникают в грудное молоко. Возможно изменение кишечной микрофлоры, сенсибилизация ребенка, кандидоз, кожная сыпь |
||||||
|
Амоксициллин |
С осторожностью/ С осторожностью |
Проникает через плаценту в высоких концентрациях. Данных об увеличении числа врожденных аномалий нет |
Проникает в грудное молоко |
||||||
|
Ампициллин, ампициллин/ сульбактам |
С осторожностью/ С осторожностью |
Быстро проникает через плаценту, но в низких концентрациях. Снижает как плазменный уровень, так и экскрецию эстриола с мочой путем нарушения гидролиза конъюгированных стероидов в кишечнике. Эстриол мочи используется для оценки состояния фетоплацентарной системы, снижение его уровня может быть признаком дистресс-синдрома |
Проникает в грудное молоко |
||||||
|
Карбенициллин |
С осторожностью |
Проникает через плаценту в высоких концентрациях |
Проникает в грудное молоко в низких концентрациях |
||||||
|
Оксациллин |
С осторожностью |
Проникает через плаценту в высоких концентрациях |
Проникает в грудное молоко в низких концентрациях |
||||||
|
Цефалоспорины |
|
Проникают через плаценту в низких концентрациях. Отрицательного влияния на плод не выявлено |
Проникают в грудное молоко. Возможно изменение кишечной микрофлоры, сенсибилизация ребенка, кандидоз, кожная сыпь |
||||||
|
Цефадроксил, цефазолин, цефалексин |
С осторожностью |
Проникают через плаценту в высоких концентрациях. Отрицательного влияния на плод не выявлено |
Проникают в грудное молоко в очень низких концентрациях |
||||||
|
Цефаклор, цефуроксим |
С осторожностью |
Быстро проникают через плаценту. Отрицательного влияния на плод не выявлено |
Цефуроксим применять с осторожностью |
||||||
|
Карбапенемы |
|||||||||
| Имипеем/циластатин, меропенем |
С осторожностью |
Исследований у человека не проведено |
Нет данных о безопасности применения при лактации. В оправданных случаях допускается применение имипенем/циластатина |
||||||
|
Монобактамы |
|||||||||
|
Макролиды |
|
Адекватных и строго контролируемых исследований у женщин не проводилось. Ряд препаратов применяется в период беременности для лечения хламидиоза, токсоплазмоза |
Проникают в грудное молоко. Отрицательного влияния на ребенка не выявлено |
||||||
|
Рокситромицин |
Запрещено/ Запрещено |
Нет данных |
Проникает в грудное молоко в высоких концентрациях |
||||||
|
Эритромицин |
С осторожностью/ С осторожностью |
Данных об увеличении числа врожденных аномалий нет. Проникает через плаценту в низких концентрациях. Во время беременности противопоказан эритромицина эстолат |
Проникает в грудное молоко в низких концентрациях |
||||||
|
Аминогликозиды |
|
Проникают через плаценту. Высокий риск ототоксичности и нефротоксичности |
Проникают в грудное молоко в низких концентрациях. Возможно влияние на микрофлору кишечника |
||||||
|
Амикацин |
Запрещено/ Запрещено |
Проникает через плаценту в высоких концентрациях. Высокий риск ототоксичности |
Проникает в грудное молоко в низких концентрациях. Адекватных и строго контролируемых исследований не проводилось |
||||||
|
Гентамицин |
Запрещено/ С осторожностью |
Проникает через плаценту в средних концентрациях. Адекватных и строго контролируемых исследований у женщин не проводилось |
Проникает в грудное молоко в низких концентрациях |
||||||
|
Канамицин |
Запрещено/ С осторожностью |
Проникает через плаценту в высоких концентрациях. Высокий риск ототоксичности |
Проникает в грудное молоко в низких концентрациях |
||||||
|
Неомицин |
Запрещено/ Запрещено |
Данные о безопасности отсутствуют |
Данные о безопасности отсутствуют |
||||||
|
Стрептомицин |
Запрещено в I триместре, в остальных - с осторожностью/ С осторожностью |
Быстро проникает через плаценту в высоких концентрациях. Высокий риск ототоксичности |
Проникает в грудное молоко в низких концентрациях |
||||||
|
Тобрамицин |
Запрещено/ С осторожностью |
Проникает через плаценту в высоких концентрациях. Высокий риск ототоксичности |
Проникает в грудное молоко в низких концентрациях |
||||||
|
Тетрациклины |
|||||||||
|
Оксициклин, тетрациклин
|
Запрещено/ Запрещено |
Проникают через плаценту, накапливаются в костях и зубных зачатках плода, нарушая их минерализацию. Высокий риск гепатотоксичности |
Проникают в грудное молоко. Нарушение развития зубных зачатков, линейного роста костей, фотосенсибилизация, изменение кишечной микрофлоры, кандидоз |
||||||
|
Фторхинолоны/Хинолоны
|
|
Адекватных и строго контролируемых исследований у женщин не проведено. Высокий риск артротоксичности |
Проникают в грудное молоко. Высокий риск артротоксичности |
||||||
|
Офлоксацин |
Запрещено/Запрещено |
Проникает через плаценту в высоких концентрациях |
Проникает в грудное молоко |
||||||
|
Ципрофлоксацин |
Запрещено/Запрещено |
Проникает через плаценту |
Проникает в грудное молоко в высоких концентрациях |
||||||
|
Линкозалиды |
|||||||||
|
Клиндамицин, линкомицин |
Запрещено/ Запрещено |
Проникают через плаценту в высоких концентрациях. Возможна кумуляция в печени плода |
Проникают в грудное молоко. Возможно изменение кишечной микрофлоры, сенсибилизация ребенка |
||||||
|
Нитроимидазолы |
|
Проникают через плаценту, данные о частоте врожденных дефектов противоречивы, не исключено повреждающее действие на плод в I триместре |
Проникают в грудное молоко, действие на ребенка не изучено |
||||||
|
Метронидазол |
Запрещено в I триместре, в остальных - с осторожностью/ Запрещено |
Проникает через плаценту в высоких концентрациях. Имеются указания на дефекты головного мозга, конечностей, гениталий |
Проникает в грудное молоко в высоких концентрациях. Возможна анорексия, рвота, диарея и др. |
||||||
|
Нитрофураны
|
|
Адекватных и строго контролируемых исследований у женщин не проведено |
Адекватных и строго контролируемых исследований у человека не проведено |
||||||
|
Фуразолидон |
С осторожностью/ С осторожностью |
Нет данных |
Нет данных |
||||||
|
Полимиксины |
С осторожностью/ С осторожностью |
Нет данных о повреждающем действии препарата на плод |
Нет данных |
||||||
|
Препараты других групп |
|||||||||
|
Хлорамфеникол |
Запрещено/ Запрещено |
Быстро проникает через плаценту в высоких концентрациях. Возможно развитие «серого синдрома» или угнетение костного мозга, особенно при назначении на поздних сроках беременности |
Проникает в грудное молоко |
||||||
|
Фузидиевая кислота |
С осторожностью/ С осторожностью |
Фузидиевая кислота проникает через плаценту. Адекватные данные о безопасности, отсутствуют. Возможно развитие билирубиновой энце-фалопатии, назначать только в случае крайней необходимости |
Проникает в грудное молоко. Назначать только в случае крайней необходимости |
||||||
Абсолютно противопоказанные беременным женщинам лекарственные препараты [Kacev and Lock, 1990; Cordero, 1990; Kacev, 1993] представлены в табл. 41
Таблица 41
Лекарственные средства, абсолютно противопоказанные в период беременности
|
Лекарства |
Последствия для плода |
|
Аминоптерин |
Множественные аномалии, постнатальная задержка развития плода, аномалии черепно-лицевого отдела, смерть плода |
|
Андрогены |
Вирилизация, укорочение конечностей, аномалии трахеи, пищевода, дефекты сердечно-сосудистой системы |
|
Диэтилстильбестрол |
Аденокарцинома влагалища, дефекты шейки матки, пениса, гипотрофия яичек |
|
Стрептомицин |
Глухота |
|
Дисульфирам |
Спонтанные аборты, расщепление конечностей, косолапость |
|
Эрготамин |
Спонтанные аборты, симптомы раздражения ЦНС |
|
Эстрогены |
Врожденные дефекты сердца, феминизация мужского плода, аномалии сосудов |
|
Газовые анестетики(галотан) |
Спонтанные аборты |
|
Иод131 |
Кретинизм, гипотиреоз |
|
Метилтестостерон |
Маскулинизация женского плода |
|
Прогестины |
Маскулинизация женского плода, увеличение клитора, пояснично-крестцовое сращение |
|
Хинин |
Задержка психического развития, ототоксичность, врожденная глаукома, аномалии мочеполовой системы, смерть плода |
|
Талидомид |
Дефекты конечностей, аномалии сердца, почек и желудочно-кишечного тракта |
|
Триметадон |
Характерное лицо (V-образные брови и низко поставленные глаза), аномалии сердца, глаз, задержка психического развития |
|
Ретиноиды (изотретиноин, роанккутан, этретинат, тигазон, ацитретин) |
Аномалии конечностей, черепно-лицевых отделов, аномалии сердца и ЦНС, мочеполовой системы, недоразвитие ушных раковин |
По обобщенным данным литературы лекарственные препараты, приведенные в табл. 42, обладают тератогенным действием и относятся к категории D.
Таблица 42
Лекарственные средства, обладающие тератогенным действием
|
Лекарства |
Последствия для плода |
|
Антибиотики |
|
|
Стрептомицин |
Ототоксичность |
|
Тетрациклин |
Дисколорация зубов, гипоплазия зубной эмали |
|
Антидепрессанты |
|
|
Литий |
Врожденные заболевания сердца, зоб, гипотония, неонатальный цианоз |
|
Диазепам |
Гипотермия, гипотония, раздвоение и аномалии конечностей |
|
Имипрамин |
Нарушения со стороны органов дыхания, дефекты конечностей, тахикардия, задержка мочи, неонатальный дистресс-синдром |
|
Нортриптилин |
Неонатальный дистресс-синдром, цианоз, гипертония, тремор, задержка мочи |
|
Анальгетики |
|
|
Аспирин |
Неонатальное кровотечение, внутричерепное кровотечение у недоношенных, стойкая гипертензия легочной артерии |
|
Индометацин |
Неонатальная гипертензия легочных артерий, нарушение сердечно- легочной адаптации, смерть плода |
|
Антикоагулянты |
|
|
Варфарин |
Эмбриопатия, задержка развития, атрофия зрительного нерва, судороги, кровотечение, приводящее к летальному исходу |
|
Противосудорожные |
|
|
Фенобарбитал |
Ухудшение слуха, угнетение ЦНС, анемия, тремор, синдром отмены, гипертензия |
|
Фенитоин |
Аномалии конечностей и черепно-лицевого отдела, задержка умственного развития, врожденные заболевания сердца, кровотечения |
|
Вальпроат натрия |
Расщелина позвоночника |
|
Этосуксимид |
Монголоидная внешность, короткая шея, лишний сосок, задержка развития, дермоидная фистула |
|
Гипотензивные |
|
|
Хлоротиазид |
Холестаз, панкреатит |
|
Резерпин |
Гиперемия слизистой носа, летаргия, гипотермия, брадикардия |
|
Противомалярийные |
|
|
Хлорохин |
Ототоксичность |
|
Противоопухолевые |
|
|
Азатиопирин |
Стеноз легких, полидактилия, лицевой дисморфогенез |
|
Бусульфан |
Задержка внутриутробного и послеродового развития, помутнение роговицы |
|
Хлорамбуцил |
Нарушения функции почек |
|
5-фторурацил |
Аборты, дефекты черепно-лицевого отдела |
|
Колхицин |
Спонтанные аборты, трисомия 21 |
|
Меркаптопурин |
Аборты, дефекты черепно-лицевого отдела |
|
Метотрексат |
Отсутствие лобной кости, сращение костей черепа, аборты, задержка послеродового развития |
|
Винкристин |
Маленький плод, неправильное положение плода |
|
Антитиреоидные |
|
|
Метимазол |
Зоб, изъязвление срединного отдела волосистой части головы |
|
Гипогликемические |
|
|
Хлорпропамид |
Частые пороки развития, гипогликемия |
|
Транквилизаторы |
|
|
Хлордиазепоксид |
Депрессия, полусознательное состояние, синдром абстиненции гипервозбудимость |
|
Мепробамат |
Врожденные дефекты сердца, синдром абстиненции, пороки диафрагмы |
|
Витамины |
|
|
Витамин А в дозах свыше 10.000 МЕ в сутки |
Дефекты сердечно-сосудистой системы, ушных раковин и др. |
Хотя беременность и роды относятся к физиологическим процессам, они, обусловливая гормональную перестройку организма женщины, увеличивают риск развития патологических процессов, дают обострение хронической патологии. В силу всевозрастающего действия вредных факторов окружающей среды растет число рожениц, страдающих хроническими заболеваниями, что определяет необходимость их лечения как во время беременности, так и в период вскармливания новорожденных грудью. В то же время неоправданно мало данных о влиянии лекарственных веществ, поступающих к ребенку с грудным молоком, к тому же определить содержание многих препаратов в биологических жидкостях достаточно трудно.
Влияние лекарственных препаратов на секрецию грудного молока опосредуется через гормоны, в частности пролактин, частично эстроген и прогестерон. Так, секреция пролактина снижается под действием L-допы, бромокриптина и повышается под влиянием фенотиазина, амфетамина, метилдопы и теофиллина.
Принимаемые матерью лекарственные препараты могут проникать в грудное молоко и влиять на ребенка. Возможность проникновения лекарства в грудное молоко определяется его способностью связываться с белками плазмы крови и молока, степени ионизации, кислотности и растворимости в жирах.
Препараты, имеющие выраженное сродство к белкам плазмы крови, обычно плохо проникают в грудное молоко. Так как рН молока несколько ниже, чем плазмы ионизация оснований несколько выше в молоке, а кислот — в плазме крови. С ростом силы оснований растет проникновение их в молоко, но снижается его скорость и наоборот с ростом силы кислот снижается и проницаемость, и скорость перехода. Жирорастворимые препараты быстрее проникают в молоко, чем водорастворимые.
Так как молоко представляет собой жировую эмульсию, лекарственные препараты концентрируются в липидной фракции молока и могут достигать там даже больших концентраций, чем в плазме. Доля препарата, попавшего к ребенку с молоком матери, растет с ростом периода полувыведения и снижается с ростом объема распределения препарата в организме кормящей женщины.
Из группы антибиотиков пенициллины и цефалоспорины выводятся с молоком матери в относительно малых количествах (5-20 % от концентрации препарата в плазме крови), а содержание тетрациклина в грудном молоке приближается к таковому в крови матери. В грудном молоке незначительны концентрации линкомицина, клиндомицина и эритромицина. Хотя аминогликозиды обнаруживаются в молоке кормящих матерей, но всасывание их в желудочно-кишечном тракте ребенка происходит настолько незначительно, что риск нежелательных реакций при попадании этих препаратов в желудок ребенка с молоком матери практически отсутствует. Но назначение левомицетина кормящим женщинам противопоказано несмотря на относительно низкий индекс проникновения, так как антибиотик оказывает повреждающее влияние даже небольших количеств на развитие костного мозга.
Уровень сульфаниламидов в грудном молоке сопоставим с концентрацией их в плазме крови матери, к тому же длительно действующие сульфаниламиды могут кумулировать в организме ребенка, определяя риск развития гипербилирубинемии и гемолитической анемии у детей с дефицитом Г-6-ФДГ.
Фенобарбитал обнаруживается в грудном молоке кормящих женщин уже в первый день приема, накапливаясь в организме ребенка в концентрациях, достаточных для увеличения активности метаболизирующих ферментов в организме ребенка и, как полагают, способен вызвать изменения метаболизма половых стероидов.
Такие транквилизаторы, как диазепам (седуксен, реланиум) и некоторые из его активных метаболитов обнаруживаются в больших количества в крови ребенка на 4-6-й день после рождения в случае, когда мать принимала препарат в течение 6 дней перед родами. Хотя ребенок может получить с грудным молоком примерно 10% дозы теофиллина, принятой матерью, уровень его в организме ребенка может достигать значений, достаточных для появления раздражительности, капризности, нарушений сна. В связи с повышенной чувствительностью детей к холинолитическим агентам, целесообразно избегать применения атропина в период кормления грудью. Вместе с тем, несмотря на относительно высокое содержание в грудном молоке b-адреноблокаторов, этих количеств недостаточно для появления побочных реакций у ребенка. Также не достигает терапевтических концентраций в плазме крови ребенка дигоксин, принимаемый матерью. Антикоагулянты непрямого действия, имеющие сходную фармакокинетику с дикумарином и неодикумарином, считают безопасными для приема кормящими матерями, а гепарин не проникает через липидный барьер, поэтому его также можно применять в период кормления.
Учитывая возможные отрицательные действия лекарственных средств, принимаемых кормящей матерью на ребенка, в литературе описан [Kacev S. 1993] перечень препаратов, противопоказанных кормящей матери (табл. 43) или требующих при их назначении определенной настороженности (табл. 44).
Таблица 43
Лекарства, противопоказанные для женщин в период лактации
|
Лекарства |
Побочные эффекты |
|
Алкоголь |
Головокружение, задержка роста, синдром Кушинга, снижение выработки молока |
|
Амфетамины |
Раздражительность, нарушение сна |
|
Бромокриптин |
Угнетение лактации |
|
Левомицетин |
Угнетение костного мозга, тошнота, отказ от еды |
|
Циметидин |
Угнетение кислотности желудка у ребенка, угнетение обмена лекарств, стимуляция ЦНС |
|
Кокаин |
Синдром отмены, судороги, нарушение поведенческих реакций |
|
Циклофосфамид |
Угнетение иммунитета |
|
Циклоспорин |
Потенциальная нефротоксичность |
|
Доксорубицин |
Кардиотоксичность и угнетение костного мозга |
|
Эрготамин |
Тошнота, рвота, судороги, угнетение лактации |
|
Соли золота |
Сыпь, воспалительное поражение почек и печени |
|
Героин |
Развитие наркотической зависимости у новорожденных |
|
Иод125 |
Угнетение функции щитовидной железы |
|
Иод121 |
Риск развития рака щитовидной железы |
|
Изотретиноин |
Возможны опухоли |
|
Литий |
Нарушение функции ЦНС, сердечно-сосудистые нарушения |
|
Метадон |
При резкой отмене - синдром отмены опиата |
|
Метимазол |
Снижение функции щитовидной железы, использование пропилтиоурацила как альтернативного средства |
|
Метотрексат |
Угнетение иммунитета |
|
Метронизадол |
В молоке грудной железы присутствует в той же концентрации, что и в плазме крови женщины, поэтому возможно проявление мутагенных и канцерогенных эффектов |
|
Морфин |
Развитие привыкания |
|
Фенциклидин |
Геморрагии |
|
Галлий |
Угнетение костного мозга |
|
Салицилаты |
Метаболический ацидоз, сыпь; в качестве альтернативы предлагается парацетамол |
|
Тинидазол |
В грудном молоке присутствует в той же концентрации, что и в плазме матери, поэтому возможны мутагенные и канцерогенные эффекты |
Таблица 44
Препараты, которые следует использовать с осторожностью в период лактации
|
Лекарства |
Побочные эффекты |
|
Антациды с алюминием |
Задержка развития |
|
Амантадин |
Задержка мочи, тошнота, сыпь на коже |
|
Атропин |
Угнетение лактации, антихолинергические эффекты |
|
Хлорпромазин |
Головокружение, летаргия, гинекомастия у мальчиков, галакторея у девочек |
|
Диазепам |
Седативный эффект, аккумуляция у детей |
|
Доксепин |
Бледность, утрата ответной реакции |
|
Эстрогены |
Феминизация |
|
Индометацин |
Судороги |
|
Изониазид |
Развитие дефицита пиридоксина (витамин В6) |
|
Нитрофурантоин |
Гемолиз у детей с дефицитом гпюкозо-6-фосфат дегидрогеназы |
|
Налидиксовая кислота |
Гемолитическая анемия |
|
Новобиоцин |
Гипербилирубинемия |
|
Антикоагулянты |
Цефалогематома, повышение риска кровотечений |
|
Оральные контрацептивы |
Увеличение грудной железы, снижение продукции молока и содержания белка, феминизация, снижение веса тела |
|
Фенобарбитал |
Седативный эффект, снижение ответной реакции, метгемоглобинемия, ослабление сосательного рефлекса |
|
Фенитоин |
Метгемоглобинемия |
|
Преднизон |
Угнетение роста, угнетение функции надпочечников |
|
Сульфаниламиды |
Повышение риска окраски склер, аллергические реакции, желтуха новорожденных |
|
Метотрексат |
Угнетение иммунитета |
|
Теофиллин |
Раздражительность, нарушения сна |
|
Толбутамид |
Желтуха, гипогликемия |
Актуальная проблема – влияние алкогольных напитков, употребляемых кормящей матерью, на ребенка. Этанол хорошо проходит через клеточные мембраны и свободно распределяется в водных средах организма, поэтому он практически одновременно появляется в грудном молоке и плазме почти в одинаковых количествах В литературе описаны случаи алкогольной интоксикации у детей, вскармливающихся пьющими матерями. Но не исследовано влияние этанола на ребенка при хроническом приеме его матерью.
Особенности фармакодинамики лекарственных препаратов у детей первых трех лет жизни обусловлены медленным созреванием рецепторных систем [Wahn U. et al., 1997]. У ребенка с лекарственными веществами происходят те же биохимические изменения, что и у взрослых, однако интенсивность метаболических процессов может существенно отличаться. Так, у новорожденных скорость окислительных реакций с участием цитохрома Р450 и НАДФ-цитохром-C-редуктазы снижена вдвое, поэтому биотрансформация лекарственных веществ, в основе которой лежат эти реакции, замедляется. Из-за относительно невысокой скорости и биотрансформации лекарственных веществ увеличивается их выведение в неизмененном виде.
Активность глюкуронилтрансферазы, алкогольдегидрогеназы, эстеразы у новорожденных снижена, в связи с чем выведение препаратов, в биотрансформации которых участвуют перечисленные ферменты, у новорожденного замедляется, а период их полувыведения увеличивается.
Поэтому у детей часто не удается достичь того терапевтического эффекта на тот или иной лекарственный препарат, который характерен для взрослых. Например, у детей при бронхиальной астме отмечена меньшая эффективность b-адреномиметических средств, а некоторые антагонисты кальция, широко и с хорошим эффектом применяются при пароксизмальной тахикардии, в то время как у новорожденных детей могут вызывать тяжелые побочные реакции в виде шока, артериальной гипотонии, асистолии. В первые месяцы после рождения содержание белка в крови и аффинность альбуминов к лекарственным средствам у детей снижена, затем постепенно повышается, но и в возрасте 10-12 мес. не всегда достигает нормы для взрослых. Поэтому лекарственные препараты из комплекса с белком могут вытеснять многие эндогенные вещества, связывающиеся с белками плазмы крови. В результате за счет вытеснения лекарственного препарата повышается количество его свободного состояния в крови, что может привести к преходящему усилению фармакологического действия. У новорожденных имеет место конкурентное отношение между лекарственными препаратами, продуктами метаболизма за связь с альбуминами. Поэтому такие препараты, как сульфаниламиды, салицилаты и многие другие могут вытеснять билирубин из комплекса с альбумином, чем создают риск развития желтухи у новорожденных. В то же время сам билирубин может вытеснять лекарственный препарат из комплекса с альбумином, вызывая повышение фармакологической активности лекарственного средства и объема его распределения.
В организме ребенка высокое содержание воды также влияет на фармакодинамику ряда лекарственных препаратов. Так, аминогликозиды, атропин и ряд других лекарственных препаратов, распределяющихся в основном в жидкой среде, детям назначаются в большей дозе на 1 кг массы тела, чем взрослым.
Как известно, чрескожное всасывание обратно пропорционально толщине зернистого слоя и прямо пропорционально гидрофильности кожи. Так как у новорожденных детей зернистый слой тоньше, чем у взрослых через кожу новорожденных легко проникают многие химические вещества и могут вызвать тяжелое отравление. Так, имеются сообщения о токсическом действии некоторых лекарственных средств и химических веществ, попавших на кожу новорожденного.
Имеются особенности и выведения лекарственных веществ из организма новорожденного ребенка. Так как функция почек у них снижена, выведение с мочой многих веществ происходит менее интенсивно, чем у взрослых.
.Функция канальцев почек у новорожденных снижена (канальцевый аппарат созревает позднее клубочкового). А такие лекарственные средства, как аминогликозиды, цефалоспорины, пенициллин, дигоксин, фуросемид выводятся из организма путем канальцевой секреции. Поэтому применять их следует у новорожденных особенно осторожно, тем более при наличии нарушения функции почек.
В связи с особенностями физиологии детского организма использование ряда антибиотиков в педиатрии запрещено или ограничено из-за высокого риска развития тяжелых, часто специфичных для возраста побочных реакций. В первую очередь это касается применения антибактериальных средств у новорожденных детей, особенно недоношенных, что обусловлено незрелостью ферментативных систем печени и механизмов клубочковой фильтрации почек, а также изменением распределения лекарственных средств вследствие большего объема внеклеточной жидкости у новорожденных. При лечении такими препаратами, как сульфаниламиды, имеющими высокое сродство к белкам плазмы крови высок риск развития ядерной желтухи, что связано с низкими концентрациями альбуминов в сыворотке у новорожденных детей.
Согласно различным исследованиям, среди больных старше 70, выписывавшихся из больниц, от 10% до 20% составляют те, у кого обнаруживается нежелательная реакция на прописанные им лекарства [Cooper J.W., 1996]. Дело в том, что около половины потребляемых лекарственных препаратов приходится именно на людей старших возрастных групп.
Высокий уровень побочных реакций у людей пожилого возраста – явление многофакторное. Прежде всего, в подавляющем большинстве случаев пожилые страдают несколькими недугами сразу, а значит, и принимают по несколько лекарств одновременно. У них выше удельный вес самолечения - пожилые люди пользуются лекарствами, продающимися без рецепта, в 7 раз больше, чем люди среднего возраста. Среди пожилых людей весьма распространено лечение всевозможными целебными травами. Пожилые люди часто лечатся одновременно у двух, а то и у трех врачей и получают соответственно лекарства разных групп и сочетаний, нередко и весьма не сочетающиеся. Наконец, у пожилых людей нередко солидный запас лекарственных средств, иногда просроченных, новые лекарства смешиваются со старыми, больной начинает путаться в них, принимает от одной болезни два или три лекарства со схожими свойствами. К тому же иногда побочный эффект от одного или двух лекарств больному приходится устранять при помощи еще одного (феномен каскада), дополнительного лекарства, обладающего своим побочным эффектом, и так далее [Дворецкий Л.И., 1998].
В формировании побочных эффектов лекарственной терапии у людей пожилого и старческого возраста имеет то обстоятельство, что у них изменяется реакция организма на лекарственные средства в результате физиологического старения органов и тканей и наличия различных сочетанных заболеваний. У людей пожилого возраста распределение лекарственных препаратов может нарушаться вследствие возрастных изменений, среди которых наибольшее значение имеют снижение сердечного выброса, уменьшение общего содержания воды, уменьшение мышечной массы, увеличение жировой ткани, снижение концентрации сывороточного альбумина.
Часто имеющаяся у одного и того же пациента ишемическая болезнь сердца с признаками сердечной недостаточности, патология кишечника с синдромом мальабсорбции, хронический пиелонефрит с развитием почечной недостаточности могут оказывать влияние на всасывание, распределение, метаболизм и элиминацию назначаемых лекарственных препаратов.
С возрастом изменяется секреторная и моторная функция желудочно-кишечного тракта, что приводит к повышению рН в желудке, замедлению скорости его опорожнения, активной абсорбции. В результате снижается биодоступность многих лекарственных веществ. Снижение содержания в крови альбумина с возрастом сопровождается нарушением связывания лекарственных препаратов. К примеру, несвязанная с белком фракция напроксена у больных пожилого возраста в 2 раза больше, чем у молодых. У пожилых с возрастом нарастают темпы снижения скорости биотрансформации веществ в печени в результате уменьшения активности ферментов, в силу чего идет замедление или извращение метаболизма ряда лекарственных препаратов, а поэтому повышается риск осложнений лекарственной терапии. Так, к примеру, в связи с возрастными нарушениями способности печени к метаболизму изменяется метаболизм многих антидепрессантов, в частности четвертичных аминов типа амитриптилин, имипрамин. При назначении этих препаратов в пожилом возрасте чаще развиваются ортостатическая гипотония, задержка мочи, седация, в связи с чем начальные дозы должны быть меньше, а препараты желательно назначать в условиях, близких к постельному режиму.
У пожилых людей изменяется выведение лекарственных веществ из-за уменьшения почечного кровотока в связи с атеросклерозом и артериолосклерозом, массы почек и числа функционирующих клубочков (к 65 годам их число снижается почти на 1/3), замедляется канальцевая экскреция. К 80 годам функциональная способность почек может уменьшаться приблизительно наполовину. С возрастом происходит также снижение почечного кровотока, уменьшается число функционирующих клубочков и размеры почек. С учетом указанных возрастных особенностей необходима осторожность при назначении больным медикаментов, обладающих нефротоксическим действием и элиминирующихся преимущественно почками в неизмененном виде, такие как аминогликозиды, дигоксин, прокаинамид, литий, циметидин. Необходимо учитывать, что в связи с уменьшением с возрастом мышечной массы показатели креатинина не всегда отражают истинную функциональную способность почек.
В пожилом возрасте присходит изменение объема распределения лекарственных препаратов в организме за счет снижения мышечной ткани и подкожно-жировой клетчатки. Относительное уменьшение общего содержания воды и увеличение массы жировой ткани приводят к уменьшению объема распределения, к увеличению концентрации водорастворимых медикаментов и увеличению объема распределения жирорастворимых препаратов, а как следствие – к возрастанию периода полужизни указанных препаратов и увеличению продолжительности их действия. Из-за снижения концентрации альбумина в крови с возрастом салицилаты и других нестероидные противовоспалительные препараты, имеющие кислотную основу и нередко вызывающие эрозивные поражения желудка, в пожилом и старческом возрасте следует назначать в меньших дозах.
Особенности фармакодинамики медикаментов заключаются в различной чувствительности к одному и тому же препарату больных пожилого и старческого возраста и лиц более молодого возраста. Считается, что в основе возрастных различий фармакодинамических эффектов лежит нарушение чувствительности соответствующих рецепторов. Имеются данные о снижении чувствительности больных пожилого возраста к действию блокаторов бета-адренергических рецепторов и бета2-агонистов, что обусловлено доказанным снижением количества бета-рецепторов и их афинности с возрастом. В то же время количество и аффинность альфа-адренергических и холинергических рецепторов практически не изменяется. (Дворецкий Л.И., 1998).
Так как более чем в 60% причиной смерти являются болезни органов кровообращения, наиболее часто в старшей возрастной группе используют препараты, оказывающие действие на сердечно-сосудистую систему, в частности сердечные гликозиды. В силу комплекса указанных выше причин признаки передозировки сердечных гликозидов обнаруживаются у каждого третьего.
В силу особенностей функционирования органов и систем у пожилых людей весьма осторожно следует применять гипотензивные средства, так как резкое снижение артериального давления может быть причиной нарушений кровотока в склерозированных сосудах жизненно важных органов (Ridker P,M., 1998). По тем же соображениям применять антикоагулянты и антиагреганты для предупреждения коронарного и церебрального тромбоза следует лишь под тщательным контролем, так как в пожилом и старческом возрасте изменяются фармакокинетика и фармакодинамика этих препаратов. Дозы непрямых антикоагулянтов необходимо уменьшить в 1,5-2 раза.
Физиологические изменения организма пожилых людей определяют необходимость частого применения у них антибактериальных препаратов. В то же время у пожилых людей нередко нарушены функции выведения. К примеру, возрастные изменения предстательной железы у мужчин способствуют задержке мочи и повышению частоты инфекций мочеполовых путей. Снижение функции печени у пожилых людей обусловливает нарушение метаболизма некоторых антибактериальных препаратов (например, макролидов, возрастные изменения почек замедляют элиминацию многих антибиотиков (пенициллинов, аминогликозидов, карбапенемов) [Millan J., Gleckman R.A., 1995; Gleckman R.A., Borrego F., 1997]. В таблице 45, заимствованной из Интернет, представлены антибактериальные препараты, в отношении которых имеются прямые или косвенные данные об особенностях их действия у людей пожилого возраста.
Таблица 45
Особенности применения антибактериальных препаратов у людей пожилого возраста
|
Препарат |
Особенности действия |
Рекомендации |
|
Аминогликозиды |
Повышен риск нефротоксичности, ототоксичности и вестибулотоксичности |
Применять с осторожностью, по возможности использовать менее токсичные антибиотики. Доза корригируется при снижении клиренса креатинина |
|
Ванкомицин |
Повышен риск ототоксичности и нефротоксичности |
Доза корригируется при снижении клиренса креатинина. Применять с осторожностью |
|
Кларитромицин |
В одном исследовании выявлены более высокие пиковые концентрации антибиотика и метаболитов, но роста частоты нежелательных реакций не было |
Доза корригируется при снижении клиренса креатинина |
|
Клиндамицин |
Повышен риск развития псевдомембранозного колита |
Применять с осторожностью |
|
Нитрофурантоин |
Повышен риск пневмонии и периферической полинейропатии при снижении функции почек |
Доза корригируется при снижении клиренса креатинина |
|
Спирамицин |
В одном исследовании у пожилых (73-85 лет) выявлено повышение периода полувыведения в 2 раза |
Снижение кратности введения до 1-2 раз в сутки |
|
Сульфаниламиды и ко-тримоксазол |
Высокий риск тяжелых нежелательных реакций со стороны кожи, угнетение кроветворения, тромбоцитопении иногда с пурпурой. Риск тромбоцитопении возрастает при сочетанном назначении с тиазидовыми диуретиками. |
По возможности избегать назначения. Контроль количества тромбоцитов |
|
Эритромицин |
Повышен риск ототксичности при снижении функции почек и печени |
Не применять высокие дозы |
У пожилых людей полусинтетические пенициллины, цефалоспорины гораздо медленнее выводятся из организма, при этом концентрация их в крови оказывается повышенной. Имеется прямая зависимость между концентрацией в крови антибиотиков тобрамицина, доксациклина, ампициллина, их распределением и выведением и функцией почек у людей пожилого и старческого возраста. Поэтому дозы таких препаратов необходимо уменьшить при низкой клубочковой фильтрации.
С возрастом развиваются нарушение психики и сна, поэтому пожилыми людьми широко используются психотропные средства, в частности бензодиазепины. Без коррекции на возрастные особенности больного последние вызывают побочные реакции у пожилых людей в 40 % случаев. Поэтому некоторые авторы рекомендуют уменьшать вдвое дозу бензодиазепинов у людей пожилого и старческого возраста.
Проблемой для пожилых является и то, что врачи плохо знают особенности организма пожилого человека и не учитывают их при подборе лекарственной терапии. Недавние американские исследования показали, что: 70% врачей, обслуживающих систему Medicare, провалили экзамен по лекарственной терапии у лиц пожилого возраста - при назначении трех и более лекарственных средств, 88% назначений содержали одну или более ошибок разной степени тяжести; 22% содержали ошибки, потенциально опасные для жизни пациента.
Не меньшее значение в терапии пожилых людей имеет дисциплина выполнения лекарственных назначений. По данным Л. И. Дворецкого (1998) правильность выполнения назначений сердечно-сосудистых и противодиабетических препаратов составляет 80-90%, в то время как при лечении антибиотиками, анальгетиками, седативными средствами снижается до 50 %.