
Рис.2 Алгоритмы противомикробной химиотерапии
План методических рекомендаций:
Основные возбудители ИВЗЧЛО, основные характеристики этиозависимого воспалительного процесса.
Основные группы противомикробных лекарственных средств и принципы эмпирической антибактериальной терапии.
Современное представление о повышении эффективности антимикробной химиотерапии.
Алгоритмы противомикробной химиотерапии, принципы дифференцированного подхода к планированию антимикробной химиотерапии ИВЗЧЛО.
Заключение.
Инфекционные процессы встречаются в практике стоматолога любой специальности. Наиболее часто проблема лечения инфекции встает перед стоматологами-хирургами, челюстно-лицевыми хирургами, стоматологами-терапевтами.Основным этиотропным действием является противомикробная терапия, включающая в себя многофакторное воздействие на микроорганизм, приводящее к гибели микроорганизма, ослаблению патогенности или к элиминации из очага воспаления. Противоинфекционные препараты отличаются от других групп лекарственных средств прямым воздействием на возбудителя, подавляя их существование и размножение. Для обозначения избирательного воздействия лекарственных средств на возбудителей инфекции в современной медицине применяется термин "антимикробная химиотерапия", а все вещества, вызывающие угентение их роста и размножения без вреда для макроорганизма, называют антибиотиками.
Поскольку бактерии являются наиболее частой причиной инфекционно-воспалительных заболеваний челюстно-лицевой области (ИВЗЧЛО), то антибактериальная терапия является важной составляющей частью антимикробной химиотерапии.
Основные термины и понятия, применяющиеся в клинической фармакологии, микробиологии, стоматологии, используемые в данном руководстве:
Бактерии-одноклеточные организмы, которые относятся к разным семействам. Они имеют разнообразную форму и довольно сложную структуру, определяющую многообразие их функциональной деятельности. Для бактерий характерны три основные формы: сферическая, цилиндрическая, извитая
Кокки - бактерии, имеющие сферическую (шаровидную) форму. Подразделяют в зависимости от плоскости деления и расположения отдельных особей на:
Микрококки
Диплококки
Стрептококки
Тетракокки
Сарцины
Стафилококки
Палочки(бациллы) - бактерии образующие споры
Грамположительные - это бактерии характеризующиеся более выраженным муреиновым слоем в клеточной стенке, менее проницаемой клеточной стенкой (по сравнению с грамотрицательными бактериями), соотношением РНК:ДНК в их цитоплазме 8:1 и pH 2,0-3,0
Грамотрицательные - это бактерии характеризующиеся менее выраженным муреиновым слоем в клеточной стенке, более проницаемой клеточной стенкой (по сравнению с грамотрицательными бактериями), соотношением РНК:ДНК в их цитоплазме 1:1 и pH около 5,0
Патогенность - это потенциальная, генетически детерминированная способность микроорганизмов вызывать инфекционный процесс в организме хозяина.
Вирулентность - это количественная характеристика степени патогенности данного штамма микроорганизма в отношении животных определенного вида при стандартных условиях заражения
Обострение хронического периодонтита (острый периодонтит) - острый одонтогенный инфекционно-воспалительный процесс, ограниченный границами периодонта одного зуба
Периостит-острый одонтогенный инфекционно-воспалительный процесс, ограниченнный условной границей парадонта одного зуба с образованием поднадкостничного абсцесса.
Острый одонтогенный остеомиелит челюстей - острый одонтогенный инфекционно-аллергический воспалительный процесс, распространяющийся за пределы условной границы парадонта одного зуба.
Одонтогенный абсцесс - острый гнойный инфекционно-воспалительный процесс, локализующийся в клетчаточном пространстве, ограниченный пиогенной мембраной.
Одонтогенная флегмона - распространенный острый инфекционно-аллергический процесс, развивающийся в оклочелюстных клетчаточных пространствах.
Минимальная подавляющая концентрация (МПК) - наименьшая концентрация противомикробного вещества, которая через определенный период времени приостанавливает рост специфических микроорганизмов in vitro в стандартных условиях исследования.
Противомикробная химиотерапия - раздел клинической фармакологии, рассматривающий сложное и динамическое взаимодействие трех основных компонентов: возбудителя инфекции, макроорганизма и лекарственного средства. Планирование рациональной антибиотикотерапии осуществляется исходя из определенных принципов:
Антибиотик должен избирательно подавлять жизнедеятельность патогенного микроорганизма, не оказывая существенного воздействия на гомеостаз организма больного.
Для воздействия на инфекционно-воспалительный процесс антибиотик должен поступать в ткани очага в достаточной (минимальной подавляющей) концентрации.
Назначение терапии должно осуществляться с учетом чувствительности возбудителя.
Начальная (эмпирическая) противомикробная терапия проводится с учетом органолептических свойств возбудителя, основывается на знаниях о наиболее вероятном микробном пейзаже гнойной раны.
Исходя из полиэтиологической теории ИВЗЧЛО целесообразно проведение полиантибактериальной терапии препаратами с перекрывающими полями противомикробного спектра.
Дозы, путь введения, кратность введения противомикробного препарата должны основываться на необходимости создания в очаге воспаления минимальной подавляющей концентрации (МПК).
Назначение антибактериального препарата должно сопровождаться комплексной "терапией сопровождения" направленной на регуляцию тех звеньев гомеостаза, которые наиболее подвергаются агрессии данным препаратом (группой).
При проведении противомикробной терапии необходимо учитывать химиорезистентность микроорганизмов и включать в комплекс мероприятия, направленные на ее преодоление.
Антимикробная терапия должна состоять не только из собственного антибактериального средства, но и из мероприятий, направленных на создание условий неблагоприятных для жизнедеятельности микроорганизмов и на уменьшение количества патогенов в ране.
Все инфекции ротовой полости, в зависимости от локализации входных ворот делятся на одонтогенные и неодонтогенные. Очаг инфекции является одонтогенным при :
Осложненном кариесе;
Нарушении барьерных свойств краевого парадонта;
Очаг инфекции в области непрорезавшихся или неправильно прорезававшихся зубов.
Неодонтогенные причины:
Нарушение барьерных свойств кожи и слизистых;
Переломы нижней челюсти в пределах зубного ряда;
Снижение защитных свойств слюны.
К неодонтогенным воспалительным заболеваниям относятся актиномикоз, рожа, фурункул, карбункул, туберкулез, сифилис, лепра. При анализе возбудителей одонтогенной инфекции можно выделить группу микроорганизмов персистирующих в периапикальных тканях и в краевом парадонте. При осложненном кариесе наиболее частыми возбудителями являются представители резидентной смешанной микрофлоры - зеленящие стрептококки, неспорообразующие анаэробы. При парадонтальной инфекции регистрируются Actinobacillus actinomycetemcomitans, Porphyromrnas gingivalis, Prevotella intermedia, Eieinella corrodens, Fusobacterium nucleaticum.
Острые остеомиелиты челюстей в 50% случаев вызываются золотистым стафилококком в сочетании с анаэробами. Экссудат представляет из себя скудный, жидкий, серого цвета гной.
Возбудителями абсцессов и флегмон являются золотистый стафилококк и пиогенный стрептококк. Гной при таких процессах густой, сливкообразный, имеется тенденция к отграничению воспалительного инфильтрата, некротические процессы в ране представлены мало. Гнилостно-некротическая флегмона вызывается ассоциативной флорой с участием фузобактериальная и неклостридиальная анаэробная флора. Экссудат при этом обильный, жидкий, со зловонным запахом, стенки раны с обильным некротическим налетом.
Гангренозные флегмоны вызываются клостридиальной анаэробной флорой. Воспалительный процесс, вызванный таким возбудителем протекает быстро, отсутствует тенденция к ограничению, ткани имеют вид "вареного мяса", не кровоточат при разрезе, гной скудный, свободно не выделяется, преимущественное распространение происходит по фасциям шеи. Экссудат носит вид "мясных помоев".
Возбудителем актиномикоза является A. Israeli. Так же возможна ассоциация с грамотрицательными бактериями. При актиномикозе основным воспалительным субстратом является абсцесс, гной скудный с крошковатыми включениями.
Рожа вызывается ß-гемолитическим стрептококком S.pyogenes. Заболевание имеет яркую воспалительную клиническую картину с быстрым распространением воспалительного процесса в пределах дермы.
Основной возбудитель фурункулов и карбункулов является золотистый стафилококк. Клиника фурункула сходна с одонтогенными абсцессами, однако в области волосяного фоликула формируется ткани некротического стержня. Карбункул представляет из себя конгломерат фурункулов, однако, как правило, имеется ограниченность процесса пиогенной мембраной.
Возбудителем туберкулеза органов челюстно-лицевой области являются 2 возбудителя - Mycobacteria tuberculosis u Mycobacteria bovis. Воспалительные заболевания этой этиологии имеют вялое, длительное, хроническое течение, имеется ограниченность процесса, экссудат скудный с элементом "творожистого" некроза.
Однако, не всегда наличие облигатного патогена приводит к развитию инфекционно-воспалительного процесса. Введение в ткани здорового человека до 106 в 1 см3 патогенного стафилококка не приводит к развитию клинически выраженного воспаления. Для инициации воспаления необходимо достижение «критической массы» микроорганизма, однако, при развитии гипоксии, снижении функций защитных систем организма «критическая масса» может уменьшаться на порядки.
В настоящее время в клинической фармакологии принято несколько классификаций противомикробных препаратов: по химической структуре, по механизму действия на микробную клетку, по способу введения в организм и т.д. Наиболее приемлемой для клиницистов является классификация антибактериальных веществ по их химической структуре.
Первую группу называют природными и полусинтетическими антибиотиками (Бета-лактамы, аимногликозиды, макролиды, тетрациклины, гликопептиды, линкосамиды, полимиксины, амфениколы, фузиданы). Вторая группа представлена синтетическими антибиотиками (сульфаниламиды, триметоприм, хинолоны, нитроимидазолы, нитрофураны).
Также клинически значимой является классификация по воздействию на микробную стенку - бактерицидные (пенициллины, цефалоспорины, другие бетта-лактамы, аминогликозиды, хинолоны, ванкомицин, ко-тримазол, нитроимидазолы, рифампицин, полимиксины, фосфомицин, диоксидин) и бактериостатические (тетрациклины, хлорамфеникол, макролиды,линкосамиды, сульфаниламиды, нитрофураны).
При планировании эмпирической противомикробной терапии необходимо учитывать особенности возбудителя. В настоящее время существуют методы экспресс-диагностики оценки чуствительности патогенной микрофлоры к антимикробным препаратам, возможна и доступна клиницистам окраска мазка из раны по Граму , оценка органолептических свойств раневого эксссудата. При получении из очага гнойного воспаления густого, сливкообразного гноя, предположительным возбудитетем являеся ставиллококковая флора, при жидком, зловонном гное, при наличии некротизированных тканей в ране одним из участников микробной ассоциации является Грам отрицательная бациллярная флора. Если гной из раны не получен, при сдавлении краев раны выделяется в скудном количестве мутно-красноватая жидкость, то можно предполагать анаэробную микрофлору. Также большую помощь в планировании эмпирической терапии оказывает знание наиболее часто встречающихся возбудителей ИВЗ ЧЛО. Отчеты лабораторий клинической микробиологии публикуются в специальной литературе.
В основе начала лечения лежит принцип соответствия тяжести лечения состоянию больного. Врачу необходимо решить следующий ряд вопросов:
Целесообразно ли назначение антибиотиков данному больному или возможно лечение в объеме адекватного дренирования очага гнойного воспаления и некоторая коррекция вариантов иммунного ответа;
Выбрать круг антибиотиков, воздействующих на потенциального возбудителя и соотнести это с реальными экономическими возможностями учреждения или больного;
Оценить возможность совместного приема противомикробного препарата с препаратами, постоянно или временно употребляемыми пациентом по поводу других заболеваний;
Соотнести риск развития побочных (аллергических) реакций с необходимостью применения данной группы препаратов;
Необходимо учесть опыт ранее проведенного противомикробного лечения;
Выбрать путь введения препаратов исходя из особенностей заболевания, возраста больного, варианта ответа организма на воспаление, сопутствующе патологии;
При планировании лечения в условиях стоматологической поликлиники целесообразно назначать пероральные антибиотики с высокой биодоступностью, с длительным периодом полувыведения (идеален прием 1 раз в сутки во время явки к врачу), с минимальным воздействием на микрофлору кишечника. При лечении больного в условиях челюстно-лицевого стационара целесообразен выбор препарата с парэнтеральной и энтеральной формой введения для осуществления ступеньчатой терапии при улучшении состояния больного. Тенденция к сокращению пребывания больного в госпитальных условиях за счет увеличения постгоспитального периода приводит к замене инъекционной формы антибиотика на оральную при переходе в поликлинику.
4. Современное представление о повышении эффективности антимикробной химиотерапии.
Исходя из анализа результатов многочисленных исследований отечественных и зарубежных авторов можно утверждать, что до 30% антибактериальной терапии является неэффективной, что приводит к ухудшению результатов комплексного лечения больных ИВЗ ЧЛО, увеличивает количество и тяжесть осложнений. Для представления о путях повышения эффективности противомикробных мероприятий необходимо знать причины неэффективности антибактериальной терапии:
Антибиотикотерапия при недренированном очаге гнойного воспаления или при наличии инородного тела в ране.
Инфекционный процесс вызван небактериальным возбудителем (вирусы, грибы);
Неправильный выбор антибиотика (имеется природная устойчивость возбудителя, отсутствие возможности создания МПК в очаге воспаления);
Изменение чувствительности возбудителя во время курса лечения;
Занижение терапевтических доз препаратов, нарушение метода приема препарата или техники введения (нарушение инструкции по разведению и хранению);
Нарушение кратности введения вследствии чего отсутствует МПК в очаге;
ИВЗ является осложнением основного заболевания (новообразование, врожденные кисты);
Суперинфекция госпитальной микрофлорой;
Одним из наиболее перспективным путей повышения эффективности противомикробной терапии является преодоление химиорезистентности возбудителей. В настоящее время главным механизмом природной и приобретенной резистентности является выработка ферментов гидролизирующих молекулу препарата на неактивные метаболиты. Ферменты, гидролизирующие в-лактамные антибиотики называются в-лактамазы, которые насчитывают около 400. Способность бактерий к выработке в-лактамаз постоянно возрастает, а это вызывает необходимость создания новых антибиотиков.
Существует несколько путей преодаления в-лактамной резистентости:
Синтез принципиально новых групп противомикробных препаратов, не подверженных действию в-лактамаз (например хинолоны, имипинемы и карбопинемы);
Поиск новых в-лактамных антибиотиков, которые не подвержены гидролизу в-лактамазами (цефалоспорины IV поколения);
Синтез ингибиторов в-лактамаз;
Применение ударных и сверхударных доз антибиотиков .
Для повышения эффективности противомикробной химиотерапии важно не только обеспечить достаточную резистентость препарата к в-лактамазам, но и создать достаточную (минимально подавляющую) концентрацию антибиотика в области гнойной раны или зоне операции. Для этого необходимо мотивированно выбрать путь введения препарата, который может быть внутриочаговым, внутритканевым, внутрисосудистым, энтеральным. Наименее оптимальным является внутриочаговый путь. Введение кристаллоидного вещества в область очага гнойного воспаления приводит к всасыванию действующего начала в микроциркуляторное русло и оказывает только системный эффект. Однако, как правило, при внутриочаговом введение препаратов врач изменяет дозировку и кратность введения, что приводит к недостижениию МПК и, следовательно, к формированию приобретенной химиорезистентности бактерий. Кроме того, повышение гидростатического давления в очаге гнойного воспаления может привести к распостранению гнойного процесса на смежные области. Наиболее часто в клинической медицине используется внутритканевой путь введения, который может быть внутримышечный и подкожный. Однако, для достижения МПК в плазме крови и в очаге воспаления необходимо повышение доз вводимых препаратов, кратности введения. В итоге весьма болезненная манипуляция проводиться 3-6 раз в сутки, что делает невозможность амбулаторного применения, приводит к нарушению комплиентарности. Кроме того, для преодоления естественных барьеров (гисто-гематический, гемато-энцефалический, пиогенная мембрана и т.д.) требуется создание в крови и биологических жидкостях высоких концентраций лекарственного средства или использовать антибиотики не по спектру действия, а по фармакокинетическим показаниям. Внутрисосудистый путь введения является наиболее предпочитительным. Это связано с возможностью управления концентрацией веществ в крови, с возможностью контролируемого введения и постоянным введением препарата в сосудистое русло. Однако и этом метод не лишен ряда недостатков: "привязанность" больного к аппарату, наличие катетера и катетер-ассоциированной инфекции, токсичность ряда препаратов при введении в артерии и вены и т.д.
Оптимальным является способ доставки противомикробного препарата непосредственно в зону воспаления без выраженных системных эффектов. Учитывая анатомо-физиологические особенности челюстно-лицевого региона (в частности, протекание ИВЗ без выраженного системного ответа организма, ограниченность форм, хорошая лимфо- и гемоциркуляция) возможно прицельное воздействие на очаг воспаления. Одним из наиболее перспективных путей регионарного воздействия на очаг воспаления является эндолимфатические введение противомикробных средств. Во-первых повышение концентрации антибиотика в лимфе приводит к санации очагов хронической инфекции в лимфатичесмких узлах; во-вторых, медленный ток лимфы приводит к насыщению тканей противомикробным препаратом; в-третих, создание МПК в тканях не приводит к выраженному повышению концентрации препарата в крови, так как путь лимфы весьма длитетелен и концентрация падает пропорционально приближению к месту впадения лимфатического сосуда в кровяное русло; в-четвертых, существует выраженный постантибиотический эффект, связанный с доставкой антибиотика в очаг воспаления нагруженными нейтрофильными лейкоцитами. В настоящее время известно 2 способа насыщения лимфатической системы противомикробнвми средствами: прямая и непрямая эндолимфатическая терапия (лимфотропная). При проведении прямой эндолимфатической терапии требуется катетеризация магистрального лимфатического сосуда, что сопровождается значительными техническими сложностями и практически неприменимо в условиях амбулаторно-поликлинической стоматологии.
Наибольший интерес представляет метод регионарной лимфотропной антибактериальной терапии (МРЛАТ). В основе предлагаемого способа лежит закон Старлинга, говорящий о том, что кристалоидные вещества всасываются преимущественно в кровеное русло, а коллоидные вещества - в микролдимфатическую сеть. При изменении состояния основного вещества соединительной ткани гиалуронидазой происходит гидратация и всасывание жидкости в микролимфатическое русло. Если при этом сочетать введение гиалуронидазы с противомикробным средством, то возможно добиться поступления антибиотика в лимфу в достаточном количестве.
При необходимости возможно сочетание путей введение противомикробных препаратов для достижения различных целей (лечение одонтогенного сепсиса, распостраненнх флегмон, ИВЗЧЛО у иммуносупрессивных пациентов и т.д.)
Таким образом, путями преодоления химиорезистентности возбудителей ИВЗЧЛО являются:
Разработка и внедрение современных протоколов антибиотикотерапии. Перспективным является появление принципиально новых препаратов с оригинальной химической структурой
Разработка алгоритмов антибиотикотерапии для различных ИВЗ. Нецелесообразно использование "унифицированных" схем противомикробного лечения групп заболеваний. Алгоритм должен составлятся, исходя из конкретной клинико-микролбиологической ситуации.
Применение современных антибиотиков с относительно высокой безопасностью.
Внедрение щадящих режимов антибиотикотерапии - отказ от инъекционных форм в амбулаторной практике, сокращение кратности инъекций в стационаре, применение таблетированных форм препаратов с однократных приемом (для обеспечения комплиентарности и уменьшения вероятности аллергических реакций), применение препаратов с выраженным постантибиотическим эффектом.

Рис.2 Алгоритмы противомикробной
химиотерапии
1 Оценка тяжести течения заболевания и вычисление прогноза течения основывается на оценке распространенности ИВЗ и соответствии воспалительной реакции организма. Для планирования лечения больных ограниченными формами на амбулаторном этапе лечения доступны к оценке следующие показатели:
Температура тела
Пульс
Соотношение пульса к температуре тела (при повышении температуры на 1 градус пульс учащается на 10 ударов в минуту)
Частота дыхания.
На амбулаторном этапе допустимо лечение больных со следующими нозологическими формами: острые и обострения хронических периодонтитов, острые периоститы, обострение хронических субмандибулитов после удаления конкрементов, профилактическое использование антибиотиков после оперативных вмешательств (удаление ретинированных и дистопированных зубов, цистэктомия, гранулемэктомия, имплантация опорно-удерживающих конструкций и т.д.).
Оценка тяжести больных распространенными воспалительными процессами основывается на топической диагностике гнойно-воспалительного процесса и анализе показателей гомеостаза (картина периферической крови, основные биохимические показатели) .
Шкала прогнозирования течения острых одонтогенных воспалительных заболеваний М.М. Соловьева, Т.М. Алеховой (1997)
А. Оценка общих реакций организма в баллах
1. Часота пульса
|
Абс. знач. |
До 80 |
81-90 |
91-100 |
101-110 |
111-120 |
121-130 |
131-140 |
141-150 |
151-160 |
|
балл |
0 |
5 |
10 |
17 |
25 |
32 |
40 |
49 |
59 |
2. Температура тела, С
|
Абс. знач. |
До 36,5 |
36,6-37,5 |
37,6-38,5 |
38,6-39,5 |
39,6-40,5 |
40,6-41,5 |
41,6-42,5 |
выше42,6 |
|
балл |
4 |
0 |
2 |
5 |
11 |
19 |
31 |
48 |
3. Лейкоциты, мкл/тыс
|
Абс. знач. |
До 9,0 |
10,0-19,0 |
20,0-29,0 |
30,0-39,0 |
40,0-49,0 |
50,0-59,0 |
выше 60,0 |
|
балл |
0 |
2 |
6 |
14 |
27 |
44 |
60 |
4. СОЭ, мм/ч
|
Абс. знач. |
До 9,0 |
10,0-19,0 |
20,0-29,0 |
30,0-39,0 |
40,0-49,0 |
50,0-59,0 |
выше 60,0 |
|
балл |
0 |
2 |
6 |
14 |
27 |
44 |
60 |
5. Коэффициент = Нейтрофилы%
Лимфоциты,%+моноциты,%
|
Абс. знач. |
До 2,0 |
2,1-2,9 |
3,0-3,9 |
4,0-4,9 |
5,0-5,9 |
6,0-6,9 |
Выше 7,0 |
|
балл |
0 |
3 |
12 |
22 |
35 |
49 |
62 |
Б. Оценка инфекционно-воспалительного процесса в баллах в зависимости от его локализации, характера и распространенности
|
№ |
Локализация воспалительного процесса |
Оценка в баллах |
|
|
Гнойное воспаление |
Серозное воспаление |
||
|
|
Периостит челюстей Скуловая область Подглазничная область Щечная область Подподбородочная область Околоушно-жевательная область Позадичелюстная область Височная область (поверхностная локализация) Височная область (глубокая локализация) Подъязычная область, тело языка Остеомиелит челюсти ограниченный Остеомиелит челюсти диффузный Подвисочная ямка Крыловидно-челюстное пространство Поднижнечелюстное пространство Корень языка Окологлоточное пространство Глазница Дно полости рта (в зависимости от распространенности и локализации гнойно-воспалительного процесса) |
25 25 25 30 30 40 40 40
60 40 50 70 50 50 50 60 60 70 от 80
|
- 12 12 15 15 20 20 20
30 20 25 50 25 25 25 30 30 30 до 150 |
В. Характер прогноза
|
До 90 баллов |
благоприятный |
|
От 91 до 160 баллов |
сомнительный |
|
Свыше 160 баллов |
неблагоприятный |
Табл.1 Шкала прогнозирования течения острых одонтогенных воспалительных заболеваний
2. Определение культуральных свойств возбудителя, составление антибиотикограммы, оценка органолептических свойств экссудата
Для планирования рациональной антибактериальной терапии необходимо произвести своевременный забор экссудата для бактериологического исследования. Для этого используются разнообразные транспортные среды, позволяющие доставить материал в бактериологическую лабораторию без потери жизнеспособности микроорганизмов. Одним из возможных вариантов является транспортная среда, производимая фирмой “Copan®”.
Она предназначена для транспортировки а- и анаэробных микроорганизмов в течении 3-х суток. Для точности бактериологической диагностики необходимо произвести забор материала до начала эмпирической противомикробной терапии. Мазок из раны производится тупфером, который помещается в гелевидную среду и в ближайшие сроки доставляется в лабораторию.
Традиционное бактериологическое исследование, включающее в себя идентификацию возбудителя и определение культуральных свойств занимает 4-5 суток, однако существуют различные экспресс-методы, позволяющие за несколько часов определить чувствительность микроорганизма к антибиотикам. При отсутствии результатов лабораторного исследования при лечении острых ИВЗ ЧЛО врач начинает эмпирическую противомикробную терапию до получения ответа. Однако, существует несколько способов более прицельного назначения антибиотика:
|
Группа заболеваний |
Наиболее часто встречающаяся микрофлора |
|
Острые (обострения хронических) периодонтиты и периоститы |
Str. Pyogenes Staph. Epidermidis Enterococcus |
|
Острые остеомиелиты |
Staph. Aureus Neisseria |
|
Одонтогенные абсцессы |
Str. Pyogenes Enterococcus |
|
Одонтогенные флегмоны |
Staph. Albus Staph. Aureus Neisseria Fusobacterium Clostridium septicum |
·
Для каждой нозологической формы характерен свой микробный пейзаж раны.
Таблица 2. Возбудители ИВЗ ЧЛО
Внешний вид, запах, консистенция гноя позволяет предположить возможного возбудителя.
Возможно произвести бактериоскопию с окраской по Грамму и назначить препарат в соответствии с групповой принадлежностью.
|
|
ГР(+) |
ГР(-) |
|
Палочка |
феноксиметилпенициллин, докцициклин, ампициллин, метронидазол |
метронидазол, клиндамицин, ампициллин, гентамицин, левомицетин |
|
кокк |
оксациллин, метициллин, Ванкомицин, Цефалоспорины, Ампициллин |
клиндамицин, линкомицин |
Таблица 3. Предполагаемая чувствительность микрофлоры в зависимости от данный бактериоскопии.
По результатам бактериологического исследования составляется антибиотикограмма, описывающая чувствительность микроорганизмов микробной ассоциации к антибактериальным препаратам.
Однако, возможно предположить чувствительность микрофлоры без видовой идентификация возбудителя. Мы предлагаем 3 возможных метода:
Во время оперативных вмешательств по вскрытию и дренированию очагов гнойной инфекции с помощью стерильного одноразового шприца.
Для микроскопического исследования гноя сразу после забора материала мы делали два мазка на предметные стекла. Один мазок окрашивали по Грамму, второй –для выявления эозинофильных лейкоцитов и аллергической этиологии воспаления дополнительно окрашивали по методу Романовскому - Гимзе.
Аэробы представляют значительно большую опасность, чем анаэробы, что связано с их способностью быстро вырабатывать резистентность к антибиотикам. Наиболее быстро вырабатывают устойчивость стафилококки, в том числе и к новейшим антибиотикам. Процент устойчивых штаммов у этого микроорганизма составляет:
к бензилпенициллину – 80-95%
к тетрациклину – 70-85%
к левомицетину – 30-55%
Накопительной средой для микроорганизмов, содержащихся в гное, был выбран сахарный бульон в стандартной разливке по 5 мл. В 4 пробирки с сахарным бульоном необходимо поместить 3 капли исследуемого материала и инкубировать в термостате при температуре 370С в течение 4 часов. Параллельно с этим, такое же количество материала засевается в чашку Петри с кровяным агаром и помещается в термостат для дальнейшей инкубации. 3 капли – это минимальное количество гноя, необходимое для увеличения количества микроорганизмов до субъективно видимого помутнения в пробирке с сахарным бульоном за 2 часа инкубации.
Через 2 часа пробирки достают из термостата, 1-ую пробирку оставляют контрольной, во 2-,3-и 4-ую добавляли по 1 стандартному диску с антибиотиком. Были выбраны антибиотики, наиболее часто применяемые в челюстно-лицевой хирургии С-Пб ГМУ. акад. И.П.Павлова:
гентамицина сульфат, в концентрации 2 мкг/мл
оксациллина натриевая соль, в концентрации 2мкг/мл.
ампициллина натриевая соль, в концентрации 2 мкг/мл.
цефотаксима натриевая соль, в концентрации 6мкг/мл
доксициклин гидрохлорид, в концентрации 2мкг/мл.
линкомицина гидрохрорид, в концентрации 3 мкг/мл
бензилпенициллина натриевая соль, в концентрации 2ЕД/мл.
клиндомицин, в концентрации 0,4 мкг/мл.
Концентрации антибиотиков подбираются исходя из минимальной подавляющей концентрации.
По истечении 4 часов пробирки необходимо извлечь из термостата, мутность каждой пробирки оценить визуально в «плюсах». Чем мутнее среда в пробирке-тем менее чувствиетелен к антибиотику возбудитель.
Так как степень мутности является субъективным показателем, то мы ее доказывали с помощью фотоэлектроколориметра и компьютерной программы Adobe PhotoShop 5,0.
Фотоэлектроколориметром мы определяли оптическую плотность и коэффициент пропускания растворов в каждой пробирке.
Для оценки результатов в компьютерной программе Adobe PhotoShop 5,0 производилась съемка пробирок на цифровой фотоаппарат Sony Mavica, изображение переводилось в черно-белый вариант и оценивались в 2 моделях цветов – черно-белый (учитывался коэффициент К% - % черного цвета) и Lab цвет (учитывался коэффициент L% - % яркости цвета). Измерение проводилось в двух точках и бралось среднее арифметическое значение.
Используя метод фотоэлектроколориметрии, фотографирование на цифровую фотокамеру, компьютерную программу Adobe PhotoShop 5,0, бактериологический и бактериоскопический методы мы выяснили, что:
Используя наш метод за 4 часа можно получить предварительные данные о спектре чувствительности микроорганизмов к антибиотикам в каждом конкретном случае.
Степень мутности раствора является весьма достоверным признаком чувствительности микроорганизмов к исследуемым антибиотикам.
Определение чувствительности к антибиотикам возможно без выделения чистой культуры микроорганизмов и их видовой идентификации.
Это приводит к значительному сокращению времени, необходимого для проведения тестов по классическим методикам и целенаправленной рациональной антибиотикотерапии и предотвращению возникновения лекарственной болезни.
3 Выбор противомикробного препарата дозы и пути введения.
Выбор противомикробного препарата или комбинации препаратов основывается на изложенных в соответствующем разделе принципах рациональной противомикробной химиотерапии. Главным ориентиром в выборе антибиотика является предположительная (или определенная) чувствительность и состояние больного. При оценке состояния больного, как «средней тяжести» и «тяжелое» нет необходимости ориентироваться на традиционно описываемые схемы перехода от более «легких» антибиотиков к более «тяжелым». Такая политика приводит к усугублению тяжести состояния, распространению ИВЗ, нарастанию побочных эффектов от лечения. При ограниченных формах воспалительных заболеваний, при молодом возрасте пациента и при адекватности системы защитных сил организма больного возможен отказ от использования антибиотиков и назначение препаратов природного происхождения с противомикробной активностью.
При лечении больных на амбулаторном этапе возможен выбор между эффективными энтеральными формами антибиотиков и врачебно-контролируемым эндолимфатическим введением. Однако, при планировании лечения таблетированными формами, врач должен быть уверен в адекватности всасывающей способности ЖКТ, детоксикационной функции и т.д. Также необходимо учитывать фармако-экономические особенности, такие как соотношение стоимости лекарственного средства и дохода пациента, отношение пациента к той или иной социальной группе. При планировании терапии у пациентов пожилого и детского возраста необходимо учитывать возможность нарушения схемы приема препарата.
При лечении пациента в условиях стационара наибольшую важность приобретают: достижение МПК и известные осложнения от лечения (дисбактериоз, псевдомембранозный колит, иммуносупрессия и т.д.).
Предлагаемый нами метод регионарной лимфотропной антибактериальной терапии (МРЛАТ) в амбулаторных и клинических условиях является одним из путей решения этих проблем.
Методы регионарного лимфотропного введения антибактериальных препаратов в области головы и шеи.
Методы регионарной лимфотропной терапии предусматривают создание условий, когда введенный в организм лекарственный препарат из интерстициального пространства будет всасываться в лимфатическую систему. Для этих целей используют следующие приемы:
введение лекарственных веществ в подкожную клетчатку или в подслизистый слой с учетом максимального представительства там лимфатических капилляров и лимфатических узлов;
предварительное введение лимфостимуляторов (протеолитических ферментов) для изменения агрегатного состояния основного вещества соединительной.
При выборе мест лимфотропного введения антибактериальных препаратов мы исходили из принципа регионарности на основании имеющихся литературных данных о строении лимфатической системы челюстно-лицевой области с учетом анатомо-физиологического принципа лимфооттока.
Для направленного воздействия на инфекционно-воспалительный процесс в области угла и бокового отдела тела нижней челюсти (до уровня премоляров), а так же прилежащих к ней подъязычного, подчелюстного, крыловидно-челюстного и поджевательного клетчаточных пространств введение антибиотиков производили строго подкожно на 1 см ниже и латеральнее сосцевидного отростка височной кости на стороне поражения (1). Поступление лекарственного препарата в область нижней челюсти представлено на лимфограмме .
При локализации патологического процесса в области подбородка и в подподбородочном пространстве инъекции антибактериальных препаратов осуществляли в подслизистый слой в проекции подбородочных отверстий нижней челюсти с 2-х сторон по типу инфильтрационной анестезии (4).
Для воздействия на инфекционно-воспалительный процесс в области верхней челюсти, верхней губы, подглазничной, скуловой, щечной областей предложили лимфотропное введение антибиотиков подкожно в носогубную складку (3) на стороне поражения (рационализаторское предложение №1228 от 07 октября 1998 года).
Возможно одновременное введение антибактериального препарата из 2-х и более точек в зависимости от конкретной клинической ситуации.
При выборе антибиотика мы руководствовались литературными данными о чувствительности наиболее частых возбудителей инфекционно-воспалительных процессов челюстно-лицевой локализации, результатами собственных бактериологических исследований, характеристикой местного воспалительного процесса и оценкой органолептических свойств экссудата по В.А.Козлову (1988) и М.А. Губину (1998).
Для лечения больных основной группы применяли антибиотики бактерицидного действия в дозе 600 мг\сут линкомицина гидрохлорид, 80 мг\сут гентамицина сульфат , 1000 мг\сут ампициллина натриевую соль , 1000 мг\сут цефазолин.
В качестве растворителя использовали 1-1.5 мл 0,5-1.0 % раствора новокаина, 0,5-1.0 % раствора лидокаина гидрохлорида, изотонический раствор хлорида натрия.
|
Антибиотик |
Разовая доза (мг) |
Кратность введения (раз в сутки) |
Суточная доза (мг) |
|||
|
В\м |
Лт |
В\м |
Лт |
В\м |
Лт |
|
|
Гентамицина сульфат |
80 |
80 |
2-3 |
1 |
160-240 |
80 |
|
Линкомицина гидрохлорид |
600 |
600 |
2-3 |
1 |
1200-1800 |
600 |
|
Ампициллина натриевая соль |
1000 |
1000 |
4-6 |
1 |
4000-6000 |
1000 |
|
Цефазолин |
500-1000 |
1000 |
3-4 |
1 |
1500-4000 |
1000 |
Таблица 4. Дозы антибактериальных препаратов при лимфотропном и внутримышечном способах введения
Важно отметить, что при проведении лимфотропной терапии следует избегать высококонцентрированных растворов. Не рекомендуется использовать препараты, разрешенные только для внутривенного введения, оказывающие сильное местное раздражающее действие. Нельзя вводить антибиотики, способные повредить лимфатическую систему (канамицин, мономицин, карбенициллин).
В качестве лимфостимулятора использовали лидазу в дозе 32 ЕД на 1 введение. Раствор готовили следующим образом. Содержимое 1 флакона (ампулы) лидазы 64 ЕД перед применением растворяли в 1 мл 0,5-1.0 % раствора новокаина, 0,5-1.0 % раствора лидокаина гидрохлорида, изотонического раствора хлорида натрия. Для инъекции использовали 0,5 мл (32 ЕД лидазы).
Все растворы вводимых препаратов должны быть теплыми (37о С), и готовят их обязательно ex tempore.
Инъекции выполняли по всем правилам асептики, через неповрежденную кожу или слизистую оболочку полости рта. Следует помнить о недопустимости введения препаратов в места, где кожа или слизистая оболочка плотно прилегают к надкостнице.
Методика лимфотропного введения антибактериальных препаратов.
После двукратной обработки операционного поля антисептическим раствором «АХД 2000» производили вкол иглы для подкожных инъекций под углом 45 градусов к поверхности кожи на глубину 0,5 см. Срез иглы всегда должен быть обращен вниз. Через иглу медленно вводили 32 ЕД свежеприготовленного раствора лидазы. Затем, не вынимая иглы, через 4-5 минут медленно вводили раствор антибиотика. Следует отметить, что общий объём вводимых препаратов не должен превышать 2-2,5 мл. На область инъекции больному накладывали «полуспиртовой» компресс.
Лимфотропное введение антибактериальных препаратов производили 1 раз в сутки. Курс лечения составлял 5-7-10 инъекций в зависимости от тяжести и прогноза течения инфекционно-воспалительного процесса.
При проведении полиантибактериальной терапии наиболее часто использовали следующие комбинации препаратов:
внутримышечно полусинтетические пенициллины, лимфотропно гентамицина сульфат;
внутримышечно цефалоспорины, лимфотропно гентамицина сульфат;
внутривенно метранидозол, лимфотропно гентамицина сульфат или цефазолин.
При этом курс лимфотропного введения составлял 5-7 дней, курс системной противомикробной терапии 7-10 дней.
При планировании лечения энтеральными антибиотиками в амбулаторных условиях возможно в качестве ориентира использовать таблицу.
|
Нозологическая форма |
Препарат 1 ряда |
Препарат 2 ряда |
Препарат резерва |
Примечание |
|
Острый периодонтит (обострение хронического) |
Экстракт родиолы розовой по 10 капель 2 раза в день
|
Ампициллин Оксациллин по 500 мг. 4 раза в день |
Не используются |
Назначение при наличии сопутствующей очагово-обусловленной патологии или при нарушении реактивности |
|
Острый периостит |
Сульфаниламидные препараты (Лидаприм-форте по 1 таб. 2 раза в день) Феноксиметилпенициллин Амоксициллин Ампиокс по 500 мг. 4 раза в день Доксициклина гидротартрат по 100 мг. 2 раза в день Линкомицина гидрохлорид по 500 мг. 3 раза в день |
Амоксициллин+клаувоновая кислота по 375 мг. 3 раза в день Ампициллин+сульбактам по 750 мг. 2 раза в день Метронидазол по 500 мг 3 раза в день |
Цефуроксим по 250 мг. 2 раза в день |
Использование линкомицина возможно только после результатов бактериологического исследования |
|
Острый сиалоаденит |
Оксациллин по 500 мг. 4 раза в день Ампициллин 500 мг. 3 раза в день
|
Оксациллин по 500 мг. 4 раза в день + гентамицина сульфат 160 мг;
Рокситромицин по 300 мг. 2 раза в день |
Ципрофлоксацин по 500 мг. 2 раза в день |
|
|
Профилактика нагноения послеоперационной костной раны |
Доксациклина гидротартрат по 100 мг. 2 раза в день. Линкомицина гидрохлорид по 600 мг. 3 раза в день.
|
Амоксициллин по 500 мг. 3 раза в день |
Цефуроксим по 500 мг. 2 раза в день |
Интенсивность лечения зависит от объема повреждения костной ткани и от длительности экспозиции раны |
Таблица 5. возможные схемы антибиотикотерапии в амбулаторной практике
При планировании эмпирической противомикробной химиотерапии ИВЗ ЧЛО в стационаре ориентиром может являться следующая таблица
|
Нозологическая форма |
Наиболее распространенный возбудитель |
Препараты 1 ряда |
Препараты 2 ряда (резерв) |
|
О. одонтогенный (травматический) остеомиелит челюстей |
Str. Viridans S. aureus Peptococcus spp. Peptpstreptococcus spp. Fusobacterium spp. Bacteroides spp. |
Оксациллин 1гр. 4 раза в день Метронидазол по 500 мг. 2-3 раза в день (в сочетании) Линкомицин 600 мг 2 раза в день |
Амоксициллин+клаувоновая кислота по 1200 мг. 3 раза в день Ампициллин+сульбактам по 1500мг. 2 раза в день Пиперациллин+тазобактам 2500 мг 4 раза в день (у иммуносупрессивных пациентов) |
|
Абсцессы и флегмоны ЧЛО |
S.aureus Str. Pyogenes Str. Spp Veilonella spp. Eikenella spp. Moraxella spp. Peptococcus spp. Peptpstreptococcus spp. Fusobacterium spp. Bacteroides |
Ампициллин+сульбактам по 1500мг. 2 раза в день Амоксициллин+клаувоновая кислота по 1200 мг. 3 раза в день Ампициллин по 1 гр 4 раза в день Оксациллин 1-2гр. 4 раза в день + Метронидазол по 500 мг. 2-3 раза в день Цефазолин по 1 гр 4 раза в день + Гентамицин 160 мг в день Линкомицин 600-1200 мг 2 раза в день
|
Амикацин 15 мг/кг веса больного в сутки в 2 введения Цефепим 1-2 гр 2 раза в день Имипенем 500мг-1000 мг 3-4 раза в день Клиндамицин до 1.8 г в сутки |
|
Лимфадениты |
ß-гемолитический стрептококк группы А
Bacteroides spp. F. nucleaticum |
Оксациллин 1-2гр. 4 раза в день Цефазолин по 1 гр 4 раза в день Клиндамицин до 1.8 г в сутки |
Рокситромицин по 300 мг. 2 раза в день Клиндамицин до 1.8 г в сутки Гентамицин по 80 мг. лимфотропно 1 раз в день |
|
Филлиноз (болезнь кошачьих царапин) |
Bartonella henselae |
Доксициклин 100 мг. 2 раза в день Ципрофлоксацин по 500 мг 2 раза в день
|
Азитромицин 500 мг 1 раз в день
|
|
Острый одонтогенный синусит |
Bacteroides spp Peptpstreptococcus spp S. pneumoniae H.influenza |
Амоксициллин+клаувоновая кислота по 1200 мг. 3 раза в день
|
Цефуроксим по 500 мг. 2 раза в день Ципрофлоксацин по 500 мг 2 раза в день
|
|
Актиномикоз |
A.israelli |
Бензилпенициллин 18-24 млн ЕД в сутки |
Доксициклин по 100 мг. 2 раза в день Клиндамицин по 2.7 г в сутки |
|
Фурункулы и карбункулы |
S. aureus |
Оксациллин 1-2гр. 4 раза в день Амоксициллин+клаувоновая кислота по 1200 мг. 3 раза в день
|
Цефалексин по 500-100 мг. 4 раза в день Цефуроксим 1000 мг 3 раза в день Азитромицин 500 мг в сутки Кларитромицин 500 мг 2 раза в день
|
|
Внутричерепные осложнения (восходящая инфекция) |
S. aureus Str. Spp F. necrophorum Bacteroides spp Neisseria spp Corunebacterium spp |
Бензиллпенициллин 18-24 млн. Ед в сутки Ванкомицин 1 гр 2 раза в день Метронидазол 500 мг 3 раза в день Оксациллин 2-3 гр 4 раза в день Рифампицин 600 мг в сутки
|
Меропенем 4 гр в сутки Цефотаксим 2 гр 6 раза в день Амикацин 1 гр 6 раза в день
|
|
Медиастинит (нисходящая инфекция) |
S. aureus Str. Spp F. necrophorum Bacteroides spp Neisseria spp Corunebacterium spp Eikenella spp. Moraxella spp. Peptococcus spp.
|
Амоксициллин+клаувоновая кислота по 1200 мг. 3 раза в день Ванкомицин 1 гр 2 раза в день Метронидазол 500 мг 3 раза в день Амикацин 15 мг/кг веса больного в сутки в 2 введения Цефепим 1-2 гр 2 раза в день Имипенем 500мг-1000 мг 3-4 раза в день Клиндамицин до 1.8 г в сутки |
Имипинем+циластин 500 мг 4 раза в день Меропенем по 1 гр до 6 раз в день
|
|
Сепсис (генерализованная инфекция) |
S. aureus E. coli B. fragilis Ps. aurogenosa Veilonella spp. Eikenella spp. Moraxella spp H.influenzae Klebsiella Enterobacter
|
Оксациллин по 1 гр 4 раза в день +метронидазол по 500 мг 3 раза в день +гентамицин 160 мг 1 раз в день Цефатаксим по 2гр 3 раза в день+амикацин по 1 гр до 6 раз в день Клиндамицин до 1.8. гр. В сутки + гентамицин до 240 мг в сутки Пиперациллин+ тазобактам по 2.5 гр 4 раза в день Амоксициллин+клаувоновая кислота по 1200 мг. 3 раза в день
|
Имипинем+циластин 500 мг 4 раза в день Меропенем по 1 гр до 6 раз в день Ципрофлоксацин по 1 гр 2 раза в день + метранидазол по 500 мг. 3 раза в день Орнидазол по 500 мг 2 раза в день Ниморазол по 500 мг 2 раза в день Ванкомицин по 1 гр 2 раза в день+амикацин по 1 гр до 6 раз в день
|
|
Рожа |
ß-гемолитический стрептококк группы А
|
Бензиллпенициллин 18-24 млн. Ед в сутки Феноксиметилпенициллин 500 мг 8 раз в день
|
Амоксициллин+клаувоновая кислота по 1200 мг. 3 раза в день Цефотаксим 2 гр 6 раза в день Цефуроксим 1000 мг 3 раза в день
|
Таблица 6. Возможные схемы антибиотикотерапии в стационаре
|
Препараты |
Анаэробные кокки |
Clostridium spp. |
Actinimyces spp. |
Bacteroides fragilis |
|
Пенициллин G/V |
+++ |
+++ |
+++ |
- |
|
Аминопенициллины |
+++ |
+++ |
+++ |
+ |
|
Мезло/ пиперациллин |
+++ |
+++ |
+++ |
++ |
|
Ампициллин /сульбактам |
+++ |
+++ |
+++ |
+++ |
|
Цефазолин |
+++ |
++ |
+ |
+ |
|
Цефокситин |
+++ |
++ |
++ |
+ |
|
Латамоксеф |
+++ |
+++ |
+++ |
+++ |
|
Цефатаксим |
+++ |
+++ |
+++ |
+ |
|
Имипенем |
+++ |
+++ |
+++ |
+++ |
|
Клиндамицин |
+++ |
Cl.perfrfingens |
+++ |
+++ |
|
Эритромицин |
++ |
+++ |
+++ |
- |
|
Тетрациклины |
+ |
+ |
+ |
+ |
|
Хлорамфеникол |
+++ |
+++ |
+++ |
+++ |
|
Метронидазол |
+++ |
+++ |
- |
+++ |
|
Ванкомицин/ тейкоплакин |
++ |
Cl.difficile |
- |
- |
Таблица 7. активность антибиотиков в отношении анаэробных микроорганизмов
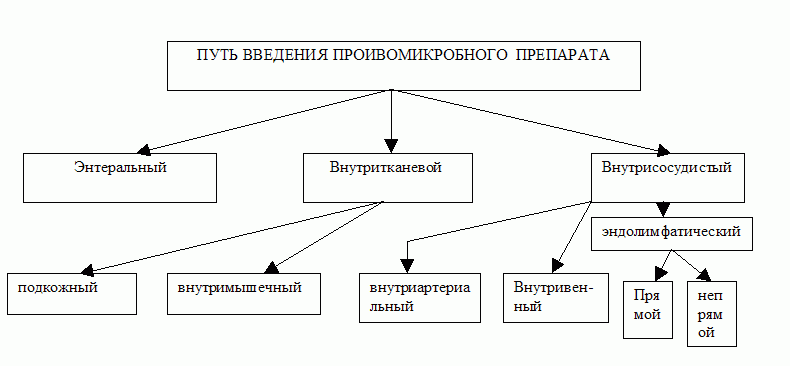
Рис.9 Пути введения противомикробных препаратов.
Для интенсивной терапии ООИ наиболее подходящим является внутривенный и внутриартериальный путь введения. Для этого используются системы круглосуточного введения лекарственных средств. На 240 мл. физиологического раствора разводится суточная доза препарата (при условии стабильности раствора) и осуществляется введение со скоростью 10 мл. в час. Однако, на фоне очевидных преимуществ (стабильное поддержание МПК в плазме, высокая точность дозирования и т.д.) этот способ не лишен недостатков: ограничение подвижности пациента, возможность развития катетер-ассоциированной инфекции, раздражение сосудистой стенки.
При инфекции средней тяжести и ограниченных форм возможной использование внутримышечного способа введения. при этом необходимо учитывать следующие особенности: у пациента должно быть адекватное кровообращение и функционирующее микроциркуляторное русло, внутримышечное введение не должно выполнятся в инфильтраты мягких тканей, во многих случаях требуется контроль МПК в плазме, необходимо преодолевать психо-эмоциональный барьер болезненной манипуляции.
Также одним из возможных способов введения противомикробного препарата в организм является энтеральный. Удобства данного метода очевидны – прием не связан с болезненными манипуляциями, возможен самостоятельный прием препарата пациентом, большинство таблетированных форм не требуют специальных условий хранения. При этом нельзя забывать о недостатках метода: сложность контроля за кратностью и дозированием приема, выраженное подавление нормальной микрофлоры кишечника, прохождение препарата через портальную систему печени.
Кроме бактериальной этиологии ИВЗЧЛО существуют заболевания, вызываемые вирусами. При лечении данной группы заболеваний можно ориентироваться на таблицу
|
Нозологическая форма |
Наиболее распространенный возбудитель |
Противовирусные препараты |
|
|
Эпидемический паротит |
Вирус паротита |
|
|
|
Вирусный неэпидемический паротит |
Вирусы респираторно-вирусных инфекций (грипп, парагрипп , респираторно синтициальная инфекция). Аденовирус Вирус Эпштейна-Барра |
Ремантадин по 50 мг 2 раза в день Рибавирин доза индивидуальна Валацикловир по 1 гр 3 раза в день |
Циклоферон по 1 амп. 2 раза в день через день Виферон-3 по 1 свечке 2 раза в день в прямую кишку Интерферон человеческий лейкоцитарный по 1 амп. в день интраназально |
|
Цитомегаловирус
|
Ганцикловир 5 мг на 1 кг массы тела 2 раза в день (обязательно лабораторное подтверждение ЦМВ) Валацикловир по 1 гр 3 раза в день |
Препараты, повышающие функцию защитных систем организма |
|
|
Острый герпетический стоматит |
Вирус простого герпеса |
Ацикловир по 200 мг. 5 раз в день Валацикловир по 1 гр 3 раза в день |
|
|
Хронический рецидивирующий герпес губ |
Вирус простого герпеса |
Ацикловир по 200 мг. 5 раз в день
|
|
|
Опоясывающий лишай |
Varicella Zoster |
Фамцикловир по 250 мг 3 раза в день Валацикловир по 1 гр 3 раза в день |
|
|
Вирусный лимфаденит |
Вирусы респираторно-вирусных инфекций, вирус простого герпеса |
Лечение назначается исходя из «причинного» заболевания |
|
Таблица 8. Схемы лечения ИВЗ ЧЛО вирусной этиологии
Особенности планирования антибактериальной терапии в «проблемных» группах больных (пациенты старших возрастных групп и беременные женщины).
Выделяют ряд факторов, утяжеляющих течение инфекционно-воспалительного процесса у пожилых людей:
нарушение сознания;
снижение иммунитета;
сопутствующие хронические заболевания;
постельный режим;
длительная госпитализация.
Диагностика
инфекции. У пожилых пациентов
инфекционно-воспалительный процесс часто имеет скудную клиническую симптоматику:
отсутствие острого начала, слабая лихорадочная реакция, умеренные изменения
лейкоцитарной формулы (как правило, без лейкоцитоза).
Иногда
воспалительный процесс у таких больных протекает атипично и клинически может
проявляться симптоматикой со стороны центральной нервной системы
(заторможенность, сонливость, слабость, нарушение сознания, изменения психики,
головная боль, головокружение и др.), внезапным развитием или прогрессированием
дыхательной, сердечной или почечной недостаточности. В случае “беспричинного”
возникновения подобных симптомов в первую очередь следует исключить инфекцию.
Социально-экономические факторы
осложняют процесс лечения пожилых пациентов. К ним в первую очередь относятся
снижение памяти и интеллекта, нарушения двигательных функций, трудности
самообслуживания, одиночество, плохое соблюдение личной гигиены, ограниченные
финансовые возможности.
Фармакокинетика
лекарств (все основные параметры)
у лиц пожилого возраста меняется, что может вызвать изменение
фармакодинамики
Всасывание
антибактериальных средств, как правило, происходит так же, как у пациентов
других возрастных групп, снижение мезентериального кровотока способно привести к
незначительному уменьшению скорости, но не степени всасывания лекарств.
Распределение.
С возрастом за счет атрофии мышц снижается масса тела, поэтому в организме
уменьшается содержание воды (на 10 – 15%) и увеличивается относительная масса
жировой ткани (у мужчин с 18 до 36%, у женщин с 33 до 48%). В результате, у
пожилых пациентов уменьшается объем распределения водорастворимых лекарств, что
сопровождается некоторым повышением их концентрации в крови; а объем
распределения жирорастворимых соединений - увеличивается. Изменение объема
распределения антибактериальных средств клинически незначимо, так как
компенсируется более выраженными последствиями возрастного снижения метаболизма
и экскреции препаратов. Однако одной из причин недостаточной клинической и
бактериологической эффективности антибиотиков у лиц пожилого возраста является
ухудшение транспорта лекарств в ткани из-за падения объема распределения и
величины тканевого кровотока.
Метаболизм лекарств в печени снижается с возрастом из-за уменьшения:
массы печени (после 40 лет на 1% в год), печеночного кровотока (с 25 до 65 лет
на 40-45%) и активности микросомальных ферментов. В результате снижается клиренс
и повышается сывороточная концентрация антибактериальных средств, которые в
основном (> 50%) метаболизируются в печени (цефоперазон, доксициклин,
линкомицин, клиндамицин, хлорамфеникол, пефлоксацин, макролиды, изониазид,
этионамид, пиразинамид, рифампицин) [2].
Выведение.
Большинство антибактериальных препаратов выводятся почками. Экскреция многих
лекарственных средств у пациентов пожилого возраста замедляется, что приводит к
увеличению их концентраций в крови. Это обусловлено атрофией коркового слоя
почек и, как следствие, снижением скорости клубочковой фильтрации (с 20 до 50
лет на 0,4 мл/мин в год , после 50 лет на 1 мл/мин в год; к 65 годам скорость
клубочковой фильтрации уменьшается примерно в 2 раза) и канальцевой секреции
(уменьшение на 7% каждые 10 лет). В связи с этим необходимо корректировать дозы
антибактериальных препаратов, имеющих преимущественно почечный путь элиминации,
в зависимости от величины клубочковой фильтрации (особенно для потенциально
токсичных лекарств - аминогликозидов, ванкомицина, карбенициллина, тикарциллина,
тетрациклинов, полимиксинов) [3].
Сопутствующие
заболевания - застойная сердечная
недостаточность, заболевания почек и почечная недостаточность, хронические
обструктивные болезни легких, сахарный диабет, цирроз печени, злокачественные
новообразования - cпособствуют обострению очагов хронической одонтогенной
инфекции, ухудшают результаты антибактериальной терапии. Кроме того,
необходимость лечения сопутствующих заболеваний повышает риск нежелательных
взаимодействий антибиотиков с другими средствами и появления токсического
эффекта лекарственных препаратов.
Тип возбудителей. У пожилых пациентов возбудителями чаще всего являются так называемые “проблемные” микроорганизмы (энтерококки, стафилококки, синегнойная палочка, энтеробактер, серрация, ацинетобактер). Но в последние годы отмечается неуклонная тенденция к росту количества устойчивых штаммов микроорганизмов, главным образом грамотрицательных, к бета-лактамным антибиотикам (пенициллинам и цефалоспоринам). Серьезная проблема для больных этой категории - суперинфекция резистентными штаммами микробов (энтерококки, анаэробы) или грибами, возникающая на фоне проведения антибактериальной терапии. Предрасположенность к развитию суперинфекции обусловлена как особенностями макроорганизма (колонизация условно-патогенными микробами полости рта и желудка, дыхательных и мочевых путей, иммунодефицит и др.), так и нерациональным применением антибиотиков:
необоснованное назначение препаратов широкого спектра действия;
использование слишком коротких (3 – 4 дня) или чрезмерно длительных курсов лечения;
применении препаратов бактериостатического действия;
длительное (более 24 ч) использование антибиотиков с профилактической целью в хирургии.
Особенности
лекарственной терапии. Использование
ряда антибактериальных препаратов у больных пожилого возраста нежелательно и
даже противопоказано (табл. 1). Необходимо избегать рутинного назначения
указанных препаратов, поскольку последствия их токсического действия могут быть
сильнее благоприятного терапевтического эффекта. Не рекомендуется широко
применять антибактериальные средства с бактериостатическим действием
(тетрациклины, хлорамфеникол, сульфаниламиды, линкозамины), так как из-за
ослабления защитных сил организма повышается вероятность возникновения неполного
бактериологического эффекта, что увеличивает риск развития рецидива инфекции и
хронизации инфекционного процесса. Отметим, что при использовании
бактериостатических препаратов повышается вероятность селекции устойчивых
штаммов микроорганизмов и развития суперинфекции.
При выборе
антибактериального средства необходимо учитывать следующие факторы:
антимикробную активность антибактериального средства (преимущество имеют препараты бактерицидного действия);
устойчивость препарата к бета-лактамазам;
переносимость лекарственного средства пациентом;
возрастные изменения фармакокинетики лекарств;
удобство режима дозирования, особенно для препаратов, назначаемых внутрь (желательно, чтобы частота приема лекарства не превышала двух раз в сутки, иначе велика вероятность несоблюдения режима дозирования).
Указанному не соответствуют многие лекарственные средства, широко применяемые при лечении инфекционно-воспалительных процессов. Так, природные пенициллины неактивны в отношении многих возбудителей (стафилококки, грамотрицательные бактерии) [4]; аминопенициллины (ампициллин, амоксициллин) нестабильны к бета-лактамазам; цефалоспорины I поколения (цефалотин, цефазолин, цефалексин) неактивны в отношении большинства грамотрицательных бактерий, разрушаются бета-лактамазами грамотрицательных бактерий; аминогликозиды плохо проникают в легочную ткань, активность их снижается при гнойных процессах, высока токсичность; тетрациклины оказывают бактериостатическое действие, плохо переносимы и потенциально токсичны; сульфаниламиды вызывают бактериостатический эффект, к ним устойчивы многие штаммы.
Антибактериальными средствами первого ряда для лечения инфекционно-воспалительного процесса челюстно-лицевой области у пожилых пациентов являются цефалоспорины III поколения: цефосин (цефотаксим), цефтриаксон, цефоперазон, цефтазидим. Эти препараты до настоящего времени считаются высоко эффективными [5-6]. В комплексное этиотропное лечение данной патологии целесообразно включать лекарство из группы природных адаптогенов родиолу розовую, которая обладает собственными антибактериальными свойствами [7].
Проведение целенаправленной терапии возможно только при получении результатов бактериологического исследования и выделения патогенных микроорганизмов (табл. 2).
Современные антибактериальные средства в большинстве случаев позволяют проводить лечение одним препаратом (монотерапию), подобранным в соответствии с вероятным или верифицированным диагнозом (эмпирически или целенаправленно). Комбинированная антибактериальная терапия назначается в следующих случаях :
тяжелое течение процесса при неизвестном возбудителе, особенно - осложненное сепсисом;
воспалительный процесс на фоне выраженного иммунодефицита;
наличие микробных ассоциаций, на которые не действуют отдельные антибактериальные препараты;
низкая чувствительность штаммов микроорганизмов к монотерапии.
Хорошие результаты
получают при использовании полусинтетических пенициллинов или цефалоспоринов с
аминогликозидами, фторхинолонов с аминогликозидами.
Эффективность
назначаемого лекарственного средства следует оценивать не позже, чем через 48-72
ч от начала лечения по уменьшению лихорадки, исчезновению ознобов и признаков
интоксикации. Снижение температуры тела до начальной может отмечаться в более
поздние сроки (на 3-5-й день лечения). Отсутствие эффекта в течение 2-3 сут
требует замены антибактериального средства первого ряда альтернативным (с учетом
спектра его действия и предполагаемого характера возбудителей).
Продолжительность антибактериальной терапии должна быть 7-10 дн (в реанимации – до 14 дн). Более длительное лечение, особенно препаратами широкого спектра действия, способствует развитию суперинфекции, угнетает местную защиту легких и увеличивает стоимость лечения, для снижения которой целесообразно с парентерального введения антибиотика (через 3-5 дн от начала терапии при стабилизации состояния больного) переходить на прием препарата внутрь.
Лечение инфекционно-воспалительного процесса в челюстно-лицевой области у больных пожилого возраста – сложная проблема, которую трудно обсудить подробно в коротком сообщении. Мы представили наиболее важные, с нашей точки зрения, аспекты и указали подходы к ее решению.
|
Антибактериальные средства |
Причины нежелательности назначения |
|
Аминогликозиды |
Нефротоксичность, снижение слуха, глухота, вестибулярные нарушения |
|
Карбоксипенициллины: карбенициллин, тикарциллин |
Дисфункция тромбоцитов (кровотечения), гипернатриемия (прогрессирование сердечной недостаточности), гипокалиемия (нарушения ритма сердца) |
|
Нитрофураны |
Высокая токсичность при сниженной функции почек |
|
Пенициллины в больших дозах |
Токсические эффекты со стороны ЦНС (судороги) |
|
Полимиксины |
Нефротоксичность, нейротоксичность |
|
Тетрациклины |
Нефротоксичность при заболевании почек, гепатотоксичность |
|
Хлорамфеникол |
Угнетение функции костного мозга (нейтропения/агранулоцитоз, апластическая анемия) |
|
Цефалоспорины с N-метилтиотетразольной структурой* |
Нарушение всасывания витамина К в кишечнике; кровотечения |
|
* Цефамандол, цефотетан, цефметазол, цефоперазон, латамоксеф |
|
Таблица 9. Антибактериальные средства, назначения которых следует избегать у больных пожилого возраста
|
Возбудитель |
Препараты первого ряда |
Препараты второго ряда |
Альтернативные средства |
|
Acinetobacter spp. |
Фторхинолоны |
Карбапенемы |
Аминогликозиды, АСПен, цефалоспорины III-IV |
|
Actinomyces spp. (+) An |
Пенициллин |
Клиндамицин Тетрациклин Эритромицин |
|
|
Bacteroides fragilis |
Метронидазол
|
Клиндамицин |
Цефокситин, АМП/СБ, АМО/КК, карбапенемы, линкомицин, ПИП/ТАЗ |
|
Citrobacter freundii |
Фторхинолоны |
Карбапенемы |
Аминогликозиды, цефалоспорины IV, ПИП/ТАЗ |
|
Clostridium spp. (+) An (кроме C.difficile) |
Бензил-пенициллин Метронидазол Ванкомицин Ампициллин |
Карбенициллин Левомицетин
|
Тикарлциллин Мезлоциллин Азлоциллин Пиперациллин |
|
Enterobacter spp. |
“ |
АСПен, аминогликозиды |
Карбапенемы, цефалоспорины III-IV, ко-тримоксазол |
|
Enterococcus feacalis |
АМП/СБ, АМО/КК +/- АГ |
Ванкомицин, тейкопланин |
Ампициллин + аминогликозид, АСПен+ аминогликозид, ПИП/ТАЗ |
|
Enterococcus faecium |
Ванкомицин |
Тейкопланин |
|
|
Escherichia coli |
Цефалоспорины II-IV |
Фторхинолоны |
Ампициллин + гентамицин, ко-тримоксазол, АСПен, АМП/СБ, АМО/КК, ПИП/ТАЗ |
|
Fusobacterium spp. (-) An. |
Пенициллин |
Клиндамицин Метронидазол |
|
|
Haemophilus influenzae |
Цефтриаксон или цефуроксим |
Цефалоспорины III-IV |
Фторхинолоны, карбапенемы, АМО/КК, АМП/СБ, АСПен |
|
Klebsiella pneumoniae |
Цефалоспорины II-IV |
Фторхинолоны |
Аминогликозиды, карбапенемы, ко-тримоксазол |
|
Legionella pneumophila |
Макролиды |
Фторхинолоны |
Рифампицин, ко-тримоксазол |
|
Moraхella catarrhalis |
АМО/КК, АМП/СБ, цефалоспорины II |
Цефалоспорины III |
Фторхинолоны, ко-тримоксазол, макролиды, доксициклин |
|
Proteus mirabilis |
АМП/СБ, АМО/КК |
Фторхинолоны |
Ко-тримоксазол, цефалоспорины II-IV, АСПен, аминогликозиды |
|
Proteus vulgaris |
Фторхинолоны |
Цефалоспорины III |
Аминогликозиды, карбапенемы, ПИП/ТАЗ |
|
Pseudomonas aeruginosa |
Цефтазидим, ципрофлоксацин |
Офлоксацин, меропенем |
Имипенем, АСПен+аминогликозид, ПИП/ТАЗ, полимиксины |
|
Serratia marcescens |
Фторхинолоны |
Цефалоспорины III |
Аминогликозиды, карбапенемы, ПИП/ТАЗ |
|
Staphylococcus aureus: |
|||
|
оксациллин- чувствительный |
Оксациллин |
Цефалоспорины I-II Экстракт родиолы розовой |
Макролиды, клиндамицин, АМП/СБ, АМО/КК, ко-тримоксазол |
|
оксациллин- резистентный |
Ванкомицин |
Тейкопланин Экстракт родиолы розовой |
Рифампицин, фузидин |
|
Staphylococcus epidermidis |
Ванкомицин, |
оксациллин, Цефалоспорины I-II, тейкопланин Экстракт родиолы розовой |
ко-тримоксазол Фторхинолоны, клиндамицин |
|
Streptococcus гр. А,B,C,G(+) A |
Пенициллин G, макролиды |
Цефалоспорины I-II Экстракт родиолы розовой |
Ко-тримоксазол, АМО/КК, АМП/СБ, клиндамицин, оксациллин |
|
Streptococcus viridans пенициллин- резистентный |
Цефтриксон, цефотаксим |
Ванкомицин Экстракт родиолы розовой |
Цефалоспорины II, макролиды |
|
АМО/КК – амоксициллин/клавулановая кислота; АМП/СБ – ампициллин/сульбактам; ПИП/ТАЗ – пиперациллин/тазобактам; цефалоспорин I – цефалоспорины I поколения (цефазолин, цефалотин); цефалоспорины II – цефалоспорины II поколения (цефуроксим, цефамандол); цефалоспорин III – цефалоспорины III поколения (цефотаксим, цефтриаксон, цефтазидим, цефоперазон); цефалоспорин IV – цефалоспорины IV поколения (цефпиром); АСПен – антисинегнойные пенициллины; АГ – аминогликозиды. |
|||
Таблица 10. Антибактериальные средства, используемые при установленной этиологии
Планирование противомикробного лечения у беременных основывается на принципах разумной достаточности. При каждом назначении антибиотиков необходимо соотнести риск для здоровья матери с опасностью развития осложнений у плода. Однако, это не означает, что при заболевании матери нельзя проводить противомикробное лечение. Необходимо учесть, что все антибиотики проникают через трансплацентарный барьер и оказывают действие на плод. Учитывая отличия разных групп по выраженности действия на плод выделяют 3 группы антибиотиков по возможности применении у беременных
|
Опасные (противопоказаны беременным) |
Потенциально опасные (применяются в случае, если риск заболевания матери превышает риск токсического действия на плод) |
Неопасные (разрешены при беременности) |
|
Амфениколы |
Аминогликозиды |
Пенициллины |
|
Тетрациклины |
Карбапенемы |
Цефалоспорины |
|
Ко-тримазол |
Азтреонам |
Эритромицин, спирамицин |
|
Нитроимидазолы |
Гликопептиды |
Полимиксина М сульфат |
|
Нитрофураны |
Фузидиевая кислота |
нитрофураксазид |
|
Фторхинолоны |
Азитромицин |
|
|
Хинолоны и оксихинолоны |
|
|
|
Сульфаниламиды |
|
|
|
Диаминопиримидины |
|
|
|
Полимиксины |
|
|
|
Рифампицины |
|
|
Таблица 11. возможность использования противомикробных средств у беременных
При планировании лечения у женщин детородного возраста необходимо тщательно собирать половой анамнез, уточнять день цикла и способ контрацепции и при любых сомнениях назначать лечение , как при беременности. Тератогенное, эмбриотоксическое и органитоксическое действие наиболее значимо именно в первые недели беременности, так как ворсины хориона обладают значительно меньшими фильтрационными свойствами нежели плацента.
При наличии показаний возможно назначение антибиотика и во время лактации. При этом необходимо учесть следующие особенности
возможна экскреция и секреция препарата и (или) его метаболитов в грудное молоко
многие препараты не оказывают значимого влияния на ребенка при коротком периоде использования (5-7 дней)
при применении антибиотиков назначаются пробиотичесике препараты (лактобактерин или бифидобактерин) после консультации педиатра
если используются запрещенные во время лактации препараты по жизненным показаниям, то грудное молоко сцеживается и выливается, ребенка переводят на искусственное вскармливание до прекращения лечения и выведения препарата из организма матери, а затем, грудное кормление возобновляют
|
Антибиотики применение которых разрешено у кормящих |
Антибиотики, применение которых нежелательно у кормящих |
Антибиотики противопоказанные при лактации |
|
Пенициллины |
Макролиды (кроме эритромицина) |
Амфениколы |
|
Цефалоспорины |
«защищенные» пенициллины) |
Тетрациклины |
|
Эритромицин |
Карбапенемы |
Сульфаниламиды |
|
Аминогликозиды |
Фторхинолоны |
Нитроимидазолы |
|
Линкосамиды |
Фузидиевая кислота |
Нитрофураны |
|
Азтреонам |
|
Хинолоны |
|
Гликопептиды |
|
Спирамицин |
Таблица 12. возможность использования противомикробных средств у кормящих
По нашему мнению, наиболее безопасным способом введения антибиотиков в «проблемных» группах пациентов является лимфотропное введение цефалоспоринов (поколение зависит от особенности микрофлоры). Удаленность места введения от молочных желез и матки исключает вероятность лимфогенного проникновения, а низкая концентрация в плазме позволяет уменьшить вредные влияния на плод или организм ребенка.
Особенностью противомикробного лечения в «проблемных» группах является полипрагмазия – одновременное назначение нескольких лекарственных средств. При этом возможно увеличение риска развития побочных эффектов. Наиболее опасные комбинации приведены в таблице
|
Группы антибиотиков |
Одновременно назначаемые препараты |
Опасные результаты взаимодействия |
|
Аминогликозиды |
Диуретики Нестереоидные противовоспалительные средства |
Снижение слуха Нарушение функции почек |
|
Тетрациклины Карбоксипенициллины Макролиды |
Сердечные гликозиды |
Гликозидная интоксикация |
|
Макролиды |
Карбамазепин
|
Тошнота, рвота |
|
Фторхинолоны Макролиды |
Тефиллин |
Возбуждение, судороги, бессонница |
|
Макролиды |
Антигистаминные II поколения |
Нарушения сердечного ритма |
|
Метронидазол Сульфаниламиды Макролиды |
Антикоагулянты непрямого действия |
Кровотечения |
|
Сульфаниламиды Тетрациклины Хлорамфеникол |
Пероральные противодиабетические |
Гипогликемия |
Таблица 13. опасные взаимодействия антибиотиков с лекарственными средствами.
При тяжелых инфекциях, при ассоциативной этиологии инфекционного процесса, часто назначают комбинацию из 2-х, а в исключительных случаях и из трех антибиотиков. Необходимо внимательно подбирать комбинации с учетом синэргизма: ß-лактами и аминогликозиды, метронидазол и клиндамицин и т.д. Сочетание антибиотиков с разными полями спектра противомикробной активности препядствует быстрому развитию резистентности возбудителей, однако способно усилить и увеличить частоту побочных эффектов каждого из них
|
№ |
Побочный эффект |
Для какой группы антибиотиков характерен |
|
1 |
Аллергические реакции |
:ß-лактамы |
|
2 |
Эозинофилия и изменения в биохимическом анализе |
Все группы |
|
3 |
Боли в животе, снижение аппетита, диарея |
Пр пероральном применении Макролиды Тетрациклины Фторхинолоны Линкосамиды Нитрофураны Рифампицин Нитроимидазолы |
|
4 |
Нефротоксичность |
Аминогликозиды Некоторые цефалоспорины Полимиксины |
|
5 |
Ототоксичность |
Аминогликозиды |
|
6 |
Угнетение кроветворения |
Амфениколы Ко-тримазол Сульфаниламиды |
|
7 |
Иммунодепрессия |
Амфениколы Ко-тримазол Сульфаниламиды |
|
8 |
Кандидоз и дисбактериоз |
Для всех антибиотиков при долгом применении |
|
9 |
Угнетение роста соединительной ткани (хрящи, связки, зубы) |
Фторхинолоны Тетрациклины |
|
10 |
Нейротоксичность |
Нитрофураны Полимиксин В Нитроимидазолы Фторхинолоны Линкосамины |
|
11 |
Псевдомембранозный колит |
Клиндамицин Аминопенициллины Цефалоспорины II-III поколения (преимущественно пероральные) |
Таблица 14. побочные эффекты противомикробной терапии.
До 30% назначений антибиотиков осуществляется с профилактической целью. В хирургической практике различают предоперационную, интраоперационную и послеоперационную антибиотикопрофилактику осложнений. Известно, что предупреждение инфекционно-воспалительных осложнений значительно проще и безопасней, чем борьба с развившимся процессом. Путей проникновения патогена в рану известно несколько: экзогенный (из воздуха операционной, с поверхности поля, с контактирующих с раной предметов) и эндогенный (контактный, лимфогенный, гематогенный). Для адекватной химиоприофилактики необходимо создание в биологических жидкостях достаточной концентрации противомикробного вещества. Известно, что правильно спланированная антибиотикопрофилактика снижает удельный вес осложнений с 40% до 5%.
Существует 4 группы риска развития инфекционно-воспалительных осложнений после оперативных вмешательств:
«чистые» операции (риск менее 5%) – плановые, малотравматичные операции без сообщения с полостью рта
«условно-чистые» (риск около 10%) – чистые операции в полости рта и приротовой области, малотравматичные операции, связанные с длительной экспозицией раны
«загрязненные» (риск около 20%) – операции в условиях хронического воспалительного процесса, обширные вмешательства в полости рта и приротовой зоне, высокотравматичные оперативные вмешательства, наличие сообщения клетчаточных пространств головы и шеи с полостью рта, глотки и т.д.
«грязные» (риск около 30-40%) – операции в заведомо инфицированных областях, длительная (более 4-х часов) экспозиция раны, операция в условиях острого или подострого воспаления, обширные раневые поверхности, операции на костных структурах в полости рта и т.д.
Для профилактики осложнений у иммуноадекватных пациентах в 1 группе достаточно орагнизационных мероприятий (маленький доперационный период, сокращение времени операции за счет использования современных методик, борьба с госпитальной инфекцией, строгое соблюдение принципов асептики). При планировании антибиотикопрофилактики в 2-4 группах необходимо учесть следующие важные моменты:
введение антибиотиков должно начинаться не позднее , чем за 3 часа до разреза. Применение препаратов менее, чем за час не снижает риск развития осложнений
выбранный антибиотик должен быть активен в отношении эндогенной микрофлоры больного (пероперационные посевы), в отношении госпитальной микрофлоры (эпидемиологическая обстановка)ю
должна обеспечиваться достаточная концентрация (выше МПК) препарата в тканях операционной раны
период полувыведения антибиотика должен совпадать или превышать длительность операции
препарат должен обладать минимальными побочными эффектами
Наиболее перспективными для антибиотикопрофилактики представляются ß-лактамная группа. Хорошее проникновение в ткани, и удовлетворительная периносимость позволяет использовать эту группу для пред-, интра- и послеоперационной профилактики.
Перед операцией во 2-й и 3-й группах за 3 часа до операции производится прием препарата внутрь или внутримышечно, дальнейшее введение производиться с учетом фармакодинамики препарата не менее 5 суток после операции.
При профилактическом применении антибиотиков в 4-й группе наиболее целесообразным является дооперционное внутримышечное введение, интраоперационное внутривенное введение и послеоперационное – внутримышечное. При длительных операциях используют антибиотики с длительным периодом полувыведения (цефтриаксон 1-2 гр. За 30-90 мин до операции, цефотаксим – 1-2 гр во время вводного наркоза, цефуроксим 1.5 гр., метронидазол 500 мг.- 1 гр. Перед введением в наркоз. Во время вводного наркоза, доксициклин – 200 мг за 30-90 мин до операции. Далее продолжается непрерывная инфузия во время операции.
Применение противомикробных химиотерапевтических средств оказывает значительное влияние на различные звенья гомеостаза. Для предотвращения развития побочных эффектов и осложнений необходимо использовать препараты, способствующие поддержанию постоянства внутренней среды организма и не оказывающих влияние на фармакодинамику антибиотика и не отягощающие течение инфекционно-воспалительного процесса. Для терапии сопровождения целесообразно применение следующих групп препаратов:
|
Показания |
Препарат |
Механизм действия |
Доза |
|
Иммунодепрессия |
Экстракт родиолы розовой |
Повышение сопротивляемости организма, усиление фагоцитоза, интерфероноген |
10 кап. 2 раза в день |
|
|
Циклоферон |
Индуктор эндогенного интерферона |
1 амп. через день |
|
|
Виферон-3 |
интерферон |
По 1 свечке 2 раза в день |
|
Дисбактериоз |
Энтерол |
Антагонистический эффект . Препарат назначается одновременно с антибиотиком |
1 капс 2 раза в день за 30мин до введение антибиотика |
|
|
Витафлор Бифидобактерин Лактобактерин Биовестин
|
Пробиотический эффект, конкурентное вытеснение патогенной флоры кишечника, устранение ротового дисбиоза. Применение возможно в до- или послеоперационном периоде. Препарат теряет активность на фоне антибактериальной терапии |
Подъзячно 1 фл. 2 раза в день |
|
|
Бифидофилюс флора форсе (NSP) |
|
1 капс 3 раза в день |
|
|
Хилак-форте |
Создание условий для жизнедеятельности нормальной микрофлоры кишечника. Возможен прием вместе с антибиотиком |
40 кап. 3 раза в день |
|
Микоз |
Нистатин |
Замедление роста грибов Candida |
По 500000 3 раза в день |
|
|
Флуконазол (дифлюкан) |
Микоситатик |
150 мг. однократно. При продлении антимикробной терапии более 14 дней – повторный прием. |
|
Гепатотоксичность |
Тыквеол |
Противоязвенное, гепатопротекторное, противовоспалительное действие |
1 капс. 4 раза в день |
|
|
Эссенциале-форте |
Нормализация метаболизма липидов в печени |
По 2 капс 3 раза в день |
|
Метаболические нарушения |
Аскорбиновая кислота |
Противовоспалительное действие, нормализация окислительно-восстановительных процессов |
По 500-1000 мг. 2 раза в день |
Таблица 15. Лечение и профилактика возможных осложнений от антибактериальной химиотерапии.
Следует внимательно отнестись к назначению адаптогенов (кроме родиолы розовой) и витаминных препаратов (кроме аскорбиновой кислоты). Эти препараты проникают внутрь микробной клетки, усиливая возможность сопротивления защитным системам организма и, тем самым, усиливая патогенность.
Самым важным критерием эффективности лечения является клинический. В течении первых трех суток после начала антибиотикотерапии необходимо убедиться в правильности выбора противомикробного препарата на основании анализа жалоб пациента, характере температурной кривой, динамики видимого раневого процесса. При правильном выборе противомикробного средства к третьим суткам воспалительный процесс переходит во 2-ю фазу. Если к концу 3-х суток отсутствуют данные о клиническом улучшении – необходимо изменить схему противомикробного лечения. В случае лечении тяжелого, распространенного или генерализованного процесса решение принимается к концу 1-х суток.
Основными лабораторными критериями эффективности являются:
изменение микробного пейзажа раны
уменьшение количества микробных тел в стандартном мазке отпечатке с раневой поверхности
цитологические признаки перехода воспаления во 2-ю фазу
нормализация клинического анализа крови (снижение лейкоцитоза, увеличение абсолютного содержания лимфоцитов, появление эозинофилов)и биохимических показателей.
Наиболее простым и доступным является предложенный нами метод, суть которого заключается в следующем: из мягкой резины изготавливается и стерилизуется блок с площадью квадратной поверхности 1 см2 . Далее с помощью зонда или гладилки он плотно прижимается к раневой поверхности и далее к предметному стеклу. Производится окраска по Граму у подсчет микробных тел в камере Горяева. Снижение количества микробных тел неопровержимо свидетельствует об эффективности выбранной схемы лечения.
Длительность проводимого антимикробного лечения зависит от нескольких факторов:
особенность возбудителя (хламидийная инфекция лечиться антибиотиком не менее 21 дня, инфекции, вызванные ß-гемолитическим стрептококком получают лечение не менее 10 дней)
особенности течения раневого процесса (не менее суток после купирования симптомов острой фазы воспаления)
особенность фармакокинетики и фармакодинамики антибиотика (возможно однократное введение Бициллина-5)
нозологическая форма (лечение хронических остеомиелитов и актиномикоза не менее 21 дня)
Комплекс включает в себя мероприятия, направленные на восстановление нарушенных звеньев гомеостаза, нивелирование органотоксических эффектов от лечения.
|
Нежелательные последствия антибактериальной терапии |
Предлагаемый комплекс |
|
Гиповитаминоз |
Поливитаминный комплекс (супрадин по 1 таблетке в день) |
|
Дисбиотический сдвиг в полости рта |
Бифидофилюс жевачка (NSP) по 1 жевачке 3 раза в день Витафлор по 1/3 флакона 3 раза в день сублингвально |
|
Кишечный дисбиоз |
Бифидофилюс флора форсе (NSP) по 1 капс. 3 раза в день |
|
Дарея |
Энтеросорбенты (смекта по 1 пор. 3 раза в день, полифепан по 1 ст.ложке 3 раза в день) |
|
Интоксикационный синдром |
Экстракорпоральная детоксикация (плазмоферез, УФО аутокрови, лазерное облучение крови) |
|
Астено-вегетативный синдром |
Растительные адаптогены (родиола розовая, заманиха, элеутерококк колючий, женьшень по 10 капель 2 раза в день) |
|
Иммунодепрессия |
Циклоферон по 1 амп. в день через день Иммунотропная терапия после оценки иммунограммы |
Таблица 16. Профилактика нежелательных эффектов от антибактериальной терапии.
Разработка алгоритма противомикробного лечения позволяет добиться хорошего клинического результата с наименьшими нежелательными эффектами и последствиями. Для иллюстрации приводим несколько клинических примеров
Больной 48 лет обратился в хирургическое отделение стоматологической поликлиники с жалобами на боли в верхней челюсти в области 15 зуба, возникшие 2 суток назад и асимметрию лица. Анамнез жизни хроническими заболеваниями и интоксикациями не отягощен. Температура тела больного составляла 37.5 оС, пульс 74 удара в минуту. После оценки местного статуса был поставлен диагноз: «периостит верхней челюсти от 15 зуба», - удален разрушенный 15 зуб и выполнена периостотомия в области 16-14 зубов, из лунки и раны получен в небольшом количестве густой сливкообразный гной без запаха.
Учитывая ограниченность воспалительного процесса и адекватную реактивность организма больного, принято решение о проведении курса противомикробной терапии экстрактом родиолы розовой по 20 капель 2 раза в день. Через сутки после операции состояние больного улучшилось, асимметрия лица уменьшилась, через трое суток асимметрия и инфильтрация краев раны носила остаточный характер, гноетечение отсутствовало, жалоб больной не предъявлял и с 4-х суток после операции восстановлена трудоспособность.
Больная 54-х лет обратилась в клинику по направлению стоматологической поликлиники по месту жительства с диагнозом: «флегмона подглазничной области слева, острый остеомиелит верхней челюсти от 23 зуба. Температура тела при поступлении зарегистрирована 37.9оС , пульс 86 ударов в минуту, количество лейкоцитов в мазке периферической крови - 11*109 в литре, абсолютное содержание лимфоцитов 2.2* 109 в литре. В клинике «причинный» зуб удален, выполнена периостотомия и вскрытие флегмоны внутриротовым доступом. В качестве противомикробного лечения проводилось лимфотропное введение цефазолина в область носо-губной складки троекратно по 1 гр.
К концу третьих суток после операции инфильтрат носил остаточный характер. В качестве терапии сопровождения применяли экстракт родиолы розовой по 20 капель 2 раза в день .На фотографии представлен внешний вид больной на 4 сутки лечения.
В связи с кратковременным назначением противомикробной терапии реабилитационный комплекс не проводился.
Больной 48 лет доставлен в клинику бригадой скорой медицинской помощи с жалобами на боли в подглазничной области справа. Считает себя больным 3 дня, когда появились боли в области 12 зуба. 2 дня назад 12 зуб трепанирован в поликлинике по поводу обострения хронического периодонтита, был получен жидкий гной. Противомикробная терапия не проводилась. Состояние прогрессивно ухудшалось, боли в верхней челюсти приобрели разлитой характер, появился отек нижнего века OS.
При поступлении состояние средней тяжести, пуль 86 в 1 минуту, температура тела 39.0 оС. Отмечалась асимметрия лица за счет инфильтрации бокового ската спинки носа справа. Инфильтрат вытянут по направлении носо-щечной складки, пальпируется резко болезненный валик. 12 зуб с трепанационным отверстием, перкуссия резко болезненна, переходная складка сглажена за счет отека, из трепанационного отверстия – гнойное отделяемое с резким запахом. Был выставлен диагноз: «флебит v.angularis sinistra., обострение хронического периодонтита 12 зуба». Произведено дренирование очаго гнойного воспаления наружным доступом и удален «причинный» 12 зуб. Из раны и из лунки получен жидкий, гной со зловонным запахом и с включением газа. Забор материала осуществлен во время операции.
В исследовании мазка после окраски по Граму определялись Грам- отрицательные палочки и Грам-положительные кокки. В послеоперационном периоде больной пулучал
Цефазолин по 1 грамму 4 раза в день внутривенно капельно 7 дней;
Гентамицин по 160 мг. один раз в сутки 5 дней;
Метронидазол по 500 мг. 3 раза в сутки 3 дня;
Виферон – 3 по 1 свечке 2 раза в день ректально 5 дней;
Экстракт родиолы розовой по 20 капель 2 раза в день 10 дней.
Витафлор по 1 флакону в день 10 дней через рот.
На третьи сутки пребывания больного в стационаре состояние улучшилось, температура тела понизилась до 36.9 оС, в мазках из раны рост микрофлоры не определялся. Результаты бактериологического исследования – Bacteroides spp. , Streptococcus viridans. Среди активных в отношении данной ассоциации микроорганизмов имелись гентамицин, цефазолин и метронидазол. На седьмые сутки больной выписан из стационара, на амбулаторном этапе получал УВЧ, поливитамины. На четырнадцатые сутки после операции наступила эпителизация раны.
Разработка алгоритма противомикробной химиотерапии носит сугубо индивидуальный характер, исходя не только из особенностей возбудителя, особенностей течения инфекционно-воспалительного процесса, состояния функций защитных систем организма больного, но и от социального анамнеза. При назначении лекарственных средств в амбулаторных условиях необходимо быть уверенным в возможности пациента приобрести препарат, желания и возможности принимать, соотнести риск развития побочных реакций с необходимостью амбулаторного ведения.
Стремительно развивающаяся фармацевтическая промышленность выпускает ежегодно на рынок десятки новых препаратов, что диктует необходимость постоянного обучения практикующих врачей. Целесообразно не реже, чем 2 раза в год проводить занятия с врачами ЛПУ о новинках фармацевтического рынка, повторять принципы противомикробного лечения. Руководителям ЛПУ необходимо учитывать динамику фармацевтического рынка, состояние госпитальной инфекции и своевременно составлять формуляры и стандарты антибактериальной терапии.
ПРИЛОЖЕНИЕ
СПИСОК НЕКОТОРЫХ МЕЖДУНАРОДНЫХ И СООТВЕТСТВУЮЩИХ ИМ ТОРГОВЫХ НАЗВАНИЙ АНТИБАКТЕРИАЛЬНЫХ ПРЕПАРАТОВ (по данным МЗ РФ).
|
Международное непатентованное название |
Торговое название |
|
аминогликозиды |
|
|
Амикацин |
Амикацин Амикацина сульфат Амикин Амикозит Амицин Ликацин Селемицин Фарциклин Хемацин |
|
Гентамицин |
Гарамицин Гентамисин Гентамицин Гентамицин-К Гентамицина сульфат Генцин Гентина |
|
Канамицин |
Канамицина моносульфат Канамицина сульфат Умекан-1000
|
|
Амфениколы |
|
|
Хлорамфеникол |
Левомитецин
|
|
Ансамицины(рифампицины) |
|
|
Рифабутин |
Микобутин Р-Бутин |
|
Рифамицин |
Рифогал |
|
Рифампицин |
Бенемицин Р-Цин Римактан Римпацин Рисима Рифамор Рифампицин Рифацин Тибицин |
|
Карбапенемы |
|
|
Имипинем+циластин |
Тиенам |
|
Меропенем |
Меронем |
|
Линкозамиды (линкосамиды) |
|
|
Клиндамицин |
Далацин Далацин Т Далацин Ц Далацин Ц фосфат Климицин Клиндафер |
|
Линкомицин |
КМП Линкомицин Линкомицина гидрохлорид Линкоцин Медоглицин Нелорен |
|
Макролиды |
|
|
Азитромицин |
Азивок Азитромицин Замакс Зитролид Сумамед Сумамед форте |
|
Джозамицин |
Вильпрафен |
|
Кларитромицин |
Клабакс Клацид Клацид СР Фромилид |
|
Мидекамицин |
Макропен |
|
Рокситромицин |
БД-Рокс Роксибид Роксимизан Рокситромицин-Лек Рулид Рулицин |
|
Спирамицин |
Ровамицин |
|
Эритромицин |
Синэрит Эомицин Эритромицин Эритромицин-Тева Эритромицина фосфат Эрмицед |
|
Монобактамы |
|
|
Азтреонам |
Азактам |
|
Нитроимидазолы |
|
|
Метронидазол |
Апо-Метронидазол Дефламон Клион Медазол Метрогил Метроксан Метронидазол Нидазол Розамет Трихазол Трихопол Филмет Флагил Эфлоран |
|
Ниморазол |
Наксоджин |
|
Орнидазол |
Тиберал |
|
Тенонитрозол |
Атрикан-250 |
|
Тинидазол |
Тизол Тинапрот Тиниба Фазижин |
|
«Защищенные» пенициллины |
|
|
Амоксициллин+клаувоновая кислота |
Амоклан Гексал Амоксиклав Аугментин Клавунат Курам Моксиклав |
|
Пиперациллин+Тазобактам |
Тазоцин |
|
Сультамициллин (ампициллин+сульбактам) |
Сулациллин Сультасин Уназин |
|
Тикарциллин+клаувоновая кислота |
Тиментин |
|
Пенициллины |
полусинтетические |
|
Азлоциллин |
Секуропен |
|
Амоксициллин |
Амоксон Амотид Атоксилин Оспамокс Раноксил Упсамокс Флемоксин-солютаб Хиконцил |
|
Ампициллин |
Ампирекс Ампициллина натриевая соль Ампициллина тригидрат Зетсил Пентрексил Стандациллин |
|
Карбенициллин |
Карбанициллина динатриевая соль |
|
Оксациллин |
Оксациллина натриевая соль Простафлин |
|
Пиперациллин |
Пипрацил Пициллин |
|
Пенициллины в составе |
комбинированных препаратов |
|
Амоксициллин+Метронидазол |
Хеликоцин |
|
Ампициллин+Оксациллин |
Ампиокс Ампиокс-Натрий Оксамп Оксампицин Оксамп-Натрий |
|
Пенициллины |
природные |
|
Бензатин Бензил-пенициллин |
Бензициллин-1 Бициллин-1 Ретарпен Экстенциллин |
|
Бензатин Бензил-пенициллин+ Бензил-пенициллин прокаина |
Бензициллин-5 Бициллин-5 Дициллин-5 |
|
Бензатин Бензил-пенициллин+ Бензил-пенициллин прокаина+ Бензил-пенициллин |
Бензициллин-3 Бициллин-3 Дициллин-3 |
|
Бензил-пенициллин |
Бензилпенициллина калиевая соль Бензилпенициллина натриевая соль Пенициллин G натриевая соль |
|
Пенициллин прокаин |
Бензилпенициллина новокаиновая соль Прокаин пенициллин G мега Прокаин - Бензилпенициллин |
|
Феноксиметилпенициллин |
V – пенициллин Мегациллин орал Оспен |
|
Сульфаниламиды |
|
|
Сульфагуанидин |
Сульгин |
|
Сульфасалазин |
С.А.С. 500 С.А.С. Энтерик 500 |
|
Сульфатиазол |
Норсульфазол |
|
Сульфаэтидол |
Этазол |
|
Фталилсульфатиазол |
Фталазол |
|
Сульфаниламиды+ |
диаминопиримидины |
|
Ко-тримазол |
Апо-сульфатрим Бактрим Берлоцид Бакотрим Бисептол Ген-Ультразол Дуо-Септол Котримазол Котримол Котрифарм Ориприм Ранкотрим Септрин Сулотрим Суметролим Тримезолд Циплин |
|
Сульфаметрол+триметоприм |
лидаприм |
|
Сульфамонометоксин+триметоприм |
сульфатон |
|
Сульфадоксин+пириметамин |
фансидар |
|
Тетрациклины |
|
|
Доксициклин |
Апо-Докси Бассадо Вибрамицин Довицин Доксал Доксидар Доксициклина гидрохлорид Докст Медомицин Тетрадокс Этидоксин Юнидокс-солютаб |
|
Тетрациклины в составе |
комбинированных препаратов |
|
Окситетрациклин+эритромицин |
Эрициклин |
|
Ролитетрациклин+хлорамфеникол+колистин+ бетоматазона дипропионат |
Эубетал антибиотико |
|
Тетрациклин, Висмута трикалия дицитрат, Метронидазол |
Гастростат |
|
Тетрациклин+олеандомицин |
Олететрин |
|
Фторхинолоны |
|
|
Левофлоксацин |
Таваник |
|
Ломефлоксацин |
Ломфокс Максаквин Окацин |
|
Моксифлоксацин |
Авелокс |
|
Норфлоксацин |
Анквин Бактинор Гираблок Локсон 400 Негафлокс Нолицин Норбактин Норилет Нормакс Норфлоксацин Ренор Софазин Ютибид |
|
Офлоксацин |
Глауфос Заноцин Киролл Офло Офлоксин 200 Таривид Флоксал |
|
Пефлоксацин |
Абактал Пенлокс-400 Перти Перфлокс Пефлацин Пефлацине Пефлоксацин Пефлоксацина мезилат |
|
Спарфлоксацин |
Спарфло |
|
Ципрофлоксацин |
Арфлокс Афеноксин Веро-ципрфлоксацин Ифиципро Квинтор Квипро Липрохин Медоциприн Микрофлокс Неофлоксин Проципро Реципро Сифлокс Тацип Ципрова Цефобак Цилоксан Циплокс Ципринол Ципробай Ципробид Ципролет Ципромед Ципроксан Ципроцинал Цитерал Цифлоксинал Цифлоцин Цифран |
|
Эноксацин |
Эноксор |
|
Цефалоспорины |
парентеральные |
|
Цефазолин |
Атралцеф Вулмизолин Золин Золфин Интразолин Ифизол Кефзол Лизолин Оризолин Рефлигн Тотацеф Цезолин Цефамезин Цефаприм Цефзолин Цефоприд |
|
Цефамандол |
Мандол Цефамабол Цефат |
|
Цефипим |
Максипим |
|
Цефокситин |
Атралкситин Бонцефин Мефоксин |
|
Цефоперазон |
Дардум Лоризон Медоцеф Цефобид |
|
Цефотаксим |
Байотакс Кефотекс Клафоран Клафатоксим Лифоран Оритаксим Спирозин Талцеф Тарцефоксим Цетакс Цефабол Цефантрал Цефоксин |
|
Цефтиазим |
Кефадим Тазицеф Фортазим Фортум Цефазид Цефтидим |
|
Цефтизоксим |
Эпоцелин |
|
Цефтриаксон |
Бетоспорин Ифицеф Лендацин Лифаксон Лонгацеф Офрамакс Роцефин Тороцеф Триаксон Форцеф Цефаксон Цефатрин Цефтриабол Цефтрон |
|
Цефуроксим |
Аксетин Зинацеф Кетоцеф Кефурокс Суперо Цефуксим Цефурабол |
|
Цефалоспорины |
пероральные |
|
Цефадроксил |
Биодроксил Дурацеф Лайдроксил Цефрадур |
|
Цефаклор |
Альфацет Верцеф Тарацеф Цеклор |
|
Цефалексин |
Кефлекс Клорцеф Оспексин Палитрекс Пиассан Споридекс Цефадар Цефаклен |
|
Цефиксим |
Цефспан |
|
Цефтибутен |
Цедекс |
|
Цефуроксим |
Зиннат |
|
Флуконазол |
Дифлюкан |
|
|
Микосист |
|
|
Форкан |
Бажанов Н.Н., Пашков Е.П., Култаев М.С. и др. Бактериальная микрофлора при одонтогенных острых гнойных заболеваниях челюстно-лицевой области // Стоматология. – 1985. – Т.64, № 1. – С. 31-32.
Белобородова Н.В., Богданов М.Б., Черненькая Т.В. Алгоритмы антибиотикотерапии. Руководство для врачей. М.-1999.
Белоусов Ю.Б., Шатунов С.М. Антибактериальная химиотерапия. М. - Р.Врач.-2001.
Биберман Я.М., Стародубцев В.С., Литовкина Т.М. Изменение состава и свойств микрофлоры при абсцессах и флегмонах челюстно-лицевой области // Стоматология. – 1991. – Т.70, № 1. – С. 34-35.
Дворецкий Л.И., Лабезник Л.Б., Яковлев С.В. Диагностика и лечение бактериальных инфекций у пожилых. - М.: Универсум Паблишинг.-1997.
Регионарная лимфотропная антибактериальная терапия в лечении и профилактике инфекционно-воспалительных заболеваний челюстно-лицевой области и шеи. Дисс. К.м.н. Н.В.Яременко 2001.
Соловьев М.М., Большаков О.П.. Абсцессы и флегмоны головы и шеи. С-Пб, КН 1997
Таушниц Р.. Антибактериальная химиотерапия. М.: Универсум Паблишинг.-1996.
Тец В.В. Справочник по клинической микробиологии. – СПб.: Стройлеспечать, 1994.
Шумский А.В., Пожарицкая М.М., Юрченко Е.В. Противогрибковая и иммуномодулирующая лимфотропная терапия кандидоза слизистой оболочки полости рта // Стоматология. – 1996. - Т.75, № 4. – С. 17-20.
Яковлев С.В. Микробиологические и фармакодинамические факторы, определяющие клинический эффект антибиотикотерапии // Антибиотики и химиотерапия. – 1999. – Т. 44, № 5. - С. 3-5.
Яременко А.И. Планирование комплексного лечения больных острой одонтогенной инфекцией на основе прогноза заболевания: Дис. … канд. мед. наук: 14-00-21 / СПбГМУ им. ак. И.П.Павлова. – СПб, 1998. – 183 с.
Could 1.М. Determinants of response to antibiotic therapy // J. Chemoth-er. – 1998. – Vol. 10, № 5. – Р. 347-353.
Giamarellou H., Antoniadou A. Epidemiology, diagnosis, and therapy of fungal infections in surgery // Infect. Control Hosp. Epidemiol. – 1996. –Vol.17, № 8. – Р.558-564.
Ibrachim М.S., Maged Z.A., Haron A. Antibiotics and immunity effects of antibiotics on mitogen responsiveness of lymphocytes and interleikin-2 production // Chemiotherapia. – 1988. - Vol.7, № 6. – Р. 369-372
Marcucci L., Velucci A., Miani P. et al. Antibiotic prophylaxis in ear, nose and throat surgery: a comparison of a single preoperative dose with three perioperative doses of ceftazidime // J. Hosp. Infect. – 1990. - № 15: Suppi A. – Р. 81-86.
Nattestand A. Использование антибиотиков в ротовой хирургии // Пародонтология. – 1997. - № 1(3). – С. 45-46.