РИСУНОК 1
СХЕМА ОСВОБОЖДЕНИЯ БАВ.
САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ИМ.АК. А.П. ПАВЛОВА
Кафедра хирургической стоматологии и челюстно-лицевой хирургии
Алехова Т.М., Яременко А.И., Петропавловская О.Ю.
Иммунологическая реактивность у больных с инфекционно-воспалительными процессами челюстно-лицевой области и способы иммунокоррекции.
РЕКОМЕНДАЦИИ ДЛЯ СТУДЕНТОВ III-V КУРСОВ СТОМАТОЛОГИЧЕСКОГО ФАКУЛЬТЕТА.
Санкт-Петербург 2000 г.
ВВЕДЕНИЕ
Интерес к иммунологии, имеющую длительную историю, резко возрос в последние годы. Во многом это связано с накоплением значительного объема теоретических знаний в данной области.
Хорошо известно, что при одонтогенной инфекции, вызываемой различными возбудителями, часто наблюдается неадекватный иммунный ответ организма, поэтому при планировании комплексного лечения больных с инфекционно-воспалительными заболеваниями челюстно-лицевой области необходимо включать мероприятия по оптимизации реактивности организма.
Особенно иммунокоррекция необходима при использовании высоких доз антибактериальных препаратов, обладающих выраженными иммунодепресивными свойствами. Так же сами микроорагнизмы, в свою очередь, обладают целым рядом иммунносупрессивных свойств.
В настоящее время в клинической практике широко применяются иммунокоррегирующие препараты: лекарственные средства для активной и пассивной иммунизации, иммуномодуляторы животного и синтетического происхождения, провоспалительные интерлейкины для местного применения, растительные и химические адаптогены и т.д.
Исходя из высокой актуальности вышеизложенной проблемы авторским коллективом кафедры хирургической стоматологии и челюстно-лицевой хирургии предложены конкретные рекомендации для самостоятельного углубленного изучения студентами-стоматологами.
ТЕМА1. Нормальный иммунный ответ организма, понятие об иммунитете и неспецифической резистентности организма.
Цель занятия: знать основные функции защитных систем организма. Формы иммунного ответа.
Иммунитет – способ защиты организма от живых тел и веществ, несущих на себе признаки генетической чужеродности. Иммунная система организма – совокупность всех лимфоидных органов и скоплений лимфоидных клеток тела. Неспецифическая резистентность – совокупность свойств различных органов и систем, направленная на защиту организма от проникновения во внутренние среды чужеродного генетического материала и на скорейшую нейтрализацию и элиминацию последнего без признаков специфичности.
Основная функция иммунной системы – контроль за качественным постоянством генетически продетерминированного клеточного и гуморального состава организма. Имунная система обеспечивает:
Функционирующей основой иммунной системы является сложный комплекс иммунокомпетентных клеток (Т-, В-лимфоциты, макрофаги).
В настоящее время в иммунологии известны шесть форм специфических иммунных реакций:
В таблице 1 приведены наиболее изученные факторы неспецифической резистентности и специфические формы ответа организма.
ТАБЛИЦА 1
Факторы неспецифической защиты и иммунитета.
|
Неспецифические факторы |
Иммунная реактивность |
|
Фагоцитоз |
Антителообразование |
|
Комплемент Интерферон и интерлейкины Барьерные свойства кожи и слизистых оболочек Бактерицидные субстанции тканей Гидролитические ферменты Лизоцим Пропердин Протеолитические ферменты |
Гиперчувсвительность немедленного типа Гиперчувствительность немедленного типа; Гиперчувствительность замедленного типа; Иммунологическая память; Иммунологическая толерантность; Идиотип – антиидиопатическое взаимодействие |
В самых общих чертах иммунный ответ состоит из следующих этапов:
1. Макрофаг захватывает антиген, перерабатывает его определенным образом, что облегчает последующий контакт с ним T- и B-лимфоцитов и передает им информацию об антигене.
2. Лимфоциты, после взаимодействия с макрофагом, превращаются в бласты, клетки, способные к дифференцировке.
3. В результате дифференцировки B-лимфоцит превращается в плазматическую клетку, обладающую способностью продуцировать иммуноглобулины (антитела) и выделять их в межклеточную жидкость (humor). Антитела обеспечивают гуморальный иммунитет, при высокой степени развития которого развиваются реакции немедленного типа.
4. T-лимфоциты после бласттрансформации способны увеличивать популяцию T-киллеров (от англ. killer - убийца). Они обладают способностью распознавать клетки, несущие чужеродные антигены. T-киллеры способны вызывать лизис таких клеток при помощи лимфокинов. В связи с этим данную популяцию Т-лимфоцитов называют цитотоксическими лимфоцитами или киллерами. Т-лимфоциты обеспечивают клеточный иммунитет, при высокой степени развития которого возникают аллергические реакции замедленного типа.
Кроме этого, Т-хелпер (англ. help - помощь), с помощью специфического и неспецифического сигналов помогает включению В-лимфоцитов в антителогенез.
Т-супрессор (англ. supressor - подавитель) способен тормозить это включение, останавливать развитие антителопродуцентов и обеспечивает развитие толерантности. Главная миссия Т-супрессоров, по-видимому, состоит в том, чтобы блокировать развитие иммунных реакций, блокировать выработку антител.
Т.о. Т-хелперы и Т-супрессоры выполняют функции основных регуляторов иммунной системы.
Благодаря их согласованной функции иммунная система обеспечивает защиту организма от бактерий, вирусов и паразитов; противораковую защиту и др. Нарушения функции иммунной системы приводит к развитию различных патологических состояний: возникновению злокачественных образований, аутоаллергических состояний, преждевременному старению.
ТАБЛИЦА 2
ОБЩАЯ СХЕМА: СИСТЕМА ИММУНИТЕТА.
|
Первый этап Второй этап Третий этап Четвертый этап Пятый этап Шестой этап |
поглощение антигена и его переработки распознавание антигена и клетки предшественника бластогенез пролиферация продукция антител эффекторные реакции |
|
Подсистема независимая от тимуса |
Т-зависимая подсистема |
|
МАКРОФАГ + АНТИГЕН
|
|
|
Т-хелпер Тсупрессор В-лимфоцит Бласт Плазматическая клетка Иммуноглобулины (антитела) Гуморальный иммунитет Аллергические реакции немедленного типа |
Т-лимфоцит Бласт Т-киллер Клеточный иммунитет Аллергические реакции замедленного типа
|
Для оценки иммунопатологии необходимо правильно оценивать иммунограмму. В таблице 3 приведены нормальные показатели иммунитета здорового человека. Однако необходимо помнить, что иммунная система является очень лабильной частью гомеостаза и для адекватного трактования отклонений необходимо оценивать всю совокупность клинико-лабораторных показателей.
ТАБЛИЦА 3
НОРМАЛЬНАЯ ИММУНОГРАММА.
|
Показатель |
Значение |
|
CD3+ зрелые Т-лимфоциты(%) CD4+ Т-лимфоциты-хелперы(%) CD8+ Т-лимфоциты-киллеры(%) CD4+/CD8+ CD22+ В-лимфоциты(%) |
54,3+2,1 36,1+1,9 17,6+1,8 2,05+0,06 14,1+1,6 |
|
РБТЛ спонт. (имп/мин) РБТЛ стим. (имп/мин) ФГА Кон-А PWM |
352+38 6347+234 3267+182 1727+99 |
|
ИС спонтанный (%) ИС индуцированный (%) НСТ-тест баз. (%) НСТ-тест стим. (%) РК НСТ-теста IgA (мг/мл) IgG(мг/мл) IgM(мг/мл) |
12,2+1,6 36+2,9 5,8+0,6 48,9+2,4 8,4+1,6 1,9+0,22 12,61+10,43 1,26+0,21 |
ТЕМА 2. ГИПЕРЧУСТВИТЕЛЬНОСТЬ НЕМЕДЛЕННОГО И ЗАМЕДЛЕННОГО ТИПА.
Цель занятия : Знать основы взаимодействия антигена и антитела. Понятие анафилаксии и аллергии. Феномен сенсибилизации.
Антитела – белки, относящиеся к тому или иному классу иммуноглобулинов (IgM, IgG, IgA, IgE, IgD), синтез которых стимулируется после парэнтерального поступления антигена; антитела обладают способностью специфически взаимодейтсвовать с данным антигеном.
Реакции специфического взаимодействия сывороточных антител с антигенами, против которых они направлены, проявляются в виде нескольких основных феноменов. Эти феномены легко наблюдать в лабораторных условиях.
Основные диф.диагностические признаки гиперчувствительности приведены в таблице 4.
ТАБЛИЦА 4
ПРИЗНАКИ И КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ГИПЕРЧУВСТВИТЕЛОЬНОСТИ НЕМЕНДЛЕННОГО И ЗАМЕДЛЕННОГО ТИПА.
|
ПРИЗНАК |
ГНТ |
ГЗТ |
|
Клинические проявления |
Анафилаксия, сывороточная болезнь, сенная лихорадка, астма, феномен Артюса |
Туберкулез, туляремия, бруцеллез, реакция на некоторые гаптены, трансплантационные реакции |
|
Антиген |
Сывороточные и другие растворимые белки, пыльца растений и другие аллергены |
Вирусы, некоторые бактерии, трансплантационные антигены, некоторые гаптены |
|
Антитела в крови |
Присутствуют |
Отсутствуют или не играют роли |
|
Сроки проявления |
Несколько минут |
Не ранее 6—8 ч |
|
Гистология |
Полиморфно-ядерная инфильтрация, экссудация |
Мононуклеарно-клеточная инфильтрация |
|
Пассивный перенос |
Возможен |
Невозможен |
|
Адоптивный перенос |
Возможен |
Возможен |
|
Токсичность антигена для сенсибилизированных лимфоцитов |
Отсутствует |
Резко выраженна |
|
Десенсибилизация |
Успешна |
Невозможна |
Патогенез немедленных аллергических реакций.
Немедленные аллергические реакции (НАР) являются результатом взаимодействия антигена с антителом, в процессе которого высвобождаются биологически активные вещества (БАВ), например, гистамин, серотонин, брадикинин, ацетилхолин, гепарин, медленно реагирующая субстанция аллергии и др.
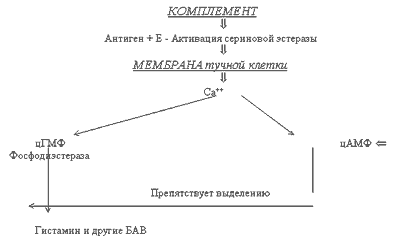
Механизм высвобождения гистамина и других БАВ.
При попадании антигена в сенсибилизированный организм, происходит его взаимодействие с реагином - иммуноглобулином Е (Ig-E) на поверхности мембран тучных клеток и базофилов. В результате активизируются ферменты (например, сериновая эстераза), приводящие к увеличению проницаемости мембраны для ионов кальция. Последние приводят к усилению синтеза циклического гуанозин-монофосфата (цГМФ), с помощью которого высвобождается гистамин и другие БАВ (см. РИС.1)

РИСУНОК 1
СХЕМА ОСВОБОЖДЕНИЯ БАВ.
Выделяющиеся БАВ приводят к возникновению немедленных аллергических реакций - спазм гладкой мускулатуры бронхов, падение АД и др. Освободившийся гистамин возбуждает два типа рецепторов в тканях Ги1- и Ги2-рецепторы (H1 и H2 -рецепторы). В результате взаимодействия с указанными рецепторами наблюдаются следующие эффекты (см. таблицу 5).
Таблица 5
Эффекты, возникающие под влиянием гистамина.
|
Стимуляция Н1 -рецепторов |
Стимуляция Н2 -рецепторов |
|
1. Снижение АД (за счет расслабления капилляров). 2. Повышение тонуса гладкой мускулатуры бронхов, кишечника, матки. 3. Увеличение проницаемости сосудистого эндотелия и усиление экссудации. |
1. Усиление секреции соляной кислоты и желудочного сока. 2. Возбуждение ведущих узлов сердца. 3. Увеличение секреции в бокаловидных клетках бронхиол (выделение большого количества слизи). 4. Стимуляция Т-супрессоров (снижение иммунного ответа). |
Так же одной из сложных иммунных реакций является феномен лихорадки. Основные звенья патогенеза представлены на рис.2
.
РИСУНОК 2
ГЛАВНЫЕ ЗВЕНЬЯ ПАТОГЕНЕЗА ЛИХОРАДКИ
ТЕМА 3 ИММУНОЛОГИЯ И НЕСПЕЦИФИЧЕСКАЯ РЕЗИСТЕНТОСТЬ ПОЛОСТИ РТА.
Цель занятия : знать факторы неспецифической защиты и иммунитета полости рта и их роль в защите орнаизма от инфекции.
НЕСПЕЦИФИЧЕСКИЕ ФАКТОРЫ ЗАЩИТЫ ПОЛОСТИ РТА
Неспецифические факторы защиты полости рта от кариесогенных и других бактерий включают антимикробные свойства слюны и барьерную функцию клеток слизистой оболочки и подслизистого слоя.
Слюна - это жидкий секрет, продуцируемый парными околоушными, подъязычными и подчелюстными железами, а также мелкими железами слизистой оболочки щек, языка и губ. Состав слюны неодинаков у разных людей и может изменяться в зависимости от возраста, питания, состояния нервной системы и других факторов. Она имеет нейтральную или слабощелочную реакцию, богата неорганическими солями(хлориды, фосфаты, бикарбонаты и другие) и органическими веществами белковой •природы(муцин, амилаза, лизоцим и другие).
За сутки слюнные железы продуцируют от 0,5 до 2,0 л слюны, которая обладает выраженными бактериостатическими и бактерицидными свойствами благодаря содержащимся в ней гуморальным факторам :
лизоциму, лактоферрину, лактопероксидазе, компонентам системы комплемента, иммуноглобулинам.
Лизоцим - муколитический фермент продуцентами которого являются,в основном,мононуклеарные фагоциты. Лизоцим присутствует у человека и животных в слюне,слезной жидкости. лимфоидной ткани, материнском молоке и других секретах. Он оказывает бактериолитическое действие на грамположительные бактерии за счет расщепления гликозидных связей полимерных N-глюкозаминов, входящих в состав бактериальных клеточных стенок. В качестве тест-бактерий при изучении активности лизоцима используется культура Micrococcus lysodellrticus.
Лизоцим состоит из полипептидной цепи, включающей 129 аминокислот, из которых С-терминальная - лейцин,a N -терминальная - лизин.Его молекулярная масса около I4000. В секрете околоушной железы содержание лизоцима составляет около 0,5 мг в 100 мл.В слюну, также как в сыворотку крови и другие жидкости, .лизоцим может попасть либо в результате активной секреции мононуклеарными фагоцитами ,либо в результате разрушения депонирующих этот фермент полиморфноядерных лейкоцитов.
Выраженная антимикробная активность лизоцима обеспечивает его участие в неспецифичоокой защите. О важной роли лизоцима в местном иммунитете может свидетельствовать учащение инфекционных, и воспалительных процессов, развивающихся в полости рта при снижении его активности в слюне. Кроме того, лизоцим усиливает фагоцитоз и потенцирует литическую активность комплекса sIgA с СЗ фракцией комплемента в отношении грамотрицательных бактерий(E.coli),
Лактоферрин - железосодержащий транспортный белок, бактериостатическое действие которого связано с его способностью конкурировать с бактериями за железо. Отмечен синергизм лактоферрина с антителами. Его роль в местном иммунитете полости рта наиболее демонстративна в условиях грудного вскармливания, когда новорожденные получают с молоком матери высокие концентраций этого балка в сочетании с секреторными иммуноглобулинами (sIgA) . Лактоферрин синтезируется в гранулоцитах.
Лактопероксидаза - термостабильный фермент, который в комплексе с тиоционатом и перекисью водорода (H2O2) проявляет бактерицидное действие. Он устойчив к действию пищеварительных ферментов, активен в широком диапазоне рН от 3,0 до 7,0,в полости рта блокирует адгезию s.mutans. Лактопероксидаза обнаружена в слюне детей уже в первые месяцы жизни.
Фракция G3 системы комплемента выявлена в слюнных железах. Она синтезируется и секретируется макрофагами. Условия для активации литического действия системы комплемента на слизистых оболочках полости рта менее благоприятны, чем в кровяном русле. Агрегированный
sIgA может активироваться и присоединять комплемент по альтернативному пути через G3. IgG u IgM обеспечивают активацию комплемента по классическому пути через CIg- СЗ— С5 - С9 -мембранатакующий комплекс. Фракция C3 участвует в реализации эффекторных функций активированной системы комплемента.
Слюна содержит тетрапептид сиалин. В его состав входят гли-цил-глицил-лизин-аргинин. Сиалин способен нейтрализовать кислые продукты, которые образуются в результате жизнедеятельности микрофлоры зубных бляшек и благодаря этому обладает сильным противокариозным действием.
В слюне здоровых людей всегда обнаруживаются полиморфноядерные лейкоциты, моноциты, лимфоциты, которые попадают в нее из десневых карманов.
В местном иммунитете полости рта большую роль играют клетки соединительной ткани слизистой оболочки. Основную массу этих клеток составляют фибробласты и тканевые макрофаги, которые легко мигрируют в очаг воспаления. Фагоцитоз на поверхности слизистой оболочки и в подслизистой осуществляют фагоцитирующпе клетки (гранулоциты и макрофаги). Они способствуют очищению очага от патогенных бактерий. Кроме того, между коллагеновыми волокнами и вокруг сосудов располагаются тучные клетки - потенциальные участники аллергических реакций анафилактического типа. Плазматические клетки соединительной ткани обеспечивают местный синтез антител, главным образом - иммуноглобулинов класса sIgA .
АНТИГЕНЫ И ИММУННАЯ СИСТЕМА ПОЛОСТИ РТА
Слизистая оболочка полости рта является одной из наиболее реактивных аллергических зон организма. Она богата рецепторными и медиаторными соединениями. Являясь входными воротами для множества антигенов и аллергенов, она представляет собой арену гуморальных и клеточных реакций иммунитета, является "шоковым" органом, местом реакций антиген-антитело. Эти реакции влекут за собой первичные и вторичные повреждения.
Иммунологические особенности полости рта заключаются, кроме того, в быстроте резорбции веществ антигенной природы, в неравномерном распределении тучных клеток, вырабатывающих гистамин и высокоактивные медиаторы.
В полости рта постоянно находятся вещества животного, растительного и бактериального происхождения. Они могут адсорбироваться на различных участках слизистой и связываться со специфическими антигенами макроорганизма, вызывая изоиммунизацию. Специфические антигены обнаружены в слюне, тканях зуба, зубных бляшках, эпителии языка и щек; антигены групп крови АВО - в эпителии щек, языка, пищевода.
Антигенный спектр нормальной слизистой оболочки полости рта сложен. Он включает набор видовых и органоспецифических антигенов. В антигенной структуре разных отделов слизистой оболочки полости рта выявлены существенные различия: антигены, присутствуют в области мягкого неба, отсутствуют в слизистой твердого неба, щек,языка, десны.
В составе слизистой оболочки полости рта,(в области мягкого неба) обнаружен эндодермальный антиген (Эн-антиген),который в норме содержится в тканевых элементах, являющихся производными эндодермы. В полости рта этот антиген продуцируется слизеобразующими клетками подчелюстных и подъязычных слюнных желез мягкого неба. Содержание Эн-антигена в секрете слюнных желез резко увеличивается при хронических заболеваниях слизистой оболочки полости рта, вследствие чего этот признак можно использовать для лабораторной диагностики данных заболеваний.
Местная защитная система слизистой оболочки полости рта слагается из вышеописанных факторов неспецифической защиты и специфических механизмов иммунитета; антител и Т-лимфоцитов, направленных против определенного антигена.
Решающую роль в обеспечении местного иммунитета слизистой полости рта играют антитела класса IgA ,особенно его секреторная форма - sIgA.Секреторный IgA образуется в результате ассоциации димерной формы IgA,которая продуцируется плазматическими клетками. с особым белком, получившим название секреторного комплекса sc), который синтезируется в эпителиальных клетках. Молекула IgA проникает в эпителиальную клетку, где соединяется с SC и выходит на поверхность эпителиального покрова в виде sIgA.
У здоровых людей в строме всех желез внешней секреции (в том числе слюнных желез) и слизистых оболочек, сообщающихся с внешней средой, подавляющее большинство плазматических клеток продуцирует IgA. Ведущую роль в образовании sIgA играют подcлизистые скопления лимфоидных клеток типа пейеровых бляшек, покрытых особым кубоидальным эпителием. Антигенная стимуляция ведет к селекции клонов предшественников В-лимфоцитов, синтезирующих IgA. Антигенное воздействие одновременно активирует регулярные субпопуляции Т-клеток, контролирующих пролиферацию В-лимфоцитов. Далее возможен выход В лимфоцитов за пределы пейеровых бляшек с последующей циркуляцией и расселением в различные слизистые оболочки и железы внешней секреции (в том числе и слюнные), где преобладают Т-хелперы в отношении В-лимфоцитов, предназначенных для синтеза IgA .Этим обеспечивается функциональное единство всей иммунологической системы местной защиты организма от инфекций. Отсюда следует, что стимуляция тифоидных элементов слизистой ободочки пищеварительного тракта может привести к появлению соответствующих антител во внешних секретах, омывающих поверхности тканей, отдаленных от точек первичного воздействия антигенов. Так,была выявлена корреляция между уровнем специфических sIgA в кишечном отделяемом и слюне при дизентерии.
Обоснованное представление о единой секреторной системы местного иммунитета, обеспечивающей защиту от инфекций, открывает возможности для специфической профилактики кариеса. Об этом свидетельствуют результаты перорального введения волонтерам s.mutang, которое вызывает появление в слюне у этих людей специфических антител, препятствующих адгезии кариесогенных стрептококков на зубной эмали.
По особенностям содержания иммуноглобулинов внесосудистые жидкости ротовой полости делят на внутренние и внешние секреты. Внутренние секреты представляют собой отделяемое десневых карманов, в которых содержание иммуноглобулинов близко к их концентрации в сыворотке крови .Во внешних секретах, например слюне, количество IgA значительно превышает их концентрацию в сыворотке крови, В то время как содержание IgM , lgG и IgE в слюне и сыворотке примерно одинаково. Секреторный IgA более резистентен к действию протеолитических ферментов по сравнению с сывороточным IgA ,поскольку секреторный компонент ( sc ) экранирует наиболее чувствительную к действию ферментов шарнирную часть молекулы IgA.
Для точного иммунохимического определения концентрации в биологических жидкостях (в слюне) использует ангисыворотку к свободному и связанному секреторному компоненту.
Показано, что sIgA и SC присутствуют в слюне у детей с момента рождения. Концентрация sIgA отчетливо нарастает в раннем постнатальном периоде. К 6-7 дню жизни уровень sIgA в слюне увеличивается почти в 7 раз. Нормальный уровень синтеза sIgA является одним из условий достаточной устойчивости детей первых месяцев жизни к инфекциям, поражающим слизистую полости рта.
Секреторные иммуноглобулины sIgA могут выполнять несколько защитных функций. Они подавляют адгезию бактерий, нейтрализует вирусы и препятствуют всасыванию антигенов (аллергенов) через слизистую оболочку. Так,например, slgA - антитела подавляют адгезию кариесогенного стрептококка ( s.mutana ) к эмали зуба, что ппрепядствует развитию кариеса.
Достаточный уровень sIgA - антител способен, видимо, предотвращать развитие некоторых вирусных инфекций в полости рта напримео - герпеткческой инфекцни, при которой уровень местных секретов IgA -антител лучше коррелирует с противовирусный защитой по сравнению с сывороточными антителами. Вероятно,sIgA -антитела. способствуют элиминации вируса после его нейтрализации.
Кроме того, sIgA -антитела образуют с чужеродными антигенами и аллергенами, попавшими на слизистую оболочку полости рта иммунные комплексы, которые при участии не специфических факторов (макрофагов и системы комплемента) выводятся из организма. У лиц с дефицитом sIgA антигены беспрепятственно адсорбируются на сли-зистой и поступают в кровь,что может привести к тяжелым последствиям аллергизации.
Благодаря этим функциям sIgA являются ведущими факторами первой линии защиты организма от инфекционных и других чужеродных агентов. Антитела этого класса препятствуют возникновению патологических процессов на слизистой оболочке, не вызывая ее травматизации так как взаимодействие sIgA -антител с антигеном, в отличие от антител классов lgG и igM , не вызывает активации системы компле-мента.
Из защитных функций sIgA вытекает перспективность мeтодов создания местного пассивного иммунитета, в том числе, против кариеса.
ТЕМА 4. ИММУНОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ У БОЛЬНЫХ ОДОНТОГЕННЫМИ ВОСПАЛИТЕЛЬНЫМИ ЗАБОЛЕВАНИЯМИ.
Цель занятия: знать основные виды иммунопатологии и их значение в практике врача-стоматолога.
Клинические признаки иммунологической недостаточности
Выявление признаков иммунопатологической недостаточности позволяет сформировать группу риска для проведения клинической иммунодиагностики. Иммунологическая недостаточность включает 4 основных синдрома:
1. Инфекционный синдром (рецидивирующие, хронические инфекции):
2. Аллергический синдром:
3. Аутоиммунный синдром:
4. Иммунопролиферативный синдром:
ИММУНОДЕФИЦИТЫ
Иммунодефицит (иммунологическая недостаточность) — врожденное или приобретенное нарушение иммунного ответа, проявляющееся, в частности, потерей способности к защите от инфекций и опухолевых заболеваний. В соответствии с этим определением иммунодефицит (ИД) или иммунодефицитное состояние (ИДС) - это не болезнь, а именно состояние, обусловливающее:
• высокую восприимчивость к различным инфекциям
• склонность их к ациклическому течению
• развитие аллергических и аутоиммунных заболеваний
• возникновение онкологической патологии
Первичные ИДС (первично страдает иммунная система)
Врожденные ИД:
1. Комбинированное поражение клеточного (Т-) и гуморального (В-) иммунитета (синдром Вискотта-Олдрича, швейцарская форма агаммаглобулинемии, общая вариабильная иммунологическая недостаточность).
2. Нарушения Т-клеточного иммунитета (синдромы Дя-Джорджи, Незелофа и др.).
3. В-клеточная недостаточность: агамма- и гипогаммаглобулинемии (чаще IgG и IgA или подклассов G).
4. Дефекты системы комплемента:
• С 1 -тяжелые рецидивирующие инфекции, ксантоматоз кожи, пиодермия;
• СЗ, С6, С7, С8-рецидивирующие гнойные инфекции, сепсис;
• С2 и С7-аутоиммунные заболевания, болезни крови.
5. Недостаточность ПМЯЛ -хронический гранулематоз, синдром Чедиак-Хигаси.
6. нарушения экспрессии антигенов и рецепторов на поверхности ИКК (нарушения экспрессии АГ ГКГС, адгезивных молекул, рецепторов для ИЛ-2 и др.
Приобретенные ИД:
вич\спид
ЭБВ-инфекция ВГ-6 инфекция ВГ-7 инфекция ВГ-8 инфекция
Вторичные ИДС (иммунная система страдает вторично)
Врожденные ИДС:
1. Ферментопатии:
• Г-бФДГ-снижение бактерицидной акт. МФ, МН, ПМЯЛ;
• аденозиндезаминазная недостаточность-поражение различных видов ИКК. 2. Гормонопатии.
Приобретенные ИДС:
1 .Физиологические:
• новорожденности;
• пубертатного периода;
• беременности и лактации;
• старения;
• биоритмические.
2. Экологические:
• сезонные:
• токсические;
• радиационные и др.
3. Патологические:
• инфекционно-паразитарные;
• дисбактериозные;
• неинфекционные (хр. патология);
• дистрессовые;
• онкологические;
• метаболические дефекты при: трофической недостаточности, ожирении, диабете, атеросклерозе;
• медикаментозные (гормоны, цитостатики и др.)
ТЕМА 5: ОСНОВЫ ИММУНОКОРРЕГИРУЮЩЕЙ ТЕРАПИИ.
Цель занятия: Познакомиться с основами иммунокоррегирующей терапии, усвоить понятия активной и пассивной иммунотерапии, знать основные группы иммунотропных препаратов и механизмы их действия. Показания к иммунокоррекции.
ИММУНОТРОПНЫЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА
Состояние здоровья современного человека с иммунобиологических позиций характеризуется двумя особенностями: снижением иммунологической реактивности населения в целом и, как следствие, повышением острой и хронической инфекционной, аутоиммунной, онкологической, алллергической и иной заболеваемости.
Результатом этого является необычайно большой интерес врачей практически всех специальностей к проблеме иммунотерапии. Препараты, оказывающие воздействие на иммунную систему, начинают широко применяться в клинической практике при самых разнообразных заболеваниях, часто весьма квалифицированно и обоснованно, но иногда без достаточных оснований.
Прежде всего следует определить, что понимают под термином “иммунотропные лекарственные средства”. По М.Д.Машковскому, препараты, корригирующие процессы иммунитета (иммуномодуляторы, иммунокорректоры), делятся на препараты, стимулирующие процессы иммунитета, и иммунодепрессивные препараты (иммуносупрессоры).
Такая классификация, на наш взгляд, является “функциональной”, объясняющей направленность действия препарата. Однако, при изучении иммунотропных препаратов был обнаружен феномен “маятника” - противоположное влияние на иммунитет одного и того же лекарственного средства. Оказалось, что конечный результат зависит не только от дозы, времени и схемы его введения, но и от предшествующего иммунологического анамнеза, генетических особенностей организма и других факторов. Поэтому в настоящее время относительно средств, влияющих на показатели иммунитета, чаще применяется термин “имму-
номодуляторы”. Термины “иммунодепрессанты” и “имму-ностимуляторы” употребляются лишь в случае классификации этих веществ для того, чтобы подчеркнуть их основное, преимущественное влияние на функцию иммунной системы.
Иммуномодуляторы применяются в медицинской практике для коррекции врожденных и (или) приобретенных аномалий иммунитета, первичных и вторичных иммунодефицитом. Возможны три варианта иммунокоррекции: заместительный, стимулирующий, угнетающий. Характер коррекции определяется конкретной целью. Например, для профилактики инфекционных заболеваний назначают вакцины, сыворотки, гамма-глобулин, то есть средства заместительной терапии. При лечении инфекционных заболеваний наряду с химиотерапевтическими средствами показаны препараты, стимулирующие иммунную систему. Иммунокоррекция, направленная на угнетение иммунологической реактивности, применяется при пересадке органов и тканей. При аутоиммунных процессах, а также при некоторых онкозаболеваниях повышение эффективности основных лечебных мероприятий достигается за счет комбинированной иммунокоррекции, то есть сочетанного или альтернирующего назначения иммунодепрессантов и иммуностимуляторов. К иммунотропным методам воздействия, кроме медикаментозных, относятся ионизирующее облучение, УФО и лазерное облучение, удаление или трансплантация лимфоидной ткани, удаление иммунных комплексов путем гемосорбции или плазмафереза и другие.
Таким образом, иммунокоррекция или иммунотерапия—это комплекс этиотропных и патогенетических мероприятий, предусматривающих активное воздействие на иммунологическую реактивность организма.
Далее описаны наиболее известные иммуномодуляторы и рассмотрены возможности их применения в клинической практике.
Иммуномодуляторы
К иммуномодуляторам, или иммунокорригирующим средствам, относят препараты химической или биологической природы, способные модулировать (стимулировать или угнетать) реакции иммунитета в результате воздействия на иммунокомпетентные клетки, на процессы их миграции или на взаимодействие таких клеток или их продуктов (лимфокины, антитела) с соответствующими мишенями.
Таблица 6
Иммуностимуляторы, разрешенные к медицинскому применению в России и за рубежом
|
Препарат |
Механизм действия |
Показания к применению |
|
Стафилококковый анатоксин (СА). Вводят подкожно в возрастающей дозе от 0.1 до 2.0 мл. с интервалом в 3-4 дня. На курс лечения 5-9 инъекций |
Активная иммунизация. Способствует образованию антистафилолизина. Повторное введение приводит к нарастанию титра антител |
Подострая и хроническая фаза одонтогенных, травматических и лучевых остеомиелитов челюстей при верифицированном возбудителе. |
|
Стафилококковый антифагин. Вводят подкожно от 0.2 до 1.0 мл. ежедневно с увеличением по 0.1 мл. |
Активная иммунизация. Стимулирует РЭС, приводит к усилению выработки антител, повышает фагоцитирующую активность нейтрофиллов. . |
Фурункулез. При сочетании с стафилококковым анатоксином показания те же, что и при СА |
|
Стафилококковая вакцина. Вводится внутрикожно, подкожно, внутримышечно, от 0.05-0.1 мл. до 1.0 мл. через 3-4 дня, на курс 8-10 инъекций |
Активная иммунизация. Способствует повышению уровня антител. |
Хронические воспалительные заболевания челюстно-лицевой области. |
|
Октакам, сандоглобулин, петнаглобин (комбинации иммуноглобулинов). Вводятся внутримышечно и внутривенно3-5 мл/кг ежедневно |
Пассивная иммунизация. Готовые антитела
|
Распостраненные флегмоны челюстно-лицевой области, шеи, одонтогенный медиастинит, сепсис. |
|
Гипериммунные плазмы. Вводится внутривенно капельно по 200-400 мл. в сутки, используется для орошения ран, возможно обкалывание ран. |
Пассивная иммунизация. Создает эффект “заместительной иммунотерапии”. |
Те-же, что и при иммуноглобулинах. |
|
Бактериофаги. Вводят в рану на тампоне, возможно подкожное и внутримышечное введение от 0.5 до 2.0 мл. Курс лечения – 5-7 дней. |
Прямой противомикробный эффект |
Гнойные раны. |
|
Пирогенал – препарат микробного происхождения. Вводится внутримышечно 25-50 МПД через день. |
Повышение температуры тела, интерфероногенез, усиление фагоцитарной активности фагоцитов. |
Гипо- и анэргический тип течения инфекционно-воспалительного процесса. |
|
ИРС-19. Препарат микробного происхождения Вводится интраназально по 2 дозы 2 раза в день 10-14 дней. |
Активная иммунизация. выработка антител к основным патогенам. |
Хронические инфекционно-воспалительные процессы. |
|
Иммунал. Препарат микробного происхождения. Таблетки для рассасывания в полости рта по 6-8 таблеток в день курсом 10-21 день. |
Активная иммунизация. выработка антител к основным патогенам. |
Хронические инфекционно-воспалительные процессы. |
|
Тималин – препарат пептидной природы, выделенный из тимуса крупного рогатого скота. Вводят внутримышечно по 5-10 мг. ежедневно курсом 3-5 инъекций. |
Регулятор соотношения Т- и В-лимфоцитов, стимулирует клеточный иммунитет, усиливает фагоцитоз. |
Острые и хронические заболевания челюстно-лицевой области с преимущественным поражением Т-системы иммунитета. |
|
Такивин, тимоптин, тимактид, тимостимулин. Тимоген – вводят интраназально 1 тюбик ежедневно 3-5 дней за 30 мин.до еды |
Регулятор соотношения Т- и В-лимфоцитов, стимулирует клеточный иммунитет, усиливает фагоцитоз. |
Острые и хронические заболевания челюстно-лицевой области с преимущественным поражением Т-системы иммунитета. |
|
Эпителамин- препарат полипептидной природы, выделенный из эпиталамо-эпифизарной области головного мозга крупного рогатого скота. Вводится по 5-10 мг. ежедневно на курс 3-5 инъекций. |
Воздействует на клетки-мишени стероидных гормонов, стабилизирует напряжение гипоталамо-гипофизарной системы. |
Инфекционно-воспалительные заболевания у пациентов старших возрастных групп. |
|
Беталейкин (интерлейкин –1бета). Применяется в виде раствора концентрации 100нг/мл. физиологического раствора в первой фазе раневого процесса и в мазевой форме во второй фазе раневого процесса. |
Оптимизирует течение раневого процесса, ускоряет наступление второй фазы. |
Наиболее целесообразно применение у больных с флегмонами клетчаточных пространств глубокой локализации. |
|
Дибазол. Принимается внутрь по 1/4 таблетки 0,005 г. 3 раза в день в течении 10 дней. |
Адаптоген. Повышает резистентность организма ко многие инфекциям, стимулирует образование антител, усиливает фагоцитарную активность лейкоцитов, является интерфероногеном. |
Острые и хронические инфекционно-воспалительные заболевания челюстно-лицевой области. |
|
Экстракт родиолы розовой. Препарат растительного происхождения. Начальная доза составляет 10-15 капель официнального экстракта 2 раза в день перед едой. |
Адаптоген. В отличии от других адаптогенов растительного происхождения обладает собственной антибактериальной активностью. Оказывает стимулирующее влияние на дифференцировку лимфоцитов, оптимизирует течение воспалительного процесса, нормализует тип воспалительной реакции. |
Острые и хронические воспалительные процессы. |
|
Гипосенсебилизирую-щие препараты - Средства, препятствующие высвобождению гистамина и др. БАВ. Глюкокортикоиды (преднизолон, дексаметазон, беклометазон). Вещества, препятствующие взаимодействию свободного гистамина с тканевыми рецепторами (классические антигистаминовые средства: ФЕНКАРОЛ ,ДИАЗОЛИН , ТАВЕГИЛ, ДИМЕДРОЛ, ДИПРАЗИН, (син. ПИПОЛЬФЕН), ПЕРИТОЛ и другие).
|
Уменьшают образование гистамина и блокируют процесс его выделения..
Противогистаминовые препараты блокируют HI-рецепторы , взаимодействуя с их активными центрами . Благодаря этому антигистаминные препараты устраняют или уменьшают эффекты гистамина . |
Гиперэргические формы течения инфекционно-воспалительных заболеваний |
ЛИТЕРАТУРА.