Идентификация микобактерий в клинической лаборатории остается сложной и длительной процедурой. Морфологические, культуральные и биохимические тесты, используемые при идентификации требуют специальных знаний и тренированного лабораторного персонала. Остается актуальным в России иммунный метод, который сам по себе не является в достаточной мере эффективным [Сахелашвили, Хоменко][1,2] В последнее десятилетие получили широкое распространение быстрые и специфичные методы идентификации микобактерий, в том числе и непосредственно в пробах мокроты, основанные на генетическом методе. Имеются коммерческие наборы, например Roche Amplicor Mycobacterium Tuberculosis Kit (Amplicor PCR) и Gen-Probe Amplified Mycobacterium Tuberculosis Direct Test (AMTDT, Gen-Probe)[3]. Они основаны на ампллификации участка ДНК или РНК совпадающего с реперным участком нуклеиновой кислоты-зонда. Метод обладает высокой специфичностью и чувствительностью при использовании качественных зондов, изготовление которых в России не налажено, а импортные очень дороги. Кроме того, его результаты в практической диагностике туберкулеза по большому счету неоднозначны [4,5].
В связи с этим представляет интерес использование методов газовой (ГХ) [6] и жидкостной (ЖХ) [7] хроматографии, а также сочетания первого с масс спектрометрией (ГХ-МС) [8]. Фирма MIDI Inc., Delawere, USA предлагает использование жидкостных хроматографов Хьюлетт-Паккард 1050 и 1100 для идентификации микобактерий непосредственно в мокроте [9]. Эти методы не требуют биологических стандартов, питательных сред, тестовых наборов и других дорогостоящих расходуемых материалов. Средства вкладываются единожды при покупке хроматографа ($50000) или хромато-масс-спектрометра ($100000). Для сравнения отметим, что ежегодные расходы на тестовые материалы клинической бактериологической лаборатории при пользовании импортными системами бактериальной диагностики превышают $50000. Следует учитывать, что многие медицинские учреждения имеют в своем арсенале хроматографы и ГХ-МС системы.
Наиболее известно диагностирование туберкулеза по туберкулостеариновой (10-метил-октадекановой) кислоте непосредственно в клиническом материале методом хромато-масс-спектрометрии. Опубликованы данные анализа проб от 791 пациента с различными респираторными заболеваниями, которые показали, что у 169 пациентов с активной формой легочного туберкулеза получено 90% положительных и 10% ложно-положительных определений [6]. Последнее связано, видимо, с тем, что сама туберкулостеариновая кислота (ТСК) не является специфичной только для M.tuberculosis. Ее продуцируют также другие виды микобактерий, а также некоторые коринебактерии и нокардии. Для повышения специфичности привлекают другие жирные кислоты и спирты клеточной стенки микобактерий для их диагностики в чистой культуре[10]. Видоспецифичное детектирование M.tuberculosis в клинических пробах достигается при одновременном мониторинге ТСК и С-32 микоцерозовой кислоты [8] и/или 2-эйкозанола непосредственно в мокроте [11] или подрощенной (1-5 дней) культуре. Минимальное количество определяемой ТСК соответствует 100-1000 бактерий[6], что составляет чувствительность метода.
Таким образом, накопленный экспериментальный материал показывает принципиальную возможность постановки экспрессной, специфической и дифференциальной диагностики M.tuberculosis и других представителей рода методом ГХ-МС непосредственно в клиническом материале.
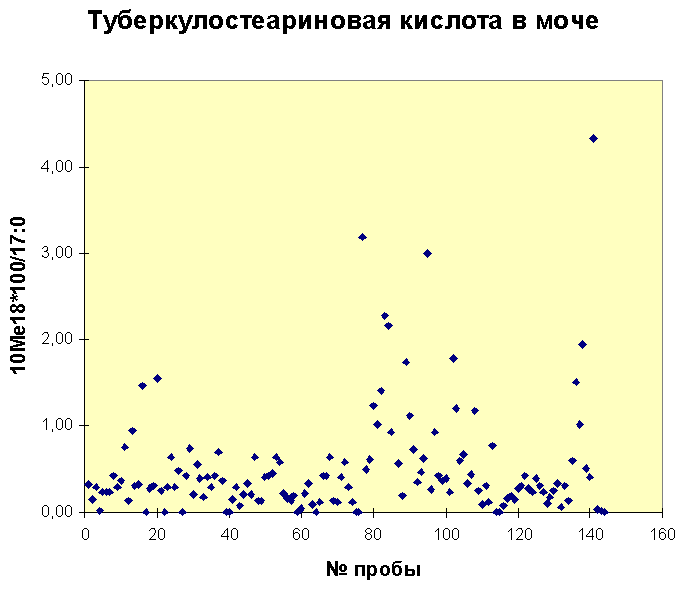
Нами (Академическая группа Академика РАМН Ю.Ф.Исакова, НЦССХ) осуществляется контроль туберкулостеариновой кислоты в различных биологических жидкостях человека (кровь, моча, мокрота, выпот, вагинальное содержимое, сперма) в течение пяти лет. Анализ материала больных разного профиля (но не туберкулезных), взрослых и детей, проводится методом ГХ-МС по разработанной нами методике [12-15]. Распределение концентрации ТСК показано на прилагаемых диаграммах. Почти во всех случаях наблюдается отличный от нуля (точнее, предела чувствительности, 50пг/мл) уровень содержания ТСК. Видимо это обусловлено носительством соответствующих бактерий: коринеформных, нокардиоформных или микобактерий, так как клетки человека ТСК не синтезируют. В ряде случаев мы обнаруживали двукратное и более увеличение ее содержания у пациентов с подозреваемым, выявленным или хроническим заболеванием туберкулезом.
Универсальность метода ГХ-МС в отношении вида биологической пробы, возможность количественной оценки содержания маркера (а следовательно и микроба) и экспрессность анализа позволяет определять локализацию процесса. Например, у больной О. с диагнозом вагинит определено существенное превышение содержание ТСК в вагинальном содержимом. Анализ других проб показал, что в мокроте ее уровень соответствует норме, завышен в крови, повышается в моче и максимален в вагине, где и локализован воспалительный процесс.
У больного П. с подозрением на туберкулез по данным рентгеноскопического обследования обнаружено значительное превышение содержание ТСК над уровнем нормы в мокроте и в крови одновременно.
При воспалении левого коленного сустава у девочки К.Х. (14 лет) в синовиальной жидкости обнаружено десятикратное по сравнению с нормой содержание ТСК. Маркеры микобактерий группы МАИС, а также M.marinum, M.malmoense не превышают фонового уровня, а обнаруженные одновременно коринебактерии принадлежат к группе (C.betae), не содержащей ТСК. Маркер нокардий не обнаружен. По данным анализа других микробных маркеров, который проводится одновременно по комплексной программе, обнаружено присутствие золотистого стафилококка (S.aureus). В профиле микробных маркеров из синовиальной жидкости правого колена ТСК содержится в норме, а коринебактерии группы С.betae и S.aureus обнаруживаются, как и в правом колене.
Как показывает последний пример, наша методика разработана в расчете на определение широкого круга микробных маркеров, а следовательно, и возбудителей воспалительных процессов и инфекций. При целевых исследованиях, например, при диагностике и мониторинге течения заболевания туберкулезом и его лечения это позволяет фиксировать количественно (т.е. в динамике) и сопутствующую микрофлору. Круг микроорганизмов, которые можно контролировать одновременно в единообразной форме пробоподготовки, анализа и обработки данных представлен в таблице маркеров. Мы не имели возможность мониторирования заболевания туберкулезом, однако успешно применяем его для диагностики и мониторинга микст-инфекции при эндокардите, воспалениях неясной этиологии и мочеполовых патологиях.
Методика опробована на ряде моделей ГХ-МС приборов фирмы Хьюлетт-Паккард (HP-5985/95/71/72/73), а также на инструментах фирм Шимадзу (QP-200) и Микромасс (Trio-VG). Наилучшим вариантом для реализации методики диагностики и мониторинга туберкулеза и сопутствующей микрофлоры нам представляется использование последних моделей ГХ-МС фирмы Хьюлетт-Паккард (HP-5973 МСД), поскольку они позволяют осуществление полной автоматизации процесса анализа и расчета, исключая пробоподготовку.
Краткая характеристика метода ГХ-МС микробных маркеров в биологических жидкостях человека представлена в приведенных литературных ссылках, а также в других разделах "Микробная диагностики" на сайте интернет http://www.rusmedserv.com.
Литература.
1. Сахелашвили М.И. Клиническая и лабораторная диагностика первичного туберкулеза
респираторных органов взрослых. Проблемы туберкулеза. 1998, №1, С.23-26.
2. Khomenko A.G. et al. Serodiagnosis of tuberculosus: detection of mycobacterial
antibodies and antigens. Tuber.Lung.Dis., 77(6), 510-515, 1996. (ЦНИИ Туберкулеза).
3. Lebrum L., Mathieu D., Saulnier C., Nordmann P. Limits of commertial molecular
tests for diagnosis of pulmonary tuberculosis. Eur.Resp.J. 1997, Aug.10(8), 1874-1876.
4. Bennedsen J. et al. Utility of PCR in diagnosing pulmonary tuberculosis. J.Clin.Microbiol.
1996. Jan 34(6),1407-1411.
5. Турова Т. П. Микробиология ......
6. Muranishi H., Nakashima M., Ando T. Shigematsu N., Isobe R. Basic and clinical
evaluation of rapid diagnosis of tuberculosis by detecting tuberculostearic acid.
Kekkaku. 1990, Jan, 65(1), 39-42. (in Japanese)
7. Jost K.C. et al. Identification of Mycobacterium tuberculosis and M.avium complex
directly from smear-positive sputum specimens and BACTEC 12B cultures by high
perfomance liquid chromatography with fluorescence detection and computer-driven
pattern-recognition models. J.Clin.Microbiol. 1995, 33, 1270-1277.
8. Larsson L., Mardh P., Odham G., Westerdahl G. Use of selected ion monitoring
for detection of tuberculostearic and C32 mycocerosic acid in mycobacteria and
in fife-day-old cultures of sputum specimens from patients with pulmonary tuberculosis.
Acta Pathol.Microbiol.Scand. [B], 1981, Aug, 89(4): 245-251.
9. Waddington M. Sherlock: HPLC Identification of Mycobacteria. May 1996. Инфформация фирмы MIDI Inc., Delawere, USA. 115 Barksdale Professional Center, Newark, DE
19711 U.S.A. Fax 302-737-7781.
10. Liquin M. Et al. Evaluation of practical chromatographic procedures for identification
of clinical isolates of mycobacteria. J.Clin.Microboil., Jan.1991, vol.29, No.1,
p. 120-130.
11. Alugupally S., Olsson B., Larsson L. Detection of 2-eicosanol by gas chromatography
- mass spectrometry in sputa from patients with pulmonary mycobacterial infections.
J.Clin.Microbiol. 31: 1575-1578, 1993.
12. Осипов Г.А. Демина А.М. Хромато-масс-спектрометрическое обнаружение микроорганизмов
в анаэробных инфекционных процессах. //Вестник РАМН. -1996, Т.13,-№2,- С.52-59.
13. Осипов Г.А. Хромато-масс-спектрометрическое исследование микроорганизмов и
их сообществ. Докторская диссертация, дбн, микробиология. Библиотека Московской
медицинской академии им.Сеченова или Института микробиологии РАН, Москва, 1996г.
14. Осипов Г.А. // Способ определения родового (видового) состава ассоциации микроорганизмов.
// Патент РФ №2086642от 10.08.97. С12Т 1/00, 1/20, С12Q 1/04. Бюл №22. Приоритет
от 24.12.93.
15. Роль анаэробов в возникновении урогенитальных инфекций. Пособие для врачей.
Центральный научно-исследовательский кожно-венерологический институт. Минздрав
РФ. Утверждено 09.09.97. Москва, 1998.

Рис. Распределение концентраций туберкулостеариновой кислоты в моче пациентов с различными заболеваниями. Уровень 0,7 видимо является верхней границей распределения в норме. Данные выше этого уровня возможно связаны с наличием микобактерий туберкулеза. Содержание репера - гептадекановой кислоты (17:0), относительно которой построен график, - составляет 20 мкг/мл крови.
Осипов Георгий Андреевич
дбн, вед научн сотр
Москва 103001
Садово-Кудринская, 15
Детская городская клиническая больница им. Н.Ф.Филатова
Академическая группа Академика РАМН Ю.Ф.Исакова
Тел (095) 254 67 40