Вестник РАМН. -1996, Т.13,-№2,- С.15-27
Г.А.Осипов, А.М. Демина
Хромато-масс-спектрометрическая индикация микроорганизмов в анаэробных инфекционных процессах.
ГосНИИ биологического приборостроения Минздрава РФ
Введение.
Особенности химического состава клеток микроорганизмов широко используются для их хемодифференциации /6/, автоматической идентификации рода или вида микроорганизмов в чистой культуре /14/, в том числе и для целей медицинской диагностики /8,10/. Обычно анализу предшествует выделение чистых культур из очага инфекции с помощью посева материала на селективные среды. Затем следует фаза пробоподготовки - выделение фракции жирных кислот путем гидролиза, перевод их в форму, удобную для хроматографирования, проведение газохроматографического анализа и идентификация рода (или вида) микро-организма с помощью компьютерной программы. По сравнению с традиционными методами бактериологического исследования использование хемодифференциации с помощью газовой хроматографии (ГХ) или ГХ в сочетании с масс-спектрометрией (ГХ-МС) позволяет существенно сэкономить время исследования за счет стадии повторных пересевов первичных колоний и тестовых ферментаций. Особенно это относится к диагностике анаэробных микроорганизмов, тестирование которых технически затруднено по сравнению с аэробами.
Предлагаемый в настоящей работе способ прямого анализа биологической жидкости на содержание маркерных веществ микроорганизмов позволяет еще более сократить время диагностики, т.к. при этом исключается стадия высевания колоний, которая занимает не менее суток.
Химический состав микробных клеток, в общем хотя и схож с составом клеток высших организмов, тем не менее имеет ряд отличий, достаточных для специфической идентификации на фоне клеток организма-хозяина. Высшие жирные b -оксикислоты присущи только грамотрицательным микроорганизмам. Разветвленные жирные кислоты и альдегиды также более характерны для клеток прокариотов. Циклопропановые кислоты встречаются исключительно у бактерий. К настоящему времени жирнокислотный состав большинства микроорганизмов изучен, показана его воспроизводимость, оценена родо- и видо-специфичность. Серии работ посвящены хемодифференциации клинически важных микроорганизмов. Это работы E.Yantzen /9/, C.W.Moss /15/, I.Bronds /5/ и других. Эти исследования имели своей целью получение дополнительной информации при спорных ситуациях в клинических бактериологических исследованиях. Метод маркера, т.е. выявление присутствия микроорганизма определенного рода или вида по присущему ему одному химическому веществу, используется в различного рода анализах при изучении окружающей среды /13/. Однако его возможности в области практической медицины мало изучены. Известна диагностика кандидомикоза по арабинитолу /12/, попытки обнаружения микроорганизмов, содержащих в эндотоксине b -оксимиристиновую кислоту /11/, диагностика видов Haemophylus по специфическим оксикислотам /4,17/. Наконец, недавно опубликована работа по дифференциации видов Campylobacter при бактериологическом исследовании в одной из Швейцарских клиник /7/.
Нами ранее разработан и использован в клинике метод диагностики анаэробной газовой инфекции по окси-стеариновой кислоте - метаболиту клостридий в мышечной ткани при послеоперационной и раневой инфекции /2/. В настоящем исследовании мы ставили целью определить возможности метода маркера в экспресс-диагностике инфекционного процесса в разных отделах организма человека по данным хромато-масс-спектрометрического анализа биологических жидкостей в режиме селективных ионов.
Материалы и методы.
Образцы проб. Образцы биологических жидкостей обрабатывали сразу после отбора. При невозможности немедленного анализа их консервировали в органических растворителях или замораживали при -5оС. Пробы промывали, центрифугировали, супернатант сливали, а осадок высушивали и подвергали кислому метанолизу в 2.5 М HCl в метаноле. Метанолиз проводили в 0.5 мл реактива на 2-10 мг сухого остатка в течение двух часов при 70° С. На этой стадии происходит освобождение жирных кислот и альдегидов из сложных липидов микроорганизмов и других клеток жидкости. В гнойных отделениях и в моче это в основном лейкоциты, в сперме - клетки сперматозоидов. В результате реакции метанолиза жирные кислоты освобождаются в виде метиловых эфиров (МЭЖК), а альдегиды в виде диметилацеталей (ДМА). Эти компоненты двукратно экстрагировали гексаном, высушивали и обрабатывали 20 мкл N,О-бис(триметил-силил)-трифторацетамида в течение 15 мин при 65 ° С для получения триметилсилильных эфиров окси-кислот. Реакционную смесь эфиров в количестве 2-4 мкл вводили в инжектор ГХ-МС системы НР-5984В Хьюлетт-Паккард с компьютером НР-100. Для управления и обработки данных использовали штатные программы прибора. Хроматографическое разделение пробы осуществляли на капиллярной колоне с метилсиликоновой привитой фазой Ультра-1 Хьюлетт-Паккард длиной 25 м и внутренним диаметром 0.2 мм. Режим анализа 120° С - 2 мин, далее програмирование температуры 7 град/мин в течение 18 мин. Масс-спектрометр - квадрупольный, с ионизации электронами (70эв) работал в режиме селективных ионов, или масс-фрагментографии (МФ), при периодическом сканировании четырех ионов в четырех интервалах времени. Интервалы и ионы выбирали таким образом, чтобы селективно детектироать маркеры определяемых видов микроорганизмов. В том числе использовали сильный ион m/z = 87 для детектирования малых количеств кислот С12-С15, С17, С19, выбрав интервалы групп так, чтобы обойти интенсивные пики кислот С16 и С18, доминирующие в жирнокислотном профиле клеток макроорганизма. Один из вариантов групп ионов и их распределение по времени приведен ниже.
|
Группа |
Начало сканирования, мин |
Ионы |
|
1 |
7 |
87, 175, 287,301 |
|
2 |
10.5 |
175, 315, 329,343 |
|
3 |
15 |
87, 175, 312, 357 |
Время накопления сигнала везде 100 мсек. Ион 175 взят постоянно в каждом режиме для детектировани #98; -оксикислот, для которых он специфичен и интенсивен в спектре. Ионы 301, 315 и далее через 14 единиц массы- это свидетели (М-15) молекулярного иона оксикислот тридекановой, тетрадекановой и далее в гомологическом ряду. Ион 312, как молекулярный, взят для выявления изомеров нонадекановой кислоты, важной для диагностики стафилококка и пептококков. Альдегиды (в виде диметилацеталей), при необходимости, выявляли в отдельном опыте в режиме фрагментных ионов или при прямом сканировании. Их присутсвие определяли по единственному интенсивному иону m/z=75 при несовпадении с хроматографическими пиками жирных кислот.
Результаты и обсуждение.
Основой для определения рода микроорганизма служил сформированный нами ранее банк данных по химическому составу клинически важных микроорганизмов. Из них отобраны вещества или их комбинации, специфичные для конкретных родов или видов. Поскольку обнаружение проводится на фоне биологической жидкости, то требуется учет мономерных компонентов сложных липидов самой жидкости в нерастворимом осадке. Водорастворимые белки, углеводы, липиды, метаболиты и пр. не мешают анализу, т.к. удаляются с супернатантом. Клеточные углеводы, белки также не участвуют в процессе, т.к. остаются в кислотной фракции при экстракции липидов гексаном после метанолиза. Не удается избавиться лишь от некоторых МЭЖК и ДМА биологической жидкости, т.к. они тождественны аналогичным микробным компо-нентам. В наших опытах мешающим клеточным материалом являются лейкоциты, эритроциты, клетки эпителия и сперматозоиды. В их составе присутствуют 12 жирных кислот, три альдегида и одна оксикислота, которые могут помешать выявлению микробных маркеров (таблица 1). Данные по лейкоцитам, осадку мочи и компонентам спермы получены нами, по эритроцитам взяты из литературных данных /3/.
Всего в таблице приведено 21 вещество из состава фоновых липидов. Три из них взяты как специфические (арихидоновая кислота - С20:4, кислоты С24:1 и С22:0) для количественного учета клеток фона, а кислота С26:0, вернее ее отсутствие, отмечено, чтобы показать возможности ее использования для детектирования микобактерий. В таблице опущен ряд веществ, нехарактерных для микрорганизмов и кислоты с 16 и 18 атомами углерода, которые присутствуют во всех клетках и не могут быть маркерами.
Клетки клинически важных микроорганизмов (около 500 штаммов 350 видов), собранных в нашем банке, содержат 140 веществ, среди которых могут быть обнаружены маркеры. Отсюда видно, что с учетом компонентов среды мы имеем достаточно большой набор веществ - около120 - для обнаружения микроорганизмов на фоне биологической жидкости. Их реальное количество на самом деле меньше из-за ограничений, связанных с методическими факторами.
Мы не ставили задачей приводить в данной работе исчерпывающие рекомендации по определению широкого круга микроорганимзмов, а лишь ограничимся демонстрацией возможностей метода на конкретных примерах. В таблице 2 приводятся отдельные индивидуальные вещества (маркеры) и их комбинации, характерные для наиболее актуальных в медицине микроорганизмов.
Таблица 1
Фон биологических жидкостей при определении маркеров микроорганизмов
Состав в % к сумме *
|
№ |
Вещество |
Гной** |
Вагинальная жидкость |
Моча |
Клетки спермы |
Эритроциты |
|
1 2 3 |
12 : 0 14 : 0 i15 : 0 |
0.7 10.0 0.4 |
1.0 2.3 0.3 |
- 10.0 <0.1 |
- 1.0 0.04 |
1.1
<0.1 |
|
4 5 6 |
а15 : 0 15 : 0 16 : 0а |
1.0 3.5 21.0 |
0.6 1.0 2.6 |
<0.1 1.5 1.0 |
0.03 0.5 0.8 |
<0.1 0.6 - |
|
7 8 9 |
i17 : 0 a17 : 0 17 : 0 |
3.3 4.9 6.8 |
0.2 0.1 1.0 |
1.5 3.3 4.6 |
0.1 0.05 0.5 |
0.8 0.6 2.0 |
|
10 11 12 |
18 : 0a 18 : 1a 3OH 16 : 0 |
16.2 0.5 - |
1.3 0.05 0.05 |
0.5 - - |
0.4 0.1 0.05 |
- - - |
|
13 14 15 |
19 : 1 19 : 0 20 : 4 |
0.8 0.5 14.5 |
0.01 0.2 1.9 |
- 1.4 7.0 |
0.01 0.12 2.8 |
- 1.3 88.3 |
|
16 17 18 |
20 : 1 20 : 0 22 : 0 |
2.3 1.1 1.4 |
0.2 0.6 0.6 |
- 5.5 2.2 |
0.4 1.0 1.3 |
1.3 0.7 1.0 |
|
19 20 21 |
24 : 1 24 : 0 26 : 0 |
2.4 0.8 0.0 |
0.01 1.0 0.3 |
- 3.0 - |
1.2 1.5 - |
1.8 2.2 - |
* кислоты с 16 и 18 атомами углерода исключены из рассмотрения, т.к. они не используются при диагностике.
**гнойное отделяемое челюстного абсцесса.
Таблица 2
Некоторые индивидуальные и составные маркеры микроорганизмов.
|
№ |
Организм |
Маркер * |
Примечание |
|
1 |
Bacteroides |
h16, hi17, ha17 |
Видоспецифично |
|
2 |
Fusobacterium |
h14/h16=1/0.8 |
|
|
3 |
Wollinella recta |
h14/h16=1/0.5 |
|
|
4 |
Campylobacter |
h14/19Ñ =1/2 |
|
|
5 |
E.coli, Klebsiella, Yersinia, |
h13/h14/17Ñ =1/15/3 |
|
|
6 |
Lactobacillus |
19Ñ |
|
|
7 |
Pseudomonas aeruginosa |
h10/h12/2h12/=5/2/2 |
fluorescense,putida |
|
8 |
P.multophila |
hi11/2hi11+1/1,hi13 |
|
|
9 |
Actinomyces гр.bovis |
20:1/20:0=1/0.7 |
|
|
10 |
Bacillus subtilis |
i13/i18/i19=1/15/1 |
|
|
11 |
Flavobacterium |
i17:1 |
|
|
12 |
Capnocytophaga |
hi15/hi17=1/1 |
При i15 более 50% |
|
13 |
Myxococcus, Stigmatella |
2hi15, 2hi17 |
|
|
14 |
Cytophaga, Flexybacter |
2hi15, 15:1 |
|
|
15 |
Bifidobacterium |
18:1a, 17:1 |
|
|
16 |
Propionibacterium |
i15, a15 |
|
|
17 |
Bacillus |
i, a13; i18; i19 |
Видоспецифично |
|
18 |
Peptostreptococcus |
a15, i19, 19:0 |
а15 без i15 |
|
19 |
Clostridium perfringens |
10h18:0 |
|
|
20 |
Mycobacterium tuberculosis |
10Me18:0, |
26:0/24:0>1 |
|
21 |
Propionibacterium |
20:1 |
в отсутствии i, а15 |
|
22 |
Streptococcus |
19:0, 20:0, 10:0 |
|
|
23 |
Staphilococcus |
i19/19:0=3/1 |
наличие i, а15 и17 |
|
24 |
Actinomyces albus |
i16:0/10Ме18=1.5/1 |
много, >25%кажд |
|
25 |
Nocardia asteroides |
10Me 18:0, 16:1d11 |
|
|
26 |
Selenomonas |
h13;17:1 |
|
|
27 |
Propionibacterium jensenii |
20:1 |
16.2% |
|
28 |
Propionibacterium acnes |
i15-68%, i17-25% |
нет 20:1 |
|
29 |
Candida albicans |
17:1 |
|
|
30 |
Neisseria gonorrhoae |
h12/h14>0.2 |
|
|
31 |
Chlamidia trachomatis |
h22 |
|
|
32 |
Serratia marcescens |
19:1 |
|
|
33 |
Haemophilus |
h14/14:0=1/1 |
много, по12% |
|
34 |
Micromonospora |
i16/a17=1.5/1 |
много, >15%кажд |
* - Обозначения веществ: 17:1 - 17- число атомов углерода, цифра после двоеточия - число двойных связей; h - оксикислота; а,i - в начале означает разветвление; а - в конце символов - альдегид. Например, ha17 - 3-окси-антеизогептадекановая кислота, i18а - изооктадекановый альдегид.
Интерпретация данных масс-фрагментограмм состоит в отнесении пиков к определенным веществам на основании их массы, соотношения интенсивностей (площадей) и времени хроматографического удерживания. Последнее определяется заранее по хроматограммам, полученным в режиме полного сканирования, когда можно точно определить природу химического компонента клетки. По набору веществ и их относительной концентрации определяют родовую или видовую принадлежность микроорганизмов, пользуясь банком данных, или приведенной выше таблицы 2.
Ниже приводятся примеры индикации микроорганизмов в некоторых биологических жидкостях человека.
Плевральная жидкость. Профиль простых и оксикислот плевральной пункции больного Л. с диагнозом рак легких с плевритом изучен в режиме масс-фрагментографии. Получена типичная хроматограмма (Рис.1), где на фоне преобладающих компонентов биологической жидкости видны пики, принадлежащие микроорганизмам . Наиболее интенсивные пики относятся к лейкоцитам, их профиль составляет основу хроматограммы. У лейкоцитов отсутствуют оксикислоты, поэтому оксимиристиновая и оксипальмитиновая кислоты (h14 и h16) в соотношении примерно 1:1 являются признаком фузобактерий согласно таблице 2. Кроме них присутствуют Actinomyces гр.bovis (додеценовая кислота С20:1 больше додекановой С20:0) и псевдомонады группы P.aeruginosa, (табл.2, № 7, - маркеры h10 и h12).
Гной из челюстного абцесса. Образец представлен Пашковым Е.П. (Кафедра микробиологии Московской медицинской Академии им. И.М.Сеченова). Исследованы две фракции пробы: эфир-гексановый экстракт из исходной жидкости и продукты кислого метанолиза клеток по методике, описанной выше. Первый экстракт взят для анализа липидных компонентов отмерших, автолизированных клеток, тогда как второй представляет информацию о клетках, сохранивших целостность к моменту анализа.
В первой фракции присутствуют оксикислоты hi15 и hi17 в сопоставимых количествах при большогм пике (в тридцать раз больше hi15) кислоты i15 : 0. По нашей таблице маркеров (таблица 2) это Capnocytophaga (№ 12). Учет количества оксикислоты h16 и сопоставление суммы данных с банком стандартов дает возможность определить вид возбудителя - Capnocytophaga ochraceae. Но это организм, который был ведущим в прошлом, вероятно в начале заболевания. Среди целых клеток, как показывает результат анализа продуктов кислого метанолиза, этот вид уже не является ведущим, он составляет по количественной оценке 5% от числа клеток другого возбудителя, который характеризуется оксикислотами h16, hi17 и ha17 при соотношении 1:3:0.3. По таблице 2 это должен быть предствитель рода Bacteroides (№1). Сопоставление с банком данных показывает, что это Bacteroides fragilis. Очевидно, что к моменту отбора проб этот вид стал доминирующим в миклофлоре абсцесса.
2. Моча.Проведен анализ осадка пробы мочи больной с подозрением по клиническим проявлениям на туберкулез. Осадок обработан, как указано в методической части. Супернатант тоже подвергнут анализу, но дополнительной информации он не дал. Возбудитель туберкулеза, Micobacterium tuberculosis, имеет четкий маркер - туберкулостеариновую кислоту 10Ме 18:0 (№20 табл. 2), при соотношении кислот С26:0/С24:0>1. В масс-хроматограмме по иону m/z=87, специфическому для простых жирных кислот, туберкулостеариновая кислота отсутствует, а соотношение указанных выше кислот примерно равно 1. Поскольку в норме в моче С26:0 отсутствует, а С24:0 в пять раз меньше , чем в пробе, то по их соотношению, следует предполагать наличие Mycobacterium smegmatis. Далее, изучение фракции оксикислот и альдегидов показало отсутствие грамотрицательной микрофлоры и плазмологен-содержащих организмов. Однако во фракции жирных кислот выделяется изононадекановая кислота iС19:0. С ней связано несколько вариантов: Bacillus, Peptostreptoccocus и Staphilococcus. Сопоставляя данные по другим маркерам с табл.2, можно отвергнуть бациллы из-за отсутствия разветвленных тридекановых кислот (i,a13), а пептострептококки - вследствие того, что у них должна быть а15 кислота при отсутствии i15. Кроме того, сопоставление с полным химическим профилем банка данных показывает, что соотношение изо- и нормальных кислот С19 соответствует стафилоккоку. Наконец, ведущим микроорганизмом в этой пробе является стрептококк, поскольку его маркеры - декановая (С10) и додекановая (С12) кислоты имеют максимальную концентрацию в составе компонентов мочи микробного происхождения.
3. Сперма. Эта биологическая жидкость представляет собой сложный объект для диагностики микроорганизмов из-за многовариантного фона, обусловленного липидами сперматозоидов и других клеточных элементов, секретов различных желез и неклеточных образований, а также свободных веществ нейтрального и кислого характера - метаболитов арахидоновой кислоты и стероидных гормонов. Кроме того, она наименее инфицирована по сравнению с другими жидкостями организма человека. Состав спермы в целом хорошо изучен, однако в частности для данного рода анализа требуется сопоставление конкретных фракций жирных кислот, альдегидов и оксикислот спермы в норме и патологии. Поэтому для начала приведем пример анализа инфицированной спермы больного С.В. и здорового донора К. При сопоставительном анализе взяты три фракции: фракция свободных компонентов (водно-этанольная), гексановая фракция продуктов кислого метанолиза липидов и соответствующий ей остаток моносахаров. В свободной фракции (водно-этанольный экстракт) у инфицированного больного наблюдается снижение содержания пироглутаминовой кислоты, глутаминовой кислоты, лизина и дигидроксифенилаланина. Резко уменьшается концентрация лимонной кислоты - более чем в 10 раз (Рис.2). В связанной фракции моносахаридов и аминокислот (фракции полисахаридов и гликопептидов - белок при этом режиме не гидролизуется) в пробе больного также отсутствуют те же аминокислоты, что и в свободной фракции. Кроме того, здесь обнаруживается существенное снижение инозита и деоксиманнитола.
Фракция жирных кислот, содержащая также оксикислоты и альдегиды, представляет собой интерес с позиции обнаружения и идентификации микроорганизмов в биологической жидкости, поэтому на ее составе остановимся подробнее. Следует отметить некоторые важные для дальнейшей диагностики соотношения концентраций липидных кислот в нормальном профиле. Они воспроизводятся у разных людей в отсутствии инфекции. В норме а15 составляет 9% от 15:0, 10Ме16:0 - 50% от 17:0, 24:1 - 50% от 24:0, 26:0 отсутствует, 20:1 составляет 38% от 20:0, 13:0 и изомеры отсутствуют, разветвленные 19:0 кислоты составляют 40% от нормальной 19:0.
За небольшим исключением полные профили основных компонентов жирнокислотной фракции больного и здорового человека совпадают. Как будет видно ниже, отличия появляются при рассмотрении минорных компонентов. На рисунке 3 представлены масс-фрагментограммы оксикислот, снятые в режиме, указанном в методической части. По сравненю с нормой у больного выявлены оксикислоты hi13, h13, h14, hi15, ha15, hi17 и ha17 (рис.3А). По таблице 2 и с учетом деталей банка данных следует констатировать наличие Bacteroides fragilis как ведущего микроорганизма, так как его маркеры - hi17 и h17 - на порядок больше остальных оксикислот. Пики hi15 и ha15 в данном случае обусловлены B.melaninogenicus, h14 - Fusobacterium, hi13 принадлежит P.multophila, а h13 связана с небольшим количеством грамотрицательных палочек из семейства Enterobacteriaceae. После курса лечения больного трихополом, эффективным в отношении Bacteroides, при повторном анализе маркерные вещества бактерий этого рода hi15, ha15, hi17 и ha17 уже не были обнаружены (Рис.3Б). После лечения осталось небольшое количество маркеров Pseudomonas и h14:0, отнесенной нами к Fusobacterium.
Пример 2.Смешанная грам-отрицательная бактериальная и грибковая микрофлора наблюдалась в сперме больного SF-302. При анализе обнаружены маркеры актиномицетов - редко встречающиеся 10-метилизомеры пента-и гептодекановых кислот 10Ме14:0 и 10Ме16:0 (Micromonospora). Грам-отрицательные бактерии выявлены по их специфическим оксикислотам. Псевдомонады - по h12, hi13 и ha13 (разные виды), Bacteroides melaminogenicus - по hi15 и ha15. Кроме того, присутствует группа микроорганизмов, характеризуемых b -оксимиристиновой кислотой (кроме грамотрицательных палочек сем. Enterobacteriaceae, для которых не хватает h13).
Род Pseudomonas, как и Bacteroides, гетерогенен по составу жирных кислот клеточной мембраны и оксикислот ЛПС. Это позволяет различать отдельные виды или группы видов. Оксилауриновая кислота h12 в отсутствии h10 характерна для трех видов псевдоманад типа P.ducrey, hi13 - для P.multophila.
Кровь. Определения возбудителя по компонентам эндотоксина. Диагностика заболевания по специфической реакции антиген-антитело в крови широко известна. Наиболее часто антигенами являются белковые макромолекулы. Они специфичны на уровне надмолекулярной структуры и не могут быть предметом исследований для хромато-масс-спектрометрии. Другой вид антигена - эндотоксин грамотрицательных бактерий - представляет собой липополисахарид, содержащий в своей структуре липид А. Этот липид включает три моносахарида, к которым присоеденены остатки жирных кислот, в том числе b -оксикислот, представляющих собой удобный объект для ГХ-МС исследований методом селективных ионов. Идея обнаружения сальмонелл и E.coli по b -оксимиристиновой кислоте в сыворотке крови была предложена давно/11/. Однако с тех пор, судя по отсутствию публикаций, практически не использовалась в медицинской практике. По деталям работы можно предполагать, что это было связано с недостаточной эффективностью набивной колонки хроматографа и неспецифичностью b -окси-миристиной кислоты в данном случае. Контрольные опыты показали, что во-первых в сыворотке крови содержится лишь малая часть ЛПС-эндотоксинов. Их на порядок больше на форменных элементах, т.к. ими переносятся. Во-вторых, судя по набору оксикислот, в кровь поступают эндотоксины всей естественной микрофлоры человека или животного. Наблюдаются пики b -оксикислот от С10 до С18. Поэтому такая диагностика носит количественный характер: контроль превышений над фоновым уровнем.
Пример 1. Бруцеллез. Для проведения этой работы специально изучен состав липида А бруцелл (препарат ЛПС B.abortas и B.melitensis любезно предоставлен Маликовым В.Е., ИЭМ им.Н.Ф.Гамалеи). Он примерно одинаков для этих двух основных видов рода (табл.3). Серия из пяти животных (морских свинок), инфицированных возбудителем бруцеллеза при одном контрольном, наблюдалась в течении трех месяцев. У всех животных периодически брали кровь и определяли содержание основной оксикислоты антигена бруцелл-b -оксипальмити-новой кислоты во фракции форменных элементов. Фоновый уровень содержания оксикислот в крови различен для разных животных. Это обусловлено вариациями в составе их естественной микрофлоры. Поэтому для количественных оценок оказалось удобным брать соотношение концентраций h16 и гептадекановой кислоты, которая наименее подвержена вариациям у млекопитающих.
Таблица 3
Состав жирных кислот липида А ЛПС бруцелл (в % от суммы)
|
Вид |
Нормальные кислоты 14:0 15:0 16:0 17:0 18:0 |
Оксикислоты 12:0 13:0 14:0 15:0 16:0 17:0 18:0 |
|
Brucella meltensis |
1.2 0.6 31.6 5.2 5.3 |
5.6 5.5 6.7 1.6 21.1 5.9 7.0 |
|
B.abortus |
1.4 0.7 41.0 2.0 2.7 |
4.0 2.0 9.5 1.4 23.1 4.0 8.2 |
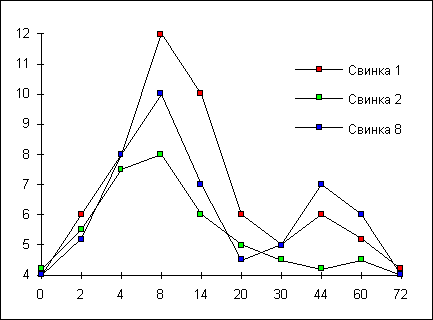
На рисунке 5 приведены три кривые изменения относительной концентрации h16, представляющих два типа протекания болезни. У двух животных из пяти инфицированных кривая имела один максимум (например, свинка 2). Для трех других наблюдались кривые с двумя максимумами концентрации антигена в крови в районе 8 и 44 суток от момента инфицирования (свинки 1 и 8). Достаточно заметное изменение соотношения h16/17:0 - 1.5-2 раза от исходного уровня наблюдалось уже на 2- 4 сутки, что в случае бруцеллеза можно считать ранней диагностикой.
Соотношение h16/17:0
 |
Время, суток |
Рис.5. Кривые изменения концентрации маркера бруцелл b -оксипальмитиновой (h16) кислоты от времени в крови морских свинок при экспериментальном бруцеллезе.
Сальмонеллез. У сальмонелл основной оксикислотой в ЛПС является b -оксимиристиновая. Поэтому, для оценки диагностической значимости метода масс-фрагментографии в отношении сальмонеллеза сопоставляли концентрацию этой кислоты, как меры содержания антигена сальмонелл в сыворотке крови больных людей, с величиной титра иммунного метода. Результаты приведены в таблице 4.
Таблица 4
Сопоставление тиров иммунного метода и концентрации b -оксимиристиновой кислоты в сыворотке крови больных сальмонеллезом
|
ПациентыÞ № пробыÞ |
Здоровые доноры 1 2 3 |
Больные сальмонеллезом 4 5 6 7 8 9 10 11 |
|
Величина об-ратного титра |
0 0 0 |
0 10 10 20 160 640 640 320 |
|
Концентрация h14/h16 |
0.2 0.2 0.7 |
1.1 0.7 0.8 0.7 1.2 1.3 2.0 2.0 |
Для количественной оценки выбрано соотношение h14/h16, позволяющие получить наилучшую корелляцию с титрами. Из таблицы видно, что у здоровых людей выбранное соотношение меньше 1, а у больных с ярко выраженным иммунным ответом оно больше единицы.
Вагинальный дисбиоз. Вагинальная микрофлора представляет собой определенное локальное сообщество микроорганизмов. Участие в нем разнородных бактерий и простейших делает затруднительным анализ микрофлоры традиционными методами. Некоторые организмы медленно растут, другие требуют сложных искусственных сред, третьи не высеваются вообще, так как развиваются внутри эпителиальных клеток. Метод химических маркеров, определяемых с помощью хромато-масс-спектрометрии, удалось успешно применить для экспрессного анализа видового состава этого сообщества. При этом использован разработанный нами способ определения структуры экологических микробных сообществ по химическому составу суммарной биомассы /1/. Для анализа вагинальной микрофлоры составлен локальный банк данных по химическому составу составляющих ее микроорганизмов и предложен механизм вычислений с помощью электронных таблиц на персональном компьютере. Эта работа будет опубликована отдельно. Для полноты иллюстрации описываемой здесь методики приведем лишь один пример анализа (Табл.5, рис.5). Таблица содержит сведения о составе и количестве определяемых микробных компонентов, а автоматически производимая компьтером диаграмма дает наглядное представление о ведущих микроорганизмах. Анализ занимает восемь часов.
Таблица 5 Состав вагинальной микрофлоры. Проба VF-417.
|
№ |
Род, вид |
0,01Ni,клеток |
|
1 |
Clostridium perfringens |
3480 |
|
2 |
Bacteroides fragilis |
2080 |
|
3 |
Bacillus |
48750 |
|
4 |
Staphilococcus epidermidis |
24600 |
|
5 |
Bifidobacterium |
275 |
|
6 |
Propionibacterium |
4650 |
|
7 |
Chlamidia trachomatis |
201 |
|
8 |
Lactobacillus |
10 |
|
9 |
Enterobacteriaceae |
4600 |
|
10 |
Fusobacterium |
353,6 |
|
11 |
Peptostreptococcus |
2310 |
|
12 |
Neisseria gonorrhoae |
1 |
|
13 |
Mycobacteria |
1 |
|
14 |
Candida albicans |
284400 |
|
15 |
Nocardia asteroides |
1 |
|
16 |
Actinomyces |
1 |
|
17 |
Prevotella melaninogenica |
1 |
|
18 |
Capnocytophaga |
1 |
|
19 |
Pseudomonas |
1 |
|
20 |
Flavobacterium |
1 |
|
21 |
Haemophilus |
1 |
|
22 |
Myxococcus |
150 |
Заключение
Приведенные здесь примеры в целом показывают, что диагностика возбудителей инфекционных процессов по данным масс-фрагментографии биологических жидкостей является экспресным, чувствительным и универсальным методом индикации, одинаково эффективным как для аэробных, так и для анаэробных микроорганизмов.
Он может быть использован для определения любого микроба, имеющего в составе структурных клеточных компонетов вещество-маркер, отличное от химических веществ фоновой биологической жидкости. Наши наблюдения и литературные данные свидетельствуют о достаточном количестве клеточных компонентов, специфичных сугубо для возбудителя, по которым его можно идентифицировать, используя индивидуальные или коллективные маркеры (табл. 2).
Наиболее благоприятные условия создается для диагностики грамотрицательных микроорганизмов во всех биологических жидкостях, т.к. в их собственном составе не содержатся оксикислоты, специфичные для липида А ЛПС. Удобно диагностировать также плазмологенсодержащие бактерии, имеющие альдегидные фрагменты.
Важным обстоятельством, влияющим на эффективность диагностики, является специфичность единого маркера. Если, например, имеется в единственном числе b-оксимиристиновая кислота, характерная для многих микроорганизмов, то определение рода в каждом случае зависит от дополнительных сведений. Тем не менее, первые опыты использования масс-фрагментографии /11/ и газовой хроматографии с детектором электронного захвата /16/ в бактериальной диагностике проведены с использованием этого маркера. Как видно из приведенных примеров, если дополнительно пользоваться другими признаками, кроме h14, то можно определить вид микроорганизма. Например, если наряду с h14 присутствует h16 - это Fusobacterium или Wollinella recta, если есть 19Ñ , то это - Сampybacter; при наличии h13 и 17Ñ - Е.coli и т.д. (см. табл.2).
Аналогичная ситуация складывается и с другими маркерными веществами. Сейчас, когда имеются данные химического состава большинства известных микроорганизмов, трудно назвать единственный вид, для которого характерен строго определенный маркер. Практика показывает, что через некоторое время обнаруживается второй , третий и т.д. организм с таким же веществом. Несмотря на это, привлекая к анализу другие компоненты химического состава клетки, нетрудно определить род или вид присутствующего микроорганизма или исключить те или иные виды из списка предлолагаемых. Обычно анализ данных и начинается с операции исключения микроорганизмов, маркеры которых отсутствуют. Например, отсутствие оксикислот сразу исключает из рассмотрения грамотрицательные микроорганизмы. Отсутствие альдегидов исключает большую группу плазмогенсодержащих организмов. Наличие или отсутствие a -оксикислот предполагает или отвергает определенные виды, для которых характерны сфинголипиды, включающие эти оксикислоты (в отличие от b -оксикислот ЛПС). И так далее: наличие ненасыщенных, циклопропановых, разветвленных изомеров и их комбинаций дает основу для алгоритма идентификации.
Приведенные примеры идентификации отдельных видов микрорганизмов показывают универсальность метода: он одинаков для любых таксономических, физиологических и трофических групп микроорганизмов. Неважно, какой микроорганизм требуется определить: аэробный, анаэробный, быстро или медленно растущий, образующий споры, или нет и т.п.
Чувствительность метода по ряду измерений составляет 104-105 клеток в пробе в зависимости от содержания маркера в клетке. В этом качестве метод уступает микробиологическому методу селективных сред, однако имеет преимущества в экспрессности.
В настоящее время для проведения анализа требуется примерно 5 часов на 1 образец, или 7 часов на серию из 5 проб, тогда как бактериоскопия занимает , как минимум, сутки. В перспективе можно сэкономить еще час на стадии кислого метанолиза. Дальнейшее сокращение времени в принципе возможно при сужении цели анализа или применении высокой технологии пробоподготовки и автоматизации стадии идентификации.
В отношении цели анализа следует заметить, что мы говорили в обсуждении о задаче общего плана: какие микроорганизмы присутствуют в пробе. В ряде конкретных случаев задача проще: есть ли в пробе признаки организма определенного вида: микобактерий туберкулеза, бруцелл, кампилобактера или других возбудителей инфекционных заболеваний. В этом случае можно совершенствовать метод в части экспресности и чувствительности, отрабатывая стадию пробоподготовки на максимальное извлечение целевого маркера. Стадия идентификации при этом сокращается до нескольких минут и общее время составит 2 часа на пробу или 4 часа на серию из пяти проб.
Литература
Identification by gas chromatography - mass spectrometry of microorganisms in anaerobic infections
G.A.Osipov, A.M.Dyomina
A single ion monitoring (SIM) method for the detection of microorganisms in biological fluids such as suppurative, pleural, seminal, vaginal and also in urine and blood is described. The method was used for recovering chemical markers in lipid moiety of biomass as assigned for some microorganisms. SIM technique is sensitive, specific and express. This study is based on ten years of experience in the investigation of microbs and body fluids constituents such as normal an hydroxy fatty acids and fatty aldehydes originating from cell membrane and lipopolysaccharide. Analytical procedure does not require that the microbial organisms be isolated or cultured. It provide the direct analysis of lipid biomarkers from whole biomass. The method is sensitive (n*104 cells/ml) and universal, irrespective to bacterial type: anaerobic, aerobic, slow or fast growing, fermenting or not. Examples are given for simultaneous detection of Bacteroides, Fusobacterium, Candida, Pseudomonas, Actinomyces, Clostridium, Staphylococcus, Haemophylus, Campylobacter, Flavobacterium, Chlamidia and other bacteria and microscopic fungi.
|
|
Dr of Sci G.A.Osipov Moscow Paediatric Centre of Laboratory Diagnostic Sadovo-Kudrinskaya str.,15, Moscow 103001, Russia Tel. /095/ 254 67 40, Fax /095/ 254 60 15 /call before/ E-mail: osipovga@rusmedserv.com |