
Журнал: Здравоохранение и медицинские технологии № 5 2007 стр. 20-23
redaktor@zdravmedtech.com
Осипов Г.А., ведущий научный сотрудник, доктор биологических наук, профессор
Федосова Н.Ф., заведующая клинико-диагностической лабораторией
Лядов К.В. , директор, член-корреспондент РАМН, доктор медицинских наук, профессор
ФГУ Лечебно-реабилитационный центр Росздрава
Введение
Метод масс-спектрометрии микробных маркеров разработан в России и с 1991 года используется для количественного анализа таксономического (родового или видового) состава микробных сообществ в медицине, экологии и биотехнологии [Осипов, 1993]. В его основе лежит высокоточное определение присутствия молекулярных признаков микроорганизмов (маркеров) из числа их клеточных липидов – высших жирных кислот, альдегидов, спиртов и стеролов в анализируемой пробе. Определение производится высокочувствительным и селективным методом газовой хроматографии – масс спектрометрии (ГХ-МС), позволяющим одновременно измерять более сотни микробных маркеров непосредственно в анализируемом материале, крови, моче, биоптатах, пунктатах, мокроте, и других биологических жидкостях и тканях без предварительного посева на питательные среды или использования тестовых биохимических материалов. Разработан автоматический алгоритм анализа с помощью штатных программ ГХ-МС, позволяющих определить концентрацию более 50 микроорганизмов в материале через три часа после его поступления в лабораторию. Метод подтвержден патентами на изобретения, его научная обоснованность заключена в двенадцати кандидатских и докторских диссертациях, четырех патентах и десятках публикаций в научной периодике, в том числе в иностранных реферируемых журналах. Метод рекомендован к клиническому использованию в руководствах и пособиях для врачей [Роль.., 1998; Осипов, 2005; Дисбактериоз…, 2007]. Данная технология разработана на основании 15 летнего опыта хромато-масс-спектрометрического анализа клинических образцов крови и других биологических жидкостей (мочи, слюны, вагинального и уретрального секрета, мокроты, ликвора, пунктатов, биоптатов и пр.), а также инфицированных тканей.
Применяемые на сегодняшний день в клинической практике методы диагностики инфекции имеют определенные ограничения и недостатки. Например, существенным недостатком классического бактериологического исследования, помимо дороговизны и длительности (7-10 дней), является невозможность оценить роль некультивируемых микроорганизмов в инфекционно-воспалительном процессе, прежде всего – анаэробов. При этом в большинстве случаев в клинической практике приходится работать со смешанной аэробно-анаэробной микрофлорой, что значительно затрудняет диагностику и требует высокой квалификации специалиста. Используемый в сомнительных случаях в качестве дополнительного к классическому иммуно-серологический метод является непрямым - определяется не возбудитель, а иммунный ответ на него, который может иметь индивидуальные вариации. Это является серьезной помехой для интерпретации результатов и принятия адекватных клинических решений. Известные молекулярно-биологические методы (ПЦР, гибридизация РНК и ДНК), при несомненных преимуществах - прямое определение возбудителя, высокие специфичность и чувствительность, универсальность, скорость, возможность диагностики хронических и латентных инфекций – имеют такие серьезные недостатки, как частые ложно-положительные результаты и невозможность адекватной количественной оценки.
Из всего вышесказанного вытекает очевидная востребованность в надежном экспрессном методе диагностики возбудителей инфекции. Метод газовой хроматографии масс-спектрометрии (ГХ-МС) позволяет детектировать в исследуемых образцах маркеры – компоненты микробной клетки – широкого спектра микроорганизмов собственной и инородной микробиоты человека. Метод является высокочувствительным, экспрессным (3 часа на полный цикл исследования), универсальным, экономичным и имеет широкий диагностический спектр. Он легко поддается стандартизации, для его реализации используются доступные любым лабораториям химические реактивы и методики пробоподготовки. Метод автоматизирован, что обуславливает простоту лабораторной диагностики. Предлагаемый метод ГХ-МС обеспечивает возможность при проведении анализа одного образца одновременной детекции десятков маркеров микроорганизмов. Диагностические возможности метода для выявления маркеров в клинических материалах представляются перспективными. Поэтому в ФГУ Лечебно-реабилитационный центр Росздрава (директор – член-корреспондент РАМН К.В.Лядов) в течение 2,5 лет проводились клинические испытания, результаты которых приводятся в настоящей работе.
Диагностика
Суть анализа состоит в прямом извлечении с помощью химической процедуры высших жирных кислот из подлежащего исследованию образца, их разделения на хроматографе в капиллярной колонке высокого разрешения и анализа состава в динамическом режиме на масс-спектрометре. Поскольку хроматограф соединен в едином приборе с масс-спектрометром (рис 1) и снабжен компьютером с соответствующими программами автоматического анализа и обработки данных, сам процесс анализа занимает 30 мин, а с учетом времени пробоподготовки и расчета данных - около 3 часов. Его результатом является определение концентрации микробных маркеров и последующая реконструкция состава микробного сообщества.

Рис. 1 Система газовый хроматограф с масс-спектрометром
Впервые исследования по хромато-масс-спектрометрическому определению микробных маркеров микроорганизмов непосредственно в клинических материалах от больных появились в конце 80-х гг. [Sonesson, 1987; Morgan, 1989; Brandtzaeg, 1992]. Они были направлены на мониторинг маркера одного микроорганизма (например – менингококка, или кишечной палочки в цитируемых работах) известным в масс-спектрометрии методом фрагментных ионов. За рубежом он носит название single ion monitoring (мониторинг отдельного иона). Этот ион является специфичным в масс-спектре вещества – маркера мониторируемого микроорганизма. Наш вариант отличается тем, что мы ввели в программу скрининга 37 спектральных линий (масс ионов), которые перекрывают 150 таксономически значимых маркеров микроорганизмов (рис 2). Благодаря их комбинации при сканировании и хроматографическому разделению веществ пробы удается количественно контролировать все доминантные микроорганизмы, обитающие в теле человека, или являющиеся агентами внешней инфекции.
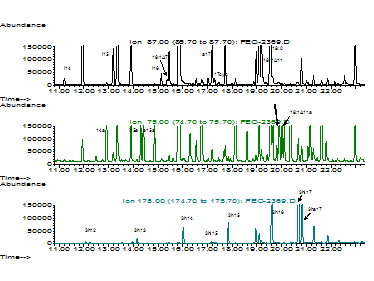
Рис. 2. Селективные хроматограммы жирных кислот (ион 87, верхний рисунок), жирных альдегидов (ион 75, рисунок в середине) и гидрокси-кислот (ион 175, нижний рисунок), экстрагировпнных из клинического материала, содержащего микроорганизмы и/или их маркеры. Обозначения веществ: 17:1 - 17- число атомов углерода, цифра после двоеточия - число двойных связей; h - оксикислота; а,i - в начале означает разветвление; аlc - в конце символов - спирт, cyc - циклопропановая кислота. Например, ha17 - 3-окси-антеизогептадекановая кислота, 2h24alc - 2-окситетракозиловый спирт
На сегодня установлены отличия, достаточные для специфической идентификации микроорганизмов на фоне клеток организма хозяина. Клетки высших организмов синтезируют лишь прямоцепочечные, четные, насыщенные и ненасыщенные жирные кислоты с числом атомов от 14 до 24 [Alexander, 1985], в то время как нечетные, разветвленные и циклопропановые жирные кислоты и жирные альдегиды встречаются исключительно у бактерий, высшие жирные бета-оксикислоты присущи только грамотрицательным микроорганизмам. К настоящему времени состав жирных кислот большинства микроорганизмов изучен, показана его воспроизводимость, доказана их родо- и видоспецифичность [Stead, 1992]. Метод детектирования микроорганизмов по ЖК-маркерам сходен с генетическим анализом (ПЦР, определение последовательности нуклеотидов 16sРНК и пр.), поскольку состав жирных кислот детерминирован в ДНК и воспроизводится путем репликации участка генома транспортными РНК и последующего синтеза ЖК в митохондриях по матричным РНК. Т.е, профиль ЖК так же консервативен, как и строение ДНК. Исследования в области бактериальной палеонтологии подтвердили постоянство состава ЖК отдельных микроорганизмов и пула их жирных кислот в целом с глубины времен в 2.5 млрд. лет [Shekhotsova, 2003].
Методу ГХ-МС микробных маркеров присущи:
широкий диагностический спектр: определение маркеров десятков микроорганизмов одновременно в одном анализе;
универсальность: определение разных групп микроорганизмов: бактерий, грибов, вирусов;
экспрессность: время одного анализа не более 3 часов
высокая чувствительность: 0.01 нг/мл маркера
селективность: определение микроорганизма до вида - при наличии видового маркера
независимость от оснащения микробиологической лаборатории и возможность прямого анализа клинических образцов без высевания и подращивания;
экономичность: метод не требует биологических и биохимических тестовых материалов, культуральных сред, ферментов, праймеров.
Для проведения экспресс-анализа маркеров микроорганизмов требуются: хромато-масспектрометр, программа расчета и база данных.
Обнаруженный в результате систематических исследований гомеостаз микробных маркеров в крови (Белобородова, 1999; Beloborodova, 2000) и адекватность его профиля составу кишечной микрофлоры здорового человека обеспечил уникальную возможность мониторировать состояние микробиоты кишечника неинвазивным экспрессным методом – по анализу крови (Осипов, 2003). Поскольку в кровь попадают также липидные компоненты отмирающих микроорганизмов из других органов, то его можно считать экспрессным методом определения микроэкологического статуса высших организмов.
Реабилитация
Одним из последствий стрессовых воздействий на организм человека является нарушение, порой устойчивое, обмена веществ в организме как следствие изменений микрофлоры кишечника и ассоциированной с ними проницаемости кишечной стенки. В результате возникает диспропорция в поступлении биологически активных веществ, продуцируемых микроорганизмами, в организм хозяина и нарушение нормального функционирования его органов. Последствия могут быть патологическими, поскольку от микробиоты кишечной стенки зависит продукция более половины необходимых для человека витаминов, ферментов, факторов, сигнальных молекул, медиаторов и других гормоноподобных соединений, требуемых для обеспечения метаболизма и репродукции его собственных клеток и систем – иммунной, нервной, эндокринной и других. Пептидогликан клеточных стенок грамположительных микроорганизмов (они составляют абсолютное большинство пристеночной микробиоты кишечника человека) активно участвует в регуляции иммунного статуса хозяина на местном и системном уровнях. Считается, что именно микроэкологические изменения в организме хозяина являются запускающим механизмом подавляющего большинства патологических процессов, и существует столько вариантов дисбаланса микробиоценозов человека, сколько известно нозологических форм заболеваний [Шендеров , 1998]
Поэтому микроэкологический статус человека, точнее, поддержание его гомеостаза, является необходимым условием стабильного функционирования всех его органов и систем. Соответственно, одним из первых этапов в реабилитации людей, переживающих экстремальные ситуации в силу особенностей своих профессий (бойцы горячих точек, эвакуаторы, ликвидаторы аварий и другие), должен быть контроль и восстановление микробиоценоза, если он оказался нарушенным.
На рубеже ХХI века сформировалось представление о микрофлоре организма человека как о еще одном органе, покрывающим в виде чулка кишечную стенку, другие слизистые оболочки и кожу человека. Оставаясь невидимым, этот «орган» весит около двух килограммов и насчитывает порядка 1014 клеток (сто биллионов) клеток микроорганизмов. Это число в десять раз превышает число собственных клеток организма-хозяина [Шендеров , 1998; Осипов, Парфенов, 2003].
При обследовании пациентов с подозрениями на изменение микроэкологического статуса (кишечные или кожные проблемы, аллергия, сепсис, лихорадка неясного генеза и прочее) выявлены следующие типы изменений нормальной микробиоты организма пациентов.
Эти изменения соответственно адекватны изменению пула химических веществ, поступающих к хозяину от микробиоты.
Как следует из собственных экспериментальных данных и данных работы [Осипов, 2003], дисбактериоз кишечной стенки при СРК носит преимущественно дефицитный характер. В то же время растет численность анаэробов Bacteroides fragilis, Porphyromonas, Propinobacterium acnes, а также Campylobacter mucosalis, энтерококки, псевдомонады, Acinetobacter, бациллы и стрептококки. Эта группа микробов вероятно является источником токсинов, поддерживающих заболевание при дефиците противодействия со стороны основных представителей нормальной микробиоты. В переводе на общепринятый язык ее можно определить как группу условно-патогенных микроорганизмов. В таком случае разумно говорить об антибиотикотерапии при СРК, хотя это выглядит на первый взгляд абсурдным. В действительности, назначение полусинтетические пенициллинов и сульфамиламидов параллельно с сухими пробиотиками оказывается эффективным. Однако выборочные контрольные анализы после лечения показывают, что микробиота кишечника восстанавливается лишь на 50%. Добавление в терапию метронидазола, повышает эффект. Эффективность пары амоксициллин-метронидазол отмечена при избыточном росте анаэробных бактерий (эубактерии, пропионобактерии, клостридии и другие). В пяти клинических случаев было показано, что монотерапия метронидазолом стимулирует рост нормальной микробиоты тонкого кишечника. Прием этого препарата в течение времени и доз, указанных в аннотации, не показал по данным ГХ-МС анализа угнетения остальной части полезной микробиоты кишечника. Как следует из литературных данных, анаэробы не восприимчивы к обычно применяемым антибиотикам резерва: ванкомицину и амикацину. Эти препараты эффективны в случае участия в инфекционном процессе аэробных актинобактерий: стрептомицетов, нокардий, родококков [McNeil, 1990], которые довольно часто включаются в микст-инфекцию обследованных нами больных (микрофото 1).
При синдроме раздраженного кишечника общая численность микроорганизмов кишечника снижается в четыре раза по сравнению с нормой. В большинстве остальных случаев имеет место не более чем двукратный общий дефицит колонизации кишечника, преимущественно за счет уменьшения численности лактобацилл, бифидобактерий, основной группы эубактерий и пропионобактерий при наиболее частом избытке энтеробактерий, клостридий группы C. ramosum и Eggertella lenta, а также избирательном росте некоторых других бактерий: стрептомицетов, нокардий, лактобацилл. Тотальный избыточный рост микроорганизмов при дисбактериозе наблюдался лишь в отдельных случаях и отличался преимущественным ростом количества C. ramosum.
Типовой вид результатов обследования на микроэкологический статус методом масс-спектрометрии микробных маркеров показан на рис. 3.
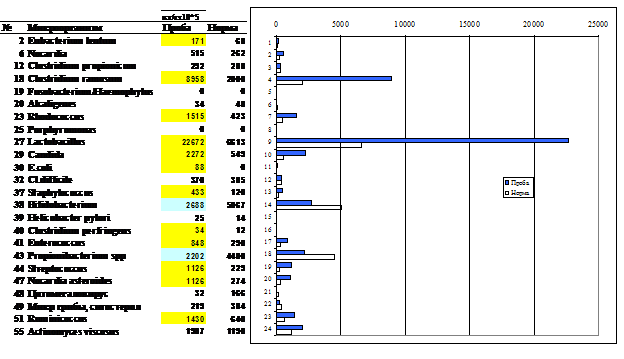
Рис.3. Сепсис у больной А (проба NT-530). Доминируют маркеры Clostridium ramosum и лактобацилл при дефиците пропионобактерий, бифидобактерий и других микроорганизмов нормальной микробиоты. Клинически значимый уровень превышают маркеры дрожжей кандида, стрептококков, руминококков, бактерий сем. Enterobacteriaceae (E. coli), актинобактерий Rhodococcus, Streptomyces, Nocardia asteroides и Eubacterium lentum.
Для коррекции дисбиоза выглядит перспективным применение жидких пробиотиков типа нормофлоринов или биовестинов. В них на два порядка больше живых бактерий (N=1010), кроме того, жидкая культуральная среда содержит естественный пул ростовых факторов микроорганизмов в качестве пребиотика. Конечно, и этого мало, чтобы восполнить недостаток или подрастить дефицитные лактобациллы или бифидобактерии – дело не в этом. Поскольку в кишечнике их примерно 1012 , то добавка пробиотика не восполняет дефицита по количеству клеток, но на самом деле клинический эффект достигается. Можно предположить, что живые культуры бифидо- и лактобактерий вместе с частью культуральной среды содержат биокаталитические вещества, стимулирующие восстановление не только этих, но и других микробов – то есть восстановление кишечного гомеостаза. В качестве примера можно привести коррекцию дисбактериоза у одного из больных (рис 4).
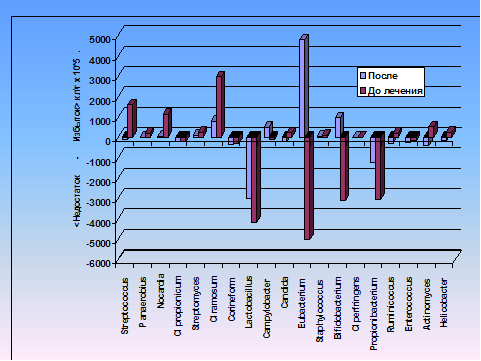
Рис 4. Дисбактериоз и его коррекция. Применены жидкие концентраты бифидо- и лактобактерий. После лечения микроэкологический статус в основном нормализовался, за исключением того, что лактобацилы не достигли нормы, а численность эубактерий перешла в избыток.
До лечения у больного обнаружен избыток C. ramosum, стрептококков, нокардий и Actinomyces viscosus при существенном недостатке основных микроорганизмов нормальной микробиоты кишечника – лактобацилл, бифидобактерий, эубактерий и пропионобактерий. После лечения микроэкологический статус в основном нормализовался, за исключением того, что лактобацилы не достигли нормы, а численность эубактерий перешла в избыток. При восстановлении нарушенного микроэкологического статуса оказалось полезным применение имуномодуляторов (гепон, имуномакс), висмутовых препаратов типа де-нола а также метронидазола, который, как оказалось, кроме подавления внедренных в слизистую оболочку бактероидов стимулирует рост всех микроорганизмов нормальной микробиоты кишечника.
Сепсис и инфекция в области хирургического вмешательства
При септических состояниях, лихорадках, как правило, неясного генеза, чаще происходит избыточный рост ряда микроорганизмов из состава нормальной микробиоты хозяина, что по определению является инфекцией. Общим признаком этой части пациентов является более чем двукратное превышение в крови концентраций маркеров стафилококков, клостридий группы Clostridium ramosum, энтерококков, лактобацилл, Eubacterium lentum (Eggertella lenta) и дрожжей кандида (рис 3). Наибольший прирост численности бактерий приходится на C. ramosum и лактобациллы. К частным признакам относится прирост численности основной группы эубактерий (Eubacterium moniliforme, E.nodatum, E.sabureum), который наблюдается не у всех пациентов. Частично участвуют в инфекционном процессе грамотрицательные микроорганизмы сем. Enterobacteriaceae (E. Coli, Proteus, Klebsiella и другие). Реже уровень клинической значимости превышали маркеры псевдомонад, моракселл, Fusobacterium/Haemophylus, Selenomonas, Helicobacter pylori и Prevotella. Другие грамотрицательные бактерии, такие как представители родов Stenotrophomonas, Acinetobacter, Neisseria, Bacteroides, Burkholderia, Francisella не превышали уровня клинической значимости или предела детектирования. У больных с раневой инфекцией или сепсисом наблюдали общий избыточный рост микробиоты по оценке микроэкологического статуса, при том обстоятельстве, что численность части микроорганизмов почти у всех обследованных снижалась более чем в два раза по сравнению с нормой. Это относится, прежде всего, к бифидобактериям, пропионобактериям, энтерококкам и Clostridium propionicum. В некоторых случаях значимые снижения концентраций отмечены для лактобацилл, эубактерий, коринебактерий и микроскопических грибов (не кандида).
Что касается инфекционной составляющей, то она, как и следовало ожидать, наилучшим образом выявляется при анализе материала из очага инфекции: соскоба, пунктата, экссудата. Если очаг закрыт, то информацию можно получить и из анализа крови. Сопоставление результатов двойного анализа – раневого экссудата и крови - для больного с инфекцией в области хирургического вмешательства после удаления селезенки представлено на рис 5.
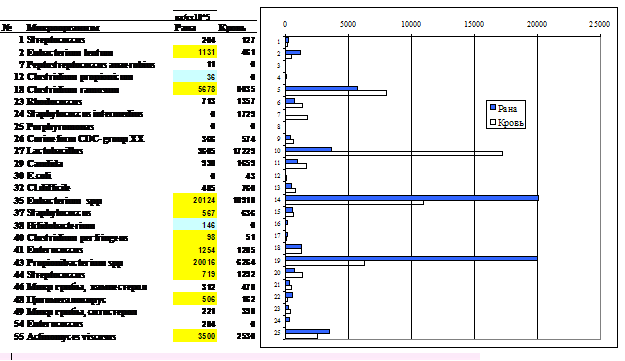
Рис. 5. Сопоставление результатов двойного анализа – раневого экссудата и крови - для больного с инфекцией в области хирургического вмешательства после удаления селезенки. Проба NT-547, больной Х. Микробные маркеры в раневом отделяемом и крови. Ведущими микроорганизмами очага воспаления являются Clostridium ramosum, пропионобактерии (P.freudenreichii), основная группа кишечных эубактерий (E. moniliforme, E.nodatum, E.sabureum) и анаэробный актиномицет Actinomyces viscosus. Им сопутствует группа кокковых бактерий: стафилококки, стрептококки, энтерококки, родококки. Выше нормы концентрация микроскопических грибов кандида, Eubacterium lentum (группа А), клостридий C. perfringens, актинобактерий Streptomyces, Nocardia и других (отмечены выделением).
Как видно из рисунка, ведущими микроорганизмами (около 90% в раневом экссудате) являются анаэробы. Это клостридии C. ramosum и C. perfringens, пропионобактерии P.freudenreichii, эубактерии Eubacterium moniliforme, E.nodatum, E.sabureum, E. lentum и анаэробный актиномицет Actinomyces viscosus. Все они составляют нормальную (индигенную) микробиоту организма человека. Им сопутствует группа кокковых бактерий: стафилококки, стрептококки, энтерококки, которые обычно выявляют при классическом бактериологическом исследовании. Их доля в данном примере около 6%. Выше нормы концентрация микроскопических грибов кандида, актинобактерий Streptomyces, Nocardia, Rhodococcus и других, на долю которых приходится 7% общей инфекции. Минорную группу составляют грамотрицательные микроорганизмы: Moraxella, Pseudomonas aeruginosa, Fusobacterium, Alcaligenes и Helicobacter pylori. Маркеров бактерий сем. Enterobacteriaceae в экссудате не обнаружено (менее 105 клеток/мл).
У больного Д-ва (анализ LF-506с) с септическим менингитом, развившимся в результате черепно-мозговой травмы при падении со скалы в ликворе найдено 23 таксона микроорганизмов, маркеры которых имеют клинические значимое (более чем в два раза) превышение нормы. Обнаружено, что ведущими микроорганизмами воспаления мозга являются клостридии группы C. ramosum, а также C. propionicum и C. hystolyticum. Вычисленная по концентрации их маркеров численность самих микроорганизмов в зоне ликвора составляет 9.108 клеток/мл. На втором уровне микст-инфекции представлены актинобактерии (аэробные актиномицеты) родов Rhodococcus, Pseudonocardia и не идентифицированные, а также стафилококки, эубактерии (род Eubacterium), пропионобактерии, дрожжи кандида и микроскопические грибы. Их уровень концентрации имеет порядок 107. На порядок ниже, но тоже с избыточным ростом обнаруживаются маркеры бактерий сем. Enterobacteriaceae, превотелл, золотистого стафилококка, клостридий перфрингенс, хеликобактера, энтерококков, стрептококков, вирусов и анаэробных актиномицетов Actinomyces viscosus. Не обнаружены (менее 105) анаэробный пептострептококк, синегнойная палочка и бактероиды.
Из экспериментальных данных следует, что измерение микробных маркеров in situ выявляет новую группу микроорганизмов из числа трудно культивируемых, и поэтому, мало известных в клинической практике. Эти участники септического или раневого инфекционного процесса - клостридии, эубактерии, лактобациллы, хеликобактеры, стрептомицеты, родококки - обладают высокой патогенетической активностью. Она известна из специфически связанных с этими организмами нозологий, каждая из которых воспринимается сама по себе как серьезное заболевание, трудно поддающееся лечению. Клостридии групп C. perfringens и C. ramosum (группа RIC – ramosum, inocuum, clostridioforme) – это гангрена, Eubacterium – септический артрит, Lactobacillus – септицемия и эндокардит, H. pylory –язвенная болезнь желудка, языка и атеросклероз; Streptomyces и другие актинобактерии - туберкулез, нокардиозы и актиномикозы.
Воспалительные процессы внутренних половых органов женщин
По данным из научной литературы, воспалительные процессы внутренних половых органов составляют 62,5% в структуре гинекологической заболеваемости, причем у 9,5% женщин диагностируют гнойные воспалительные заболевания маточных труб и яичников.
Отмечается, что инфекционные заболевания редко вызываются одним возбудителем, и также возрастает роль условно-патогенных возбудителей. Смешанные инфекции составляют примерно 20-30% в структуре инфекционных заболеваний матки и придатков, т.е. почти у каждой третьей пациентки выявляется инфекционный процесс, вызванный несколькими возбудителями. Подавляющее большинство воспалительных заболеваний органов малого таза обусловлено собственной условно-патогенной микрофлорой, ведущая роль в развитии которых принадлежит наиболее вирулентным анаэробам, энтеробактериям и коккам [Сидорова, 2007]. В микрофлоре влагалища могут присутствовать гнилостные бактерии родов Bacillus, Proteus, Clostridium, Spirochaeta., Количество анаэробов преобладает над аэробами в 10 раз в микробиоценозе вагины [Wilkins, 1984]. Выглядит перспективным выявление специфических веществ (маркеров) - структурных компонентов микроорганизмов и использование этих данных для реконструкции состава смешанной инфекции с помощью метода ГХ-МС. В настоящем разделе этот метод применен для исследования инфекционной составляющей патологического процесса внутренних половых органов (цервикальный канал, матка, трубы, яичники), приводящего к необходимости оперативного решения проблемы. Целью исследования является выявление и определение в послеоперационном материале численности анаэробов и других, редко культивируемых в клинической микробиологической лаборатории. Исследованы 21 инфицированный биоптат от 10 пациенток перенесших операции по разным поводам. В качестве группы сопоставления использованы данные анализа вагинального содержимого (N=21) больных хроническими вагинитами (кольпит, проблемы беременности). Режим анализа подробно описан ранее [Крымцева, 2003]
Из 54 таксонов микроорганизмов, контролируемых в процессе анализа, 32 показывают избыточный рост (инфекцию). Инфицирование каждого исследованного материала включает несколько (до двенадцати) таксонов микроорганизмов. Это подтверждает тезис литературного обзора о смешанном характере инфекции половых органов женщин. Полученные данные подтверждают также сформировавшееся представление о доминировании анаэробов. Их доля составляет 70-90% по нашим измерениям и соответствует оценке других авторов. В отличие от предыдущих работ наши измерения носят количественный характер, что позволяет выявить микробные доминанты воспалительного процесса на одной и той же пробе инфицированного материала в разных отделах организма, а также сопоставлять результаты измерений разных пациентов. Оказалось, что доминантами у 11 больных из 12 обследованных являются кишечные бактерии вида Propionibacterium freudenreichii, родов Eubacterium, Clostridium и Bifidobacterium. Такой тип инфекции показан на рис 6, где в графическом выражении лучше иллюстрируется количественные изменения относительно нормы и других составляющих микробного сообщества. За неимением возможности оценить уровень колонизации слизистых оболочек полости матки и придатков у здоровых женщин, мы приняли в качестве максимально возможного уровня данные нормы влагалища (Крымцева, 2003)
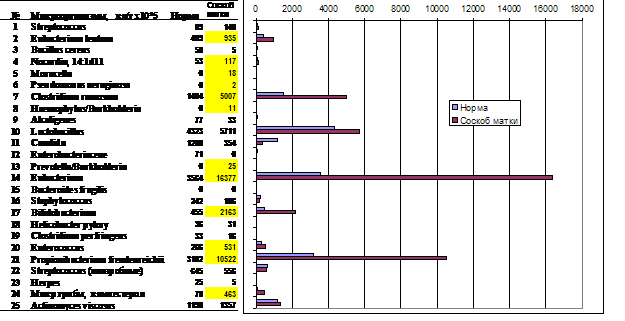
Рис. 6. Избыточный рост микроорганизмов (инфекция) полости матки (проба VF-542, больная А). Доминируют маркеры кишечных микроорганизмов: клостридий группы C. ramosum, основной группы эубактерий (E. moniliforme, E.nodatum, E.sabureum), пропионобактерий (Propionibacterium freudenreichii). Клинически значимый уровень превышают маркеры превотелл, нокардий, энтерококков.
Серия анализов больной Б (серия 512) показывает более чем десятикратное увеличение численности вида P. freudenreichii, родов Eubacterium и Bifidobacterium в матке и придатках по сравнению с уровнем колонизации влагалища в норме. В трубах и ткани яичников уровень колонизации бифидобактериями, эубактериями и пропионобактериями достигает 3-6 х 109 клеток/мл. При этом в эндометрии и ткани матки избыточного роста этих бактерий не наблюдается. В этом можно усматривать специфику инфицирования верхних половых органов, так как при вагинитах в слизистой влагалища их рост хотя и происходит, но не в такой степени (рис. 3). Для вагины более характерна инфекция Clostridium perfringens. При воспалениях, напоминающих по клиническим проявлениям кандидоз, их численность до 30 крат превышают уровень колонизации слизистой оболочки в норме. В исследованных пробах верхних отделов клинически значимых превышений маркера C. perfringens (10-гидрокси-стеариновая кислота) не обнаружено (рис. 4). Здесь регулярно участвует в воспалительном процессе другая группа клостридий – C. ramosum. Их численность до семи раз превышает норму в исследованных материалах (табл. 1). Из трудно культивируемых микроорганизмов, которые позволяет выявить масс-спектрометрический метод, следует отметить еще анаэробы Actinomyces viscosus, численность которых в ряде проб до пяти раз выше нормальной. В отдельных случаях в состав микст-инфекции включены аэробные (оральные) и анаэробные стрептококки S. mutans.
Выявляемые в клинических лабораториях при рутинных анализах микроорганизмы в рейтинговом положении оказываются во втором ранге смешанной инфекции верхних половых органов. Максимального уровня в этой группе достигает энтерококк – 108 клеток/мл. Тогда как перечисленные выше доминирующие анаэробы занимают порядки 108-1011. Грамотрицательные микроорганизмы Moraxella/Acinetobacter, P. aeruginosa, Haemophylus/Burkholderia, Prevotella, B. fragilis, H. pylori обнаруживаются в исследованных пробах в количестве 105-107 клеток/мл. Представители сем. Enterobacteriaceae присутствуют, но не выходят за пределы уровня колонизации вагины в норме.
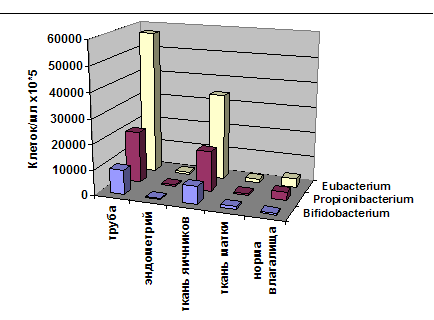
Рис. 7. Доминанты инфекции в ткани матки и придатков у больной Б., (серия анализов 512). В трубах и ткани яичников уровень колонизации бифидобактериями, эубактериями и пропионобактериями достигает 3-6 х 109 клеток\мл.
Таким образом, применение метода масс-спектрометрии микробных маркеров позволило дополнить картину инфицирования верхних половых органов женщин таксонами, которые оказались доминирующими в микробном сообществе, а также расширить список участников инфекционного процесса. Ими оказались, как и предполагалось другими исследователями, представители кишечной микробиоты. Кроме того, в отличие от предыдущих исследований, мы дали их количественную оценку, показав рейтинговый ряд агентов инфекции и подтвердив доминирование анаэробов родов Propionibacterium, Eubacterium, Clostridium и Bifidobacterium. Результаты этого анализа, на наш взгляд перспективны для выявления и консервативного лечения подобного рода заболеваний на ранних стадиях, а также уточнения механизма возникновения патологических изменений матки и придатков, приводящих к необходимости оперативного вмешательства. Обнаружение в послеоперационном материале огромного количества слизеобразующих кишечных микробов дает основание предположить, что они могут вызывать нарушение нормальных физиологических процессов в половых органах не только за счет своих факторов патогенности (инвазия, эрозия, токсигенность и прочее), а также за счет физического перекрывания протоков и капилляров биомассой в мукозе.
Литература