Источником микробных фрагментов - маркеров, в данном случае продуктов распада липидов микробного клеточного материала, является фагоцитоз и естественный лизис микробных клеток, локализованных в тканях зоны ликвора.
Кроме фагоцитоза, клетки микроорганизмов разрушаются под действием других механизмов, в том числе собственного автолиза отживших клеток и лизиса ферментами. В любом случае разрушение происходит в конечном счете до мономерных составляющих биополимеров. Исходя из основ физиологии обмена биологических жидкостей человека, обмен 70% жидкости вместе с мономерами (жирными кислотами) и интерстиционным пространством происходит за 1 мин. Поэтому малые фрагменты микробных биополимеров, образующиеся в этом пространстве, поступают в ликвор практически сразу.
Если учесть, что большая часть фагоцитирующих клеток находится в межклеточном пространстве и свободно проходит соединительные ткани, то можно полагать, что независимо от очага воспаления микробные маркеры постоянно и быстро поступают в ликвор. По той же причине следует ожидать поступление маркеров в кровяное русло, давая возможность диагностики инфекции и/или по крови.
Отсюда следует, что бактерии, маркеры которых определяются в ликворе или крови, не обязательно в них присутствуют, - малые молекулы могут поступать в бологическую жидкость из мест естественного размножения, то есть из воспалительных очагов любой локализации.
Кажущаяся высокая концентрация малых молекул в ликворе (как и в крови) создается, по-видимому, вследствие их накопления в макрофагах (нейтрофилах). В частности, известно, что нейтрофилы являются естественными аккумуляторами маркеров микроорганизмов, так как каждый из них может одновременно переваривать сотни бактерий в течение короткого времени жизни, которое составляет от 6-8 часов нахождения в крови или до двух суток в интерстиционном пространстве и на слизистых.
Подготовка пробы
Из 0,5 мл пробы ликвора экстрагировали липиды в однофазной смеси растворителей вода-метанол-хлороформ в соотношении 1:2,5:0,8 в течение часа, после чего добавляли воду и хлороформ до образования бифазной системы. Хлороформную фазу, содержащую липиды отбирали в отдельный сосуд, упаривали досуха, а остаток высушивали и подвергали кислому метанолизу (КМ) в 0.4 мл 1М HCl в метаноле в течение одного часа при 80°С. На этой стадии происходит освобождение жирных кислот и альдегидов из сложных липидов микроорганизмов и других клеток жидкости. В результате получали жирные кислоты в виде метиловых эфиров (МЭЖК), а альдегиды в виде диметилацеталей (ДМА). Эти компоненты двукратно экстрагировали 200мкл гексана, высушивали и обрабатывали 20 мкл N,О-бис(триметил-силил)-трифторацетамида в течение 15 мин при 80°С для получения триметилсилильных эфиров окси-кислот,спиртов и стеринов.
Пробу цельной крови в количестве 50 мкл высушивали с добавлением 100 мкл метанола и подвергали кислому метанолизу. Дальнейшую подготовку проводили так же, как в случае ликвора.
Аппаратура. Реакционную смесь эфиров в количестве 1-2мкл вводили в инжектор ГХ-МС системы НР-5985В, НР-5973 Хьюлетт-Паккард (США), или QP-2000 фирмы Шимадзу (Япония). Для управления и обработки данных использовали штатные программы приборов. Хроматографическое разделение пробы осуществляли на капиллярной колонке с метилсиликоновой привитой фазой Ультра-1 Хьюлетт-Паккард длиной 25 м и внутренним диаметром 0.2 мм. Режим анализа 120°С - 2 мин, далее програмирование температуры 5град/мин до 300-320град. Для выборочного детектирования целевых маркеров микроорганизмов в режиме высокой чувствительности и на превалирующем фоне биологической жидкости использовали метод селективных ионов ( масс-фрагментографии, МФ) при периодическом сканировании до восьми ионов в пяти интервалах времени.
Дейтерированый по метильной группе метил-тридеканоат использовали в качестве внутреннего стандарта.
С учетом особенностей химического состава жирных кислот клинически значимых микроорганизмов составлена программа анализа, включающая анализ химического состава пробы на хромато-масс-спектрометре с последующим расчетом состава микробного сообщества с помощью электронных таблиц Microsoft Excel на персональном компьютере по специальной программе. В нашей работе в настоящее время используются заложенные в банке данных компьютера сведения по 500 видам микроорганизмов общим числом до 800 штаммов. Их маркеры мониторируются автоматически в каждом анализе. Практически обнаруживаются в отдельных пробах до 30-40 видов микроорганизмов, возможных компонентов грибково-бактериального менингита.
Основное время анализа приходится на подготовку проб (примерно 3 часа), ГХ-МС анализ - 1час, вычислительные операции и составление заключения - 1час. Анализ серии из 15 проб занимает 15часов.
Публикации:
1. Осипов Г.А. // Способ определения родового (видового) состава ассоциации
микроорганизмов. //Патент РФ № 2086642. С12N 1/00, 1/20, C12Q 1 /4. Приоритет
от 24 дек.1993г.
2. Осипов Г.А, Белобородова Н.В. Способ выявления возбудителя инфекционного
процесса в стерильных биологических средах макроорганизма. Патент РФ по заявке
№97117426/14(018498). Приоритет от 21.10.97г.
3. Осипов Г.А., Демина А.М. Хромато-масс-спектрометрическое обнаружение
микроорганизмов в анаэробных инфекционных процессах. Вестник РАМН. -1996, Т.13,-№2,-
С.52-59.
4. Осипов Г.А. Шабанова Е.А. Бабайцева В.А. Недорезова Т.П. Ходорковская В.А.
Истратов В.Г., Сергеева Т.И. Чирикова Е.В. // Способ диагностики клостридиальной
анаэробной газовой инфекции.// Патент РФ №2021608 кл.G01N 33/50.- Зарегистрировано
в гос.реестре 15.10.94.- Бюл.№19
5. Белобородова Н.В. Осипов Г.А. Гомеостаз малых молекул микробного происхождения
и его роль во взаимоотношениях микроорганизмов с организмом хозяина. Вестник РАМН.
-1999, Т.16,-№7,- С.25-31.
Пример 1.
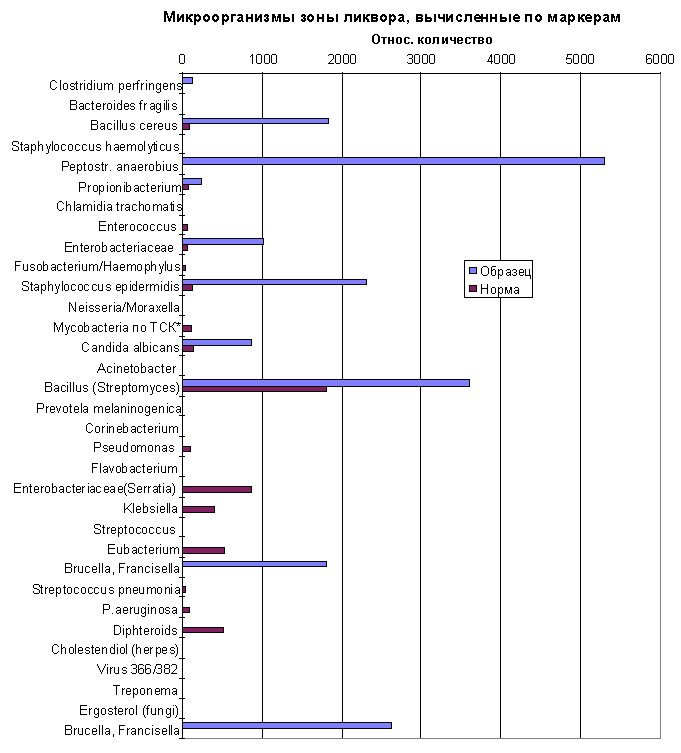
Результаты исследования видового состава микрофлоры зоны ликвора методом газовой хроматографии - масс-спектрометрии.
Проба LT-064. Больной M.A.
Грибковый менингит.
|
No. |
Род, вид |
Содержание в пробе* |
Норма* |
|
1 |
Clostridium perfringens |
123 |
10 |
|
2 |
Bacteroides fragilis |
0 |
2 |
|
3 |
Bacillus cereus |
1838 |
83 |
|
4 |
Staphylococcus haemolyticus |
0 |
13 |
|
5 |
Peptostreptococcus anaerobius |
5289 |
19 |
|
6 |
Propionibacterium |
243 |
71 |
|
7 |
Chlamidia trachomatis |
0 |
1 |
|
8 |
Enterococcus |
0 |
50 |
|
9 |
Enterobacteriaceae |
1011 |
56 |
|
10 |
Fusobacterium/Haemophylus |
0 |
21 |
|
11 |
Staphylococcus epidermidis |
2296 |
125 |
|
12 |
Neisseria/Moraxella |
0 |
0 |
|
13 |
Mycobacteria (по ТСК) |
0 |
114 |
|
14 |
Candida albicans |
860 |
136 |
|
15 |
Acinetobacter |
0 |
8 |
|
16 |
Bacillus (Streptomyces) |
3599 |
1800 |
|
17 |
Prevotela melaninogenica |
0 |
0 |
|
18 |
Corinebacterium |
0 |
0 |
|
19 |
Pseudomonas |
0 |
96 |
|
20 |
Flavobacterium |
0 |
0 |
|
21 |
Enterobacteriaceae (Serratia) |
0 |
863 |
|
22 |
Klebsiella |
0 |
397 |
|
23 |
Streptococcus |
0 |
0 |
|
24 |
Eubacterium |
0 |
526 |
|
25 |
Brucella, Francisella |
1801 |
0 |
|
26 |
Streptococcus pneumonia |
0 |
27 |
|
27 |
P.aeruginosa |
0 |
84 |
|
28 |
Diphteroids |
0 |
512 |
|
29 |
Cholestendiol (герпес) |
0,0 |
0 |
|
30 |
Virus 366/382 |
7 |
0,3 |
|
31 |
Treponema |
0 |
0,21 |
|
32 |
Ergosterol (грибы) |
0 |
0 |
|
33 |
Brucella, Francisella |
2630 |
0 |
*- расчетные относительные единицы, пропорциональные числу клеток
**- в качестве нормы взят статистический уровень содержания микробных
маркеров в крови доноров
Те же данные в виде диаграммы

Содержание маркера Candida albicans (17:1, гептадеценовая кислота) существенно превышает нормальный уровень. Так же как маркеры Clostridium perfringens (10h18, 10-гидроксистеариновая кислота), представителей семейства Enterobacteriaceae (цикло-гептадекановая кислота), Peptostreptococcus anaerobius (превалирует в пробе). Норму превышают также маркеры Staphylococcus epidermidis и Bacillus.
Обнаружены метаболиты холестерола (поз.30), которые могут быть отнесены к вирусной инфекции.
Неожиданным является обнаружение двойного маркера Francisella (Brucella) - гидрокси-гексадекановой и гидрокси-октадекановой кислот. Их следует отнести к Francisella filomiragia, так как в ряде случаев этот организм фигурирует в литературе в качестве агента воспаления при менингите. F.filomiragia был обнаружен, например сотрудниками CDC (Центр по контролю заболеваний, Атланта, США) в сппинномозговой жидкости и подтвержден профилем жирных кислот (D.G.Hollis, ..., C.W.Moss, et al., J.Clin.Microbiol. 27(7), 1601-08, 1989).