РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТАЛЬНЫХ ИССЛЕДОВАНИЙ
Влияние низкоэнергетического лазерного излучения в красном и инфракрасном диапазоне на генетический аппарат соматических тканей.
(Изучалось совместно с НИИ молекулярной генетики РАН)
Объектом исследования явились гетерозиготные личинки плодовой мушки Drosophila, на которые воздействовали низкоинтенсивным светом лазера в красном и инфракрасном диапазонах 0,628 мкм и 0,8 мкм с плотностью потока мощности 100 мВт/см2 с экспозицией 3 и 30 минут. Исследовали частоту мутаций в соматических тканях с применением тест-системы для ускоренного определения
канцерогенов (Белицкий Г.А. и соавт., 1982). Проведено 2 серии опытов, в которых решались следующие задачи: определение возможной мутагенной активности лазерного света при действии его на личинки Dr. melanogaster и определение возможного протекторного эффекта при действии его на личинки Dr. simulans – линии с собственной (спонтанной) высокой частотой мутагенеза, сравнимой с действием радиации порядка 900 Рентген.

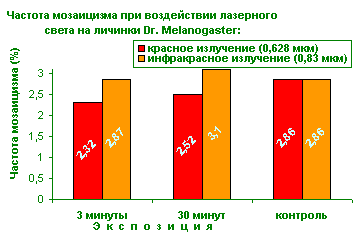
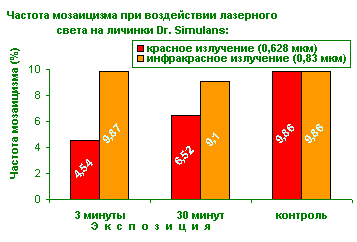
В первой серии опытов, проведенные исследования не выявили достоверного различия (95%>Р>70%) частоты мутаций облученных личинок по отношению к контрольной группе.
Более того, при воздействии излучением красной области спектра с экспозицией 3 минуты появилась тенденция к снижению частоты мутаций по сравнению с остальными группами, а при воздействии инфракрасным светом с экспозицией 30 минут - достоверное увеличение.
Во второй серии опытов при облучении красным светом лазера отмечено статистически достоверное снижение частоты мутаций (различие более 95%) более выраженное при облучении с экспозицией 3 минуты. Свет инфракрасного лазера не оказывает влияния на спонтанный метагенез.
Таким образом, все изученные параметры МКС лазера не обладали мутагенной активностью и генетически — безопасны, длительное облучение в инфракрасной области являлось фактором риска и его применение в клинике не желательно. Излучение в красном диапазоне спектра (0.623 нм.) снижало частоту спонтанного мутагенеза, что свидетельствовало о достаточно высоком протекторном эффекте МКС, более выраженном при коротких экспозициях - 3 минуты, и являлось наиболее оптимальным для применения в клинической практике.
Влияние лазерного света на показатели иммунитета
(изучено совместно с лабораторией иммунологии ЦИТО)
Исследовано влияние высокой плотности мощности гелий-неонового лазера (240 мВт/см2) со временем облучения 30 минут. Изучали иммунологические особенности выделенных из крови лейкоцитов и отдельно фракции лимфоцитов (in vitro). Облучение в указанном режиме всей популяции лейкоцитов не лишало лимфоциты способности продуцировать в присутствии антигена фактор, снижающий прилипание клеток - реакции подавления прилипания лейкоцитов (РППЛ). Обнаруженное ранее В.И. Говало (1977) блокирующее действие сыворотки на реакции клеточного иммунитета, характерное для онкологических больных, сохранялось, независимо от облучения клеток до постановки РППЛ. Лазерное облучение не оказывало существенного влияния на рецепторный аппарат лейкоцитов и лимфоцитов, не меняло их функциональной активности и общего числа, что свидетельствовало о безопасности применения предельных доз лазерного света на рецепторный аппарат иммунокомпетентных клеток.
Влияние различных режимов лазерного света на дистрофические изменения в скелетной мышце.
Объектом исследования служили морские свинки после ампутации задней конечности на уровне нижней трети голени, материалом — передняя большеберцовая мышца оперированной и интактной конечности. К воздействию лазерным излучением приступали через 1 месяц после произведенной ампутации, когда деструктивные изменения в мышечной ткани достигали максимальной выраженности. Они во многом были сходны с изменениями в ишемизированых тканях, для которых характерно накопление большого количества токсичных кислых продуктов анаэробного гликолиза и продуктов перекисного окисления липидов, снижения макроэргов (Субурова Л.М.,1974,1975). В процессе исследования сформированы три группы подопытных животных (по 10 штук) со своим контролем необлученных, оперированных интактных животных в каждой из них (по 5 наблюдений). В каждой группе подопытных животных на область передней большеберцовой мышцы применяли лазерное излучение с различной плотностью потока мощности: от слабого - 2 мВт/см2, среднего - 100мВт/см2 до высокого - 600 мВт/см2. Экспозиция и методика воздействия во всех группах была единой: 1,3,5,15 и 30-минутное лазерное облучение. Сеансы проводились ежедневно в течение 15 суток. По окончании последнего сеанса передняя большеберцовая мышца подопытных животных и контроля подвергалась исследованию.
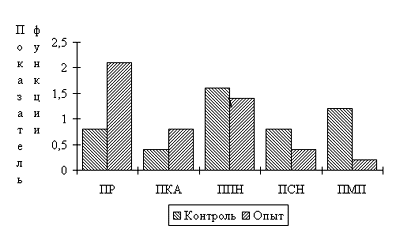
Для оценки состояния мышечной ткани применялись морфометрические методы исследования: многофакторный оптико-поляризационный анализ структурно-функционального состояния мышечной ткани по методике Е.Ф. Ураткова (1988) и морфометрическое исследование ультраструктурных органоидов по методу А.С. Ягубова и В.В. Каца (1974) с помощью наложения на электронограммы сетки Глаголева. Для интегральной оценки состояния функциональной единицы мышечной ткани использован показатель повреждения миона (ППМ), определяемый как отношение средней величины количественных характеристик структурных признаков (пиловидная контрактурная складчатость; мятая атоничная складчатость; дезинтеграция мионов; подсарколемная фрагментация мионов; полная фрагментация мионов; анизотропия мионов; миоцитолиз; внутриклеточный отек) к средней величине функциональных признаков состояния мионов (лентовидные и прямые мионы; перерастянутые мионы; образующие розетку узлы сокращения; бюхнеровские полосы сокращения; гармоничная контрактурная складчатость; переходная контрактурная складчатость), а также другие показатели, характеризующие различные стадии парабиоза (Уратков Е.Ф.,1989). В их числе:
1. Показатель рефрактерности мионов (ПР), определяющий степень невосприимчивости мионов к раздражителю (признаки 1,2), соответствующий начальной фазе парабиоза.
2. Показатель контрактурной активности (ПКА), характеризующий степень готовности мионов к контрактурным (пародоксальным, экзальтационным) реакциям (признаки 3,4,5), соответствующий переходной фазе парабиоза.
3.Показатель паранекроза мионов (ППН), характеризующий 1-ю электронегативную фазу парабиоза, когда мионы сохраняют обратимость только в определенных условиях (признаки 6,7,8).
4.Показатель структурной нестабильности и некроза мионов (ПСН), отражающий изменения, характерные для 2-й электронегативной фазы парабиоза, когда мионы теряют способность к сохранению структурной определенности (признаки 9-13).
5.Показатель мембранной проницаемости мионов (ПМП), характеризующий степень накопления отечной жидкости внутри мионов (признак 14).
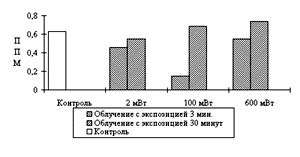
Анализ результатов показал, что независимо от плотности мощности излучения максимальный положительный эффект достигался при экспозиции 3 минуты.

При экспозиции 3 минуты и ПМ 2 мВт/см2. наблюдалось медленное снижение ППМ к 15 сеансу облучения до 17% от контроля. При ПМ 600 мВт/см2 происходило снижение ППМ после 3-7 сеансов на 70% с последующим его возрастанием к 15 сеансу до17% от контроля. При ПМ излучения 100 мВт/см2. после первого сеанса облучения наблюдалось снижение ППМ на 20%, затем к 3-7 сеансу небольшое возрастание и резкое снижение до 40% к 15 сеансу.
Таким образом, применение излучения с плотностью мощности 2мВт/см2 являлось недостаточно эффективным для воздействия на дегенеративные процессы. Неприемлемы также были большие уровни интенсивности лазерного излучения порядка 600 мВт/см2. Наиболее благоприятный эффект получили при мощности потока 100 мВт/см2 . В этом случае наблюдалось плавное положительное воздействие, достигающее своего максимума к концу курса стимуляции (рис.6). Изучение морфологических изменений эквивалентов функции мионов, соответствующих различным фазам парабиоза после воздействия оптимальных доз лазерного света на дегенеративно измененную мышцу показаны на рисунке 7. Как следует из представленных на рисунке данных, МКС лазера увеличивал число волокон, находящихся в начальной и переходной фазах парабиоза. Это позволяло считать указанное воздействие антипарабиотическим фактором.
Положительный эффект лазеротерапии был обусловлен снижением показателей мембранной нестабильности и паранекроза мионов и имел циркуляторно-метаболическую направленность. Реализация терапевтического эффекта осуществлялась за счет антиоксидантного действия, восстановления функции клеточных мембран и способности создавать благоприятные условия для выведения очага альтерации из экзальтационной фазы парабиоза, т.е. лазеротерапия обладала антипарабиотическим действием.
Помимо морфометрического метода использовали электронную микроскопию. Изучали воздействие оптимальных параметров лазерного излучения на капилляры мышечной ткани. Обнаружено увеличение количества пиноцитозных везикул капилляров на наружной клеточной мембране, что свидетельствовало об улучшении обмена веществ — переносе кислорода. При морфометрической обработке электроннограмм мышечной ткани отмечено увеличение объема митохондрий, ответственных за энергетические процессы.
Следовательно, механизм реализации механического и терапевтического эффектов лазерного излучения можно объяснить с позиции учения о парабиозе Н.Е. Введенского (1901 г.), который рассматривал парабиоз “как реакцию живой материи, реакцию более общую, чем возбуждение в обычном смысле..., реакцию, которая вызывается обычными раздражителями при известной силе и продолжительности их действия”.
Влияние различных режимов МКС на течение раневых процессов мягких тканей.
Оптимальные параметры лазерного воздействия были уточнены в последующих сериях опытов на морских свинках. Было изучено влияние различных режимов МКС на течение раневого процесса: при трофических язвах, при длительно незаживающих и гнойных ранах (60 животных). Для оценки тяжести течения раневого процесса применены методики ранговой оценки: вид и интенсивность раневого отделяемого, характер грануляционной ткани и краевой эпителизации по Г.А. Афиногенову (1976) , метод микроскопии раневых отпечатков с целью определения интенсивности и завершенности фагоцитоза.
Рисунок №8.
Течение раневого процесса (в рангах) под влиянием курсового воздействия лазерным излучением при постоянной плотности потока мощности (100мВт/см2) и разной экспозицией процедур (1-30 мин).
|
А. Группа животных (N=20) с гнойными ранами конечности |
||||||||||||||||||||||||||
|
Контроль |
1 минута |
3 минуты |
5 минут |
15 минут |
30 минут |
|||||||||||||||||||||
|
7.5 |
6.4 |
5.3 |
2 |
4.5 |
4 |
|||||||||||||||||||||
|
Б. Группа животных (N=20) с длительно незаживающими ранами конечности |
||||||||||||||||||||||||||
|
Контроль |
1 минута |
3 минуты |
5 минут |
15 минут |
30 минут |
|||||||||||||||||||||
|
5 |
1 |
0.5 |
2 |
4.5 |
4 |
|||||||||||||||||||||
|
В. Группа животных (N=20) с трофическими язвами конечности |
||||||||||||||||||||||||||
|
Контроль |
1 минута |
3 минуты |
5 минут |
15 минут |
30 минут |
|||||||||||||||||||||
|
3.5 |
1.5 |
0.7 |
2.5 |
4 |
4 |
|||||||||||||||||||||
В серии опытов с различной давностью раневого процесса выявлена зависимость положительного действия МКС лазера от экспозиционной дозы: отсутствие или слабо выраженный эффект - максимум эффекта - отсутствие или отрицательный результат при дальнейшем увеличении экспозиции. Максимальный эффект достигнут при экспозиции 3-5 минут во всех группах животных. При этом наряду с нормализацией течения раневого процесса отмечено максимальное снижение микробной обсемененности и повышение фагоцитарной активности макрофагов (рис.8).
Влияние МКС лазера на репаративный остеогенез трубчатой кости.
Целью данного эксперимента было подтверждение стимулирующего эффекта на процесс костеобразования режимов лазерного излучения, установленных в опытах с мышечной тканью. Исследование выполнено на 18 кроликах, у которых в средней трети малоберцовой кости оперативным путем моделировался костный дефект 8-10 мм. Сроки наблюдения составили 4,8,16 недель после операции. К лазеротерапии приступали сразу же после заживления операционной раны, используя гелий-неоновый лазер с плотностью потока мощности излучения равной 100 мвт/см. Стимуляцию остеорепарации проводили ежедневно по 3 минуты на протяжении 10 дней. Динамику репаративных процессов оценивали с помощью клинических, рентгенологических и морфологических методов. Контролем для сравнения являлся костный дефект, расположенный на контралатеральной конечности, который не подвергался лазерному воздействию. Исследования показали, что в серии наблюдений с использованием лазеростимуляции наблюдалась активизация регенерации костной ткани в виде ускоренной пролиферации остеобластов при одновременном усилении клеточной дифференцировки. Созревание и перестройка опытного регенерата опережали данный процесс в контрольных наблюдениях. Свидетельством ускорения процесса перестройки мозоли по сравнению с контрольными наблюдениями служило присутствие в регенерате большого количества остеобластов, отчетливые признаки трансформации регенерата в пластинчатую кость, практически полное восстановление к концу эксперимента органной структуры кости: появление кортикальной пластинки, и восстановление костномозгового канала.
Таким образом, в результате проведенных экспериментальных исследований установлено, что биологический эффект низкоэнергетического излучения лазера находился в зависимости от длины волны применяемого излучения, экспозиции, плотности мощности и количества сеансов. Оптимальным являлось излучение МКС лазера с плотностью мощности - 100 мВт/см2, экспозицией 3-5 минут, оптимальным числом сеансов при курсовом воздействии - 10-15, проводимых ежедневно. Исследованные режимы облучения не только не оказывали отрицательного влияния на показатели иммунитета и генетический аппарат соматических клеток, но и обладали протекторным действием, нормализующим функциональные и морфологические изменения в патологически измененной мышечной и костной ткани, нормализовало репаративные процессы. На примере проведенного эксперимента отчетливо проявилась специфичность биологического действия МКС лазера, механизм реализации которого может быть объяснен с позиции учения о парабиозе Н.Е. Введенского (1901г.), как действие антипарабиотического фактора.