Роль про- и противовоспалительных цитокинов в иммунной адаптации новорожденных детей.
Н.Н. Володин, М.В. Дегтярева, А.С. Симбирцев, А.Ю. Котов, Л.В. Ковальчук, Л.В. Ганковская, В.В. Долгов, А.А. Липагина, Г.А. Асмолова, К.К. Бахтикян, Е.М. Карачунская, И.Г. Солдатова, О.В. Полякова.
Государственный медицинский университет, Москва, Россия.
Медицинская Академия последипломного образования, Москва, Россия.
Государственный НИИ особо чистых биопрепаратов, Санкт-Петербург, Россия.
По материалам International Journal on Immunorehabilitation, April 2000, Vol 2, N1, pp. 175-185.
Первая неделя жизни ребенка представляет собой период радикальной функциональной, а в ряде случаев и анатомической, перестройки всех органов и систем. Результатом происходящих изменений является адаптация организма новорожденного малыша к внеутробной жизни и самостоятельное поддержание постоянства внутренней среды без помощи организма матери. Роль иммунной системы в ранней постнатальной адаптации чрезвычайно важна. В процессе перехода из стерильных условий внутриутробного развития в условия повышенной антигенной нагрузки неизбежно изменяется состояние различных звеньев иммунной системы. В результате одновременно происходят разнонаправленные процессы: постепенное становление адекватного иммунного ответа, формирование иммунологической памяти и поддержание иммунологической толерантности, сдерживание возможного развития гиперергических реакций и воспаления. Установление оптимального баланса этих процессов позволяет малышу расти здоровым.
В последние годы на фоне обострения экологических проблем, ухудшения состояния здоровья женщин детородного возраста отмечается увеличение частоты преждевременных родов, уровня заболеваемости и последующей инвалидизации детей различного гестационного возраста. Имеет место увеличение частоты инфекционной патологии, а также состояний, связанных с воздействием анте- и интранатальной гипоксии. Уровень летальности при раннем неонатальном сепсисе продолжает оставаться высоким (до 30%), несмотря на прогресс в развитии антибактериальной терапии. По-видимому, наряду с установлением инфекционного контроля в неонатальных центрах, рациональным использованием новейших антибиотиков, усовершенствованием технологии выхаживания детей целесообразно изучить закономерности функционирования иммунной системы в периоде новорожденности, выявить уязвимые звенья, нарушение которых приводит к развитию заболеваний, установить показания и способы проведения иммунокоррекции.
В современной литературе большое количество работ посвящено исследованию роли моноцитарно-макрофагального звена в регуляции иммунного ответа новорожденных детей [1, 3, 7, 8]. Местное и системное повышение концентраций провоспалительных цитокинов (интерлейкина-1b (IL-1b), интерлейкина-8 (IL-8), фактора некроза опухоли-a (TNF-a), интерлейкина-6 (IL-6), гранулоцитарно-макрофагального и гранулоцитарного колониестимулирующих факторов (GM-CSF и G-CSF, соответственно)), возникает в процессе распознавания и представления антигенов макрофагами и является необходимым для активации, пролиферации и дифференцировки лимфоцитов, изменения функционального состояния нейтрофилов [4, 19]. Высокие уровни провоспалительных цитокинов вызывают развитие системной воспалительной реакции [7]. Установлено, что фетальные моноциты и макрофаги обладают способностью к секреции провоспалительных цитокинов уже в конце первого триместра беременности [11, 12]. В суспензии клеток цельной пуповинной крови уровни индуцированной липополисахаридом (ЛПС) продукции TNF-a , IL-8, IL-6 сопоставимы с таковыми в периферической крови взрослых [16]. Будучи сформированной уже на ранних стадиях онтогенеза, способность моноцитов к продукции провоспалительных цитокинов в физиологических условиях не зависит от гестационного возраста [14].
Напротив, функциональное состояние лимфоцитов новорожденных и продукция ими противовоспалительных цитокинов (интерлейкина-4 (IL-4), интерлейкина-10 (IL-10), трансформирующего фактора роста-b 1 (TGF-b 1)) зависят от степени зрелости и гестационного возраста ребенка. Так, у недоношенных детей снижены сывороточные концентрации IL-10 [16], а также уровни пролиферации Т-лимфоцитов и цитотоксичности естественных киллерных клеток [14], стимулированной фитогемагглютинином (ФГА) продукции ИЛ-4 [17]. Степень снижения данных показателей прямо пропорциональна гестационному возрасту.
В целом ряде работ была доказана взаимосвязь материнской инфекции, особенностей течения родов, возникновения ишемии-реперфузии в различных органах и тканях и цитокинового статуса новорожденных детей [9, 10, 13, 14, 15, 18].
Изучение особенностей баланса про- и противовоспалительных цитокинов при физиологическом и осложненном течении раннего периода постнатальной адаптации представляется нам задачей крайне актуальной. Влияние цитокинов на клиническую картину и течение заболеваний у новорожденных детей осуществляется через воздействие на иммунную, центральную нервную, эндокринную и сердечно-сосудистую системы, функцию печени, гемопоэз и т.д. Большой практический интерес представляет анализ взаимосвязи гипоксии, гестационного возраста, внутриутробной и постнатальной инфекции и сывороточных уровней цитокинов как показателей, доступных для мониторинга в клинических условиях.
Цель данной работы - исследовать уровни про- и противовоспалительных цитокинов в циркуляции новорожденных детей при физиологическом и осложненном течении раннего периода адаптации, оценить их диагностическое и прогностическое значение в патологии неонатального периода.
Материалы и методы. Нами было обследовано 94 здоровых доношенных ребенка в возрасте 1-7 суток жизни в условиях физиологического детского отделения родильного дома (1 группа) и 78 новорожденных детей различного гестационного возраста с внутриутробными инфекциями, синдромом дыхательных расстройств и/или гипоксическим поражением центральной нервной системы различной степени тяжести в условиях отделения реанимации новорожденных (2 группа).
В 1-ой группе гестационный возраст (ГВ) составлял 38-41 нед., масса тела при рождении 2690-4950 г, длина - от 47 до 58 см. Мальчиков было 41, девочек - 53. 68 детей (72,3%) родились от матерей с отягощенным акушерско-гинекологическим и соматическим анамнезом. Неблагоприятное течение данной беременности и осложнения в родах отмечались у 53 женщин (56,4%). Средняя оценка по шкале Апгар составила на 1-ой минуте жизни 6,8±0,2 балла, на 5-ой минуте жизни - 8±0,1 балла.
Несмотря на нормализацию оценки по Апгар к 5-ой минуте жизни, на 1-е сутки жизни состояние было расценено как удовлетворительное у 72 детей (76,6%), среднетяжелое - у 22 детей (23,4%). Тяжесть состояния была обусловлена транзиторным нарушением гемоликвородинамики в виде синдрома повышенной нервно-рефлекторной возбудимости гипоксического генеза у 15 детей, а также внутриутробной гипотрофией 1 степени и морфофункциональной незрелостью - у 7 детей. Всем детям с отклонениями в неврологическом статусе и другими транзиторными состояниями в раннем периоде адаптации создавался охранительный режим, проводилась гемостатическая терапия, витаминотерапия, по показаниям - седативная терапия.
Таким образом, из всех наблюдавшихся детей у 72 новорожденных отмечали физиологическое течение раннего периода адаптации. Они не имели ни соматических, ни неврологических нарушений и были выписаны домой в удовлетворительном состоянии на 4-5 сутки жизни. Из 22 новорожденных, имевших отклонения в раннем периоде адаптации, у всех на фоне проводимой терапии отмечалось улучшение состояния, устранение неврологических нарушений в течение первых 5-8 дней жизни. Все они были выписаны домой в удовлетворительном состоянии в возрасте 5-10 суток жизни.
Из 78 детей 2-ой группы 26 были доношенными, а 52 ребенка родились с гестационным возрастом 27-36 недель. Все дети 2-ой группы родились от беременностей высокого риска (угроза прерывания, токсикоз в 1 триместре, анемия, гестоз, эпизоды острых инфекционных болезней и обострение хронических воспалительных заболеваний). В 28 случаях (35,9%) встречались такие осложнения как длительный безводный промежуток, быстрые и стремительные роды, первичная слабость родовой деятельности, потребовавшая медикаментозной стимуляции, тазовое и ягодичное предлежание, 2-кратное тугое обвитие пуповины вокруг шеи плода. Роды были самостоятельными в 51 случае (65,4%), оперативными - кесарево сечение по поводу тяжелого гестоза, преэклампсии, слабости родовой деятельности, при тазовом и ягодичном предлежании плода, предлежании плаценты - в 27 случаях (34,6%).
Средняя оценка по шкале Апгар на 1-ой минуте жизни составляла 5,4±0,5 балла, на 5-ой минуте жизни - 6,7±0,3 балла.
На 1-е сутки жизни состояние всех детей было расценено как тяжелое за счет нарастания дыхательной недостаточности на фоне синдрома дыхательных расстройств и неврологической симптоматики вследствие перинатального поражения центральной нервной системы гипоксического генеза. У 58 детей 2-ой группы (из них 19 доношенных) в первые 72 часа жизни отмечалось развитие симптомов инфекционного токсикоза, манифестация одного или нескольких очагов инфекции (пневмонии, омфалита, менингита, гепатита, энтероколита и других), по поводу чего им была назначена антибактериальная терапия. На основании данных анамнеза, клинической картины и лабораторных исследований им был поставлен диагноз внутриутробной инфекции. Всем детям 2-ой группы проводилась комплексная интенсивная терапия, из них 48 детей нуждались в проведении искусственной вентиляции легких (ИВЛ). По тяжести состояния все дети 2-ой группы были переведены в отделение реанимации новорожденных на 1 сутки жизни.
На фоне проводимой терапии состояние 68 детей стабилизировалось, и они были переведены в отделение патологии новорожденных на 5-20 сутки жизни для дальнейшего лечения, а впоследствии выписаны домой.
У 10 детей, несмотря на проводимую комплексную инфузионную, посиндромную, антибактериальную терапию, отмечалось ухудшение состояния, нарастание инфекционного токсикоза, полиорганной недостаточности, что привело к развитию септического шока и летальному исходу в возрасте 2-12 суток жизни.
Осуществлялся тщательный сбор соматического и акушерско-гинекологического анамнеза матерей, оценка факторов риска развития осложнений в раннем периоде адаптации, клиническое наблюдение и лабораторное обследование (общий анализ крови, мочи, рентгенография грудной клетки, ультразвуковое исследование головного мозга и органов брюшной полости, биохимический анализ крови). Микробиологическое исследование включало посев крови, а по показаниям - ликвора и мочи на стерильность и анализ чувствительности выделенной микрофлоры к антибиотикам.
Объектом иммунологического обследования была пуповинная и периферическая кровь новорожденных детей первой недели жизни. Исследование венозной крови осуществляли на 1-2 и 3-7 сутки жизни. Специальная программа обследования включала определение плазменных и сывороточных уровней IL-8, IL-1b , TNF-a , IL -4 и TGF-b 1, а у детей с внутриутробной инфекцией - ещё и IL -6 методом твердофазного иммуноферментного анализа (ИФА). Фенотипирование лимфоцитов после выделения мононуклеарных клеток проводили методом люминесцентной микроскопии с окрашиванием моноклональными антителами к кластерам дифференцировки CD3, CD4, CD8, CD21, CD16, CD25. Исследовали динамику концентрации белков острой фазы воспаления в сыворотке пуповинной и периферической крови: С-реактивного белка (СRP), a 1-кислого гликопротеида (a 1-AG), a 1-антитрипсина (a 1-АТ), гаптоглобина (Hpt), a 2-макроглобулина (a 2-AMG), С3 и С4 компонентов комплемента иммунотурбидиметрическим методом, преальбумина (РАВ), трансферрина (TFR) и иммуноглобулинов G, M, A (IgG, IgM, IgA) - нефелометрически.
Для исследования уровня провоспалительных цитокинов, белков острой фазы, а также иммуноглобулинов пуповинную и периферическую кровь детей собирали в стерильные стеклянные пробирки, отстаивали в течение 30 минут при комнатной температуре и центрифугировали при 400 G в течение 10 минут. Сыворотку отбирали в стерильные пластиковые пробирки и хранили в замороженном виде до проведения анализа при t=-20° C.
Статистическая обработка полученных результатовпроводилась методом вариационной статистики и корреляционного анализа с помощью программы Microsoft Excel 7,0 (Windows 97). Для выявления достоверности различий использовали критерий Стьюдента.
Результаты и обсуждение.
1. Особенности постнатальной адаптации иммуной системы у здоровых доношенных новорожденных детей.
В предшествующих публикациях [2, 3] нами было показано, что уровень IL-1b в плазме пуповинной крови здоровых доношенных новорожденных был достоверно выше, а уровень спонтанной продукции IL-4, ингибирующего дифференцировку Т-хелперов 1 типа и угнетающего синтез макрофагами провоспалительных цитокинов, достоверно ниже, чем в периферической крови взрослых доноров. Плазменные уровни другого противовоспалительного цитокина -TGF-b 1 - также были снижены у здоровых новорожденных детей по сравнению с таковыми у взрослых. Концентрации TNF-a в плазме крови детей и взрослых достоверно не различались.
Полученные результаты свидетельствуют о предшествующей рождению ребенка активации клеток моноцитарно-макрофагального ряда, преобладании влияния провоспалительных цитокинов и сниженном потенциале действия противовоспалительных цитокинов в пуповинной крови здоровых доношенных новорожденных по сравнению со взрослыми донорами, что сопровождается физиологическим лейкоцитозом и нейтрофилезом в пуповинной крови [6]. Это может подтверждать имеющуюся в литературе гипотезу об участии высоких концентраций провоспалительных цитокинов и, в частности, IL-1b в запуске акта родов на фоне комплексной гормональной и метаболической перестройки в организме матери.
При исследовании концентраций IL-1b и IL-8 в сыворотке пуповинной крови было установлено, что у большинства здоровых детей эти уровни очень малы и не превышают порога чувствительности используемых иммуноферментных тест-систем (<20 пг/мл). Так, IL-8 в концентрации 120 пг/мл был обнаружен только в одной из 12 исследованных проб (8,3%), а IL-1b в концентрациях 190-480 пг/мл - в 3 из 12 сывороток пуповинной крови (25%). Это, в целом, совпадает с результатами исследования данных цитокинов у здоровых доноров [5] и может быть объяснено коротким периодом полураспада большинства цитокинов в циркуляции (минуты) и наличием в сыворотке крови природных ингибиторов.
В процессе и сразу после рождения ребенка устанавливается тесный контакт стерильного организма малыша с экзогенными антигенами. В первую очередь, микроорганизмами заселяются слизистые оболочки респираторного, желудочного-кишечного, урогенитального трактов и кожа. Сложные процессы перераспределения клеток иммунной системы между органами иммунопоэза, сосудистым руслом и тканями, изменения функциональной активности клеток по сравнению с периодом внутриутробного развития отражаются в происходящем на первой неделе жизни физиологическом перекресте в формуле крови. Он проявляется резким уменьшением количества циркулирующих нейтрофилов, возрастанием доли моноцитов, эозинофилов и перераспределением субпопуляций лимфоцитов (увеличением в циркуляции доли CD4+ лимфоцитов, уменьшением процента цитотоксических CD8+ лимфоцитов, возрастанием иммунорегуляторного индекса) [2, 6].
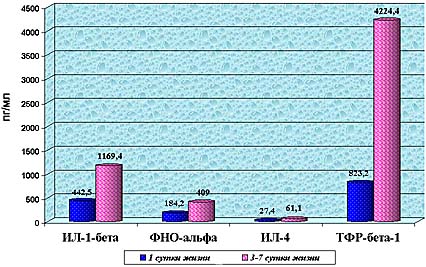
Нами было установлено, что к 3-7 дням жизни ребенка повышаются плазменные уровни про- и противовоспалительных цитокинов (график 1). Как видно из графика 1, в течение первой недели жизни в физиологических условиях происходит достоверное увеличение плазменных уровней IL-1b и TNF-a , что можно объяснить активацией клеток моноцитарно-макрофагальной природы в ответ на воздействие большого количества экзогенных антигенов (бактерии, вирусы, грибковая флора и т.д.) в раннем периоде адаптации.
Изменение концентраций цитокинов в плазме крови
здоровых новорожденных детей на первой неделе жизни.
На 3-7 сутки жизни сывороточные концентрации IL-8 (46-200 пг/мл) определялись в периферической крови 3 из 17 обследованных здоровых детей (17,7%), а IL-1b в концентрациях 1100-1400 пг/мл - в 33,3%. Т.е. не отмечалось увеличения частоты регистрации и возрастания концентрации IL-8 в сыворотке крови здоровых доношенных новорожденных при физиологическом течении раннего периода постнатальной адаптации, а учащение выявления и рост сывороточной концентрации IL-1b с 82,5±46,6 пг/мл в пуповинной крови до 415,6±209,3 пг/мл в периферической крови на 3-7 сутки жизни были статистически недостоверными.
Факт увеличения уровней изучаемых медиаторов на первой неделе жизни подкрепляется наличием прямой достоверной корреляционной связи средней силы между ними и постнатальным возрастом (сутками жизни). Для концентрации IL-1b и TNF-a в плазме крови r=0.5, p<0.01; для концентрации IL-4 r=0.6; p<0.01; для TGF-b 1 r=0.43; p<0.01; для сывороточной концентрации IL-1b r=0.43; p<0.05. Корреляция данных показателей с гестационным возрастом отсутствовала. Сывороточная концентрация IL-8 не коррелировала ни с гестационным, ни с постнатальным возрастом.
Увеличение концентраций IL-1b и TNF-a на первой неделе жизни сопровождалось достоверным изменением уровней белков острой фазы воспаления (БОФ) в сыворотке периферической крови здоровых доношенных новорожденных детей (таблица1).
Таблица 1. Динамика сывороточных уровней "индивидуальных" белков у здоровых доношенных новорожденных детей при физиологическом течении раннего периода постнатальной адаптации.
| Показатели. | Пуповинная кровь (n=20). | Периферическая кровь на 3-7 сутки жизни (n=21). | Достоверность различий. |
| M ± m | M ± m | ||
| a 1-AG (мг/дл) | 16,9 ± 2,3 | 34,4 ± 2,3 | Р < 0,001 |
| Гаптоглобин (мг/дл) | 5,2 ± 0,2 | 13,3 ± 2,6 | Р < 0,01 |
| С3 (мг/дл) | 48,7 ± 4,4 | 80,1 ± 6,3 | Р < 0,001 |
| AMG (мг/дл) | 249,75+23,32 | 304,5+16,85 | Р < 0,05 |
| Ig G (мг/дл) | 1111,59+42,58 | 908,55+54,85 | Р < 0,01 |
| Ig M (мг/дл) | 16,4+1,01 | 11,69+1,09 | Р < 0,01 |
| PAB (мг/дл) | 15,98+0,53 | 10,25+0,99 | Р < 0,001 |
| TRF (мг/дл) | 193,76+7,03 | 172,1+7,96 | Р < 0,05 |
Сывороточные концентрации a 1-антитрипсина, С-реактивного белка, С4 компонента комплемента, Ig А в раннем периоде адаптации у здоровых детей достоверно не изменялись.
По-видимому, процесс распознавания и представления антигенов, сопровождающийся повышением выработки моноцитами провоспалительных цитокинов, оказывает влияние и на усиление синтеза гепатоцитами БОФ. В ходе первичного иммунного ответа изменяется белковосинтетическая функция печени, о чём свидетельствует снижение сывороточного уровня преальбумина, расходуются собственные Ig M и полученные трансплацентарно Ig G.
Однако несмотря на увеличение количества провоспалительных медиаторов, в физиологических условиях не отмечается клинических признаков системного воспаления, и дети выписываются домой в удовлетворительном состоянии к концу первой недели жизни. Развитию системной воспалительной реакции, по-видимому, препятствует увеличение синтеза лимфоцитами противовоспалительных цитокинов IL-4 и TGF-b 1 и запускаемые ими механизмы обратной связи.
О существовании системы саморегуляции и баланса про- и противовоспалительных цитокинов в раннем периоде адаптации свидетельствует наличие сильной прямой корреляционной связи между показателями спонтанной продукции TNF-a и IL-4 (r=0.96; p<0.001). Кроме того, с увеличением сывороточных концентраций IL-1b у здоровых новорожденных детей увеличивается пролиферация Т лимфоцитов CD3+ (r=0.77; p<0.001), возрастает доля CD4+ хелперов/индукторов в периферической крови (r=0.71; p<0.001), часть из которых являются продуцентами IL-4 и TGF-b 1, уменьшается процент цитотоксических CD8+ лимфоцитов (r=-0.8; p<0.001) и естественных киллерных клеток CD16+ (r=-0.74; p<0.001).
Возрастание уровня продукции IL-4 сопровождается снижением абсолютного количества лейкоцитов периферической крови детей (r=-0.64; p<0.001), сегментоядерных нейтрофилов (r=-0.64; p<0.001), моноцитов (r=-0.7; p<0.01) как клеток, запускающих и реализующих воспаление.
Таким образом, в раннем периоде постнатальной иммунной адаптации здоровых доношенных новорожденных детей на фоне высокой антигенной нагрузки отмечается развитие лабораторных признаков системной воспалительной реакции, что выражается в достоверном увеличении сывороточных и плазменных концентраций провоспалительных цитокинов и изменении уровней белков острой фазы воспаления. Выявленные лабораторные признаки в физиологических условиях не сопровождаются развитием клинической картины системного воспаления, инфекционного токсикоза и полиорганной недостаточности. По-видимому, поддержание иммунного гомеостаза в организме новорожденного ребенка обеспечивается целым комплексом иммунных механизмов обратной связи, важнейшими среди которых являются активация, пролиферация и дифференцировка клеток-продуцентов противовоспалительных цитокинов и увеличение концентраций противовоспалительных медиаторов в сыворотке крови. Баланс про- и противовоспалительных цитокинов, в конечном счете, может являться ключевым моментом, обусловливающим клиническое состояние ребенка. Нарушение его при развитии осложнений неонатального периода может приводить к клинической манифестации заболеваний.
2. Иммунная адаптация детей с осложненным течением раннего неонатального периода.
Дальнейшей задачей нашего исследования стало изучение динамики показателей системной воспалительной реакции у новорожденных детей с осложненным течением раннего периода адаптации.
Из 26 доношенных новорожденных 2-ой группы 19 детям на основании клинико-анамнестических и лабораторных данных на 1-2 сутки жизни был поставлен диагноз внутриутробной инфекции бактериальной, вирусно-бактериальной и грибково-бактериальной этиологии. У остальных 7 детей тяжесть состояния в первые сутки жизни была обусловлена перенесенной хронической внутриутробной и/или острой интранатальной гипоксией (оценка по шкале Апгар на 1-ой минуте жизни равнялась 2-3 баллам). Клинико-лабораторные признаки бактериальной инфекции появились у них к 3-5 суткам жизни. Из 52 недоношенных детей 2-ой группы симптомокомплекс внутриутробной инфекции на 1-2 сутки жизни имели 32 ребенка. Тяжесть состояния 20 недоношенных детей в первые сутки жизни была обусловлена перинатальным поражением центральной нервной системы гипоксического генеза, а признаки инфекционного заболевания у них манифестировали к 4-5 суткам жизни. При изучении данных анамнеза было установлено, что длительность безводного промежутка как важнейшего фактора риска по возникновению восходящей инфекции была достоверно выше во 2-ой группе по сравнению с 1-ой. Все это позволило нам расценить детей 2-ой группы, обследованных в 1-2 сутки жизни, как имеющих внутриутробную инфекцию.
Особенности иммунной адаптации при внутриутробной инфекции. При сопоставлении показателей гемограммы у здоровых и больных доношенных новорожденных в первые сутки жизни было выявлено, что для детей с внутриутробной инфекцией характерны снижение гемоглобина, лейкопения, возрастание нейтрофильного индекса, изменение сывороточных концентраций реактантов острой фазы, достоверное увеличение сывороточного уровня IL-8 (таблицы 2, 3).
Таблица 2. Сравнение показателей гемограммы у здоровых доношенных детей и доношенных новорожденных с внутриутробной инфекцией на 1-2 сутки жизни.
| Показатели. | Здоровые дети. (n=20). | Дети с внутриутробной инфекцией (n=19). | Достоверность различий. |
| M ± m | M ± m | ||
| Гемоглобин (г/л) | 209,6 ± 4,8 | 177,7 ± 5,9 | Р < 0,01 |
| Лейкоциты (х109/л) | 25,4 ± 1,8 | 13,5 ± 1,3 | Р < 0,001 |
| Палочкоядерные нейтрофилы (%) | 3,6 + 0,8 | 15,6 + 2,0 | Р < 0,001 |
| Палочкоядерные нейтрофилы (х109/л) | 0,8 + 0,2 | 2,2+0,4 | Р < 0,01 |
| Юные/общие нейтрофилы | 0,04 + 0,01 | 0,21 + 0,03 | Р < 0,001 |
| Нейтрофилы (х109/л) | 17,8 + 1,3 | 9,8 + 1,1 | Р < 0,001 |
| Эозинофилы (х109/л) | 0,33 + 0,8 | 0,08 + 0,03 | Р < 0,05 |
| Лимфоциты (х109/л) | 5,2 + 0,5 | 2,5 + 0,3 | Р < 0,01 |
| Моноциты (х109/л) | 2,1 + 0,3 | 1,1 + 0,2 | Р < 0,05 |
Таблица 3. Сывороточные уровни белков острой фазы воспаления и ИЛ-8 у здоровых доношенных новорожденных детей и доношенных детей с внутриутробной инфекцией на 1-2 сутки жизни.
| Показатели. | Здоровые дети.(n=20). | Дети с внутриутробной инфекцией(n=19). | Достоверность различий. |
| M ± m | M ± m | ||
| a 1-AG (мг/дл) | 16,9 ± 2,3 | 38 ± 6,2 | Р < 0,05 |
| Гаптоглобин (мг/дл) | 5,2 ± 0,2 | 29,6 ± 11,2 | Р < 0,05 |
| a 1-AТ (мг/дл) | 262,1 ± 7,6 | 299,6 ± 12,4 | Р < 0,05 |
| СRP (мг/дл) | 0,96 ± 0,22 | 2,66 ± 0,6 | Р < 0,05 |
| С3 (мг/дл) | 48,7 ± 4,4 | 94,4 ± 12,4 | Р < 0,05 |
| С4 (мг/дл) | 29,9 + 2,6 | 15,4 + 3,5 | Р < 0,05 |
| PAB (мг/дл) | 15,98 + 0,53 | 10,8 + 0,6 | Р < 0,01 |
| IL-8 (пг/мл) | 10 + 10 | 348,8 + 137,8 | Р < 0,05 |
Сывороточные уровни IL-1b , TNF-a , IL-4 на 1-2 сутки жизни у детей 1 и 2 групп не различались, вероятно, вследствие ведущей роли нейроэндокринных изменений на фоне родового стресса. Сывороточный уровень IL-8 определялся у 75% больных доношенных детей на 1-2 сутки жизни в диапазоне концентраций 190-1000 пг/мл. У 25% детей, имевших уровень IL-8 в сыворотке крови ниже порога чувствительности тест-системы, основным диагнозом на 1-2 сутки жизни была тяжелая перинатальная гипоксия без сопутствующих признаков инфекции.
Поскольку на первой неделе жизни интерпретация результатов общего анализа крови часто бывает затруднена вследствие физиологического, "доперекрестного", лейкоцитоза и нейтрофилеза, мы провели анализ диагностической и прогностической ценности изучаемых показателей. Было обнаружено, что наиболее чувствительными и специфичными параметрами по отношению к внутриутробной инфекции независимо от гестационного возраста и влияния гипоксии являются нейтрофильный индекс (% юных форм нейтрофилов / общий % нейтрофилов), сывороточные уровни гаптоглобина, a 1-AG, СRP, преальбумина, интерлейкина-8. В группе больных новорожденных на 1-2 сутки жизни была установлена сильная прямая корреляционная связь между сывороточным уровнем IL-1b и фактом кандидурии (положительный посев мочи, рост Candida albicans) (r=0.91; p<0.001), абсолютным и относительным количеством миелоцитов (r=0.86; p<0.001), последующей длительностью пневмонии (r=0.7; p<0.001).
На 3-7 сутки жизни в гемограмме доношенных новорожденных с диагнозом внутриутробной инфекции сохранялись снижение гемоглобина, эритроцитов, тромбоцитов, лейкоцитов, нейтрофилов, эозинофилов, лимфоцитов по сравнению со здоровыми новорожденными детьми того же постнатального возраста. В течение первой недели жизни у больных новорожденных детей изменяются взаимозависимости между провоспалительными цитокинами. Если на 1-2 сутки жизни корреляция между провоспалительными цитокинами очень слаба вследствие родового стресса, то к концу первой недели жизни возникает сильная прямая корреляционная связь между IL-6 и TNF-a (r=0.8; p<0.001), а у недоношенных детей - обратная корреляция средней силы между IL-1b и IL-8 (r=-0.53; p<0.05). Прямо пропорционально возрастанию сывороточного уровня IL-1b увеличиваются концентрации острофазовых белков a 1-AТ (r=0.84; p<0.01), СRP (r=0.63; p<0.05) и мочевины (r=0.84; p<0.001). Уровень IL-8 коррелировал с сывороточными концентрациями общего белка (r=-0.6; p<0.01), общего и прямого билирубина (r=0.8; p<0.001).
В случаях, когда инфекционное заболевание заканчивалось летально (через 1-12 суток), уже на 1-е сутки жизни у детей имелись достоверно более низкие сывороточные концентрации IL-6 (12+4 пг/мл против 111,4+42,9 пг/мл, соответственно; р<0,05), РАВ (7,6+0,06 против 8,7+0,45 мг/дл, соответственно, р<0,05), СRP, a1-AG, количества эозинофилов (0,045+0,03 ´ 109 /л против 0,234+0,04 ´ 109 /л, соответственно; р<0,05), по сравнению с выжившими детьми.
У новорожденных с внутриутробной инфекцией была выявлена сильная прямая корреляционная связь сывороточной концентрации IL-6 с уровнями IgM (r=0.76; p<0.001) и IgA (r=0.8; p<0.001), что объясняется влиянием IL-6 на пролиферацию и дифференцировку В-лимфоцитов и осуществление ими эффекторных функций по синтезу иммуноглобулинов. Учитывая неблагоприятное прогностическое значение низких уровней IL-6 в сыворотке крови в сочетании с клинико-лабораторным комплексом внутриутробной инфекции бактериальной и смешанной этиологии, мы предположили, что в данной ситуации является целесообразным проведение заместительной терапии с ранним использованием препарата иммуноглобулинов для внутривенного введения, обогащенного IgM, - Пентаглобина. Пентаглобин вводили 28 новорожденным детям с внутриутробной инфекцией бактериальной и смешанной этиологии при нарастании инфекционного токсикоза на 1-4 сутки жизни в соответствии с протоколом внутривенно медленно со скоростью 1,7 мл/кг/час 1 раз в сутки в течение трех дней. Контрольную группу составили 20 новорожденных детей с внутриутробной инфекцией, получавших только базисную антибактериальную и посиндромную терапию. Наряду со снижением уровня смертности с 27,8% в контрольной группе до 14,3% в группе детей, получавших Пентаглобин, было выявлено более быстрое купирование системной воспалительной реакции и восстановление белковосинтезирующей функции печени на фоне иммунозаместительной терапии. Так, по окончании курса лечения Пентаглобином к 5-7 суткам жизни сывороточные уровни преальбумина и IgG, IgM, IgA были достоверно выше, а уровень СRP - достоверно ниже, чем в контрольной группе. Концентрации IL-6 и TNF-a у детей основной и контрольной групп к концу первой недели жизни достоверно не различались.
Влияние гестационного возраста на показатели системной воспалительной реакции. Среди детей с внутриутробной инфекцией на 1-2 и 3-7 сутки жизни не было выявлено достоверных различий по показателям общего анализа крови и сывороточным уровням цитокинов между доношенными и недоношенными новорожденными, что совпадает с данными литературы. Влияние гестационного возраста было более выраженным по отношению к величинам индивидуальных белков, чем к уровням провоспалительных цитокинов. Так, с увеличением гестационного возраста увеличиваются сывороточные уровни преальбумина (r=0.67; p<0.001), трансферрина (r=0.5; p<0.05), IgG (r=0.5; p<0.01), уменьшается уровень СRP на 3-7 сутки жизни (r=0.6; p<0.01). По-видимому, это обусловлено становлением способности макрофагов к продукции провоспалительных цитокинов в раннем онтогенезе и постепенным созреванием белковосинтетической функции печени с 28-ой по 40-ую неделю внутриутробного развития.
Влияние гипоксии на показатели системного воспаления нуждается в дальнейшем тщательном исследовании. В данной работе тяжелой гипоксии в большинстве случаев сопутствовало раннее развитие инфекционного заболевания, что оказывало сочетанное влияние на уровни про- и противовоспалительных цитокинов в циркуляции новорожденных детей. Тем не менее, при проведении корреляционного анализа нами был установлен факт отдаленного, отсроченного влияния гипоксии на цитокиновый статус новорожденных детей. Так, в первые сутки жизни отсутствовала корреляция между оценкой по шкале Апгар на 1 и 5 минуте и сывороточными уровнями IL-1b и IL-8. К 3-7 суткам жизни появляется прямая корреляционная связь средней силы между оценкой по Апгар на 1-ой минуте жизни и сывороточным уровнем IL-1b (r=0.5; p<0.05). На 15-22 сутки жизни эта корреляция усиливается (r=0.6; p<0.01), и распространяется на показатели IL-8 и оценку по Апгар на 5-ой минуте жизни (r=0.9; p<0.01). Т.е. тяжесть перинатальной гипоксии и эффективность реанимационных мероприятий в родильном зале напрямую обусловливают состояние иммунитета в целом и цитокинового статуса, в частности, на третьей неделе жизни новорожденных детей и, вероятно, таким образом влияют на возникновение и течение поздних неонатальных и нозокомеальных инфекций. Возможно, этот феномен связан с тем, что к 3-ей неделе жизни среди продуцентов провоспалительных цитокинов увеличивается количество клеток со сниженным секреторным потенциалом вследствие воздействия тяжелой гипоксии на раннем, костномозговом, этапе их развития.
Выводы.
Список литературы: