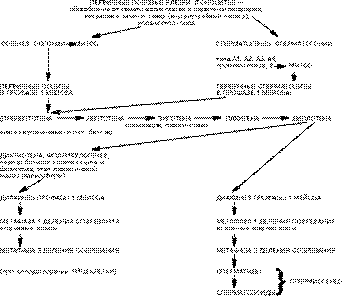
Уровень нерасхождения хромосом на разных стадиях развития мужских половых клеток человека
Половые клетки (ПК) с отсутствием или наличием дополнительной хромосомы могут стать причиной развития эмбриона с анеуплоидией хромосом в кариотипе. В большинстве случаев при анеуплоидии по какой-либо из хромосом набора внутриутробное развитие останавливается и беременность заканчивается спонтанным абортом. Малая часть таких эмбрионов и плодов (0,5—0,7%) [8] доживает до рождения и составляет контингент пациентов с хромосомной патологией. Анеуплоидия хромосом развивается либо в раннем эмбриогенезе — вследствие нерасхождения хромосом на первых этапах деления дробления эмбриона, либо ранее — в гаметогенезе: во время митотического деления оогониев или сперматогониев; во время мейотического деления (в метафазе 1 — М1 или метафазе 2 — М2 делений созревания) женской или мужской гамет. До 70-х годов ХХ века не было приемлемых методов анализа состава хромосом в гаметах. Представления о хронологии и последовательности прохождения мужскими и женскими ПК млекопитающих этапов своего развития были недостаточно четкими [11, 12]. Вместе с тем знание частоты и механизмов развития анеуплоидии ПК на этапах гаметогенеза позволит разработать профилактические меры в целях снижения частоты нерасхождения хромосом в ПК и предупреждения развития плодов с анеуплоидным кариотипом. На схеме представлена динамика гаметогенеза человека (рис. — схема).
Первичные половые клетки (ППК) обособляются от соматических клеток на ранних этапах эмбриогенеза, у 15—20-дневных эмбрионов человека [17]. ППК мигрируют из области энтодермы желточного мешка в закладки половых желез, и дальнейшее их развитие зависит от генетического пола эмбриона. У человека половая дифференцировка гонад происходит на 6-й неделе развития [9—11, 18]. У эмбрионов женского пола ППК в гонадах преобразуются в оогонии, которые трансформируются в ооциты 1, проходят последовательно через все стадии профазы 1 мейоза (рис.). На стадии диплотены ооциты 1 окружаются фолликулярными клетками — формируется примордиальный фолликул с заключенным в него ооцитом 1 на стадии диплотены профазы 1 мейоза [10]. У новорожденной девочки подавляющее число ПК находятся на стадии диплотены-диктиотены и заключены в фолликулы. В периоде половой зрелости в каждом менструальном цикле 10–15 ооцитов вступают в дальнейшее развитие мейоза: созревание, 1-е мейотическое деление, овуляция (одного ооцита 2), 2-е деление мейоза [9—11]. Для цитогенетического исследования хромосом женские ПК у эмбриона и плода (от оогониев до ооцитов в диплотене, заключенных в примордиальные фолликулы) и у половозрелых женщин (ооциты в диплотене и диктиотене в фолликулах разных этапов развития, ооциты в диакинезе, на стадии кариосферы, ооциты в М 1 и овулирующие — в М 2), практически недоступны. Даже при наличии овулирующей яйцеклетки, цитогенетический анализ одной яйцеклетки для обнаружения в гаметах анеуплоидии неинформативен. Полученная по анализу одной такой ПК информация не позволяет составить представление о доле ПК с хромосомной аномалией (ХА) у данной пациентки. У эмбрионов мужского пола ППК преобразуются в просперматогонии, которые несколько раз митотически делятся, создавая тем самым некоторое количество ПК [19]. Их дальнейшее развитие: митотические деления, последующая дифференцировка через стадии профазы 1 мейоза, деления созревания и спермиогенез возобновляется у мальчиков к наступлению половой зрелости [16) (рис). У половозрелых мужчин можно исследовать сразу большое число зрелых ПК. Анализ ХА в сперматогониях, сперматоцитах 1 и 2 возможно проводить только на биоптатах яичка. Биопсия яичка показана в случае азооспермии или олигозооспермии тяжелой степени [73]. В последние годы изучалась возможность проведения такого анализа на незрелых мужских ПК в эякуляте [5, 13, 57, 67, 68]. До разработки молекулярно-цитогенетического анализа хромосом, в том числе — в интерфазных ядрах [2, 3, 20, 23, 74, 76, 77] цитогенетический анализ ПК был возможен на стадиях гаметогенеза, когда хромосомы находятся в состоянии конденсации (в метафазных гониях, в ПК на стадиях пахитены, диакинеза, М1 и М2 делений созревания). Анализ синапсиса гомологичных родительских хромосом в зиготене и исследование специфической для мейотических хромосом структуры — синаптонемного комплекса (СК) проводят на стадиях от лептотены (по наличию и поведению осевых элементов) до стадии диплотены (анализ модификации осевых элементов), с исследованием СК в зиготене и пахитене [1, 7]. Цитогенетический анализ хромосом ПК проводят на сперматогониях в метафазе митоза, сперматоцитах 1 в пахитене, в М1 и М2 мейоза. С 1978 года с помощью гетерологичного (межвидового) оплодотворения ооцитов золотистого хомячка (или мыши) сперматозоидами человека [62] стало возможным визуализировать и исследовать хромосомы зрелых сперматозоидов (метафазные хромосомы на стадии пронуклеусов перед первым делением дробления оплодотворенной яйцеклетки) (подробнее подходы к анализу хромосом ПК см.: 12; 43). С развитием молекулярно-цитогенетических методов стало возможным проводить анализ кариотипа (по определенным хромосомоспецифическим ДНК-зондам) не только в метафазах, но и на интерфазных ядрах соматических клеток и гониев; интерфазоподобных ядрах мейоцитов и в сперматозоидах [2, 3, 20, 23, 40, 41, 56, 70, 71, 76, 77]. Молекулярно-цитогенетический метод позволяет определить или уточнить природу ХА и связать их с клиническими проявлениями. Понимание механизмов развития и наследования ХА может служить основой для разработки методов предупреждения возникновения ХА в ПК. При изучении причин мужского бесплодия по анализу лимфоцитов периферической крови установлено, что до 7—10% пациентов являются носителями ХА. Особенно высока их доля (до 18%) у лиц с азооспермией [13—15, 21, 47, 48, 61]. Большая часть ХА представлена нарушением их числа при азооспермии (подавляющая доля их связана с нарушением половых хромосом-гоносом) и структурными ХА — при олигозооспермии [4, 14, 15, 24, 38, 48, 56, 60, 61]. Цитогенетический анализ ПК позволяет у части пациентов с бесплодием выявить долю ХА, не устанавливаемых в соматических клетках [1, 13—15, 40, 49, 50]. В настоящее время информация о частоте нерасхождения хромосом в сперматогониях (как и в оогониях) практически отсутствует. Изучение гамет следующих этапов развития показало, что у пациента с бесплодием и олигоастенотератонекрозооспермией среди первичных сперматоцитов 15% оказались полиплоидными. Примерно у 50% сперматоцитов 1 гоносомы (X и Y) оставались унивалентами, что свидетельствовало о нарушении их конъюгации в зиготене [33]. В сперматоцитах 1 на стадии пахитены с помощью метода микрораспластывания клеток на водном мениске с последующим их окрашиванием нитратом серебра анализировали поведение гоносом по их СК (на 1883 клетках от 40 субфертильных с нормальным кариотипом пациентов и 566 клетках от 10 здоровых мужчин). Обнаружено, что у лиц с нарушением фертильности заметнее признаки дегенерации сперматоцитов в пахитене, выше частота ассоциаций хромосом Х и Y с ядрышко-образующими участками акроцентрических хромосом, чаще происходит фрагментация СК. У некоторых пациентов с олигозооспермией определены морфологическая незрелость СК хромосом Х и Y и снижение протяженности их синапсиса [64]. При анализе тотальных препаратов СК у 4 мужчин с бесплодием и нормальным кариотипом выявлена задержка сперматогенеза — блок в пахитене, увеличение числа (до 35—53,8%) ассоциаций аутосомных бивалентов с гоносомами или нарушение синапсиса и асинапсиса бивалентов [6, 13]. При изучении сперматоцитов 1 в диакинезе (из биоптатов яичек мужчин детородного возраста) в 84—89 % ПК определен нормальный кариотип. У 78-летнего пациента 76,9% сперматоцитов 1 в диакинезе имели нормальный кариотип [35]. При исследовании сперматоцитов в М2 из биоптата яичка от 19 мужчин с бесплодием гиперплоидия выявлена в 2% клеток; соотношение Х и Y несущих сперматоцитов 2 было 53%:47% [37]. В большинстве исследований частота гипоплоидии превышает частоту гиперплоидных гамет, что связывают с техникой приготовления тотальных препаратов хромосом [35]. Нерасхождение хромосом в М1 мейоза оценивали по частоте анеуплоидии в сперматоцитах 2 в двух группах пациентов: контрольной (1-я группа) и у пациентов с субфертильностью и нормальным кариотипом 46, XY (2-я группа). Проанализировано 93 и 91 сперматоцит 2, соответственно. Выявлены значительные различия в частоте нерасхождения хромосом у пациентов 1-й и 2-й групп (16,48 и 26,86%, соответственно). Показано, что в сперматоцитах 2 (перед М2) в большинстве случаев в анеуплоидии участвуют акроцентрические и половые хромосомы [31]. На последнем этапе сперматогенеза — для оценки плоидности в зрелых ПК методом флюоресцентного окрашивания акрихин-ипритом и красителем Гимза определяли частоту дисомии хромосом Y и 9 по числу флюоресцирующих телец в 10 700 сперматозоидах человека от 12 здоровых мужчин [58]. В 54,6% сперматозоидов флюоресцирующих телец не было выявлено,что свидетельствовало об отсутствии хромосомы Y. В 43,9% сперматозоидов определено по одному флюоресцирующему тельцу (одна хромосома Y); 1,3% имели по два таких тельца (две хромосомы Y) и 0,2% сперматозоидов были большого размера (полиплоидные) и также содержали по два Y-тельца. У 1 пациента в 25 сперматозоидах выявлено по два сигнала от хромосомы 9 [58]. С помощью метода гетерологичного оплодотворения ооцитов золотистого хомячка сперматозоидами человека установлено, что у здоровых мужчин в возрасте 25—49 лет, с нормальными спермограммой и кариотипом (по лимфоцитам периферической крови) около 10% зрелых сперматозоидов имели ХА [44, 51]. Сравнение результатов хромосомного анализа сперматозоидов с помощью гетерологичного оплодотворения, проведенного разными исследователями, свидетельствует о стабильной частоте (8,5—13,9%) нерасхождения хромосом в сперматозоидах у здоровых мужчин. Соотношение Х и Y несущих сперматозоидов колеблется, но в целом близко к соотношению 1:1. В большинстве исследований доля численных ХА ниже, чем структурных (колеблется в зависимости от сообщения от 0,9 до 8,3% и от 1,3 до 13,9%, соответственно) [26, 27, 34, 44, 46, 51, 53, 55, 68, 69]. Чаще встречается гипергаплоидия по хромосомам 1, 21 и Х. Уровень гипергаплоидии в сперматозоидах колеблется до 5,4 %, гипогаплоидии в 6,3—10,3%. Выявлена тенденция зависимости уровня гипогаплоидии от метода и режима приготовления препаратов, в частности — от режима гипотонии клеток [64]. Соотношение Х и Y несущих сперматозоидов колеблется, но в целом близко к 1:1. Одними из первых анализ дисомии хромосом в сперматозоидах человека с помощью FISH метода (флюоресцентная in situ гибридизация) провели Joseph с коллегами [45] и Wyrobek, Pinkel [68]. Данная техника значительно облегчила исследование частоты нерасхождения хромосом в сперматозоидах и ПК более ранних стадий развития. При исследовании мейотической сегрегации гоносом в сперматозоидах человека с помощью двухцветового FISH метода [29] установлено соотношение гаплоидных с хромосомой Х и с хромосомой Y сперматозоидов, равное 1:1 (49,30%: 49,22%).Частота нерасхождения хромосом Х и Y в М2 мейоза равнялась 0,05%. Авторы подчеркивают, что эти цифры сходны с таковыми, полученными иным методом — гетерологичного оплодотворения (см.выше). Частота XY несущих сперматозоидов достигала 0,42%. Авторы расценивали ее как высокую, допуская, что при этом методе возможно вовлечение в подсчет диплоидных соматических клеток, диплоидных ПК, гипергаплоидных сперматозоидов, как результат нерасхождения гоносом в М1 мейоза [29]. Для дифференцирования диплоидных соматических клеток от ПК используют двух- или трехцветовую FISH-технику [54, 66]. При использовании ДНК-зондов, специфических для хромосом 1 и Y [42], в сперматозоидах была обнаружена частота дисомии по хромосоме 1, равная 0,35% и по хромосоме Y, равная 0,18%. При анализе нерасхождения хромосом 6 и 21 в сперматозоидах 9 здоровых мужчин определена ее частота для хромосомы 21, равная 0,38% и для хромосомы 6, равная 0,14% [23]. Следует отметить, что данные (2%) о частоте нерасхождения хромосом в М1, полученные при обычном цитогенетическом анализе сперматоцитов в М2 из биоптата яичка [37], близки к таковым (0,1—2%), полученным с помощью гетерологичного оплодотворения [25, 26, 34, 51—53), и выше данных, выявленных на сперматозоидах с применением FISH-метода [41, 70]. В литературе нет единого мнения о том, нарастает ли частота ХА у мужчин в зависимости от возраста. В классических руководствах приводятся данные об их увеличении. Полагают, что с возрастом пациентов увеличивается число сперматозоидов со структурными ХА, но не с численными (анализ с помощью техники гетерологичного оплодотворения) [51—53]. У 9 из 10 обследованных доноров частота структурных ХА выше в сперматозоидах, чем в лимфоцитах периферической крови; также установлена неслучайная структурная ХА для каждого обследуемого [25—28]. Подчеркивается высокий межиндивидуальный разброс частоты нерасхождения хромосом в сперматозоидах между донорами. До настоящего времени нет доказательств или опровержений равной вероятности вовлечения различных хромосом в нерасхождение. В последние годы показано, что анеуплоидии ряда аутосом встречаются в пределах 0,05—0,28% без предпочтения какой-либо хромосомы набора [32, 59, 66]. Отмечают, что вероятность нерасхождения двух хромосом в одной клетке ничтожнo мала: 4Ѕ10–4 [37]. Не выявлено различий в частоте дисомии и диплоидии в сперматозоидах у мужчин с бесплодием и без проблем деторождения [56]. Предполагают селекцию сперматозоидов с дисомией хромосом [36, 39, 53]. Отмечают высокое число сперматоцитов в пахитене (у пациента с кариотипом 47,XYY) [65] и сперматозоидов (у пациента с кариотипом 47,ХXY) [30] с дисомией гомологичных гоносом. Одной из задач анализа литературы было привлечь внимание специалистов, занимающихся техникой ИКСИ, к данным о частоте нерасхождения хромосом в сперматозоидах человека. Поскольку у пациентов с дисомией хромосомы Х в кариотипе (47,ХXY) сперматозоиды и сперматиды (число которых снижено или они практически отсутствуют в эякуляте) могут иметь обе хромосомы (неразошедшиеся в М1 Х и Y), этот факт следует принимать во внимание при планировании таких пациентов на ИКСИ, с изъятием половых клеток из эякулята или биоптата яичка. Проведение для таких пациентов преимплантационного цитогенетического анализа клеток эмбриона показано. В случае невозможности его проведения обязательны показания для выполнения цитогенетического анализа по клеткам плода при пренатальной диагностике. Мы не ставили перед собой цель отразить в обзоре максимальное число имеющихся сообщений относительно частоты нерасхождения хромосом в гаметах человека. Анализ основного числа исследований свидетельствует о сходстве количественных данных, полученных разными исследователями с применением разных методов анализа, по уровню нерасхождения как половых хромосом, так и аутосом в сперматозоидах человека. Прослеживается тенденция снижения частоты нерасхождения хромосом и общей доли клеток с ХА (численными и структурными) по мере прохождения ПК стадий дифференцировки. Более детальный анализ исследований уровня и типов ХА (структурных и численных) на заключительном этапе сперматогенеза — в зрелых сперматозоидах, приведен в недавно опубликованном обзоре [41]. Л.Ф.Курило, В.О.Шаронин, С.Г.Ворсанова НИИ Клинической генетики Медико-генетического научного центра РАМН, Московский НИИ педиатрии и детской хирургии МЗ РФ Литература 1. Богданов Ю.Ф., Коломиец О.Л. Кариотипирование на основе синаптонемных комплексов и применение этого метода в цитогенетике. Генетика 1985; 21(15): 793—802. 2. Ворсанова С.Г., Юров Ю.Б., Дерягин Г.В., Соловьев И.В., Бытенская Г.А. К методике диагностики анеуплоидий при помощи гибридизации in situ: анализ интерфазных ядер. Бюл эксперим биолог и мед 1991; 10: 413—415. 3. Ворсанова С.Г. Хромосомные аномалии у детей с недифференцированной олигофренией и супружеских пар с отягощенным акушерским анамнезом по данным молекулярно-цитогенетических исследований. Дис. ... док биол наук. Киев 1991; 52. 4. Ворсанова С.Г., Шаронин В.О., Курило Л.Ф. Аномалии половых хромосом при нарушении репродуктивной функции у мужчин. Пробл репрод 1998; 4(2): 12—21. 5. Джгаркава Н.А., Курило Л.Ф. Цитогенетический анализ митотических и мейотических хромосом у мужчин с нарушением сперматогенеза. Цитол и генет, Киев, 1991, 12 С., Деп. ВИНИТИ, N 2471, В-91, Цитол и генет 1991; 3: 71. 6. Коломиец О.Л., Богданов Ю.Ф., Мазурова Т.Ф., Гречанина Е.Я., Джгаркава Н.А., Курило Л.Ф., Любашевская И.А. Анализ тотальных препаратов СК у мужчин, страдающих бесплодием. Тез докл 2 Всесоюзн съезда мед генет, Алма-Ата, ХII/1990; 1990; 207—208. 7. Коломиец О.Л. Синаптонемный комплекс как индикатор хромосомной изменчивости. Дис. ... док биол наук. М 1998; 62. 8. Кулешов Н.П. Частота возникновения и судьба хромосомных аномалий в популяции человека. Дис. ... докт мед наук. М 1979; 270. 9. Курило Л.Ф. Динамика преобразований хромосом в профазе мейоза в оогенезе человека. Цитология 1980 а; 22(2): 154—160. 10. Курило Л.Ф. Фолликулогенез в пренатальный период развития человека. Архив анат 1980 б; 79(7): 73—79. 11. Курило Л.Ф. Морфофункциональные характеристики оогенеза млекопитающих и человека. Дис. ... док биол наук. М 1985; 470. 12. Курило Л.Ф. Возможности цитогенетического исследования мейоза при мужском бесплодии. Цитол и ген 1989; 23(2): 63—70. 13. Kурило Л.Ф., Шаповал Н.В., Дубинская В.П. и др. Структура хромосомной патологии среди пациентов с нарушением репродуктивной системы. Тез докл 1 (3) Рос съезда мед генет, М 1994; 1: 85—86. 14. Курило Л.Ф., Шилейко Л.В., Мхитарова Е.В. и др. Структура наследственной патологии половой системы при обследовании пациентов с нарушением репродукции. Тез докл Рос науч-практ Конф «Медико-генет. консультирование в профилактике наследственных болезней», МЗ РФ, МНОМГ, МГНЦ РАМН, Москва, 1997; 154—155. 15. Курило Л.Ф. Доля генетической патологии у пациентов с нарушением развития половой системы. Лекции для врачей: Сексопатология и андрология, Киев 1998; 4: 18—27. 16. Райцина С.С. Сперматогенез и структурные основы его регуляции. М.: Наука 1985; 207. 17. Семенова-Тян-Шанская А.Г. Первичные половые клетки зародыша человека в период миграции к зачаткам гонад. Архив анат 1969; 56(6): 3—8. 18. Фалин Л.И. Эмбриология человека: Атлас. М: Медицина 1976: 544. 19. Хилькевич Л.В., Курило Л.Ф. Кинетика популяции мужских половых клеток человека в антенатальном периоде онтогенеза. Онтогенез 1992; 23(5): 506—510. 20. Юров Ю.Б. Оптимизация условий гибридизации клонированных последовательностей ДНК in situ и дифференциального окрашивания хромосом человека. Бюл эксперим биолог и мед 1984; 5: 595—598. 21. Abramsson L., Beckman G., Duchek M., Nordenson I. Chromosomal aberrations and male infertility. Isr J Med Sci 1981; 17(8): 735. 22. Bischoff F.Z., Nguyen D.D., Burt K.J., Schaffer L.G. Estimates of aneuploidy using multicolor fluorescence in situ hybridization on human sperm. Cyt Cell Genet 1994; 66: 237—243. 23. Blanco J., Egozcue J., Vidal F. Incidence of chromosome 21 disomy in human spermatozoa as determined by fluorescent in situ hybridization. Hum Reprod 1996; 4: 722—726. 24. Bourrouillou, Dastugue N., Colombies P. Chromosome studies in 952 infertile males with a sperm count below 10 million/ml. Hum Genet 1985; 71: 366—367. 25. Brandriff B., Gordon L., Ashworth L., Watchmaker G., Carrano A., Wyrobek A. Chromosomal abnormalities in human sperm: Comparisons among four healthy men. Hum Genet 1984 a; 66(2—3): 193—201. 26. Brandriff B., Gordon L., Ashworth L. et al. Chromosomal analysis of human sperm from eleven individuals. Amer J Hum Genet 1984 b; 36(4): Suppl., 87. 27. Brandriff B., Gordon L., Ashworth L. et al. Chromosomes of human sperm: variability among normal individuals. Hum Genet 1985; 70(1): 18—24. 28. Brandriff B., Gordon L., Ashworth L.K. et al. Cytogenetics of human sperm: meiotic segregation in two translocation carriers. Am J Hum Genet 1986; 38: 197—208. 29. Chevret E., Rousseaux S., Monteil M. et al. Male meiotic segregation of gonosomes analysed by two colour FISH in human interphase spermatozoa. Hum Genet 1994; 94(4): 701—704. 30. Cozzi J., Chevret E., Rousseaux S. et al. Achievement of meiosis in XXY germ cells: study of 543 sperm karyotypes from an XY/XXY mosaic patient. Hum Genet 1994; 93(1): 32—34. 31. De Torres M.L., Sanchez Ferrer M.A., Abrisqueta Y.A. Nondisjuntion in secondary spermatocytes of man. Int Congress Hum Genet 1986; Berlin, Abstr., part 1, 145. 32. Downie S.E., Flaherty S.P., Swann N.J. et al. Estimation of aneuploidy for chromosomes 3,7,16,X and Y in spermatozoa from 10 normospermic men using fluorescence in-situ hybridization. Mol Hum Reprod 1997; 3(9): 815—820. 33. Dutrillaux B., Gueguen J. Anomalies meiotiques et gametiques multiples dans un cas de sterilite masculine. Ann Genet 1971; 14: 49—52. 34. Estop A.M., Cieply K., Vankirk V. et al. Cytogenetic studies in human sperm. Hum Genet 1991; 87(4): 447—451. 35. Goetz P., Knobloch J. Meiotic chromosomes of normal men. Plzen Lek sb 1973; suppl. 31: 147—149. 36. Goldman A.S.H., Fomina Z., Knights P.A. et al. Analysis of the Primary Sex Ratio, Sex Chromosome Aneuploidy and Diploidy in Human Sperm Using Dual-Colour Fluorescence in situ Hybridisation. Eur J Hum Genet 1993; 1: 325—334. 37. Guichaoua M.R., Delafontaine D., Taurelle R. et al. Loop formation and synaptic adjustmant in a human male heterozygous for two pericentric inversions. Chromosoma 1986; 93(4): 313—320. 38. Guichaoua M.R., Delafontaine D., Noel B. et al. L’infertilite masculine d’origine chromosomique. Contracept Fertil Sex 1993; 21(2): 113—121. 39. Guttenbach M., Schmid M. Determination of Y chromosome aneuploidy in human sperm nuclei by nonradioactive in situ hybridization. Am J Hum Genet 1990; 46: 553—558. 40. Guttenbach M., Schakowski R., Schmid M. Incidence of chromosome 3,7,10,11,17 and X disomy in mature human sperm nuclei as determined by nonradioactive in sity hybridization. Hum Genet 1994; 93(1): 7—12. 41. Guttenbach M., Engel W., Schmid M. Analysis of structural and numerical chromosome abnormalities in sperm of normal men and carriers of constitutional chromosome aberrations. A review. Hum Genet 1997; 100(1): 1—21. 42. Han T.J., Ford J., WebbG.C. et al. Simultaneous detection of X- and Y-bearing human sperm by double fluorescence in situ hybridization. Mol Reprod Dev 1993; 34: 308—313. 43. Hulten M.A., Laurie D.A., Martin R.H. et al. New techniques for detecting chromosome abnormalities in the germ-line in man. In: Individual susceptibility to Genotoxic Agents in the Human Population. Eds.: F.J. de Serres, R.W.Pero. Plenum Press, N.Y., L., 1984; 441—457. 44. Jenderny J., Rohrborn G. Chromosome analysis of human sperm. 1. First results with a modified method. Hum Genet 1987; 76(4): 385—388. 45. Joseph A.M., Gosden J.R., Chandley A.C. Estimation of aneuploidy levels in human spermatozoa using chromosome specific probes and in situ hybridisation. Hum Genet 1984. 46. Kamiguchi Y., Mikano K. An improved, efficient method for analysing human sperm chromosomes using zona-free hamster ova. Amer J Hum Genet 1986; 38(5): 724—740. 47. Kjessler B. Facteurs genetiques dans la subfertilite male humaine. In: Fecondite et sterilite du male. Acquisitions recentes. Masson, Paris, 1972; 205—225. 48. Koulischer L., Schoysman R. Chromosomes and human infertility.1. Mitotic and meiotic chromosome studies in 202 consecutive male patients. Clin Genet 1974; 5(2): 116—126. 49. Luciani J.M., Morazzani M.R., Stahl A. Identification of pachytene bivalents in human male meiosis using G-banding technique. Chromosoma 1975; 52(3): 275—282. 50. Luciani J.M., Guichaoua M.R., Morazzani M.R. Complete pachytene chromomere karyotypes of human spermatocyte bivalents. Hum Genet 1984; 66(2): 267—271. 51. Martin R.,Rademaker A.W., Hildebrand K. et al. Variation in the frequency and type of sperm chromosomal abnormalities among normal men. Hum Genet 1987; 77(2): 108—114. 52. Martin R. Human sperm chromosome complements: effects of donor age, freezing and segregation in translocation and inversion carriers. Environ and Mol Mutagenes 1989; 14, Suppl.: 123. 53. Martin R. Chromosomal analysis of human spermatozoa. Preimplantat.Genet.: Proc. 1st Int. Symp.; Chicago, Sept. 14—19, 1990; N.-Y.; London 1991; 91—102. 54. Mercier S., Morel F., Roux C. et al. Analysis of the sex chromosomal equipment in spermatozoa of a 47,XYY male using two-colour fluorescence in situ hybridization. Mol Hum Reprod 1996; 2(7): 485—488. 55. Mikamo K., Kamigichi Y., Fateno H. Spontaneous and in vitro radiation-induced chromosome aberrations in human spermatozoa: application of a new method. Environ and Mol Mutagenes 1989; 14: Suppl.: 129. 56. Muharu N., Best R.G., Young S.R. Numerical chromosome abnormalities in spermatozoa of fertile and infertile men detected by fluorescence in situ hybridization. Hum Genet 1994; 93: 502—506. 57. Navarro J., Vidal F., Guitart M. et al. A method for the sequential study of synaptonemal complexes by light and electron microscopy. Hum Genet 1981; 59: 419—421. 58. Pawlowitzki J., Pearson P.L. Chromosomal aneuploidy in human spermatozoa. Hum Genet 1972; 16(1—2): 119—121. 59. Pellestor F., Girardet A., Coignet L. et al. Assessment of Aneuploidy for Chromosomes 8, 9, 13, 16, and 21 in Human Sperm by Using Primad in Situ Labeling Technique. Am J Hum Genet 1996; 58: 797—802. 60. Retief A.E., Van Zyl J.A., Menkveld R. et al. Chromosome studies in 496 infertile males with a sperm count below 10 million/ml. Hum Genet 1984; 66: 162—164. 61. Rivas F., Garcia-Esquivel L., Diaz M. et al. Cytogenetic evaluation of 163 azoospermics. J Genet Hum 1987; 35(4): 291—298. 62. Rudak E., Jacobs P.A., Yanagimachi R. Direct analysis of the chromosome constitution of human spermatozoa. Nature 1978; 274: 911—913. 63. Schattman G.L., Munne S., Grifo J.G. et al. Aneuploidy in spermatozoa using fluorescence in situ hybridization. J Assist Reprod Genet 1993; 10: 360—365. 64. Speed R.M., Chandley A.C. Prophase of meiosis in human spermatocytes analysed by EM microspreading in infertile men and their controls and comparisons with human oocytes. Hum Genet 1990; 84(6): 547—554. 65. Speed R.M., Faed M.J.W., Batstone P.J. et al. Persistence of two Y chromosomes through meiotic prophase and metaphase 1 in an XYY man. Hum Genet 1991; 87(4): 416—420. 66. Spriggs E.L., Rademakker A.W., Martin R.H. Aneuploidy in human sperm: results of two-and three-color fluorescence in situ hybridization using centromeric probes for chromosomes: 1,12,15,18,X and Y. Cytogenetics and Cell Genetics 1995; 71(1): 47—53. 67. Templado C., Marina S., Coll M. et al. Meiotic studies in human semen. Report of 180 cases. Hum Genet 1980; 53(3): 335—339. 68. Templado C., Vidal F., Navarro J. et al. Improved technique for the study of meiosis in the ejaculate: results in the first 50 consecutive cases. Hum Genet 1986; 72(2): 275—277. 69. Templado C., Marquez C., Munne S. et al. An analysis of human sperm chromosome aneuploidy. Cytogenetics and Cell Genetics 1996; 74: 194—200. 70. Van Hummelen P., Xiu R. Lowe, Wyrobek A.J. Simultaneus detection of structural and numerical chromosome abnormalities in sperm of healthy men by multicolor fluorescence in situ hybridization. Hum Genet 1996; 98: 608—615. 71. Vorsanova S.G., Yurov Y.B., Soloviev I.V. et al. Molecular-cytogenetic diagnosis of chromosomal anomalies in genetic counseling. Cesko-Slovatska pediatrie 1997; 7: 538—544. 72. Williams B.J., Ballenger C.A., Malter H.E. et al. Non-disjunction in human sperm: results of fluorescence in situ hybridization studies using two and tree probes. Hum Mol Gen 1993; 2: 1929—1936. 73. WHO Laboratory manual for the examination of human semen and sperm-cervical mucus interaction. Cambridge University press, 1992. 74. Wyrobek A.J., Pinkel D. Detecting chromosomes in human sperm by fluorescence hybridization. Am J Hum Genet 1986; 39(3): A102. 75. Wyrobek A.J., Robbins W.A., Mehraein Y. et al. Detection of sex chromosomal aneuploidies X-X, Y-Y, and X-Y in human sperm using two-chromosome fluorescence in situ hybridization. Am J Med Genet 1994; 53(1): 1—7. 76. Yurov Y.B., Saias M.J., Vorsanova S.G. et al. Rapid chromosomal analysis of germ-line cells by FISH: an investigation of infertile male with large-head spermatozoa. Mol Hum Reprod 1996; 2(9): 665—668. 77. Yurov Y.B., Soloviev I.V., Vorsanova S.G. et al. DNA probes for pre- and postnatal diagnosis of chromosomal anomalies: a collection for FISH analysis. Cesko-Slovatska pediatrie 1997; 7: 550—554. |