Особенности оплодотворения ооцитов и развития эмбрионов в культуре у женщин.
|
Программа ЭКО позволяет оценить способность половых клеток к оплодотворению и выявить факторы, влияющие на этот процесс. Визуальное наблюдение за развитием зигот и эмбрионов дает возможность анализировать их морфологические особенности и стадии развития, а также изучать влияние показателей сперматогенеза и фолликулогенеза на процесс раннего эмбриогенеза у человека. Ранее нами показано, что ответ яичника на стимуляцию влияет как на частоту оплодотворения ооцитов в культуре, так и на развитие эмбрионов [1].
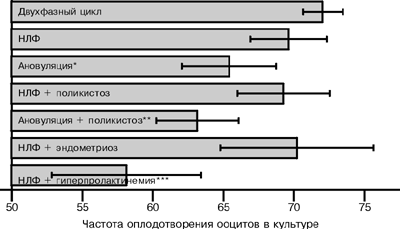
Преимплантационное развитие эмбрионов при прижизненном наблюдении характеризуется двумя основными параметрами — числом бластомеров и их морфологией. Равные морфологически правильные бластомеры без фрагментации образуются только у части эмбрионов. Остальные эмбрионы имеют бластомеры с различной степенью выраженности процесса фрагментации. Фрагментация бластомеров — цитопатологический процесс, заключающийся в обособлении и последующем отделении участков цитоплазмы. Природа и причины возникновения этого явления еще мало понятны. До сих пор остается невыясненным вопрос о факторах, вызывающих процесс фрагментации эмбрионов, а также замедление скорости дробления эмбрионов человека в программе ЭКО. С практической точки зрения информация о влиянии недостаточности яичников на частоту оплодотворения ооцитов и развития эмбрионов является необходимой, в частности, и для оценки целесообразности применения фолликулярной жидкости и сыворотки крови как компонентов культуральных сред в программе ЭКО [3, 4]. Целью настоящего исследования явилась оценка влияния нормогонадотропной недостаточности яичников, а также гиперпролактинемии, вторичного поликистоза яичников и наружного генитального эндометриоза на частоту оплодотворения ооцитов и раннее развитие эмбрионов в культуре. Материал и методы исследования Проанализированы результаты оплодотворения ооцитов в культуре и особенности дробления эмбрионов у женщин, проходивших лечение в нашем центре. У всех больных причиной бесплодия являлся трубно-перитонеальный фактор. Возраст больных варьировал от 19 до 48 лет и в среднем составил 31,4±0,3 года. Cтимуляцию суперовуляции у всех больных проводили с использованием кломифенцитрата и чМГ (хумегон, пергонал). При достижении лидирующими фолликулами диаметра 17—18 мм вводили овуляторную дозу хорионического гонадотропина (профази, прегнил). В результате обследования больных с трубно-перитонеальным бесплодием полноценный двухфазный менструальный цикл был выявлен у 215 женщин (1-я группа). У большей части обследованных больных (у 466 женщин — 2-я группа) была диагностирована нормогонадотропная недостаточность яичников, при этом у 69 женщин была выявлена ановуляция, у 387 — недостаточность лютеиновой фазы (НЛФ). Признаки центральных нарушений регуляции функции яичников имелись у небольшого числа больных. Так, у 61 женщины был выявлен вторичный поликистоз яичников и у 25 определена умеренная гиперпролактинемия. У 72 женщин был диагностирован наружный генитальный эндометриоз с НЛФ. Оценку частоты оплодотворения и характера дробления эмбрионов при трубно-перитонеальном бесплодии проводили только при нормальной спермограмме мужа. Частоту оплодотворения определяли как отношение числа зигот к числу ооцитов. Выделяли три основных морфологических типа эмбрионов — эмбрионы, имеющие бластомеры без фрагментации, а также эмбрионы с легкой и выраженной степенью фрагментации цитоплазмы. Число бластомеров определяли перед переносом эмбрионов в полость матки. Культивирование ооцитов и эмбрионов продолжалось в течение 72 ч с момента пункции. Статистическую обработку количественных данных проводили на персональном компьютере IBM-PC 486 с использованием приложений по статистическим функциям в программе Microsoft Excel. Результаты Результаты исследования приведены на рис. 1. Среднее число ооцитов в 1-й группе составило 5,8±0,2, эмбрионов — 4,2±0,1. Среднее число ооцитов и эмбрионов при НЛФ не отличалось от аналогичных показателей у женщин с полноценным двухфазным циклом. НЛФ не влияла на способность ооцитов к оплодотворению. Достоверное снижение этого показателя по сравнению с двухфазным циклом отмечено при ановуляции (р меньше 0,05).
Здесь и на рис. 2: * — р меньше 0,05 по сравнению с контролем; ** — р меньше 0,05 по сравнению с НЛФ+поликистоз; *** — р меньше 0,05 по сравнению с НЛФ. Вторичный поликистоз наблюдали у 61 женщины, при этом у 29 имелась НЛФ, у 32 — ановуляция. Эффективность оплодотворения ооцитов у больных с поликистозом яичников и с НЛФ (69,2±3,2%) не отличалась от значения, характерного для НЛФ (69,5±2,7%). У женщин с поликистозом яичников и ановуляцией эффективность оплодотворения ооцитов (63,1±2,9%) была такой же, как и у больных с ановуляцией (65,3±3,3%). Таким образом, вторичный поликистоз яичников существенно не влияет на способность ооцитов к оплодотворению. Наружный генитальный эндометриоз не влиял на частоту оплодотворения ооцитов. У больных с НЛФ и умеренной гиперпролактинемией эффективность оплодотворения ооцитов была достоверно ниже, чем при НЛФ (р меньше 0,05). В дальнейшем нами были изучены особенности нарушения развития эмбрионов в культуре при недостаточности яичников. Повышение доли эмбрионов с аномальной морфологией (с выраженным процессом фрагментации бластомеров), а также замедление (или остановка) развития на стадии до 4 клеток (после культивирования в течение 48 ч со стадии пронуклеусов) являются характерными признаками нарушения развития эмбрионов в культуре. Повышение доли эмбрионов с выраженной фрагментацией бластомеров отмечено нами при ановуляции (р меньше 0,05), эндометриозе (р меньше 0,05) и при гиперпролактинемии (р меньше 0,05). При НЛФ и поликистозе яичников этого явления не наблюдалось (рис. 2).
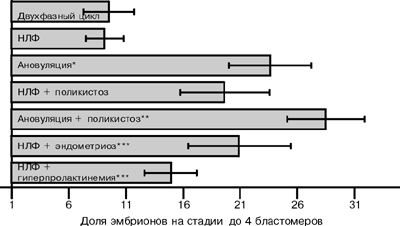
При анализе распределения эмбрионов по числу клеток (рис. 3) нами было показано, что происходит повышение доли эмбрионов на стадии до 4 бластомеров при ановуляции (р меньше 0,01), эндометриозе (р меньше 0,01) и при гиперпролактинемии (р меньше 0,01). При НЛФ нарушение дробления эмбрионов в культуре не отмечено. При поликистозе яичников и ановуляции доля эмбрионов на стадии менее 4 бластомеров составляла до 28,5—3,4%.
(3-й день культивирования). * — р меньше 0,01 по сравнению с контролем; ** — р меньше 0,05 по сравнению с НЛФ+поликистоз; *** — р меньше 0,01 по сравнению с НЛФ. Доля эмбрионов без признаков фрагментации бластомеров была максимальна у женщин с достаточным двухфазным циклом и составляла 68,4±2,5%. У больных с НЛФ наблюдалось достоверное снижение этого показателя. Данные о влиянии недостаточности яичников на частоту образования эмбрионов без фрагментации представлены на рис. 4.
(3-й день культивирования). * — р меньше 0,001 по сравнению с контролем; ** — р меньше 0,05 по сравнению с контролем; *** — р меньше 0,05 по сравнению с НЛФ. У женщин с двухфазным циклом доля эмбрионов на стадии 8 бластомеров и более составила 59,6±3,7%. При нормогонадотропной недостаточности яичников нами отмечено снижение этого показателя. Распределение доли эмбрионов на стадии 8 бластомеров и более у различных групп обследованных больных представлено на рис. 5.
(3-й день культивирования). * — р меньше 0,001 по сравнению с контролем; ** — р меньше 0,05 по сравнению с контролем; *** — р меньше 0,05 по сравнению с ановуляцией. Полученные данные свидетельствуют о влиянии нормогонадотропной недостаточности яичников на процесс дробления и морфологические показатели качества эмбрионов человека. Обсуждение Выяснение факторов, влияющих на способность женских половых клеток к оплодотворению и к последующему эмбриональному развитию в норме и при патологии, является актуальным в связи с разработкой общих представлений о молекулярно-клеточных механизмах регуляции фолликулогенеза, гаметогенеза и эмбриогенеза у человека [5]. Оптимизация методов культивирования половых клеток в программе ЭКО также невозможна без изучения влияния некоторых форм патологии на эффективность оплодотворения женских половых клеток и последующее эмбриональное развитие. В настоящее время в практике работы ряда лабораторий ЭКО с целью повышения эффективности оплодотворения ооцитов в культуре проводится инкубация сперматозоидов с фолликулярной жидкостью, а сыворотка крови применяется для культивирования гамет и эмбрионов [4]. Использование фолликулярной жидкости стимулирует гиперактивацию и акросомную реакцию в сперматозоидах, стимулирует созревание ооцитов и повышает эффективность их оплодотворения в культуре, а также улучшает преимплантационное развитие эмбрионов у человека. В то же время показано негативное влияние некоторых компонентов как фолликулярной жидкости, так и сыворотки человека на процесс оплодотворения ооцитов и последующее развитие эмбрионов у мышей. Cыворотка крови женщин с поликистозно измененными яичниками, а также у больных с эндометриозом ингибирует процесс оплодотворения и развитие эмбрионов мышей в культуре [6, 7, 8]. В связи с этим практически важным является выяснение вопроса об эффективности оплодотворения в культуре женских половых клеток и последующем развитии эмбрионов у больных с недостаточностью яичников для анализа целесообразности использования их фолликулярной жидкости или сыворотки крови как компонента культуральных сред. В настоящей работе нами был проведен сравнительный анализ способности женских половых клеток к оплодотворению в культуре у больных с трубно-перитонеальным бесплодием в сочетании с гормональной недостаточностью яичников. В качестве признаков, характерных для нарушения развития эмбрионов в культуре, нами были использованы такие показатели, как доля эмбрионов с выраженной степенью фрагментации бластомеров и частота встречаемости эмбрионов с 2—3 бластомерами. Ранее нами было показано, что выраженная степень фрагментации бластомеров снижает частоту наступления беременности в программе ЭКО [9]. НЛФ не влияла на частоту оплодотворения ооцитов, при этой патологии не отмечено также изменения доли эмбрионов как с выраженной степенью фрагментации цитоплазмы, так и c остановкой развития на стадии 2—3 бластомеров. У больных с ановуляцией эффективность оплодотворения ооцитов была снижена по сравнению с теми женщинами, у которых был двухфазный цикл. При этой патологии нами отмечено также повышение доли эмбрионов с выраженной степенью фрагментации бластомеров и увеличение частоты встречаемости эмбрионов на стадии до 4 бластомеров. В работе К. Hardy и соавт. [10] показано, что у больных с поликистозом яичников и ановуляцией развитие эмбрионов в культуре даже несколько лучше, чем у больных только с поликистозом. Следует отметить, что в нашей работе анализ был проведен на большей группе пациентов, а также на более продвинутой стадии культивирования эмбрионов (через 72 ч после выделения ооцитов из фолликулов). Оценка на этой стадии доли эмбрионов на стадии 2—3 бластомеров, а также с выраженной степенью фрагментации позволяет однозначно выявить процесс нарушения раннего эмбрионального развития. Вторичный поликистоз яичников не влиял на эффектичность оплодотворения ооцитов, а также на частоту встречаемости эмбрионов с выраженным процессом фрагментации бластомеров. Данные литературы о способности женских половых клеток к оплодотворению и дальнейшему эмбриогенезу у больных с поликистозом яичников неоднозначны. В ряде работ показано негативное влияние этой патологии на половые клетки и эмбрионы человека [11], а в других исследованиях этого эффекта не наблюдалось [10, 12]. Одним из возможных объяснений этого является влияние различных схем стимуляции фолликулогенеза. Так, при использовании схем стимуляции без агонистов гонадотропин-рилизинг гормона (а-ГнРГ) у больных с поликистозом яичников наблюдается повышение числа пунктированных фолликулов и ооцитов, но при этом снижается частота оплодотворения в культуре по сравнению с трубным бесплодием [13]. При стимуляции суперовуляции с использованием а-ГнРГ этих различий не выявляется [10, 14]. В нашем исследовании применялась схема стимуляции без использования а-ГнРГ, однако нами не отмечено влияния вторичного поликистоза яичников на эффективность оплодотворения ооцитов и развитие эмбрионов. Возможным объяснением расхождений в результатах подобного рода работ является использование в разных лабораториях различных способов инсеминации ооцитов в культуре. Применение специальных методов — тщательное удаление компонентов фолликулярной жидкости с помощью отмывания ооцитов в бессывороточных средах, а также частичная элиминация клеток кумулюса, которые могут синтезировать ряд ингибирующих факторов, с последующей сменой среды для культивирования зигот и эмбрионов — может влиять на эффективность оплодотворения и характер развития эмбрионов в культуре. При эндометриозе нами не отмечено снижения частоты оплодотворения ооцитов, в то же время вероятность нарушения развития эмбрионов при этой патологии была существенно выше, чем при НЛФ. В литературе имеются указания на влияние степени выраженности эндометриоза на качество гамет и эмбрионов [15], а также данные об отсутствии подобного эффекта [16]. В нашем исследовании анализировалась группа больных с эндометриозом I—II степени распространенности. По данным литературы, у этих больных эффективность оплодотворения ооцитов существенно выше, чем при эндометриозе III—IV степени [15]. Однако даже при I—II степени распространенности эндометриоза нами отмечено повышение частоты нарушения развития эмбрионов, что может являться следствием снижения качества женских половых клеток при этом заболевании. К аналогичному заключению пришли и некоторые зарубежные авторы, которые связывают это явление с нарушением стероидогенеза в фолликулах [17] или же с повышенной вероятностью возникновения апоптоза (генетически запрограммированной гибелью клеток) в клетках гранулезы [18]. У больных с гиперпролактинемией и с НЛФ как частота оплодотворения ооцитов, так и вероятность нарушения развития эмбрионов была ниже, чем у больных с НЛФ. Это указывает на снижение качества женских половых клеток при гиперпролактинемии. Следует отметить, что доля нормально развивающихся эмбрионов — без фрагментации цитоплазмы, имеющих 8 бластомеров и более, была максимальна у женщин с двухфазным циклом. При нормогонадотропной недостаточности яичников наблюдалось снижение частоты образования таких эмбрионов. Таким образом, недостаточность яичников у больных с трубно-перитонеальным бесплодием оказывает влияние на способность женских половых клеток к оплодотворению и к последующему эмбриональному развитию. Следует отметить, что недостаточность яичников вызывает повышение гетерогенности популяции эмбрионов как по морфологическим признакам, так и по темпам дробления. Причины, приводящие к различиям в скорости развития преимплантационных эмбрионов, еще мало понятны. Известно, что при культивировании эмбрионов млекопитающих происходит снижение темпов развития по сравнению с физиологическими. Остановка дробления эмбрионов человека наблюдается обычно на стадии от 4 до 8 бластомеров. Существенное повышение темпов развития отмечено при элиминации антибиотиков из культуральных сред [19], а также при значительном сокращении времени нахождения ооцитов в среде со сперматозоидами [20]. Таким образом, необходима дальнейшая оптимизация условий культивирования половых клеток и эмбрионов в программе ЭКО. Выводы Нормогонадотропная недостаточность яичников влияет на морфологические показатели и способность эмбрионов человека к развитию в культуре. При ановуляции снижается эффективность оплодотворения ооцитов в культуре. Гиперпролактинемия влияет на частоту оплодотворения ооцитов и характер дробления эмбрионов. При эндометриозе наблюдается повышение частоты остановки развития эмбрионов на ранних стадиях дробления. О.А. Воробьева, А.А. Кирсанов, В.В. Потин НИИ акушерства и гинекологии им. Д.О. Отта РАМН, Международный центр репродуктивной медицины, Санкт-Петербург Литература 1. Воробьева О.А., Потин В.В., Корсак В.С., Кирсанов А.А., Козлов В.В. Особенности оплодотворения ооцитов и развития эмбрионов в культуре в зависимости от реакции яичников на стимуляцию суперовуляции. Пробл репрод 1998; 5: 53—58. 2. Корсак В.С., Исакова Э.В., Воробьева О.А., Каменецкий Б.А., Кирсанов А.А. Применение золадекса (гозерелина) в схеме индукции суперовуляции в программе ЭКО. Пробл репрод 1996; 3: 23—27. 3. Bras M., Lens J.W., Piederiet M.H., Rijinders et. al. IVF Lab. Laboratory aspects of in vitro fertilization. N.Y. Organon 1996. 4. Chi H.J., Kim D.H., Koo J.J., Chang S.S. The suitability and efficiency of human follicular fluid as a protein supplement in human in vitro fertilization programs. Fertil Steril 1998; 70: 5: 871—877. 5. Потин В.В., Воробьева О.А. Современные представления о роли факторов роста в системе внутритканевых регуляторов репродукции. Пробл эндокрин 1993; 39: 58—62. 6. Deaton J.L., Demsey R.A., Miller K.A. Serum from women with polycitstic ovary syndrome inhibits fertilization and embryonic development in the murine in vitro fertilization. Fertil Steril 1996; 65: 6: 1224—1228. 7. Ito F., Fujino Y., Ogita S. Serum from endometriosis patiants impairs the development of mouse embryos in vitro-comparison with serum from tubal obstruction patient and plasmanate. Acta Obstet Gynecol Scand 1996; 75: 877—880. 8. Fallat M.E., Siow Y., Marra M., Cook C., Carrillo A. Mullerian-inhibiting substance in follicular fluid and serum: a comparison of patients with tubal factor infertility, polycystic ovary syndrome, and endometriosis. Fertil Steril 1997; 67: 5: 962—965. 9. Корсак В.С., Воробьева О.А., Кирсанов А.А., Игнатьева Т.В., Cеверова Е.Л. Влияние процесса фрагментации эмбрионов на частоту наступления беременности в программе IVF. Бесплодие, вспомогательные репродуктивные технологии. Киев 1997; 108—109. 10. Hardy K., Robinson F.M., Paraschos T., Wicks R., Franks S., Winston R. Normal development and metabolic activity of preimplantation embryos in vitro from patients with polycystic ovaries. Hum Reprod 1995; 10: 7: 2125—2135. 11. Dor J., Shulman A., Levran D., Ben-Rafael Z., Rudak E., Mashiach S. The treatment of patients with polycystic ovarian syndrome by in vitro fertilization and embryo transfer: a comparoson of results with those of patients with tubal infertility. Hum Reprod 1990; 5: 7: 816—818. 12. Trounson A., Wood C., Kausche A. In vitro maturation and the fertilization and developmental competence of oocytes recovered from untreated polycystic ovarian patiets. Fertil Steril 1994; 62: 2: 353—362. 13. MacDougall M.J., Tan S.L., Balen A., Jacobs H.S. A controlled study comparing patients with and without polycystic ovaries undergoing in vitro fertilization. Hum Reprod 1993; 8: 233—237. 14. Homburg R., Berkowitz D., Levy T., Feldberg D., Ashkenazi J. et al. In vitro fertilization and embryo transfer for the treatment of infertility associated with polycystic ovary syndrome. Fertil Steril 1993; 60: 858—863. 15. Pal L., Shifren J.L., Isaacson K.B., Chang Y., Leykin L., Toth T.L. Impact of varing stages of endometriosis on the outcome of in vitro fertilization-embryo transfer. J Assist Reprod Genet 1998;15: 1: 27—31. 16. Geber S., Paraschos T., Atkinson G., Margara R., Winston R.M. Results of IVF in pations with endometriosis: the severity of the disease does not affect outcome, or the incidence of miscarriage. Hum Reprod 1995; 10: 6: 1507—1511. 17. Harlow C.R., Cahill D.J., Maile L.A., Talbot W.M. et al. Reduced preovulatory granulosa cell steroidogenesis in women with endometriosis. J Clin Endocrinol Metab 1996; 81: 1: 426—429. 18. Nakahara K., Saito H., Saito T., Ito M., Ohta N. et al. Ovarian fecundity in patients with endometriosis can be estimated by the incidence of apoptotic bodies. Fertil Steril 1998; 69: 5: 931—935. 19. Magli M.C., Gianaroli L., Fiorentino A., Ferrareti A. et al. An inproved cleavage rate of human embryos cultured in antibiotic-free medium. Hum Reprod 1996; 11: 7: 1520—1524. 20. Gianaroli L., Magli M.C., Ferraretti A.P. et al. Reducing the time of sperm-oocyte interaction in human in vitro fertilization imprives the implantation rate. Hum Reprod 1996; 11: 101—106. |