К вопросу о хирургической тактике при синдроме тестикулярной феминизации.
|
Синдром тестикулярной феминизации [СТФ, тестикулярная феминизация; синдром андрогенной нечувствительности (Androgen insensitivity syndrome – AIS)] – наиболее часто встречающаяся форма мужского псевдогермафродитизма, обусловленная дефектом андрогенных рецепторов и характеризующаяся кариотипом 46, ХY, наличием тестикул и женскими или частично маскулинизированными наружными половыми органами [2, 3].
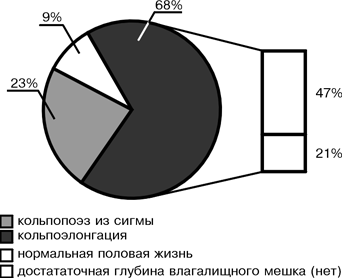
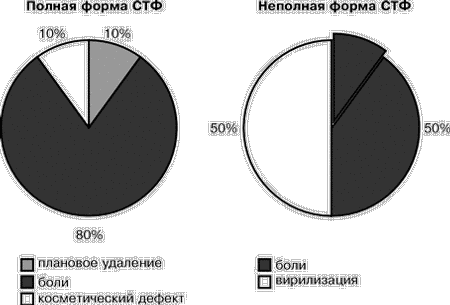
Традиционно СТФ классифицируется в клинические подгруппы, исходя из генитального фенотипа (полная форма синдрома, неполная форма синдрома). СТФ – сцепленный с Х-хромосомой признак. Патогенез СТФ обусловлен дефектом гена рецептора к андрогенам, который расположен на коротком плече Х-хромосомы. В процессе эмбриогенеза у этих больных под влиянием Y-хромосомы гонады дифференцируются как яички, которые секретируют тестостерон и вещество, ингибирующее мюллеровы протоки. Однако из-за дефекта гена андрогенных рецепторов отсутствует чувствительность к тестостерону и дигидротестостерону, ответственных за формирование мужского фенотипа (мужской уретры, предстательной железы, полового члена и мошонки). Таким образом, закономерно формируется женский фенотип при отсутствии производных мюллеровых протоков (маточных труб, матки и верхней трети влагалища). Взрослые больные отличаются женским телосложением с хорошо развитыми молочными железами, очень скудным лобковым и подмышечным оволосением, отсутствием внутренних половых органов и слепо заканчивающимся влагалищным мешком. Глубина влагалища может варьировать от нормальной до укороченной, вплоть до наличия вагинального углубления («ямки») 1–2 см по зонду. Неполный вариант имеет сходство с полной формой СТФ за исключением признаков маскулинизации (вирилизации) наружных половых органов и наличия полового оволосения [4, 5]. Цель работы: анализ хирургической тактики в отношении больных с СТФ; анализ причин удаления вентрофиксированных тестикулов. Материал и методы Изучен катамнез 90 больных с СТФ, проходивших стационарное обследование и оперативное лечение в ЭНЦ РАМН в 1967–1997 гг. Все больные были разделены на две группы: 1-я группа – 43 (47,8%) больных с полной формой СТФ и 2-я группа – 47 (52,2%) больных с неполной формой СТФ. Хирургическая тактика по отношению к тестикулам в ЭНЦ РАМН была различной в разное время. Так, с 1967 до 1987 г. использовалась предложенная И.В. Голубевой так называемая вентрофиксация тестикул. Состояние яичек оценивалось визуально, пальпаторно и гистологически (путем взятия экспресс-биопсии). В случае отсутствия опухоли тестикулы выводили из брюшной полости под кожу живота. Считалось, что основным фактором, способствующим малигнизации тестикулов, является высокая температура в брюшной полости. Соответственно было предположено, что при выведении яичек под кожу живота можно свести онкологический риск к минимуму и одновременно избежать заместительной гормональной терапии (так как яички сохранят свою функцию). Гонадэктомия выполнялась только при подозрении на опухоль тестикул или при их измененном внешнем виде (бугристость). Всем больным с неполной формой СТФ производилась феминизирующая пластика наружных гениталий (рассечение урогенитального синуса, пластическая ампутация клитора). В случае необходимости больным с обеими формами СТФ выполнялся кольпопоэз (формирование искусственного влагалища), чаще из сигмовидной кишки, иногда – с использованием брюшины ретровезикального кармана или проводилась кольпоэлонгация (механическое расширение и удлинение влагалища путем бужирования). Результаты В 1-й группе диагноз был поставлен на основании следующих критериев: обнаружение кариотипа 46,ХY (у 100% больных); характерное отсутствие полового оволосения (или скудного пушкового) при спонтанном развитии молочных желез (у 100%); первичная аменорея (у 100%); отсутствие производных мюллеровых протоков. У 16 (37,2%) больных в анамнезе была одно- двусторонняя паховая грыжа, иногда с интраоперационным обнаружением гонады и ее биопсией. Все больные этой группы имели телосложение женского типа с наружными гениталиями абсолютно женского вида, с очень скудным половым оволосением; были относительно высокорослыми (средний рост составил 171,1±10,5 см). Сроки наблюдения за больными колебались от однократного стационарного обследования (20 больных) до 25 лет динамического наблюдения (средний срок – 8,9 года). Шестнадцать больных впервые обратились в различные медицинские учреждения в детском возрасте в связи с наличием паховых грыж. Всем им было произведено грыжесечение и только четырем из оперированных (только в 22% случаев!) был поставлен диагноз СТФ (после биопсии содержимого грыжевого мешка). Остальные пациенты – 27 (63%) – впервые обратились к врачу в связи с отсутствием менструаций или по поводу скудного полового оволосения. Средний возраст первого обращения к врачу-гинекологу – 16–17 лет в больших городах и 22–26 лет – для жительниц села или отдаленных районов. Из них у 13 женщин (48%) диагноз был поставлен спустя несколько лет (от 2 до 14). Данные семейного анамнеза не противоречили известному факту об Х-сцепленном наследовании (5 пациенток имели родных «сестер» с подобной патологией, а у 4 больных по материнской линии были женщины с первичной аменореей, скудным половым оволосением). У всех 43 больных с полной формой тестикулярной феминизации слепо заканчивающийся влагалищный отросток имел глубину от 1,5 см до нормальной, не препятствующей половой жизни. 68% пациенток с полной формой СТФ имели достаточную глубину влагалищного мешка, не требующую оперативного вмешательства. Кольпопоэз из сигмовидной кишки был выполнен 10 пациенткам, в дальнейшем вели нормальную половую жизнь 5 из них, катамнестические данные о других больных отсутствуют. У 4 пациенток при укорочении влагалища до 4–5 см проведена кольпоэлонгация. Кроме того, у 5 больных отмечена тенденция к спонтанному увеличению глубины влагалища с возрастом, особенно при заместительной гормональной терапии. Это необходимо учитывать при выборе техники лечения (кольпопоэз или кольпоэлонгация). До 1987 г. было произведено 19 вентрофиксаций гонад у больных 1-й группы (с полной формой СТФ), из них у 11 больных в дальнейшем выполнено удаление вентрофиксированных тестикул (состояние тестикул у 8 больных неизвестно). Причинами их удаления были в 80% случаев боли тянущего характера, уплотнение и чувствительность при пальпации в области фиксированных гонад, появившиеся в среднем через 1,5–3 года после операции. В одном случае больная жаловалась на косметический дефект (выбухание) – гонадэктомия выполнена через 9 лет после вентрофиксации, по данным гистологического исследования в тестикулах сформировалась аденома из бесполостных семенных канальцев. В период 1967–1987 гг. было произведено 7 гонадэктомий из-за подозрения на опухолевый процесс. В одном случае была обнаружена арренобластома сертолиевого типа.
С 1987 г. двустороннюю гонадэктомию выполняли в плановом порядке всем больным с диагнозом тестикулярной феминизации (учитывая высокий риск малигнизации гонад). В группе больных с полной формой СТФ это составило 17 человек. Всем больным назначена заместительная гормональная терапия. По данным гистологического исследования гонад у больных с полной формой тестикулярной феминизации чаще всего отмечалась очаговая гиперплазия клеток Лейдига, у 12 (33%) больных – картина аденоматоза, причем у трех из них на этом фоне были выявлены опухолевые изменения: у 1 – внутриканальцевая сертолиома, у 2 – андробластомы сертолиевого типа. Еще в 2 случаях гистологическое исследование выявило тубулярную аденому (одна из них сформировалась в вентрофиксированной тестикуле, вторая обнаружена в интраабдоминально расположенной гонаде, удаленной у пациентки в возрасте 19 лет). Вторая группа больных (47) c неполной формой СТФ оказалась гораздо более разнородной. Больные отличались интерсексуальным телосложением, недостаточным развитием молочных желез в пубертате, маскулинизацией наружных гениталий, женским типом оволосения, коротким влагалищным мешком. Сроки наблюдения за больными 2-й группы колебались в широких пределах: от однократного стационарного обследования (8 больных) до 33 лет в одном случае, в среднем же составили 6,9 года. Причинами первого обращения к врачам были либо неправильное строение наружных гениталий, либо прогрессирующая вирилизация в период пубертата (13–14 лет). Всем 47 больным была выполнена феминизирующая пластика наружных гениталий, 18 больным была произведена гонадэктомия. Как и в случаях с полной формой СТФ, с 1987 г. гонадэктомия производилась всем больным в связи с онкологическим риском. Вентрофиксация тестикул была произведена у 28 больных. У 12 (44%) пациентов вентрофиксированные гонады были удалены: у 6 – из-за прогрессирующей вирилизации, у 6 – в связи с развившимся болевым синдромом. Состояние вентрофиксированных тестикулов у 8 (30%) больных неизвестно из-за отсутствия катамнестических данных. Семь других больных (26%) наблюдались в нашем центре от 2 до 15 лет (в среднем 7,5 лет); состояние фиксированных гонад было удовлетворительным (при пальпации – нормальных размеров, безболезненные). В дальнейшем всем рекомендована гонадэктомия. По данным гистологического исследования, у большинства больных с неполной формой СТФ имел место выраженный сперматогенез, а также диффузная гиперплазия клеток Лейдига и гиалиноз канальцев. Ни в одном случае не было обнаружено опухолевого перерождения гонад. Кольпопоэз из сигмовидной кишки был выполнен 13 (27,7%) больным; в одном случае понадобилось иссечение рубцового сужения преддверия влагалища из-за невозможности половой жизни. Обсуждение Изучение катамнеза 90 больных, обследованных в ЭНЦ РАМН за период с 1967 по 1997 гг. с диагнозом СТФ, выявило следующее. Хирургическая тактика в отношении тестикулов была различной в разное время: в начале 60-х годов гонады удаляли (сохранилась история болезни с описанием одной из первых подобных операций, произведенных в ЭНЦ). Затем был длительный период – с 1967 до 1987 г., когда тестикулы выводили из брюшной полости, но не удаляли, а фиксировали под кожей живота, рассчитывая, что риск малигнизации гонад, помещенных в более физиологичные для них температурные условия, сведется к минимуму, а уровня собственных эстрогенов будет достаточно для феминизации организма без применения заместительной гормональной терапии. Однако у нескольких пациенток с полной формой тестикулярной феминизации были обнаружены опухоли гонад (гистологически подтвержденные): у 2 больных (19 и 28 лет) – тубулярная аденома, причем у одной аденома сформировалась в вентрофиксированном тестикуле через 9 лет (гистологическое исследование, проведенное перед фиксацией гонады, выявило лишь умеренную гиперплазию клеток Лейдига); еще у 2 больных (16 и 25 лет) – андробластомы (одно- и двусторонняя); у 1 пациентки (20 лет) – сертолиома канальцевого типа. Кроме того, из 10 случаев вентрофиксаций тестикулов, произведенных в детском возрасте (в среднем в 6,5±3 года) пациенткам с неполной формой СТФ, только у 1 больной наблюдалась спонтанная феминизация фенотипа. Таким образом, очевидно, что тактика вентрофиксации тестикулов не оправдала возлагаемых надежд: с одной стороны, при неполной форме СТФ оставленные тестикулы не способствовали феминизации фигуры, а наоборот, вызывали прогрессирующую вирилизацию фенотипа. С другой стороны, риск опухолевого перерождения гонад слишком высок: по нашим данным 5,6%; по данным литературы, риск малигнизации увеличивается c возрастом и составляет от 3% у больных до 20 лет, выше 30% – у больных старше 50 лет [8]. Из вышеизложенного следует вывод: единственно верной тактикой при СТФ в настоящее время является гонадэктомия. Это положение принято во всем мире. Однако вопрос о сроках проведения данной операции у лиц с полной формой СТФ до сих пор не решен однозначно. Поскольку описаны случаи обнаружения интратубулярной неоплазмы герминативных клеток (называемой сейчас карциномой in situ, C.I.S.) у детей [7] и даже в двухмесячном возрасте [6], нам представляется необходимым проведение гонадэктомии в максимально ранние сроки, сразу после диагностики этой формы ложного мужского гермафродитизма (с последующей заместительной гормональной терапией начиная с препубертатного возраста). Необходимо подчеркнуть, что в детском возрасте больные с полной формой СТФ часто обращаются к хирургам по поводу одно- или двусторонней паховой грыжи. Если у девочек любого возраста при операции по поводу грыжи содержимое грыжевого мешка оказывается похожим на яичко, то данное образование подлежит удалению и обязательному гистологическому исследованию, с результатом которого ребенок должен быть направлен к эндокринологу для дальнейшего обследования и эндокринной реабилитации.
Выводы 1. Операция вентрофиксации тестикул, принятая ранее, является нецелесообразной. Всем больным с диагнозом синдрома тестикулярной феминизации показана двусторонняя гонадэктомия в максимально ранние сроки с последующей заместительной гормональной терапией. 2. Операции по формированию искусственного влагалища, особенно при полной форме СТФ, целесообразнее проводить не ранее 18–20 лет, при достаточной эстрогенизации организма при помощи заместительной гормональной терапии, поскольку отмечается тенденция к увеличению глубины влагалищного отростка под воздействием эстрогенов, что в некоторых случаях позволяет вообще избежать планируемого ранее кольпопоэза или провести консервативные мероприятия (кольпоэлонгацию), дающие пациентам возможность в дальнейшем вести нормальную половую жизнь. А.А. Пищулин, И.С. Яровая, А.Н. Тюльпаков, О.В. Манченко Эндокринологический научный центр РАМН, Москва Литература 1. Голубева И.В. Гермафродитизм (клиника, диагностика, лечение). М.: Медицина 1980; 86, 89, 92–99, 108–112, 115–120. 2. Жуковский M.A. Нарушения полового развития. М.: Медицина 1989; 181–193. 3. Йен С.С.К., Джаффе Р.Б. Репродуктивная эндокринология. Пер. с англ. М.: Медицина 1998; 1: 402–404. 4. Paul Saenger M.D. The journal of pediatrics. 1984; 104: 1: 10–11. 5. Charmian A. Quigley at al. Androgen Receptor Defects: Historical, Clinical, and Molecular Perspectives. Endocrine Reviews, 1995 by The Endocrine Society. 6. Muller J., Skakkebaek N. Testicular carcinoma in situ in children with the androgen insensitivity (testicular feminisation) syndrome. Br Med J 1984; 288: 1419–1420. 7. Cassio A., Cacciari E., DґErrico A., Balsamo A., Grigioni F.W., Pascucci M.G., Bacci F., Tacconi M., Mancini A.M. Incidence of intratubular germ cell neoplasia in androgen insensitivity syndrome. Acta Endocrinol (Copenh) 1990; 123: 416–422. 8. Manuel M., Katayama K.P., Jones Jr. The age of occurrence of gonadal tumors in intersex patients with a Y chromosome. Am J Obstet Gynecol HW 1976; 124: 293–300. |