Клонирование: прошлое, настоящее... будущее?
|
Словарь
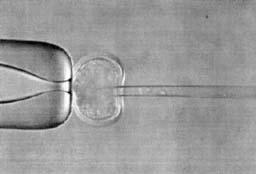
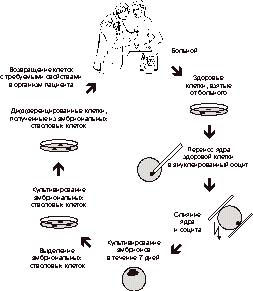
Каллусные клетки - мало дифференцированные клетки, возникающие, как правило, на раневой поверхности растения и обладающие свойством дифференцироваться в различные ткани. Тотипотентность - способность отдельной клетки дать начало целому организму. Плюрипотентность - способность отдельной клетки дифференцироваться в любой вид ткани организма. Эффективность клонирования - отношение количества эмбрионов, развившихся до стадии взрослого организма, к общему количеству клонированных эмбрионов. Энуклеация - удаление ядер из клетки. Кариопласт - изолированное донорское ядро вместе с окружающей цитоплазмой и плазматической мембраной. Цитопласт - энуклеированная яйцеклетка или зигота, в которую переносят донорское ядро. Биореакторы - генетически модифицированные животные, которые создаются для производства белков или других биологически активных веществ для использования в медицине. Экспрессия гена - процесс считывания информации и синтеза закодированного полипептида. Клонирование - это получение генетически идентичных живых организмов. Термин имеет греческий корень «klon» - веточка или черенок, с помощью которых осуществляется вегетативное размножение некоторых растений. Создание ядерных трансплантатов и, в частности, получение клональных животных - совершенно новая технология в современной биологии. В отличие от сельского хозяйства, в котором вегетативное размножение (т.е. собственно клонирование) давно широко используется, практическое применение методов клонирования млекопитающих находится в стадии активного обсуждения. Термин клонирование подразумевает прежде всего способность ядер клеток взрослого организма обеспечивать развитие другого взрослого организма. Эта способность четко была продемонстрирована сначала на клетках моркови и табака. В 1958 г. Стюард и его коллеги разработали методику, позволившую получить в условиях in vitro из отдельных соматических клеток дифференцированной ткани корня моркови целое новое растение. Было показано, что любая растительная клетка, не потерявшая в процессе дифференцировки ядра или цитоплазмы, может в культуре превратиться в каллусную тотипотентную клетку и дать начало новому организму. Вазил и Хильдебрандт провели аналогичные опыты на клетках табака. Как из клеток моркови, из клеток табака развивались растения, которые могли давать семена. Любая дифференцированная клетка, имеющая неразрушенное ядро, обладает полным набором генов, необходимых для формирования целого организма. Однако в процессе дифференцировки часть генов выключается и функционально активны только некоторые из них, которые определяют свойства и функции данной ткани. У растений гаметы образуются из соматических клеток, поэтому нет ничего удивительного в том, что единичная клетка может давать начало другому типу клеток и сформировать генетически однородный клон. У животных половые клетки обособляются довольно рано в ходе эмбриогенеза и только в процессе полового размножения, при котором происходит слияние мужской и женской гамет, образуется зигота, несущая свойства тотипотентности и плюрипотентности, то есть способна дать начало целому организму и дифференцироваться в клетки любого вида ткани взрослого организма. Этим существенным отличием и объясняется главное препятствие для клонирования позвоночных животных. 1. Клонирование эмбрионов амфибий С самого начала 19-го столетия ученые пытались решить вопрос о том, является ли сужение функций ядра дифференцированной клетки процессом необратимым. В 1938 г. Ганс Шпеман предложил произвести опыт по переносу ядра какой-либо дифференцированной клетки в яйцеклетку, собственное ядро которой было предварительно удалено. Отсутствие техники энуклеации яйцеклеток-реципиентов, изоляции донорских ядер и их интактного переноса в яйцеклетки не позволили в то время произвести такой эксперимент. Эти методы были разработаны только в 50-х годах американскими исследователями Бриггсом и Кингом. Однако предложение знаменитого ученого воспринимается в науке теперь как момент рождения новой технологии переноса ядер. Тогда же оно было выдвинуто лишь как метод для изучения роли генетического материала в процессах дифференцировки. Г. Шпеман в своих опытах продемонстрировал, что клетки бластулы недетерминированы, и, следовательно, их ядра тотипотентны. Бриггс и Кинг стали переносить ядра клеток бластулы в механически энуклеированные (лишенные ядра) яйцеклетки леопардовой лягушки Rana pipiens. Около 60% трансплантированных ядер были способны направлять развитие до стадии свободно плавающего головастика, однако при использовании ядер клеток гаструлы только около 20% из них оказались способны поддерживать развитие до стадии головастика, и ни одна из яйцеклеток с трансплантированным ядром соматической клетки от головастика на стадии хвостовой почки не смогла привести к нормальному развитию зародыша. В дальнейшем была разработана методика клонирования ядер, согласно которой после получения бластул методом трансплантации ядер от зародышей на разных стадиях развития в энуклеированные ооциты, эти бластулы становились источником донорских ядер, которые переносили в другие энуклеированные ооциты. В результате было выяснено, что в пределах одного клона (от одной бластулы) ядра обладают одинаковыми потенциями, то есть все клонированные ядра обеспечивают развитие до какой-либо определенной стадии. Кроме того, если личинки развивались с какими-либо дефектами, то эти дефекты у всех личинок одного клона были одинаковыми. Была выявлена закономерность прогрессивного ограничения потенций ядер по мере развития головастиков, что свидетельствовало об отличии ядер в разных дифференцированных клетках. Большего успеха в клонировании эмбрионов амфибий добился английский биолог Джон Гердон. Он не удалял хирургическим путем ядро яйцеклетки-реципиента, а разрушал его ультрафиолетовыми лучами. Ядра клеток донора имели генетический маркер - одно ядрышко на клетку вместо обычных двух. Объектом его исследований стала более примитивная южноафриканская шпорцевая лягушка Xenopus laevis. В отличие от леопардовой лягушки взрослая особь Xenopus способна регенерировать утраченные конечности, раннее развитие у нее протекает в три раза быстрее. Возможно, это и явилось залогом его успеха. Гердон использовал метод серийных пересадок ядер и подтвердил гипотезу о постепенной утрате потенций по мере развития. Английский исследователь переносил ядра эпителиальных кишечных клеток в активированные энуклеированные ооциты шпорцевой лягушки. Число ядер, обеспечивающих нормальное развитие, составило около семи процентов. Некоторые из них были способны реализовывать генетическую информацию только до стадии бластулы, другие - до стадии плавающего головастика, но, кроме того, семь головастиков (около 1% от оперированных эмбрионов) претерпели метаморфозу и превратились в половозрелых взрослых лягушек, то есть трансплантированные ядра были тотипотентными. Эти результаты были с недоверием восприняты другими учеными, поскольку развитие взрослых особей из ядерных трансплантатов могло быть связано с использованием ядер первичных половых клеток, которые возникают из энтодермы и длительное время присутствуют среди клеток эпителия кишечника. В последующих работах Гердон пытался брать в качестве донорских ядра безусловно дифференцированных клеток межпальцевых перепонок шпорцевой лягушки.Однако при пересадке ни одно из них не обеспечивало развитие дальше стадии нейрулы. Сходные результаты получили и другие исследователи. Ди Берардино и Хофнер в 1983 г. показали, что ядра таких дифференцированных клеток амфибий (Rana pipiens), как эритроциты, при пересадке в энуклеированные ооциты могут поддерживать развитие только до стадии ранней гаструлы, но в то же время серийная пересадка таких ядер обеспечивала развитие нормальных плавающих головастиков, что свидетельствовало об инактивированном состоянии генов в эритроцитах взрослой лягушки, контролирующих формирование головастиков, и процессах репрограммирования ядер в цитоплазме яйцеклеток-реципиентов при серийных пересадках. По причине безуспешных попыток клонирования Ди Берардино в 1987 г. пришла к заключению, что «на сегодня еще не доказано, что ядра клеток хотя бы одного какого-либо специализированного типа или клеток взрослого организма являются тотипотентными». Проблема клонирования амфибий остается нерешенной и по сей день. Теперь уже можно судить о том, что эта модель была выбрана учеными для подобных исследований не очень удачно, поскольку клонирование млекопитающих оказалось делом более простым. Не стоит забывать, что развитие микроскопической техники и технологии микроманипуляций в в то время еще не позволяло манипулировать с эмбрионами млекопитающих и проводить трансплантацию ядер. Объем яйцеклетки амфибий примерно в 1000 раз больше объема ооцита плацентарных, поэтому амфибии и были так привлекательны для изучения ранних процессов развития. Опыты с пересадкой клеточных ядер в энуклеированные яйцеклетки амфибий позволили глубже заглянуть в тонкие механизмы функционирования клеточного ядра и доказать, что ядра различных дифференцированных клеток одного организма генетически идентичны; в процессе дифференцировки они постепенно теряют способность направлять развитие реконструированных яйцеклеток, а серийные пересадки ядер и культивирование клеток in vitro повышает потенции ядер соматических клеток обеспечивать нормальное развитие реконструированных эмбрионов. 2. Перенос ядер в яйцеклетки млекопитающих К середине 70-х имелись все предпосылки для начала экспериментов по клонированию млекопитающих. Наиболее удобными объектами казались в то время мелкие лабораторные животные, а именно: мышь и кролик. К этому моменту уже были проведены фундаментальные исследования биологии и генетики развития ранних этапов эмбриогенеза этих животных. Технология микроманипуляций уже позволяла проводить эксперименты по созданию химер инъекционным методом и была достаточно развита для проведения работ по трансплантации клеточных ядер в яйцеклетки мышей. В 1969 г. Крис Грэхам показал, что соматические клетки могут сливаться с оплодотворенными и неоплодотворенными мышиными яйцеклетками и развиваться в условиях in vitro до стадии морулы. Дерик Бромхол в начале 70-х переносил ядра из морул в яйцеклетки кролика с помощью микроинъекции или слияния бластомеров с овулированными ооцитами. Слияние индуцировалось действием инактивированного вируса Сендай, который в то время широко использовался для получения клеточных гибридов. Оба исследователя не энуклеировали реципиентное яйцо, поэтому нет ничего удивительного в том, что триплоидные и тетраплоидные эмбрионы очень скоро погибали. Значительный шаг в развитии технологий переноса ядер был сделан в конце 1970-х - начале 1980-х, когда Модлинский микрохирургически трансплантировал клеточные ядра ранних эмбрионов мыши в зиготы, из которых в результате развивалось небольшое количество тетраплоидных эмбрионов до стадии бластоцисты. Он обнаружил, что ядра из внутренней клеточной массы бластоцисты могли поддерживать развитие тетраплоидного зародыша до стадии бластоцисты, тогда как ядра из клеток трофоэктодермы не обладали этой способностью. Следующим достижением в развитии технологии пересадки ядер явился новый метод, предложенный в 1983 г. МакГратом и Солтером, который заключался в удалении обоих пронуклеусов из зигот мышей с помощью стеклянной микропипетки. Один или два пронуклеуса извлекались с небольшим количеством окружающей цитоплазмы без нарушения целостности мембраны, которая осторожно перешнуровывалась при соприкосновении с краем разрыва блестящей оболочки. Пронуклеус с небольшим количеством цитоплазмы представляли собой кариопласт, а полностью энуклеированная зигота - цитопласт. Донорский кариопласт вводился вместе с вирусом Сендай через разрыв под zona pellucida. Эта методика оказалась надежной, простой в исполнении и с небольшими модификациями используется до сих пор. С помощью этого метода было выяснено, что для нормального развития эмбриона необходимы гены, достающиеся от обоих родителей, а отцовский и материнский геномы функционально различны. Несмотря на свое изобретение, МакГрат и Солтер были разочарованы, так как хотя обмен пронуклеусами между двумя зиготами и приводил к развитию достаточного числа эмбрионов, но зиготы с трансплантированным ядром от четырехклеточного эмбриона и старше не развивались вовсе. Разочарование было настолько сильным, что МакГрат и Солтер отказались от дальнейших экспериментов и заявили о биологической невозможности клонирования млекопитающих из-за функциональных отличий отцовского и материнского геномов. К счастью, их предсказание не сбылось: Виладсен опубликовал в 1986 г. результаты клонирования овец путем пересадки ядер бластомеров 8- и 16-клеточных эмбрионов. Успех Виладсена может быть объяснен тем, что он использовал в качестве цитопласта энуклеированный ооцит, а не зиготу: энуклеированная яйцеклетка представляет собой лучший реципиент, поскольку предоставляет донорскому ядру больше времени для адаптации и репрограммирования в цитоплазме. К тому же, как позднее оказалось, овцу легче клонировать, чем мышь. В эмбриогенезе мыши клеточные ядра рано теряют тотипотентность, что связано с ранней активацией генома зародыша - на стадии 2 бластомеров. У кроликов, овец и крупного рогатого скота активация первой группы генов в эмбриогенезе, то есть начало усиленного считывания с них информации - транскрипция, происходит позднее, а именно на 8-16-клеточной стадии. Американским исследователям во главе с Робл из Висконсинского университета в 1987 г. удалось получить здоровых телят после переноса эмбрионов в матку коровы-реципиента, полученных при трансплантации пронуклеусов зигот в другие энуклеированные зиготы. К этому времени уже было установлено, что электрослияние является наиболее надежным методом переноса клеточного ядра в цитоплазму энуклеированного реципиента: зиготы или ооцита. Обработка кариопластов, подсаживаемых под zona pellucida, вирусом Сендай оказалась почти в 10 раз менее эффективной. В 1988-1989 гг. последние достижения в области переноса ядер позволили американским ученым клонировать эмбрионы кролика на 8-клеточной стадии, эмбрионы свиней на 4-клеточной стадии. Работа с сельскохозяйственными видами животных постоянно ставила перед учеными интересные вопросы, на которые требовалось найти ответ. Например, чтобы освободить для энуклеации пронуклеусы в зиготах крупного рогатого скота от липидных гранул, необходимо было их центрифугировать при 15 000 g, у свиней из-за того, что малоплодная беременность не развивается, приходилось подсаживать в яйцеводы вместе с ядерными трансплантатами и полученные в результате ЭКО эмбрионы. Однако оказалось, что при смешанном переносе происходит негативная селекция реконструированных эмбрионов и они замирают на ранних стадиях. Выход из затруднительного положения был найден: трансплантация не менее 50-100 реконструированных эмбрионов в матку животного-реципиента обеспечивала имплантацию и развитие всего нескольких из них. 3. Начало новой эры: клон из ядра соматической клетки Когда технология использования ядер из бластомеров ранних эмбрионов для клонирования достигла реальных успехов, стало понятным, что это не принесет значительной коммерческой выгоды для применения в сельском хозяйстве. Коммерческое клонирование в сельскохозяйственной отрасли преследует две цели - это создание высокопродуктивных животных с желаемым фенотипом, то есть копий животных-рекордистов, и размножение генетически модифицированных трансгенных животных-биореакторов, которые производили бы ценные биологически активные вещества. Выполнение этих задач становится возможным, если источником донорских ядер служат ткани взрослых животных (для клонирования особей с известным фенотипом) или линии клеток (для их генетической модификации и отбора в культуре). Поэтому можно назвать настоящей революцией в эмбриологии достижение англичан Уилмута и соавт., которыми было получено в 1997 г. первое клональное животное по кличке Долли из ткани взрослого животного. Ученые выделили первичную культуру клеток молочной железы шестилетней овцы породы Фин Дорсет, находившейся в последнем триместре беременности, которая состояла на 90% из эпителиальных клеток молочной железы, кроме того, она содержала миоэпителиальные клетки и фибробласты. Перенос ядер более эффективен, если клетки-доноры находятся в стадии G-0 или G-1 клеточного цикла, но не в S или G-2, что связано с процессом репликации геномной ДНК в стадии S, которую может нарушить смена цитоплазматического окружения ядра. Выход донорских клеток из цикла роста и остановка в стадии G-0 достигались снижением концентрации фетальной телячьей сыворотки в культуральной среде с 10 до 0,5% в течение 5 дней. Трансплантация ядер осуществлялась после 3-6-го пассажа в энуклеированные ооциты овцы породы шотландская черномордая. Всего было реконструировано 277 эмбрионов, из них получено и перенесено в матку животных-реципиентов 29 морул и бластоцист, в результате развилась только одна беременность, которая завершилась рождением здорового ягненка. Не исключена возможность того, что успех был связан с наличием в первичной культуре небольшого количества тканеспецифичных стволовых клеток, которые поддерживают регенерацию эпителиальных клеток молочной железы во время беременности, одна из которых и могла стать донором ядра. Рождение ягненка указывает на то, что в клетках молочной железы нет необратимой модификации генетической информации, необходимой для нормального развития плода. Это соотносится с общепринятым взглядом, что дифференциация у млекопитающих происходит за счет систематических, дискретных изменений в генной экспрессии, возникающих при взаимодействии между ядром и меняющимся составом цитоплазмы. С удовлетворением весь научный мир воспринял известие о нормальной фертильности Долли: в апреле 1998 г. она принесла ягненка Бонни, а в марте 1999 г. суягность завершилась рождением тройни.
4. Клонирование мышей После блестяще выполненных экспериментов Уилмута, сообщения о клонированных животных других видов стали появляться в научных журналах чуть ли не каждый день. В июле 1998 г. в журнале «Naturе» появилась статья японца Вакаямы и коллег об успешной попытке клонирования мыши из ядер кумулюсных клеток. Во второй серии экспериментов было реконструировано и подсажено в яйцеводы 54 мышей-реципиентов 800 эмбрионов. На 19-й день беременности исследователи произвели кесарево сечение и обнаружили пять мертвых и 17 живых мышат, из которых шесть погибли вскоре после операции, а один - через семь дней. В итоге десять мышат остались живыми (самый первый был назван Кумулиной от латинского термина cumulus oophorus), и все, как и следовало ожидать, оказались самками. Попытки клонировать мышей из нервных клеток и клеток Сертоли окончились неудачей. В настоящее время проведены фундаментальные исследования проблемы клонирования мышей. В качестве клеток-доноров трансплантируе мых ядер использовались как клетки взрослых животных: кумулюсные, фибробласты из кончика хвоста, клетки селезенки и тимуса, макрофаги, нервные клетки и клетки Сертоли, так и фетальные: клетки овариальной и тестикулярной тканей, а также эмбриональные стволовые клетки. Полноценное эмбриональное развитие и рождение здоровых и плодовитых клональных мышей было достигнуто только при трансплантации ядер кумулюсных клеток, клеток Сертоли, фибробластов из кончика хвоста, эмбриональных стволовых клеток и фетальных клеток гонад. В этих случаях количество новорожденных мышат не превышало 3% от общего числа реконструированных ооцитов. Ядра клеток остальных исследованных тканей были способны поддерживать развитие эмбрионов чаще всего лишь до стадий морулы и бластоцисты, в немногих случаях наблюдалось спонтанное прерывание беременности на 7-18-дневном сроке. Все новорожденные обладали патологией плаценты. Ее вес был увеличен по сравнению с контролем. Была выяснена интересная закономерность, что вес плаценты зависит от стадии развития донорской клетки. Если трансплантировались ядра из клеток взрослых мышей, плацентарный вес составлял 0,3 г, если из эмбриональных стволовых или фетальных - 0,24-0,3 г, в норме же он составляет 0,1 г. Коллектив авторов из Гавайского университета во главе с профессором Р. Янагимачи провели изучение поведенческих реакций и моторной активности у клонированных мышей с помощью специальных тестов. В результате исследования оказалось, что способность обучения, запоминания, двигательная активность и моторные реакции у клонов отличались от таковых у контрольных животных незначительно. Из-за низкой эффективности переноса ядер не удалось получить такое количество клональных мышей одинакового возраста, которое позволило бы рассматривать эти данные как статистически достоверные. Однако было установлено, что вес клонированных мышат имел существенные отличия начиная с 8-10-недельного возраста. Они были заметно крупнее своих сородичей и в возрасте одного года весили в среднем 60,41±9,51 г, тогда как в контроле - 48,56±1,66 г. В остальном клоны ничем не отличались от мышей той же линии и одного возраста. Янагимачи с сотрудниками создали целую популяцию клональных мышей, что позволило им перенести методику трансплантации ядер на уже клонированных животных и в течение 6 поколений получать здоровое и плодовитое потомство. 5. Применение клонирования у продуктивных животных На современном этапе еще трудно определить, найдет ли техника переноса ядер широкое применение в медицине, однако в других сферах, таких как, например, создание животных-биореакторов для производства биологически активных веществ, клонирование в сочетании с технологией трансгенеза начинает постепенно занимать прочное положение. Известие о клонировании крупного рогатого скота пришло в декабре 1998 г., когда японцам И. Като, Т. Тани и др. удалось получить 8 здоровых телят после переноса 10 реконструированных эмбрионов в матку коров-реципиентов. На сегодня клональные телята получены из клеток взрослого животного, а именно: кумулюсных, клеток яйцеводов, кожи, уха печени, мышечных, кожных фибробластов, клеток гранулезы; а также фетальных клеток - кожных фибробластов. Клоны из клеток взрослого крупного рогатого скота абортируются чаще и имеют более серьезную патологию, чем если они из клеток плода или новорожденного теленка. В августе-сентябре 2000 г. появилось сразу два сообщения в журналах «Science» и «Nature» о клонировании свиней в Японии и США. В статье коллектива авторов из Японии заявлялось о получении клонального поросенка из ядер клеток культуры фетальных фибробластов после 2-6 пассажей. В сообщении американцев, работой которых, собственно говоря, руководил человек, клонировавший Долли, - англичанин К. Кэмпбелл, говорилось впервые в истории клонирования о рождении пяти поросят после переноса ядер клеток гранулезы взрослых свиней. Ими была разработана специальная методика двойной трансплантации. На первом этапе клетка гранулезы сливалась с неоплодотворенной яйцеклеткой, находящейся в фазе МII митоза, после формирования псевдопронуклеуса начинался второй этап - извлечение псевдопронуклеуса с небольшим количеством окружающей цитоплазмы и электрослияние с энуклеированной, сформировавшейся in vivo зиготой. Клетки гранулезы культивировались in vitro до 100% конфлуенции для контактной синхронизации клеточного цикла (G1/G0). Двум группам исследователей пришлось столкнуться с проблемой спонтанного прерывания супоросности свиней, если количество хороших имплантирующихся эмбрионов было меньше четырех. Только одновременная трансплантация большого количества эмбрионов и гормональное поддержание беременности способствовали нормальному вынашиванию. Клонирование свиней перспективно для повышения мясной продуктивности и ксенотрансплантации. 6. Клонирование и трансгенез Трансгенез - это техника переноса экзогенной ДНК, то есть генов, через клетки зародыша в целый новый организм. Эксплуатируя этот метод, можно получать животных, несущих качественно новые признаки. Например, возможно создание пород, устойчивых к заболеваниям или несущих новые, полезные для промышленной деятельности человека признаки. С распространением трансгенеза процесс создания новых пород и линий продуктивных животных значительно ускорится, кроме того, этот метод позволяет уже в настоящее время перенести исследования функциональной активности генов in vitro (на культурах клеток) в условия in vivo (на живых организмах), что важно для понимания фундаментальных основ жизни. По мнению многих видных ученых, технология создания трансгенных животных - это одна из наиболее захватывающих отраслей науки, появившихся в последние два десятилетия. Производство человеческих рекомбинантных медицинских препаратов из молока трансгенных животных служит выходом из многих затруднений, связанных с микробными биореакторами, таких как отсутствие у бактерий посттрансляционных модификаций белков, неправильное складывание молекул синтезируемого вещества, высокие расходы на очищение. Использование клеточных культур животных в качестве биореакторов характеризуется высокими расходами на культуральные среды и невысоким выходом продукта. Поэтому многие специалисты в области клонирования видят главную задачу в применении технологии переноса ядер для создания и размножения трансгенных животных с полезными свойствами. В настоящее время существуют разные технологии создания трансгенных животных. Наиболее распространенный - это микроинъекции генных конструкций в пронуклеусы зигот млекопитающих. Серьезным препятствием на пути использования этого метода является низкая эффективность его применения у сельскохозяйственных видов животных (<1%). Техника переноса ядер может помочь в решении и этой проблемы. Создание трансгенных животных методом клонирования, как правило, начинается с получения культуры клеток-доноров ядер. В 1997 г. И. Вильмут, К. Кэмпбелл и др. выделили культуру овечьих фетальных фибробластов из плодов на 35-дневном сроке суягности. На втором этапе фибробласты трансфицировались экзогенной ДНК: двумя генными конструкциями, одна из которых несла ген 9-го фактора свертывания крови (ген интереса) под бета-глобулиновым промотором, вызывающим экспрессию в молочной железе овец, а другая - ген устойчивости к антибиотику неомицину (маркерный), который позволил отобрать трансфицированные клоны, которые в дальнейшем подвергались анализу на содержание нужного гена. Перенос ядер трансфектантов в энуклеированные ооциты происходил по методике, использованной при клонировании Долли. В итоге было получено три трансгенных ягненка, несущих оба гена: маркерный и ген интереса. Белок 9-й фактор свертывания крови играет важную роль в коагуляции крови, его недостаток вызывает гемофилию В. В настоящее время он производится из человеческой сыворотки, поэтому выработка этого белка из молока овец могла бы стать альтернативным источником, лишенным потенциальной возможности переноса инфекционных заболеваний. Это было первое сообщение о рождении трансгенных животных в результате применения технологии клонирования. Уже известно о получении с использованием метода переноса ядер трансгенных мышей, крупного рогатого скота, овец и коз. В качестве доноров ядер использовались как трансфицированные культуры эмбриональных фибробластов, так и эмбриональных стволовых клеток. 7. Технология клонирования и спасение исчезающих видов Внедрение в практику методов межвидового переноса ядер может открыть невиданные перспективы для спасения находящихся на грани исчезновения видов животных. Как было показано в работе Т. Доминко и соавт. в 1999 г., энуклеированные ооциты крупного рогатого скота после электрослияния с ядрами кожных фибробластов быков (Bos taurus), овец (Ovis aries), свиней (Sus scrofa), обезьян (Macaca fascicularis) и крыс (Rattus rattus) могут поддерживать развитие эмбрионов до ранних стадий (в некоторых случаях до стадий бластоцисты). В других исследованиях было зафиксировано, что энуклеированные яйцеклетки крупного рогатого скота обеспечивают реализацию генетического материала донорских ядер из соматических клеток человека даже до более продвинутых эмбриональных стадий. Это является свидетельством того, что даже перенос ядер в ооциты далеких в эволюционном отношении видов обеспечивает их частичное репрограммирование. А может ли быть так, что трансплантация ядер в энуклеированные яйцеклетки близких видов приведет к получению полноценного здорового потомства? В конце 2000 - начале 2001 г. весь научный мир следил за попыткой исследователей из американской фирмы «АСТ» клонировать вымирающий вид буйволов Bos gaurus (гяур), который распространен на территории Индии и Юго-Западной Азии. Соматические клетки-доноры ядер (кожные фибробласты) были получены в результате биопсии post mortem от быка в возрасте 5 лет и после двух пассажей в культуре длительное время (8 лет) хранились в криоконсервированном состоянии в жидком азоте. Всего было получено четыре беременности. Чтобы подтвердить генетическое происхождение плодов, два из них были выборочно изъяты. Цитогенетический анализ подтвердил наличие в клетках характерного для гяуров нормального кариотипа, однако выяснилось, что вся митохондриальная ДНК происходит от коров-доноров яйцеклеток (Bos taurus). Как известно, митохондрии являются «энергетическими станциями» клеток, именно в них происходит синтез АТФ, соединения с гиперергическими связями, при разрушении которых выделяется большое количество энергии, используемой в процессах жизнеобеспечения клетки. Активность митохондрий регулируется как собственным генетическим аппаратом - генами, закодированными в митохондриальной ДНК, так и генами, локализованными в ядре клетки. Общее количество митохондриальной ДНК (мДНК) в соматической клетке насчитывает 20 000-30 000 молекул в отличие от яйцеклетки млекопитающего, в которой содержится около 100 000 молекул мДНК. Такое явление, когда в цитоплазме клетки находится более одного типа мДНК, называется митохондриальной гетероплазмией. Митохондриальная ДНК наследуется по материнской линии вместе с цитоплазмой ооцита, поэтому получаемые в результате клонирования животные не являются стопроцентными клонами, потому что несут митохондрии донора ядер и индивидуумов-доноров реципиентных энуклеированных яйцеклеток, и обладают, таким образом, митохондриальной гетероплазмией. Взаимодействие между ядерной ДНК и чужеродной мДНК требует дальнейшего изучения. Весьма вероятно, что митохондриальная гетероплазмия может приводить к дисбалансу в энергетическом обмене клетки и служить причиной серьезных нарушений. К сожалению, в опыте американских ученых одна из беременностей прервалась на 200-дневном сроке, а в результате другой родился теленок, который умер спустя 48 ч. Представителями фирмы было заявлено, что это произошло «по причине инфекционного клостридиозного энтерита, не имеющего отношения к клонированию». Стоит отметить, что в результате клонирова ния очень часто обнаруживается различная патология. Количество спонтанных абортов после переноса реконструированных эмбрионов у крупного рогатого скота в двух последних триместрах стельности более чем в 10 раз выше, чем в естественных условиях, и в два с половиной раза выше, чем в программах ЭКО. (Длительность стельности у коров составляет 9 мес.) У абортированных плодов находят различную патологию: гипертрофированную плаценту, гидроалантоис, плацентомы, увеличенные в размере кровеносные сосуды пупочного канатика, отечность плодных оболочек. Клоны, погибшие в течение нескольких дней после рождения, характеризуются наличием патологии сердца, легких, почек, мозга. У новорожденных часто встречается так называемый «синдром крупного молодняка». В работах новозеландца Д. Уэллса и соавт. говорится о превышении веса телят-клонов в среднем на 20%. Реализация всего потенциала, заложенного в новой технологии клонирования, для спасения исчезающих видов животных может быть возможна только при разумном подходе к решению возникающих проблем. Например, чтобы избежать генетического химеризма, появляющегося при митохондриальной гетероплазмии, предлагается получать только самцов, не передающих мДНК потомству, или использовать методы «обратного клонирования» для создания стада самок, несущих мДНК вымирающего вида, чтобы использовать их в качестве источника реципиентных ооцитов. 8. Терапевтическое клонирование: за и против Новейшие технологии в области клонирова ния и создания эмбриональных стволовых клеток открывают огромные возможности для лечения многих заболеваний, связанных с дегенерацией определенных типов клеток, потерей функций тканей и целых органов. Около 16 млн человек во всем мире страдают нейродегенеративными заболеваниями, такими как болезнь Альцгеймера и Паркинсона, свыше 120 млн - диабетом и миллионы - артритами, СПИДом, инфарктами и другими заболеваниями, которые могут быть излечены с помощью применения клеточных трансплантатов.
Термин «терапевтическое клонирование» означает метод получения клеточных культур-трансплантатов, который заключается в том, что ядро соматической клетки пациента (например, кожных фибробластов) переносится в энуклеированный донорский ооцит; после процесса репрограммирования ядро становится тотипотентным и инициирует формирование эмбриона, который на определенной стадии развития может использоваться для получения культуры эмбриональных стволовых клеток (ЭС клетки), обладающих ядерным геномом пациента. Культура ЭС клеток подвергается воздействию веществ-индукторов, вызывающих направленную дифференциацию в определенный тип клеток, например, в такие как кардиомиоциты для замещения поврежденного участка миокарда или в синтезирующие инсулин бета-клетки островков Лангерганса. В настоящее время разрабатываются другие методы получения ЭС клеточных культур с использованием технологии генетической модификации генома для отбора дифференцированных популяций. По самым скромным подсчетам десятки наиболее распространенных заболеваний могут быть вылечены с внедрением клеточной терапии. Методы терапевтического клонирования позволяют избежать иммунного отторжения трансплантатов, поскольку ЭС клетки несут генетическую информацию донора ядер. Низкая эффективность трансплантации ядер не важна для осуществления клеточной терапии, так как для получения линии ЭС клеток достаточно всего одного или нескольких предимплантационных эмбрионов. Кроме того, сейчас рассматривается вопрос об использовании в качестве цитопластов энуклеированных яйцеклеток животных, например, крупного рогатого скота, которые поддерживают реализацию генетического материала ядра человеческой соматической клетки до стадии 5-дневного эмбриона. Одной из перспективных сфер применения клонирования может оказаться ксенотрансплантация, то есть межвидовая трансплантация тканей и органов. Некоторыми компаниями ведется работа по созданию линии свиней с инактивированным геном альфа-1,3-галактозилтрансферазы. Этот ген кодирует фермент, участвующий в синтезе поверхностных антигенов клеток свиней, которые обусловливают немедленное отторжение трансплантатов у приматов. Технология клонирования с использованием генетически модифицированных культур клеток в качестве доноров ядер значительно упростит процесс создания такой линии. Успешно проведенные эксперименты по клонированию макак-резус американскими учеными Л. Менг и др. из центра по изучению приматов в Орегоне свидетельствуют о потенциальной возможности переноса технологии трансплантации ядер на человека. Л. Менг и соавт. получили двух макак-резус в результате переноса ядер бластомеров из ранних эмбрионов. Ввиду значительного сходства физиологии и генетики у человека и остальных приматов для изучения процессов репрограммирования генома, развития клонов как во время протекания беременности, так и в постнатальный период и их эпигенетической стабильности нечеловеческие приматы могут служить самой оптимальной моделью. Прежде чем станет возможным всерьез воспринимать заявления о внедрении терапевтического клонирования в медицине необходимо добиться клонирования обезьян с использованием соматических дифференцированных клеток. Эффективность реконструкции эмбрионов приматов будет зависеть от оптимизации многих параметров. Наши представления о процессах созревания яйцеклеток в условиях in vitro все еще являются неполными, требуют усовершенствования протоколы слияния кариопласта с цитопластом и активации генома. Электрослияние не считается в настоящее время наиболее эффективным методом для соединения донорского ядра с энуклеированной яйцеклеткой: электрический импульс вызывает одновременно активацию реконструированного ооцита, вследствие чего в ядре не успевают завершиться процессы репрограммирования ядра. Уже разработаны методики по индукции слияния с использованием фитогемагглютинина, этиленгликоля и микрохирургическими методами, которые не вызывают одновременную активацию. Это позволяет отсрочить ее индукцию у прооперированного ооцита на 4-5 ч. Согласно вышеупомянутой методике И. Тезарик, П. Наги и др. в 2000 г. переносили кариопласты зрелых человеческих ооцитов в другие энуклеированные ооциты на стадии метафазы II. Учеными изучались слияние кариопласта с цитопластом и спонтанная и химическая активация реконструированной яйцеклетки. Эта технология, по мнению исследователей, может найти применение при лечении бесплодия, связанного с недостаточностью функции цитоплазматических компонентов яйцеклеток. К подобным экспериментам необходимо относиться с большой осторожностью, поскольку сама методика механического переноса кариопласта, воздействие на яйцеклетку химических агентов слияния могут иметь непредсказуемые последствия. Даже внедряемая технология переноса незначительного количества цитоплазмы от ооцита здорового донора в реципиентную яйцеклетку пациента в настоящее время подвергается активной критике из-за возможной дисрегуляции во взаимоотношениях между ДНК ядра и митохондрий. Отрицательный эффект генетического химеризма может быть еще более сильным при тотальной замене цитоплазматического окружения кариопласта и проявиться в виде нарушений различной природы как во внутриутробный период развития, так и после рождения организма. Несмотря на массовый ажиотаж по поводу достижений в области клонирования и многочисленные спекуляции в прессе и на телевидении в недавнем прошлом, принимая во внимание последние открытия в этой области, возникает больше вопросов, чем ответов на них; в настоящее время сама возможность получения стабильных клонов ставится под сомнение. Эпигенетическая модификация генома обеспечивает активацию определенных генов в разные периоды развития и включает метилирование ДНК, специфическое соединение гистонов в нуклеосомы и ремоделирование других хроматинассоциированных протеинов. Оба родительских генома формируются в течение гаметогенеза таким образом, чтобы соответствовать цитоплазматическому составу яйцеклетки и направлять развитие всего организма. Чтобы успешно реализовать генетическую информацию, ядро соматической клетки после трансплантации должно быстро репрограммироваться для экспрессии генов, включаемых на ранних этапах развития. В 80-х годах Д. Солтер и другие исследователи установили, что отцовский и материнский геномы функционально неидентичны и оба необходимы для нормального развития. Такое явление называется геномным импринтингом; оно заключается в том, что из двух аллелей одного гена в гомологичных хромосомах после оплодотворения может быть функционально активным только отцовский или только материнский. Нормальное развитие требует правильной экспрессии импринтированных генов. У клонированных животных из-за неполного репрограммирования ядра соматической клетки и нарушения экспрессии импринтированных генов возникает эпигенетическая нестабильность генома. Несоответствующий данному гену уровень метилирования изменяет его активность и может приводить к его полной инактивации или наоборот - к его активированию. Большинство процессов в организме находятся под двойным, тройным и т. д. контролем со стороны генетического аппарата клетки, благодаря этому в результате трансплантации ядер относительно часто рождается и вырастает полноценный молодняк. Исследователям не удалось идентифицировать гены, нарушение регуляции которых приводило бы к часто встречающейся патологии плаценты и аномальному весу у клонированных мышей. Возможно, что это результат кумулятивного воздействия многих неправильно экспрессирующихся генов. Выдвигается гипотеза, что развитие млекопитающих скорее толерантно к эпигенетической нестабильности и летальный эффект проявляется только при потерях нормальной регуляции во множественных локусах. Внешне здоровые клонированные животные могут иметь различные физиологические нарушения, которые трудно обнаружить. До сих пор неизвестно, почему не удается размножить последовательным клонированием мышей далее 6-го поколения. Это может быть связано с накоплением в поколениях мутаций в соматических клетках или с укорочением в каждом раунде репликации концевых участков хромосом - теломер. Процесс репликации ДНК (т. е. удвоения ДНК) при делении клеток происходит таким образом, что теломеры в течение жизни человека или животного укорачиваются. Существует фермент теломераза, который достраивает концевые участки хромосом, однако высокой теломеразной активностью обладают только тотипотентные клетки на ранних стадиях эмбрионального развития в период повышенного количества митозов и герминальные, которые дают начало гаметам. Теломераза усиленно синтезируется также в опухолевых клетках, характеризующихся способностью к неограниченному делению. С укорочением концевых участков хромосом связывают в настоящее время процессы старения организма человека: когда теломеры достигают определенной длины, дальнейшее деление клеток становится невозможным, и ткани утрачивают свою регенерационную и функциональную активность. Так как при трансплантации ядер донором служат соматические клетки, не экспрессирующие теломеразу, для установления генетического возраста клонального животного определяется статус теломер в его клетках. Именно таким образом было показано, что первая клонированная из соматических клеток овца Долли генетически старше своих ровесников. Укорочение теломер у клонов в дальнейшем не подтвердилось в опытах на крупном рогатом скоте. Как оказалось, теломеразная активность заново возникает в клонированных эмбрионах и происходит восстановление концов хромосом до нормальной длины. Клонирование млекопитающих - это одна из захватывающих проблем современной биологии, однако попытки создания клонов нельзя назвать успешными - большая часть реконструированных зародышей не развивается далее ранних эмбриональных стадий, из родившихся около половины не достигают взрослого состояния, и нет уверенности в том, что взрослые клоны - абсолютно здоровые животные. Изучение фундаментальных основ генной экспрессии и генетического контроля развития поможет объяснить причины затруднений, с которыми сталкивается новое направление. Технология клонирования уже внесла огромный вклад в наше понимание ранних процессов развития, взаимодействия родительских геномов, репрограммирования ядер и геномного импринтинга. Было бы близорукостью отвергнуть метод трансплантации ядер, пока мы в точности не узнаем все возможные перспективы его использования. А.А. Шкуматов Институт молекулярной генетики РАН, Москва Российская ассоциация репродукции человека Президент В.С. Корсак Санкт-Петербург, Менделеевская линия, 3 Институт акушерства и гинекологии им. Д.О. Отта Центр "Эко" тел.: (812) 328-2251 |