Возможности микрохирургии в реконструктивной андрологии.
|
Необходимость в таком виде высокоспециализированной помощи и в специалистах андрологах и микрохирургах также возникает при разного рода травматических повреждениях и ампутациях наружных мужских половых органов.
Третьей группой пациентов, оперативное лечение которых вызывает наибольший общественный и медицинский интерес, являются больные женским ядерным транссексуализмом. Операции по коррекции пола при транссексуализме объединяются в англоязычной литературе понятием «сексуальная конверсионная хирургия» (sexual conversional surgery). Одним из основоположников генитальной хирургии явился российский хирург Н.А. Богораз, который в 1936 г. использовал трубчатый (филатовский) лоскут передней брюшной стенки для формирования неофаллоса [1]. Аутотрансплантат на питающей ножке из переднебоковой поверхности живота был использован у 16 больных с травматической ампутацией полового члена, в основном у жителей села при случайном попадании в сенокосилку. С целью достижения ригидности неофаллоса на этапе формирования филатовского стебля в аутотрансплантат помещался фрагмент реберного хряща. С этого момента и вплоть до конца 70-х годов в генитальной хирургии применялись несвободные лоскуты, что не обеспечивало необходимого эстетического и функционального результата, сопровождалось трофическими расстройствами перемещенной ткани, реберные хрящи, как правило, лизировались в течение нескольких месяцев. В классическом варианте Н.А. Богораза формирование неофаллоса выполнялось в пять этапов, требовало не менее 4 мес и редко обеспечивало удовлетворительный эстетический и функциональный результат, сопровождалось отсутствием чувствительности. Лишь с внедрением в мировую хирургическую практику нового метода микрохирургической аутотрансплантации комплексов тканей с осевым типом кровоснабжения для пластики различных дефектов в андрологии появились альтернативные возможности реконструкции, позволяющие избежать многих из недостатков и ограничений. В 1977 г. C. Horton и соавт. [5] предложили методику фаллопластики с использованием двух кожно-мышечных аутотрансплантатов на основе m. Rectus abdominis и m. Rectus femoris. В 1979 г. C. Horton и соавт. применили микрохирургическую трансплантацию лоскутов комплекса тканей из дельтовидной области. Для восстановления чувствительности кожный нерв трансплантата анастомозировали с n. genitofemoralis. В соответствии с предложенной концепцией комплекса тканей с осевым типом кровоснабжения в 1981 г. также C. Horton, C. Devine и Terzis использовали тыльный лоскут стопы с анастомозом n. pudendus с чувствительной ветвью донорского лоскута. В послеоперационном обследовании было отмечено восстановление чувствительности неофаллоса. В 80-х годах T. Chang и W. Hwang [3] описали донорскую зону сгибательной поверхности предплечья и предложили для фаллореконструкции использовать лучевой лоскут, который получил название "китайского". Его основными преимуществами явились небольшая толщина, потенциально восстановимая чувствительность, постоянство сосудистой анатомии, простота взятия. Однако ограниченная длина лоскута (лимитирована длиной донорского предплечья), использование в качестве артерии лоскута одного из магистральных сосудов предплечья (a. radialis et ulnaris), некосметичность донорского дефекта привели к тому, что этот пластический материал стал использоваться в качестве альтернативного в основном при микрохирургической уретропласти ке (Gottlieb и соавт., 1993). Различные методики микрохирургической фаллопластики свободным лоскутом нашли наиболее широкое применение в хирургии транссексуализма, в основном из-за отсутствия удовлетворительных хирургических альтернатив. В 1984 г. T. Chang и W. Huang использовали для фаллопластики лучевой свободный "китайский" лоскут, частью которого был участок васкуляризированной неоуретры. Причем неоуретра формировалась из локтевой части лоскута. G. Farrow и соавт. [4] модифицировали «китайский лоскут» и дали ему название "крикетная бита". Изменения состояли в том, что неоуретра и тело неофаллоса формировались из кожного лоскута одновременно, что значительно упростило процедуру. Как и китайские авторы, они включили в состав лоскута чувствительные волокна латерального и медиального нервов предплечья. Кроме того, расположение неоуретры в центре лоскута позволило обеспечить более стабильную васкуляризацию. E. Biemer [2] описывает модификацию лучевого лоскута, в дизайне которого неоуретра занимает центральное положение, непосредственно над лучевой артерией, а части лоскута, формирующие впоследствии неофаллос, располагаются по бокам. Однако такое размещение неоуретры создавало трудности с закрытием донорского дефекта кожи предплечья. Кроме того, кожный участок в этом месте имеет интенсивный волосяной покров. В оригинальном описании лоскут также содержит участок лучевой кости, что впоследствии приводило к отсроченным переломам лучевой кости предплечья. D. Gilbert и соавт. [6], основываясь на исследованиях Lovie и соавт., касающихся сосудистой анатомии локтевой зоны, предложили использовать аналогичный Biemer лоскут локтевой области. Этот лоскут включал также в себя дистальную островковую часть, из которой формировалась головка неофаллоса. Этот островковый лоскут, в дистальной части связанный с неоуретрой, ротировался проксимально над участком деэпидермизации, что позволяло одновременно сформировать псевдовенечную борозду. R. Sadove и соавт. [7] для фаллопластики использовали кожно-костный лоскут малоберцовой области. В качестве основных достоинств этого лоскута отмечали хорошую ригидность неофаллоса (так как возможно использование длинного фрагмента малоберцовой кости), размер лоскута не наносит существенного ущерба донорскому участку, чувствительность восстанавливается за счет n. cutaneus surae, диаметр и жесткость неофаллоса близки к естественной. Также длина сосудистой ножки лоскута позволяет включить ее в кровоток конец-в-бок без использования аутовенозных вставок, что в конечном итоге не ограничивает уровень фиксации неофаллоса. Описанные лоскуты не являются единственно возможными в реконструктивной хирургии наружных гениталий. Микрохирургическая аутотрансплантация является лишь методом, который позволяет решать поставленные перед реконструкцией задачи. За период с 1996 по 2001 г. в нашей клинике выполнено 57 микрохирургических реконструкций полового члена (см. таблицу). Характер реконструктивных вмешательств
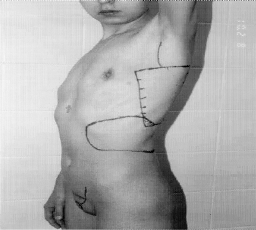
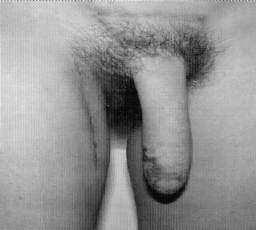
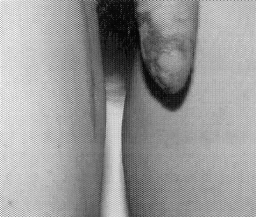
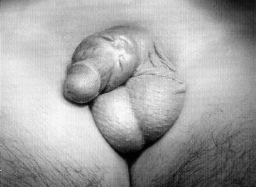
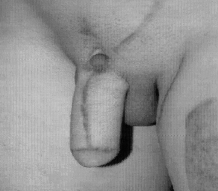
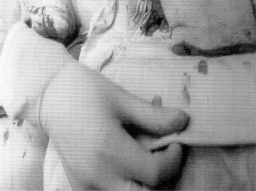
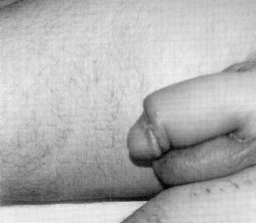
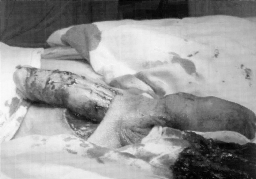
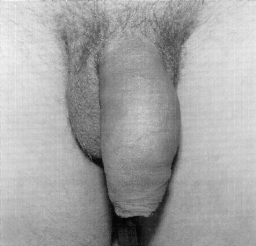
Микрохирургическая уретропластика лучевым лоскутом проводилась в случаях травматической ампутации полового члена (2 наблюдения), транссексуализма (2 наблюдения), врожденных аномалий развития (2 наблюдения). По нашему мнению, этот лоскут является предпочтительным из-за его небольшой толщины, относительно небольшого волосяного покрова и возможности взятия значительного по длине участка кожи. Во всех наблюдениях лоскуты прижились полностью, мочеиспускание восстановилось. Дефект донорской зоны предплечья закрывался свободной пересадкой полнослойного кожного трансплантата передней поверхности бедра, полученного с помощью стандартного дерматома. Функциональных нарушений со стороны кисти и предплечья донорской зоны не отмечено. Еще одним распространенным вмешательством является тотальная фаллопластика. В наших наблюдениях она проводилась в случаях аномалий развития, травматической ампутации, транссексуализма. В качестве пластического материала использовали лопаточный лоскут, лопаточный лоскут с фрагментом лопаточной кости, торакодорсальный лоскут с двигательным нервом, лучевой лоскут по методике Gilbert. В 2 случаях в раннем послеоперационном периоде наблюдалось осложнение - венозный тромбоз, что потребовало ревизии микроанастомозов с последующей аутовенозной пластикой вены лоскута. Остановимся подробнее на тактике и особенностях техники проведения реконструктивных вмешательств. Применение лопаточного лоскута для формирования неофаллоса мы считаем обоснованным в тех случаях, когда для пациента значимым являются размеры пениса, а также при высоком риске развития сосудистых осложнений в раннем послеоперационном периоде, при нежелании пациента иметь некосметичный рубец в зоне донорского предплечья. Торакодорсальный лоскут, в отличие от всех остальных, позволяет включить в свой состав также широчайшую мышцу спины с собственным двигательным нервом, анастомозируемым с двигательной порцией n. obturatorius, иннервирующего нежную мышцу бедра (m. Gracilis) (Н.О. Миланов и соавт., 1999). При последующей реиннервации мышцы возможны произвольные сокращения неофаллоса, что позволяет избежать в дальнейшем имплантации эндопротезов. Приводим наблюдение. Пациент Б., 29 лет, поступил в клинику с диагнозом ядерного транссексуализма. Нами были выполнены два этапа хирургической коррекции пола: подкожная мастэктомия и ампутация матки. Третьим этапом пациенту выполнена тотальная фаллопластика торакодорсальным лоскутом. Через 4 мес при осмотре видна хорошая сократимость трансплантированной мышцы (рис. 1-4). В качестве альтернативного пластического материала в подобных случаях может служить лоскут бассейна лучевой артерии по методике Gilbert. Неоспоримым преимуществом этого лоскута является возможность одновременного формирования полового члена, уретры и головки. Однако следует признать, что донорский дефект на предплечье в результате такой операции значителен. Иногда в послеоперационном периоде требуется проведение дополнительных реабилитационных мероприятий, чтобы полностью восстановить функцию конечности. Рубцовая деформация кожных покровов предплечья также является значительным эстетическим дефектом. В связи с этим мы считаем этот лоскут своего рода резервным для тех случаев, когда все другие возможности уже исчерпаны или же когда необходимо максимально сократить этапность реконструкции. Приводим наблюдение. Пациент А., 18 лет, поступил в клинику с диагнозом: микропенис, гипоспадия, мошоночная форма. Больной был неоднократно и безуспешно оперирован. Пациент психологически истощен и настаивает на сокращении этапности хирургического вмешательства (рис. 5-8). Следует заметить, что в описываемом наблюдении разметка лоскута несколько отличалась от традиционной в связи со значительным дефектом уретры. Некоторые авторы (Biemer) включали в состав лоскута участок лучевой кости, т. е. пытались одновременно решить проблему ригидности неофаллоса. Мы имеем одно наблюдение, когда в состав лопаточного лоскута при тотальной фаллопластике был включен фрагмент лопаточной кости. Причем очевидно, что участок лопаточной кости менее функционально значим для донорской зоны, чем аналогичный фрагмент лучевой кости (т. е. вероятность переломов в зоне лопатки в отдаленном периоде после операции минимальна). Более того, полученная ригидность неофаллоса, с нашей точки зрения, была неудовлетворительная. Мы считаем, что современные эндопротезы полового члена обеспечивают гораздо лучший функциональный результат.
Рис. 1.
Рис. 2.
Рис. 3.
Рис. 4. В нашей клинике протезирование неофаллоса проводится в два этапа. Первым этапом выполняется имплантация полых сосудистых протезов (Gortex), проксимальная часть которых фиксируется к лонным костям, дистальная моделируется по форме кавернозных тел. В дальнейшем в сформированные соединительнотканные футляры на эластичном каркасе (аналоги кавернозных тел) имплантируют эндопротезы AMS-650 (рис. 9, 10). Реконструктивные операции на мужских гениталиях нередко связаны с пластикой пораженных кожных покровов полового члена и мошонки. Основной причиной таких поражений можно считать образование гранулем различного генеза (вазелин, парафин, вазелиновое масло). В тех случаях, когда кожные покровы мошонки не могут быть использованы в качестве пластического материала, применяется свободная аутотрансплантация тканей (рис. 11-13).
Рис. 9.
Рис. 5.
Рис. 6. Рис. 10.
Рис. 7. Рис. 11.
Рис. 8. В нашей клинике проведено 20 операций по поводу увеличения диаметра тела полового члена по функциональным показаниям или по поводу генитальной дисморфофобии. Следует подчеркнуть, что популярность хирургической коррекции гениталий по эстетическим и функциональным критериям в последнее время возросла. В данной публикации не ставится задача определения и уточнения медицинских и иных показаний к увеличивающей фаллопластике. Увеличение диаметра тела полового члена проводилось по методике, описанной Н.О. Милановым и Р.Т. Адамяном (1999). После скелетизации полового члена тело пениса укутывается в виде муфты свободным васкуляризированным фрагментом фасции передней зубчатой мышцы (рис. 14-16). Рис. 12.
Рис. 13.
Рис. 14. Рис. 15. Рис. 16. Описанная методика позволяет достичь стойкого косметического и функционального результата увеличения диаметра тела полового члена. Это является основным преимуществом данной микрохирургической методики перед подкожным введением неваскуляризированных фрагментов жировой ткани, биогелей или дермальных свободных лоскутов. Не вызывает сомнений, что трудоемкость использования микрохирургической аутотрансплантации комплексов тканей в генитальной хирургии оправдана значительным увеличением возможностей реконструкции гениталий, обеспечением функционального и эстетического результата, возможность которого вне микрохирургических подходов даже не обсуждалась. Результаты нашего опыта свидетельствуют, что данный подход позволяет добиваться надежной и хорошо воспроизводимой социальной и сексуальной реабилитации тяжелой группы больных, помощь которой всегда была ограничена. С.В. Гагарина, А.С. Акопян, М.М. Сокольщик Республиканский центр репродукции человека Минздрава РФ, Москва Литература 1. Богораз Н.А. О полном пластическом восстановлении мужского полового члена, способного к совокуплению. Советская хирургия 1936; 8: 32-34. 2. Biemer E. Penile construction by the radial arm flap. Clin Plast Surg 1988; 15: 425. 3. Chang T.S., Hwang W.J. Forearm flap in one-stage reconstruction of the penis. Plast Reconstr Surg 1984; 74: 251. 4. Farrow G.A., Boyd J.B., Semple J.L. Total reconstruction of the penis employing the "cricket bat flap" single stage forearm free graft. AUA Today 1990; 3: 7. 5. Horton C.E., McCraw J.B., Devine C.J. et al. Secondary reconstruction of the genital area. Urol Clin Noth Am 1977; 4: 133. 6. Gilbert D.A., Schlossberg S.M., Jordan G.H. Ulnar forearm phallic construction and penile reconstruction. Microsurgery 1995; 16: 314. 7. Sadove R.C., Sengezer M., McRoberts J.W. et al. One-stage total penile reconstruction with a free sensate osteocutaneous fibula flap. Plast Reconstr Surg 1993; 92: 1314. Хирург: - Я вам скажу всю правду. Рана на вашей голове была очень тяжелой, но ампутации удалось избежать.
|