Анализ течения I триместра индуцированных беременностей.
|
Широкое внедрение методов вспомогательных репродуктивных технологий, предусматривающих индукцию суперовуляции, а также все более успешное применение современных стимуляторов овуляции при лечении эндокринных форм бесплодия привело к тому, что доля индуцированных беременностей за последние годы значительно возросла, а проблема сохранения этих беременностей и рождения здоровых детей приобрела особую актуальность. Многие исследовате ли, анализируя особенности течения индуцированных беременностей, отмечают высокую частоту осложнений и репродуктивных потерь, особенно в I триместре [1—4], что может быть связано с синдромом гиперстимуляции яичников и многоплодием, сопровождающимися высокими, не физиологичными уровнями половых гормонов вследствие функционирова ния нескольких желтых тел и нарушением соотношения между эндогенными гормонами, поддерживаю щими беременность.
Одним из наиболее важных аспектов, способствую щих снижению репродуктивных потерь, является адекватное назначение поддерживающей гормональной терапии в лютеиновую фазу индуцированного цикла и ранние сроки беременности. В этой связи в литературе широко дискутируются вопросы, посвященные ведению индуцированных беременностей, в частности назначению гормональной поддержки ранних сроков препаратами прогестагенового действия, эстрогенов, хорионического гонадотропина, глюкокортикоидов. Ряд авторов указывают на необходимость экзогенного введения больших доз гестагенов, опираясь на гипотезу о недостаточности функции желтых тел и относитель ной гиперэстрогении [5—7], другие — рекомендуют ограничивать прием препаратов рамками завершения лютеиновой фазы стимулированного цикла, обосновывая свои ограничения отрицательным влиянием высоких концентраций прогестерона на репродуктивную систему плода [8, 9]. Несмотря на значительное количество публикаций на указанную тему, вряд ли представленные мнения можно считать в достаточной степени обоснованными и учитывающими индивидуаль ные характеристики индуцированного цикла. Мы провели анализ особенностей течения и попытались изучить динамику гормональных параметров, обеспечивающих течение I триместра индуцирован ных беременностей. Материал и методы Под наблюдением находилась 51 женщина со сроком беременности 2—12 нед. Беременность была достигнута с помощью индукции овуляции по поводу ановуляторного бесплодия (у 44 больных) и с помощью ЭКО при трубно-перитонеальной форме бесплодия (у 7). Индукция овуляции проводилась непрямыми (кломифенцитрат) и прямыми (меногон, хумегон, пурегон) стимуляторами, а также после предваритель ной десенситизации гипоталамо-гипофизарной системы агонистами гонадолиберина. Все женщины получали гестагены начиная с лютеиновой фазы индуцированного цикла. Средний возраст беременных составил 29,4+1,7 года. Многоплодных (двойни) беременностей было 9 (17,6%), синдром гиперстимуляции яичников имел место у 3 (5,9%) пациенток. Всем беременным в сроки беременности 2—3, 4—5, 6—7, 8—10 нед проводили общепринятое клиническое обследование, ультразвуковой мониторинг и определение в сыворотке крови методом радиоиммунологического анализа уровня эстрадиола (Е2), прогестерона (Р), 17-оксипрогестерона (17-ОР), b-субъединицы хорионического гонадотропина (ХГ) с целью характеристики функции желтого тела и трофобласта. Статистическую обработку полученных результатов проводили с помощью пакета программного обеспечения статистического анализа Statgraph. Достоверность различия между средними значениями признаков выявляли для уровней значимости 0,05. Результаты и обсуждение На первом этапе исследования мы провели анализ особенностей течения и основных осложнений индуцированных беременностей (см. таблицу). Следует отметить, что у всех пациенток имела место прогрессирующая маточная беременность. Более чем у 2/3 женщин выявлена угроза самопроизвольного выкидыша в первой половине беременности, у 1/3 беременных имели место токсикозы, более чем у половины — нарушения системы гемостаза, причем многоплодие и синдром гиперстимуляции яичников (СГЯ) усугубляли неблагополучное течение индуцированных беременностей.
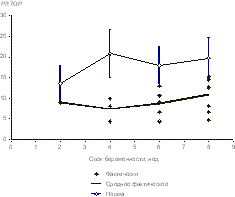
Таким образом, пациентки с индуцированной беременностью, несомненно относятся к группе высокого риска развития акушерских осложнений, что показано и в других исследованиях [10—12]. С целью выяснения возможных причин, способствующих неблагополучному течению индуцированных беременно стей, проведен мониторинг гормональных параметров I триместра. Нормативными послужили результаты, полученные в лаборатории эндокринологии нашего центра для спонтанных беременностей. Анализ полученных данных свидетельствует о следующих закономерностях. Средний уровень концентра ции всех стероидных гормонов в сроки беременности 2—10 нед превышает нормативы, причем уровень P — в 2,3 раза, 17-ОР — в 4,9 раза. Уровень Е2 в сроки беременности 2—4 нед в 2,1 раза выше нормы, к 6—8 нед он несколько снижается. Мы сочли целесообраз ным провести анализ соотношений концентраций в крови стероидных гормонов, которые представлены на рис. 1 и 2. Установлено, что соотношение уровней Р/Е2 превышает соответствующие нормативные показатели на протяжении всего I триместра индуцированной беременности, причем в сроки 2—4 нед — в 1,3 раза, 6—8 нед — в 4,3 раза. Соотношение концентраций Р/17-ОР меньше соответствующего для нормы в 1,6 раза в сроки беременности 2—8 нед.
Рис. 1. Динамика отношения концентраций P/Е2.
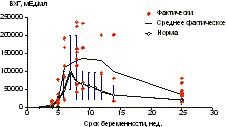
Рис. 2. Динамика отношения концентраций P/17OP. Таким образом, течение ранних сроков индуцированных беременностей происходит на фоне повышенной концентрации всех стероидных гормонов, что, по-видимому, обусловлено одновременным функционированием множества желтых тел. В то же время, по нашим данным, в I триместре индуцированной беременности имеют место преобладание концентрации P и особенно 17-OP и относительная гипоэстрогения. Полученные результаты расходятся с данными ряда авторов, указывающих на наличие дефицита P и обосновывающих необходимость его экзогенного введения [5—7]. Зарегистрированная нами высокая концентра ция P может быть обусловлена как гиперфункцией желтых тел, так и экзогенно вводимыми препаратами прогестеронового действия, которые получали пациентки на протяжении лютеиновой фазы стимулиро ванного цикла и ранних сроков беременности. Учитывая, что 17-ОР является предшественником андрогенов, можно считать, что в I триместре индуцирован ной беременности имеет место гиперандрогения, что подтвердили исследования экскреции 17-кетостерои дов с суточной мочой у 58,8% женщин. На роль гиперандрогении в развитии акушерских осложнений указывают многие исследователи [13—15]. Полученные нами данные позволяют предположить, что назначение прогестеронподобных препаратов с целью поддержания индуцированной беременности в ранние сроки является не всегда целесообразным, а в ряде случаев — вредным, так как усугубляет имеющуюся гиперандрогению. Динамика среднего уровня b-ХГ не отличалась от таковой при физиологической беременности (рис. 3), однако отмечались индивидуальные колебания уровня гормона, что могло быть связано с многоплодной беременностью. Дисбаланс между аномально высоким, связанным с гиперстимуляцией яичников, уровнем P и 17-ОР и нормальным уровнем b-ХГ, характеризую щим состояние трофобласта, может косвенно указывать на снижение его функции. При физиологически протекающей беременности основная роль в регуляторных процессах, обеспечивающих ее нормальное развитие, принадлежит хориону и трофобласту, которые через продукцию ХГ определяют уровень синтеза стероидов желтым телом и запускают нейрогуморальный механизм адаптационных реакций организма матери к развивающейся беременности [15]. Мы предполагаем, что этот механизм регуляции в условиях индуцирован ной беременности нарушается за счет гиперфункции яичников, вызванной индуктором овуляции.
Рис. 3. Динамика концентрации b-субъединицы хорионического гонадотропина ВХГ. О страдании трофобласта свидетельствуют и данные ультразвукового исследования, выявившие более чем у половины беременных ту или иную патологию хориона (гипоплазия хориона — у 9,8%, низкое прикрепление и предлежание — у 35,3%, кольцевидный хорион — у 11,8%, ретрохориальная гематома — у 7,8%), которая может служить в дальнейшем причиной развития первичной плацентарной недостаточно сти в более поздние сроки беременности. Заключение Таким образом, индуцированные беременности характеризуются высокой частотой акушерских осложнений, обусловленных в основном нарушением адаптационных механизмов развития беременности на фоне выраженной гиперсекреции и дисбаланса стероидных гормонов, гиперандрогении и страдания трофобласта в ранние сроки. Выявленные особенности течения индуцированных беременностей требуют дифференцированного подбора поддерживающей гормональной терапии с обязательным учетом индивидуальных колебаний уровня гормонов, а также поиска методов адекватной коррекции нарушенных механизмов адаптации. Литература 1. Сидельникова В.М., Стрельченко М.Б., Ходжаева З.С., Кирющенков П.А. Вопросы подготовки, особенности течения и тактика ведения беременности, возникшей в программе ЭКО и ПЭ. Экстракорпоральное оплодотворение и его новые направления в лечении женского и мужского бесплодия (теоретические и практические подходы). Руководство для врачей. М: Медицинское информацион ное агентство 2000; 574—579. 2. Тютюнник В.Л. Особенности течения и тактика ведения беременности и родов у больных с гипогонадотропной формой аменореи: Дис. ... канд. мед. наук. М 1994; 128. 3. Чечнева М.А., Логутова Л.С., Левашова И.И. Особенности течения индуцированной беременности и родоразреше ния у женщин с бесплодием в анамнезе. Вестн Рос асс акуш-гин 1998; 3: 86—89. 4. Ben-Rafael Z., Dor J., Mashias S. et al. Abortion rate in pregnancies following ovulation induced by human menopausal gonadotropin/human chorionic gonadotropin-induced pregnancy. Fertil Steril 1983; 39:1/2: 157—161. 5. Калинина Е.А., Смольникова В.Ю., Леонов Б.В., Жакова И.И. Применение препарата Утрожестан после переноса эмбрионов в полость матки в программе ЭКО и ПЭ. Экстракор поральное оплодотворение и его новые направления в лечении женского и мужского бесплодия (теоретические и практические подходы). Руководство для врачей. М: Медицинское информационное агентство 2000; 746—758. 6. Fleming R., Howles C. New trends in superovulation. Science and Medicine 1991; 3—25. 7. Kondaveete U., Gordon A.C., Hennelly B. et al. Comparison of two regimes of luteal support following long protocol GnRH-a/HMG administration in an IVF/ET programme. Hum Reprod 1993; 8: 1: 102. 8. Schmidt K.L., Ziebe S., Popovic B., Lindhard A. et al. Progesterone supplementation during early gestation after in vitro fertilization has no effect on the delivery rate. Fertil Steril 2001; 75(2): 337—341. 9. Stovall D.W., Van Voorhis B. J., Sparks A.E., Adams L.M., Syrop C.H. Selective early elimination of luteal support in assisted reproduction cycles using a gonadotropin-releasing hormone agonist during ovarian stimulation. Fertil Steril 1998; 70(6): 1056—1062. 10. Витязева И.И. Течение, ведение и исход беременностей после лечения бесплодия методами вспомогательной репродукции: Автореф. дис. ... канд. мед. наук. М 1999; 26. 11. Татевосян М.С. Гормональные перестройки и особенности течения беременности и родов у женщин с индуцированной беременностью: Дис. ... канд. мед. наук. Ереван 1990; 146. 12. Zimmermann R., Soor B., Braendle F., Lehmann F. et al. Gonadotropin therapy of female infertility — analysis of results in 416 cases. Gynec Obstet Invest 1982; 14: 6: 856—862. 13. Ляшко Е.С. Клинико-патогенетические особенности гестационного периода у женщин с гиперандрогени ей различного генеза: Автореф. дис. ... д-ра мед. наук. М 2000; 40. 14. Раисова А.Т., Орлова В.Г. Гиперандрогения в клинике невынашивания беременности. Профилактика, диагности ка и лечение женщин с невынашиванием беременности и оказание медицинской помощи их детям. Сб. научных трудов, ч. 1. Всесоюзный научно-исследовательский центр по охране здоровья матери и ребенка МЗ СССР. М 1986; 80—85. 15. Сидельникова В.М. Невынашивание беременности. М: Медицина 1986; 175. Т.Н. Лысая, Т.А. Назаренко, Э.Р. Дуринян, М.Л. Кочиева Научный центр акушерства, гинекологии и перинатологии РАМН, Москва |