Эволюция диагностики и хирургического лечения хронической ишемии головного мозга
А.В.Лаврентьев, З.К.Пирцхалаишвили, А.А.Спиридонов
Научный центр сердечно- сосудистой хирургии РАМН
(дир. - акад. РАМН Л.А.Бокерия) Москва
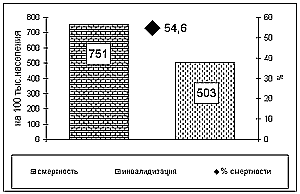
По последним данным в России заболеваемость системы кровообращения достигла 18%, а смертность от сосудистых поражений мозга и сердца составляет 54,6% от общей смертности и стала выше, нежели в предыдущие годы (граф. 1).
Рост сосудистых заболеваний головного мозга происходит в основном за счет возрастания их ишемических форм. Отмечается "омоложение" ишемического инсульта, увеличение инвалидизации работоспособного населения и стремительный рост материальных затрат, связанных с развитием, лечением и реабилитаций больных после перенесенного ишемического инсульта (граф. 2) (1).
Доля ишемических нарушений мозгового кровообращения инсульта, обусловленных окклюзирующими поражениями магистральных артерий головного мозга составляет по разным данным от 40 до 75%. Из числа выживших больных инсультом 95,2% перенесли ишемический инсульт и только 4.7% - геморрагический (2, 9).
За последние десятилетия хирургия брахиоцефальных артерий претерпела значительный прогресс. Наряду с разработкой все новых и новых диагностических методик совершенствовались хирургическая техника, методы защиты мозга от ишемии, уточнялись показания к оперативному лечению. Ряд проблем считаются решенными и принимаются большинством сосудистых хирургов apriori. По другим проблемам ведется оживленная дисскуссия и они находятся в стадии разработки.
В Научном центре сердечно-сосудистой хирургии им. А.Н.Бакулева по инициативе академика В.И.Бураковского в 1983 году на базе 15 городской клинической больницы было организовано специализированное отделение хирургического лечения нарушений мозгового кровообращения, в котором с 1983 по 1997 г.г. было обследовано более 10000 пациентов, прооперировано 1276 больных, которым было выполнено 1459 реконструктивных операций на ветвях дуги аорты ( 1115 мужчин и 161 женщин, средний возраст -54,2+16.7 года).
Распределение больных по этиологии показало, что основной причиной развития окклюзирующих поражений является атеросклероз (78 %), заметную часть (21.3%) составили пациенты с извитостью внутренних сонных и позвоночных артерий, а также с экстравазальной компрессией позвоночных артерий, неспецифический аорто-артериит был причиной поражения ветвей дуги аорты всего в 0.7% от общего числа больных. Поражение сонных артерий было выявлено у 62.2% больных, поражение брахиоцефального ствола (БЦС) или общей сонной артерии (ОСА) - у 3.1 %. Поражение позвоночно-подключичного сегмента диагностировалось у 29.7 % от общего числа больных. Сочетанная патология сонных и позвоночных артерий определялась у 8.1 % больных.
Изучение клинических проявлений сосудисто-мозговой недостаточности показал, что компенсированная стадия сосудисто-мозговой недостаточности (по классификации НЦ ССХ 1989 г.)(11) в виде асимптомного течения или начальных проявлений сосудисто-мозговой недостаточности определялось у 9.2% пациентов. Стадия относительной компенсации (транзиторные ишемические атаки, малый инсульт и дисциркуляторная энцефалопатия 1-2 ст.) в каротидном бассейне диагностировались у 16.2% больных и в вертебрально-базилярном бассейне - у 30.1%. Стадия декомпенсации (завершенный ишемический инсульт различной степени выраженности и дисциркуляторная энцефалопатия 3 ст.) в каротидном бассейне наблюдалась у 37.2% больных, в вертебрально- базилярном - 7.3% больных .
Отличительной особенностью отделения с первого дня его работы, являлся тщательно выверенный глубокий патофизиологический подход к оценке индивидуальных особенностей мозговой гемодинамики, полученных результатов обследования и лечения больных. В этом немалая заслуга первых руководителей отделения д.м.н. Ю.Л.Грозовского и профессора д.м.н. Е.Б.Куперберга.
В настоящее время школа хирургии брахиоцефальных артерий НЦ ССХ им.А.Н.Бакулева при оценке степени сосудисто-мозговой недостаточности считает необходимым анализировать мозговое кровообращение комплексно, как единое кровообращение одного органа. Раздельная оценка по полушариям или по бассейнам кровообращения (как это принято в некоторых отечественных и зарубежных клиниках) на наш взгляд неприемлема.
Оценка степени нарушения кровоснабжения основывается на следующих патофизиологических индивидуальных особенностях мозговой гемодинамики пациентов с хронической сосудисто-мозговой недостаточностью:
На основании полученных величин рассчитывается коэффициент реактивности в обеих каротидных и вертебро-базилярном бассенйнах, являющийся краеугольным показателем в определении уровня компенсации кровообращения.
Основанием для подобного подхода послужило то, что в функцию сосудистой системы входит не только обеспечение кровоснабжаемого органа в покое достаточным притоком крови, но и возможность увеличения притока крови к органу в момент его интенсивного функционирования. Это свойство получило название сосудистой реактивности, а процентное выражение по отношению к исходному уровню кровотока - индекса церебральной реактивности. Физическим смыслом этого показателя является уровень потенциальной возможности увеличения мозговой перфузии при нагрузке или экстремальном состоянии (6),
На основании собственных сравнительных исследований оптимальным был признан метод анализа прироста линейной скорости кровотока по средней мозговой артерии (транскраниальная допплерография) в процессе проведения гиперкапнической дыхательной нагрузки 3-5% смеси воздуха и углекислого газа. Результирующий показатель оценивается как величина прироста скорости кровотока на единицу изменения концентрации pCO2 в крови. Проведенные исследования на здоровых добровольцах позволили нам определить норму этой величины - 3,22 + 0.34 см/сек/1 mm Hg pCO2.
Также в отделении совместно с кафедрой глазных болезней РГМУ им Н.И.Пирогова был разработан метод оценки функционального состояния кровообращения в ВББ с использованием нейросенсорной фотостимуляции (14). При раздражении зрительного анализатора пульсирующим ярким светом происходит дилятация мелких ветвей задней мозговой артерии - локальная реактивная гиперемия, что приводит к увеличению потока крови по задним мозговым артериям. У группы здоровых добровольцев индекс фотореактивности (прирост скорости кровотока по ЗМА, определяемой методом транскраниальной допплерографии) составил 25 - 45% от исходной. У пациентов с поражением позвоночных артерий и с симптомами вертебро-базилярной недостаточности ИФР варьировал от отрицательных величин до 10 - 12%.
Дальнейший комплексный анализ объема и уровня окклюзирующего поражения магистральных артерий головного мозга, степени выраженности клинических неврологических проявлений ишемии мозга и уровня компенсации кровообращения в пораженном и не пораженном бассейнах определял дальнейшую хирургическую тактику и первоочередность сосудистой реконструкции того или иного артериального бассейна.
В своей работе мы придерживаемся обоснованно агрессивной стратегии в определении показаний к реваскуляризации головного мозга. Выделено три основных вида показаний:
Наличие у больного хотя бы одного вида показаний определяло необходимость проведения сосудистой реконструкции.
Комплексная оценка мозговой перфузии и реактивности не только в максимально пораженном бассейне, но и в менее пораженных позволила нам оценивать заинтересованность всех сосудистых бассейнов и определять этапность и необходимость проведения дальнейшей ревакуляризации.
Среди выполненных 1459 реконструктивных операций наибольший удельный вес заняли, как следует из табл.1, каротидная эндартерэктомия (ЭАЭ), экстраинтракраниальный микроанастомоз (ЭИКМА) и реконструкция позвоночных артерий (ПА). В меньшем объеме проводились реконструктивные операции при поражении брахиоцефального ствола, общих сонных и подключичных артерий, при извитости внутренних сонных артерий, стенотических поражений наружных сонных артерий при окклюзии гомолатеральной ВСА. Ряду больных выполнялись двухэтапные и в небольшом числе случаев трехэтапные операций на ветвях дуги аорты.
Таблица 1
Виды и количество операций за 1983- 97 гг. у 1276 больных
| Вид операции | Число операций | % |
| ЭИКМА | 465 | 31.8 |
| Каротидная ЭАЭ | 353 | 24.2 |
| Реконструкция проксимальных сегментов позвоночных артерий | 320 | 21,9 |
| Реконструкция ПкА | 95 | 6.5 |
| Реконструкция НСА | 70 | 4.8 |
| Реконструкция дистальных сегментов позвоночных артерий | 50 | 3.5 |
| Ликвидация извитости ВСА | 38 | 2.7 |
| Реконструкция ОСА | 38 | 2.7 |
| Протезирование БЦС | 28 | 1.9 |
| 1459 | 100 |
Средняя летальность и число нелетальных осложнений за 15 лет составила соответственно 3.6% и 4,2% с ее прогрессирующим снижением за последние 5 лет. В 1994-97 годах она составила 1.35% и 2,7%.
Достаточно большой опыт хирургического лечения и, как было сказано выше, патофизиологический подход к индивидуальной оценке мозговой гемодинамики больных с окклюзирующими поражения магистральных артерий головного мозга позволил нам продвинуться вперед в решении основных на сегодняшний день проблем реваскуляризации головного мозга.
Объем необходимых диагностических мероприятий.
Первично состояние пациента оценивает невролог, в результате чего определяется выраженность клинической симптоматики и заинтересованные бассейны кровоснабжения головного мозга. Далее проводится ультразвуковое обследование включающее в себя ультразвуковую допплерографию цервикальных артерий, транскраниальную допплерографию, дуплексное сканирование сонных и позвоночных артерий. Параллельно по показаниям проводятся необходимые общесоматические исследования и специальные исследования сочетанной патологии других сосудистых регионов (ЭХО КГ, УЗДГ нижних конечностей и т.д.).
Ангиография, стандартно включает в себя визуализацию дуги аорты, селективное контрастирование сонных артерий с интракраниальным руслом в 2-х проекциях и селективное контрастирование позвоночных артерий включая интракраниальное русло. Ангиографическое исследование проводилось всем пациентам, за исключением больных с верифицированным изолированным стенозом или окклюзией ВСА (18).
После сопоставления анатомического объема и уровня окклюзирующего поражения с неврологической клиникой, проводится определение церебрального перфузионного резерва в обеих каротидных бассейнах и индекса фотореактивности в бассейнах обеих задних мозговых артерий позволяющих оценить не только уровень функциональных нарушений в пораженном бассейне, но и их степень в смежных артериальных бассейнах за счет формирования коллатеральных перетоков и развития феномена обкрадывания.
Недостаточная информация и/или несоответствие выраженности клинической симптоматики, анатомического объема и уровня окклюзирующего поражения и степени функционального нарушения артериального русла головного мозга является основанием для проведения специальных методов исследования (статическая и динамическая периметрия, аудиография, КТ, МРТ головного мозга, МР-ангиография, спиральная КТ-ангиография, rCBF, ПЭТ).
Интраоперационно стандартно проводится транскраниальное мониторирование реконструируемого бассейна, что позволяет контролировать динамику уровня мозговой перфузии, объем микроэмболизации и наличие синдрома гиперперфузии. На основании применения этого метода также оперативно определяется необходимость применения защиты мозга, изменения параметров анестезии и особенности послеоперационного ведения больного.
В послеоперационном периоде на основании ультразвуковых методов исследования оценивается проходимость реконструированной артерии и динамика функциональных изменений.
Защита головного мозга от ишемии
По нашим данным в 19,4% реконструкция пораженной артерии требует защиты головного мозга от ишемии. Кроме широко известных методов защиты головного мозга - внутрипросветный шунт, системная артериальная гипертензия, медикаментозная защита, краниогипотермия - мы так же выделяем методы тактической защиты, когда проводимая операция реваскуляризации головного мозга проводится превентивно в менее пораженном и менее гемодинамически значимом бассейне с целью защиты головного мозга при дальнейших этапных реваскуляризирующих операциях (17).
Наиболее часто встретившиеся в нашей практике варианты тактической защиты головного мозга это:
В настоящее время мы воздерживаемся от применения в качестве мероприятий по защите мозга от системной артериальной гипертензии, в связи с повышенным риском развития коронарных осложнений и от краниогипотермии. Достаточно актуальным представляется вопрос о показаниях к применению внутрипросветного временного шунтирования, поскольку повсеместное использование ВВШ не лишено недостатков ( риск интраоперационного тромбоза шунта, отрыв фрагментов бляшки во время введения). На ранних этапах деятельности с целью определения показании ВВШ мы проводили измерение ретроградного АД по внутренней сонной артерии. Но анализ осложнений и результаты сопоставления величины ретроградного АД по ВСА и данные интраоперацитонного ЭЭГ-мониторирования показали недостаточную достоверность данного метода. С 1991 года мониторинг кровотока в реконструируемом бассейне (средней или задней мозговой артерии) осуществлялся с помощью транскраниальной допплерографии (ТКД) или биоэлектрической активности мозга с помощью компрессированного спектрального анализа ЭЭГ (“Берг-Фурье анализатор”, “Biomedica”, Италия).
Компрессированный спектральный анализ ЭЭГ (КСА ЭЭГ) позволяет проводить мониторирование биоэлектрической активности головного мозга в реальном масштабе времени., При этом математический анализ позволяет получить полную цифровую и графическую информацию о спектре частот ЭЭГ и дать анализ любых его составляющих. Мониторирование операции каротидной ЭАЭ с помощью метода КСА ЭЭГ основывалось нами на следующих критериях:
Сопоставление данных ретроградного давления (РД) и КСА ЭЭГ было проведено во время 106 каротидных ЭАЭ и показало , что высокая толерантность мозга к ишемии совпадала по данным РД и КСА ЭЭГ в 95.5%.В то же время при анализе случаев низкой толерантности по данным РД совпадение показателей РД и КСА ЭЭГ было только в 65% случаев, в остальных 35% данные КСА ЭЭГ указывали на высокую толерантность. Операция каротидной ЭАЭ в этих случаях выполнялась без ВПШ и не привела к осложнениям.
Таким образом, проведенное сопоставление показало, что КСА ЭЭГ является значительно более чувствительным методом в определении толерантности мозга к ишемии преимущественно при низких значениях РД, отражая, скорее всего, индивидуальные особенности коллатерального кровообращения - включение внутримозговых и корковых анастомозов, которые при ангиографическом исследовании выявить не представляется возможным, и высокую индивидуальную переносимость гипоперфузии (4). Отказ от измерения РД в ВСА значительно снизил число случаев применения ВПШ, при этом осложнений, связанных с неадекватной защитой мозга, не было.
Необходимо отметить, что использование интраоперационного ТКДГ мониторинга в значительной мере снижает риск операционных осложнений. Локация кровотока по средней мозговой артерии на всем протяжении операции позволяет определять изменения скорости кровотока по СМА на разных этапах реконструкции ВСА. Контроль уровня снижения кровотока при пробной компрессии ВСА наряду с данными КСА ЭЭГ необходим для определения показаний к применению внутрипросветного временного шунтирования. ТКДГ позволяет контролировать проходимость внутреннего шунта и проводить регистрацию микроэмболов при различных манипуляциях с ВСА (20).
Уровень микроэмболии (МЭ) в наших исследованиях колебался от 0 до 180 за время операции, и составил с среднем 44 МЭ. Основными этапами операции, на которых определялась залповая МЭ были:
У 88,2% пациентов уровень МЭ в первый час после операции не превышал 60 МЭ, у 5,9% составил в среднем 90 МЭ, и у всех регрессировал до уровня 0-10 в час к третьему часу после операции. Неврологических осложнений при этом не определялось. У 5.9% больных уровень МЭ в первые шесть часов составил 210-140 МЭ в /час. При этом отмечался затрудненной выход больного из наркоза, при отсутствии очаговой неврологической симптоматики (12).
Перспективными, на наш взгляд, являются исследование применения низкомолекулярного гепарина (фраксипарина) в профилактике артерио-артериальных эмболий (ААЭ) до, во время и после операций на сонных артериях. Полученные результаты свидетельствуют, что применение фраксипарина, у больных с выраженной активацией системы свертывания крови, при выполнении операции на сонных артерий, снижает риск возникновения клинически значимых ААЭ (13).
Эффективность экстра-интракраниального микроанастомоза
Создание ЭИКМА при окклюзии внутренней сонной артерии является пожалуй единственным адекватным видом хирургического лечения больных.
История развития этого метода лечения в нашем Центре неразрывно связана с именем академика В.И.Бураковского (директор ИССХ им.А.Н.Бакулева) и академика А.Н.Коновалова (директор НИИ нейрохирургии им.Н.Н.Бурденко), которые хорошо понимали необходимость объединения усилий сосудистых нейро- и ангиохирургов в лечении окклюзирующих поражений сонных артерий любой (экстра- или интракраниальной) локализации, а также при их сочетании. Ведь сосудистые хирурги практически беспомощны при выявлении у больного окклюзии или недоступного цервикальным доступом стеноза или извитости внутренней сонной артерии. С другой стороны большинство нейрохирургов не в состоянии оказать адекватную помощь при обнаружении у пациентов интраторакального или цервикального поражения сонных и позвоночных артерий.
Несмотря на то, что в 1985 были опубликованы результаты Международного Кооперативного Исследования (EC/IC bypass study group) (19), показавшего равную эффективность ЭИКМА и консервативного лечения, в отделении за прошедшие годы было выполнено 465 ЭИКМА у 440 больных, в том числе в 415 случаях с одной , в 25 - с обеих сторон, у 153 - при наличии контралатерального стеноза ВСА. В 87 случаях в пределах одной операции перед ЭИКМА выполнялась реконструкция наружной сонной артерии (НСА). Средняя летальность после операции ЭИКМА составила 1.8%, резко снизившись за последующие 6 лет, составив 0.9%. Исследования, связанные с ЭИКМА, были предметом многочисленных публикаций , подготовленных в нашем отделении (5-8, 15,16).
На основании многолетних исследований мы пришли к тому, что при сочетанном экстра- интракраниальном поражении сонных артерий сочетанная реконструкция показана только при наличии гемодинамических показаний к ЭИКМА. Иными словами , при наличии адекватного уровня коллатерального кровообращения в бассейне окклюзированной ВСА как создание ЭИКМА ,так и реконструкция экстракраниальных сегментов сонных артерий со стороны окклюзии ВСА нецелесообразны. В то же время при сочетании экстракраниального поражения наружной сонной артерии с окклюзией ВСА, но при наличии объективных показаний к созданию ЭИКМА, необходима реконструкция НСА для обеспечения нормальных гемодинамических условий для функционирования анастомоза (10).
Таким образом, состояние мозговой гемодинамики у больных с окклюзией ВСА является определяющим фактором для гемодинамических показаний к созданию экстра-интракраниального анастомоза. Наши исследования (5), проведенные в 1990-1992 г.г., определили гемодинамические и клинические показания к ЭИКМА. Основным условием гемодинамической значимости ЭИКМА является низкий уровень перфузионного церебрального резерва. Методом многофакторного математического анализа было показано (граф. 4), что исходно низкое значение ICPR дает уверенный предоперационный прогноз гемодинамически значимого анастомоза. Только при гемодинамически значимом анастомозе возможно прогнозирование клинической эффективности этой операции. Многофакторный математический анализ (граф. 5) показал, что достижение значимых положительных клинических результатов возможно лишь при легком неврологическом дефиците (ТИА, завершенный инсульт с легкими остаточными явлениями) при минимальном объеме поражения мозговой ткани по данным компьютерной томографии. В конечном итоге совпадение условий гемодинамической, лечебной и профилактической эффективности и определяет совокупные показания к реваскуляризации мозга при хронической окклюзии ВСА (6,8) .
На основе проведенных исследований мы убедились и в высокой профилактической эффективности ЭИКМА достигавшей 85,7 - 92,2% при разных типах ЭИКМА. Это определило нашу позицию по отношению к клинически асимптомным и малосимптомным пациентам с окклюзией внутренней сонной артерии. При наличии указаний на быстрое прогрессирование многососудистого окклюзирующего поражения ветвей дуги аорты у этих больных существуют профилактические показания к созданию ЭИКМА.
Не менее важным оказалась защитная эффективность ЭИКМА, когда при наличии бикаротидного поражения по типу "окклюзия + критический стеноз" и высокого индекса церебрального перфузионного резерва со стороны окклюзии ВСА у 57 больных проведено создание ЭИКМА. Низкая толерантность мозга к ишемии при пробной компрессионной пробе Матасса со стороны стенозированной ВСА до операции ЭИКМА определялась у 41(72%) и только у 11 (19%) после. При этом у всех 11 больных увеличилось до 1.5-2 минут время появления клинических симптомов ишемии головного мозга при проведении пробы Матасса, что позволило применить процедуру внутрипросветного шунтирование с меньшим риском. Интраоперационно в 8 (14%) случаях при пережатии стенозированной ВСА наблюдалась эволюция гемодинамически незначимого ЭИКМА в гемодинамически значимый. В послеоперационном периоде не наблюдалось смертельных исходов и лишь в 1 случае (2%) определялось ишемическое поражение головного мозга (3).
Реваскуляризация вертебро-базилярного бассейна
Хирургия позвоночных артерий (ПА) является менее изученной страницей в оперативном лечении сосудисто-мозговой недостаточности. Особенности анатомического строения ПА, полиэтиологичность вертебро-базилярной недостаточности (ВБН) определяют ключевое значение вопроса о показаниях к реконструкции этих артерий.
В 1983- 97 годах нами было выполнено 320 реконструкций проксимальных отделов ПА у 296 больных (в том числе у 234 при изолированном поражении) с общей летальностью 0.9% (3 больных). Отдаленные послеоперационные результаты были прослежены у 227 больных (76.6%).Тромбоз оперированной артерии без существенных клинических последствий (возврат ТИА) диагностировался у одного (0.33%), ишемический инсульт в вертебрально - базилярном бассейне (ВББ) - также у одного больного (0.33%).Таким образом, можно уверенно констатировать высокий профилактический эффект хирургического лечения ПА.
Значительное улучшение состояния в отдаленном послеоперационном периоде было у 89,5% больных, отсутствие эффекта хирургического лечения - у 9.5% и только у 0.9% - развился ишемический инсульт в ВББ. Большинство больных жаловались на головокружение, головную боль, атаксические и координаторные нарушения, фотопсии. Такая же структура жалоб была и у больных, перенесших ишемический инсульт в ВББ, но в сочетании с симптомами ишемического поражения ствола мозга и бассейна задних мозговых артерий (гемианопсия, нистагм, дисфагия, дизартрия и др.). Анализ показал значительный регресс “функциональных” жалоб и менее выраженную динамику объективных “стойких” симптомов очагового поражения ВББ (граф. 6). Поскольку при инсульте в ВББ удельный вес “функциональных” симптомов достаточно велик, показания к хирургическому лечению при этом клиническом варианте могут быть поставлены достаточно широко, во всяком случае значительно шире, чем при ишемическом инсульте в каротидном бассейне.
Также несомненное значение в лечении больных с хронической вертебро-базилярной недостаточностью имеет разработка показаний и техники операции дистально-позвоночной реконструкции. Нами было оперировано 50 больных с окклюзией1-2 порции, патологической извитостью в костном канале или гипоплазией ПА. За время исследования были опробованы различные хирургические доступы и типы анастомозирования донорской артерии (НСА, затылочная артерия, аутовенозный шунт) и третьей порции ПА. На основе анализа полученных результатов выработаны показания к дистальной реконструкции ПА, оптимальный хирургический доступ (комбинированный доступ с применением микрохирургической техники) и оптимальный тип анастомозирования (наружно-сонное - дистальнопозвоночное протезирование). При соблюдении всех этих позиций лечебная эффективность дистально-позвоночной реваскуляризации достигает 95%.
Если ранее показания к реконструкции ПА в течении многих лет были основаны на клинических данных (наличие инсульта в ВББ, а при ТИА или хронической ВБН - неэффективность медикаментозного лечения в течение 3-6 месяцев) и наличии выявленных ангиографически поражений ПА, то в последнее время мы пришли к мнению, что основная роль в определении показаний к реконструкции ПА должна принадлежать изучению особенностей церебральной гемодинамики и церебрального перфузионного резерва в ВББ в зависимости от характера и локализации поражения ПА.
В настоящее время при определении показаний к реконструкции позвоночных артерий нами используется метод определения индекса фотореактивности в вертебрально-базилярном бассейне. Его снижение ниже 20% является основанием для утверждения о функциональной недостаточности позвоночного артериального бассейна (14).
Увеличение индекса фотореактивности, фовеолярной чувствительности и суммарной светочувствительности у больных после реваскуляризации вертебро-базилярнойго бассейна на фоне снижения клинических проявлений ВБН и увеличение показателей УЗДГ и ТКДГ указывает на высокую чувствительность офтальмологических методов в изучении гемодинамики ВББ.
Резюме
Возникнув 50 лет назад на стыке ангионеврологии, нейрохирургии и ангиохирургии, реконструктивная хирургия брахиоцефальных артерий заняла прочное место в клинической ангиологии как метод лечения ишемических нарушений мозгового кровообращения.
В настоящей статье нами были рассмотрены далеко не все, но по нашему мнению основные проблемы хирургического лечения хронической сосудисто-мозговой недостаточности.
Необходимо дальнейшее изучение распространенности и соотношения различных видов окклюзирующих поражений магистральных артерий головного мозга, естественного течения окклюзирующего процесса и его прогноз, изучение церебральной гемодинамики с помощью современных методов обследования и тщательная оценка эффективности послеоперационного периода для уточнения объективных показаний к хирургическому лечению.
График 1.
Смертность и инвалидизация от цереброваскулярных заболеваний в России (Бокерия Л.А.1998)

График 2.
Смертность и инвалидизация на 100000 населения в России от ишемических нарушений мозгового кровообращения (Бокерия Л.А.1998)
График 3.
Динамика летальности в отделении за 1983-1997 гг.
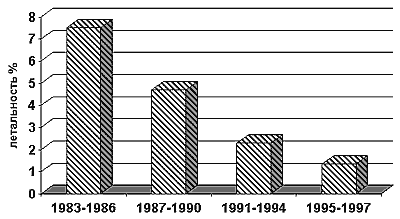
График 4.
Прогноз гемодинамической эффективности ЭИКМА методом многофакторного анализа
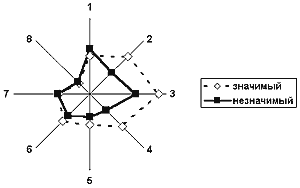
1 - степень сосудисто-мозговой недостаточности в баллах
2 - состояние коллатерального кровообращения через переднюю соединительную артерию
3 - состояние коллатерального кровообращения через заднюю соединительную артерию и глазничный анастомоз
4 - индекс церебрального перфузионного резерва
5 - величина инфаркта мозга по данным компьютерной томографии
6 - величина глубинного очага поражения по данным компьютерной томографии
7 - состояние позвоночных артерий
8 - артериальная гипертония
График 5.
Прогноз клинической эффективности ЭИКМА методом многофакторного анализа
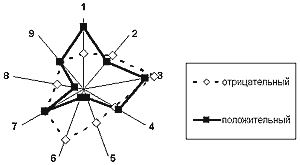
1 - степень сосудисто-мозговой недостаточности в баллах
2 - состояние коллатерального кровообращения через переднюю соединительную артерию
3 - состояние коллатерального кровообращения через заднюю соединительную артерию и глазничный анастомоз
4 - индекс церебрального перфузионного резерва
5 - величина инфаркта мозга по данным компьютерной томографии
6 - величина глубинного очага поражения по данным компьютерной томографии
7 - состояние позвоночных артерий
8 - артериальная гипертония
9 - ИБС
Рисунок 7.
Динамика симптомов при ишемическом инсульте в ВББ до и после хирургической реконструкции ПА
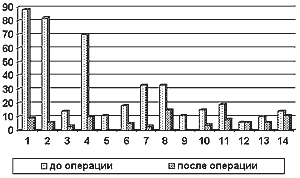
1 - головокружение
2 - атаксия
3 - координаторные нарушения
4 - головная боль
5 - дроп-атаки
6 - приступы потери сознания
7 - фотопсии
8 - слабость в конечностях
9 - двоение
10 - дисфагия
11 - шум в ушах
12 - гомонимная гемианопсия
13 - шум в голове
14 - снижение слуха
Список литературы