О кавинтоне в хирургической практике реваскуляризации головного мозга.
Спиридонов А.А., Лаврентьев А.В., Морозов К.М., Пирцхалаишвили З.К.
(Научный Центр сердечно-сосудистой хирургии им.А.Н.Бакулева РАМН, Москва)
По последним данным в России заболеваемость системы кровообращения достигла 18%, а смертность от сосудистых поражений мозга и сердца составляет 54,6% от общей смертности и стала выше, нежели в предыдущие годы (3).
Рост сосудистых заболеваний головного мозга происходит в основном за счет возрастания их ишемических форм. Отмечается "омоложение" ишемического инсульта, увеличение инвалидизации работоспособного населения и стремительный рост материальных затрат, связанных с развитием, лечением и реабилитаций больных после перенесенного ишемического инсульта (3, 18, 22).
Доля ишемических нарушений мозгового кровообращения инсульта, обусловленных окклюзирующими поражениями магистральных артерий головного мозга составляет по разным данным от 40 до 75%. Из числа выживших больных инсультом 95,2% перенесли ишемический инсульт и только 4.7% - геморрагический (6, 18). В то же время, существующее мнение, о ведущей причине смертности от инфаркта миокарда по сравнению с церебральным инсультом опровергается статистическими данными. Так, в Санкт-Петербурге в 1992 году от инфаркта миокарда умерло в 3 раза меньше мужчин, чем от церебрального инсульта (20, 21). К настоящему времени в отечественной и мировой литературе определены основные факторы риска церебральных и спинальных инсультов, среди которых кроме возраста, являются артериальная гипертония, заболевания сердца, сахарный диабет, гиперлипидемия, курение, избыточная масса тела, гиподинамия, генетическая предрасположенность, злоупотребление алкоголем (6, 10, 18, 22). Особенно неблагоприятно сочетание нескольких факторов риска. Борьба с факторами риска существенно снижает частоту церебральных инсультов (6).
С другой стороны, хоть и не такими быстрыми темпами, как бы хотелось, развиваются методы хирургического устранения основных причин развития ишемии головного мозга: нарушение мозговой гемодинамики и артерио-артериальная эмболия сосудов головного мозга (3, 22).
За последние десятилетия хирургия брахиоцефальных артерий претерпела значительный прогресс. Наряду с разработкой все новых и новых диагностических методик совершенствовались хирургическая техника, методы защиты мозга от ишемии, уточнялись показания к оперативному лечению. Ряд проблем считаются решенными и принимаются большинством сосудистых хирургов apriori. По другим проблемам ведется оживленная дискуссия и они находятся в стадии разработки (22).
Научный центр сердечно-сосудистой хирургии им. А.Н.Бакулева на настоящее время обладает опытом хирургического лечения более 2500 больных с нарушением мозгового кровообращения, было обследовано и консультировано более 20000 пациентов. И совершенно естественно, что как после хирургической реваскуляризации головного мозга, так и в половине случаев после консультаций больным назначалась консервативная терапия (23).
Среди множества лекарственных препаратов, оказывающих действие на сосудистую систему мозга и микроциркуляцию, метаболизм нервной системы в течение последних 15-20 лет ведущее место занимает Кавинтон, (“Гедеон Рихтер”, Венгрия) – этиловый эфир аповинкаминовой кислоты. По данным литературы кавинтон обладает сосудорасширяющи действием, в основе механизма действия которого лежит увеличение концентрацию аденозина в плазме и цАМФ, в гладких мышцах сосудов (блокада фосфодиэстеразы), что дает антиагрегантный эффект. Также происходит повышение содержания моноаминов и повышенное усвоение глюкозы и кислорода в ткани головного мозга (39, 43).
Динамика показателей мозгового кровообращения происходит в основном за счет снижения общей резистентности сосудистого русла (5).
Однако следует более подробно остановится на современном видении механизмов ауторегуляции мозгового кровообращения, патофизиологических изменений при хронической и острой (эмбологенной) ишемии головного мозга.
Человеческий мозг использует глюкозу в качестве единственного источника энергии (около 75-100 мг/мин). При аэробном расщеплении из одной молекулы глюкозы образуется 36 молекул АТФ, а при анаэробном только две вместе с молочной кислотой (51).
Клеткам мозга требуется постоянное обеспечение АТФ для поддержания их стабильности и сохранения ионов калия внутри клетки и ионов натрия и кальция снаружи. Так как мозг не в состоянии аккумулировать энергию, то ему требуется постоянное поступление оксигенированной крови.
В норме уровень мозгового кровотока составляет приблизительной 50-60 мл/100 г/ мин, что при весе мозга 1300-1400г. составляет приблизительно 750-900 мл/ мин. При этом потребление кислорода составляет около 3.3-3.5 мл/10г/мин.
Однако из крови экстрагируется лишь определенная часть кислорода в соответствии с потребностями мозга.
В основе ауторегуляции кровотока лежат изменения диаметра мелких пиальных сосудов - при снижении перфузионного давления происходит их расширение, при его повышении - сужение. Этот вид регуляции мозгового кровотока обеспечивается миогенными механизмами. При этом достигается изостатическое состояние церебрального перфузионного давления, которое в пределах изменения системного артериального давления от 70 до 180 мм.рт.ст. составляет приблизительно 80-85 мм рт. ст. (25, 51)
Другим важнейшим фактором, влияющим на регуляцию мозгового кровотока является парциальное давление углекислого газа. Так при повышении рСО2 всего на 1 мм рт. ст. отмечается повышение уровня мозгового кровотока на 3-5% за счет дилятации резестивных сосудов (33, 44, 51).
Учитывая, что уровень мозгового кровотока пропорционален общему переферическому сопротивлению, а оно в свою очередь – вязкости крови, особое место следует уделить показателям гемореологии. Высокий гематокрит увеличивает вязкость и соответственно снижает уровень мозгового кровотока. Отрицательно на уровень кровотока влияет также фибриноген плазмы и агрегация тромбоцитов.
При хроническом постепенно медленно нарастающем ограничении уровня поступающей крови к головному могу (вследствие прогрессирования окклюзирующего поражения магистральных артерий головного мозга) немаловажным моментом в компенсации недостатка крови является формирование адекватного коллатерального кровообращения из смежных бассейнов кровоснабжения (5, 18, 29).
Суммарное действие всех механизмов поддержания адекватного кровообращения и функции клеток мозга (нейронов и глии) формирует церебральный перфузионый резерв физическим смыслом которого является потенциальная возможность увеличения уровня мозгового кровотока в ответ на возросшие потребности мозга в кислороде (33, 37, 51).
При длительно существующих окклюзиях ВСА, в результате снижения перфузионного давления происходит стабилизация сосудистой емкости, и возможность ауторегуляции ограничена, а уровень церебрального перфузионного резерва снижен. Интересен тот факт, что формирование адекватно развитого коллатерального кровообращения в бассейне пораженной магистральной артерии головного мозга происходит за счет снижения церебрального перфузионного резерва в смежных областях кровоснабжения (33, 51).
В момент резкого падения объемного кровотока (вследствие тромбоза ВСА или иной катастрофы) перфузионное давление в бассейне одноименной средней и передней мозговых артерий снижается. При этом темп развития тромбоза и скорость включения коллатеральных путей компенсации кровообращения существенно влияют на уровень мозгового кровотока в бассейне окклюзированной артерии.

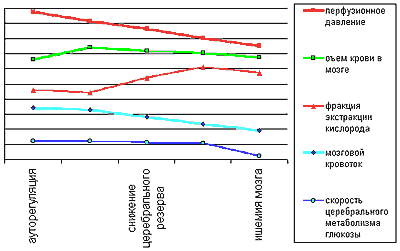
Рис.1. Схематическое изображение динамики уровня компенсаторных мехонизмов при прогрессирующем снижении мозгового кровоотока (51)
Первыми включаются в механизм компенсации коллатерального кровообращение, механизм ауторегуляции перфузионного давления и увеличивается фракция экстракции кислорода из крови. Неэффективность этих мер истощает механизмы компенсации и уменьшает церебральный перфузионный резерв. Однако и это состояние является лишь до- или субклинической стадией ишемии головного мозга (5, 46, 50).
Дальнейшее снижение ПД не приводит к адекватной компенсации объема кровотока, в результате чего падает кислородное напряжение, происходит снижение фракции извлечения кислорода и истощение других метаболических факторов компенсации. Эта ситуация обозначается как “синдром нищей перфузии”. При " нищей перфузии " даже незначительное снижение ПД, вызванное различными экстра- и интракраниальными причинами, может привести к уменьшению кровотока в мозговой ткани с развитием инфаркта. Области “нищей перфузии” как бы отражают своеобразную “ишемическую готовность” ткани мозга к развитию очагов некроза в случаях относительно небольшого снижения ПД при гемодинамически значимых поражениях ветвей дуги аорты.
При его снижении до критического уровня (9-15 мл./100г./мин.) возникают морфологические изменения мозговой ткани с формированием зоны инфаркта, а при сохранении его на уровне 18-20 мл/100 г/мин. возникают грубые функциональные изменения - так называемый “функциональный паралич”, без формирования зоны инфаркта. Состояние мозговой ткани при перфузии ниже порога “функционального паралича”, но выше порога морфологических нарушений, получило в литературе название “зоны ишемической полутени” или “пенумбры” – это зона обратимых изменений ткани мозга (5).
Нарушение перфузии и энергетического обмена мозга приводит к нарушению электролитного обмена той или иной степени выраженности. При этом происходит нарушение клеточного йонного гомеостаза (баланса концентрации К+, Na+, Ca++) и его выхода в интерстициальное пространство. При этом наблюдается увеличение концентрации Na+ и Ca2+ внутри нейронов. Этот процесс сопровождается разрушением клеточных мембран, что на макроуровне проявляется инфарктом мозга и его отеком (29, 33, 51).
Также возникает ингибироование синтеза белков, вслед за чем происходит увеличение анаэробного гликолиза, накопление молочной кислоты, ацидоз и угнетение работы клеточного транспорта. Вслед за этим происходит высвобождение нейротоксических трансмиттеров, свободных кислородных радикалов и липидных перекисей.
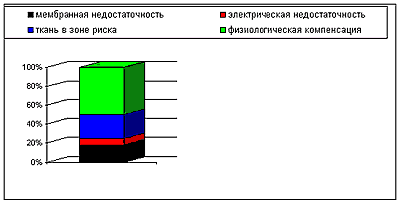
Рис.2. Динамика морфологических нарушений и пороговые значения мозгового кровотока (в % к норме) (51)
Первые исследования предполагали, что механизм действия микроэмболов заключается исключительно в механической блокаде кровотока, однако дальнейшее изучение этого механизма показало гораздо более сложные как механические, так и биохимические взаимоотношения сосудов, клеток эндотения и клеток мозга.
Клеточные агреганты, включающие в себя активные тромбоциты и белые кровяные клетки кроме механической блокады и сопровождающегося спазма артериальных сосудов вызывают высвобождение серотонина, кининов, гистамина и простогландинов, что приводит к повреждению целостности эндотелия. Дна из промежуточных реакций является образование тромбоксана А2, являющегося мощным стимулятором агрегации кровяных пластинок и вазоконстриктором. Этот процесс уравновешивается образованием простациклина – антагониста тромбоксана (25).
Миграция эмбола вызывает образование в зоне контакта с кровью значительного слоя денатурированных плазменных белков в котором происходит адгезия и агрегация тромбоцитов и липидных капельных форм, стимулирующих увеличение размеров эмбола и формирование порочного круга.
Следует также отметить, при генерализованном и мультифокальном поражении сосудистого русла (т.н. при атеросклерозе) происходит нарушение баланса свертывающе-противосвертывающей систем за счет истощения резерва противосвертывающей системы (16).
Однако, следует более подробно остановится на литературных данных результатов исследований специфического действия кавинтона.
При исследовании действия простациклина на жизнеспособных сегментах мозговых артерий человека (8, 9), в условиях сохранения полную жизнеспособности, спонтанную активности и полноценной реакции на действие вазотропных агентов (1,31). В высоких концентрациях простагландин вызывал сокращение сосудистых полосок. Нифедипин (избирательный кальциевый блокатор) вызывал дилятацию мозговых артерий человека, предварительно обработанных простагландином F2a, и усиливал релаксирующий эффект простациклина. Также потенцировал сосудорасширяющий эффект простациклина кавинтон. Антагонисты кальция влияют на действие простациклина на сарколеммальный транспорт ионов кальция, опосредуемый, по крайней мере частично, Na-K-АТФазой. Кавинтон, ингибируя фосфодиэстеразу, увеличивает способность простациклина вызывать рост внутриклеточной концентрации цАМФ; в его влиянии на эффекты простациклина главную роль играют процессы перераспределения внутриклеточного Ca2+.
Одной из причин нарушений состояния сосудистого тонуса при атеросклерозе и изменения реактивности мозговых сосудов может быть подавление активности транспортной АТФазы в пораженной стенке сосуда (21).
Введение Кавинтона при моделировании эмболии мозговых сосудов приводит к кратковременному снижению сопротивления мозговых сосудов. Однако перфузионное давление вскоре вновь повышается, что свидетельствует об отсутствии реканализации кровеносного русла мозга под действием препарата. К отчетливому снижению перфузионного давления приводит введение простациклина, который не только оказывает сосудорасширяющее действие, но и вызывает дезагрегацию тромбоцитов и блокирует их чувствительность к индукторам агрегации (2, 8, 9, 40, 42).
При изучении влияния Кавинтона на скорость кровотока по средней мозговой артерии с помощью транскраниальной допплерографии у пациентов с признаками хронической сосудисто-мозговой недостаточности атеросклеротического генеза (17, 27, 34, 47), определено, что при введении Кавинтона систолическое АД снизилось в среднем на 20 мм рт. ст., диастолическое – на 14 мм рт. ст., что совпадает с данными литературы (38). В средней мозговой артерии выявлено ускорение кровотока на 12,2–26,1% (преимущественно в дистальном отделе). Эти результаты согласуются с данными других авторов (13, 14), выявивших при церебральной ангиографии ускорение мозгового кровотока при введении Кавинтона у больных с сосудистыми заболеваниями головного мозга (36).
При изучении мозгового кровотока с помощью гамма-сцинтиграфию с технеций-99-пертехнетатом (26). Уровень активности регистрировали в проекции внутренней сонной артерии при вступлении ее в полость черепа, проекции средней мозговой артерии, зоне полушарий вне проекции крупных мозговых артерий (паренхиматозная зона, зона микроциркуляции), проекционной зоне верхнего продольного синуса – одного из главных коллекторов на пути оттока венозной крови. Увеличение кровенаполнения под влиянием Кавинтона наблюдали главным образом в зоне артерий мышечного типа преимущественно на стороне “больного” полушария. Увеличивалось кровенаполнение в венозном русле (48).
У больных в острой стадии нарушения мозгового кровообращения при определении регионарного мозгового кровотока и параметров центральной гемодинамики на фоне введения Кавинтона путем изучения клиренса раствора ксенона-133, при сравнительно высоком объеме и гиперкинетическом типе кровообращения имелись признаки централизации кровообращения. Под влиянием Кавинтона центральная гемодинамика существенно не менялась. Исходно регионарный мозговой кровоток у всех больных был значительно снижен. У больных артериальной гипертонией он оказался ниже, чем у больных с нормальным АД. Введение 10 мг Кавинтона привело к увеличению регионарного объемного мозгового кровотока на 17%. Динамика этого показателя не достигала достоверности только в височной области, где исходно он был самым низким. Вероятно это связано с усилением функции корковых и тканевых путей коллатерального кровообращения из бассейнов смежного кровообращения и развитием транзитной гиперемии. Динамика регионарного объемного кровотока (и его направленность) зависели от исходной перфузии. В области абсолютной гиперемии после введения Кавинтона мозговой кровоток парадоксально уменьшался (на 30%), а при выраженной гипоперфузии мозга увеличивался в среднем на 17%. Наиболее значительным увеличение регионарного объемного мозгового кровотока было при его умеренном снижении или нормальном уровне. У некоторых больных в отдельных областях реакция регионарного объемного мозгового кровотока на Кавинтон отсутствовала. Парадоксальное его уменьшение чаще встречалось после внутривенного введения 20 мг препарата, чем объясняется и незначительное среднее увеличение показателя (на 2%) в этой группе. (20, 21 48), Однако авторы не приводят значения церебрального перфузионного резерва в инцидентном бассейне и отсутствие эффекта (равно как и его парадоксальная реакция) может быть связана с истощением компенсаторных возможностей мозга. Аналогичная реакция наблюдается в случае снижения церебрального перфузионного резерва и активации его ацетазоламидом или ингаляционным СО2 (44).
Увеличение регионарного объемного мозгового кровотока на 1-й неделе заболевания было менее выражено (на 7%), чем на 2 и 3-й (на 18 и 13%). При увеличенной вязкости крови динамика показателя оказался незначительной. При поражении вертебрально-базилярного бассейна он увеличивался в большей степени, чем у больных инфарктом в зоне внутренней сонной артерии.
Влияние Кавинтона на микроциркуляцию при начальных проявлениях недостаточности мозгового кровообращения и дисциркуляторной энцефалопатии оценивали методом бульбарной биомикроскопии. Вычисляли периваскулярный, внутрисосудистый, сосудистый и общий конъюнктивальный индексы. Морфометрически определяли диаметр артериол, венул первого порядка, их соотношение и количество функционирующих капилляров на 1 мм2. Реологическую активность крови изучали путем исследования агрегации тромбоцитов, индуцированной АДФ. После курса лечения Кавинтоном показатели микроциркуляции и реологические свойства крови нормализовались. С помощью тех же методов у больных атеросклеротической и инволютивной депрессией выявлены выраженные нарушения микроциркуляторно-реологических свойств крови, которые исчезли при приеме Кавинтона (7). Нифедипин усиливал антиагрегантный и спазмолитический эффекты Кавинтона. Одним из методов профилактики и лечения ишемии мозга является применение средств, уменьшающих сродство гемоглобина к кислороду и повышающих отдачу (фракцию экстракции) последнего тканям (28). Кавинтон уменьшает гипоксию головного мозга за счет снижения связывания гемоглобина с кислородом (19, 45, 49).
В литературе обобщен опыт применения Кавинтона при начальных проявлениях недостаточности кровообращения в головном мозге у людей молодого и среднего, пожилого и старческого возраста (4, 11-15, 26, 41). Некоторые исследования проведены у пациентов с нарушениями мозгового кровообращения на фоне артериальной гипертонии (11). Для изучения мозгового кровообращения использовали допплерографию, гамма-сцинтиграфию, реоэнцефалографию, эхокардиографию, радиоизотопную кардиографию, электроэнцефалографию, вызванные биопотенциалы (слуховые, зрительные), а также экспериментально-психологические пробы. Результаты исследований подтверждают, что Кавинтон увеличивает линейную скорость кровотока по стенозированным артериям головы, уменьшает объем циркулирующей крови и сердечный выброс, улучшает реологические свойства крови. По данным реоэнцефалографии, после внутривенного введения Кавинтона снижается тонус церебральных сосудов мелкого и среднего калибра. Менее выраженные изменения отмечали в тех случаях, когда исходно имелись признаки повышения тонуса сосудов не только мелкого и среднего, но и крупного калибра, а также довольно выраженное снижение эластичности сосудистой стенки. При низком сосудистом тонусе головного мозга после введения Кавинтона он еще больше снижался, что совпадало с плохим или слабым терапевтическим эффектом. (20, 30, 32).
Таким образом, из обзора доступной нам литературы видно, что Кавинтон относится к группе вазоактивных препаратов антигипоксического действия с избирательным влиянием на мозговой кровоток с отчетливым повышением последнего у больных с васкулярно-церебральными заболеваниями. Увеличение мозгового кровотока при введении Кавинтона подтверждают результаты радиографических, ангиографических, допплерографических, полярографических и реографических исследований (15, 24, 35). Кавинтон нормализует тонус мозговых сосудов и устраняет его снижение или дистонию. Препарат снижает содержание норадреналина, дофамина и серотонина в ткани головного мозга, улучшает потребление глюкозы и кислорода, тормозит цАМФ, активирует цикл трикарбоновых кислот Кребса, уменьшает концентрацию калия и увеличивает концентрацию магния. Эти сдвиги нормализуют энергетический обмен в нейронах и митохондриях (40, 41, 48).
Однако при всем многообразии экспериментальных и клинических исследований применения Кавинтона мы не встретили ни одного сообщения о применении препарата в практике хирургической ревакуляризации головного мозга при предоперационной подготовке и послеоперационной реабилитации больных с хронической ишемией головного мозга.
Используемая литература