Методы купирования хронической критической ишемии нижних конечностей
Согласно рекомендациям консенсуса (положения изложены в рекомендации 24) у больных с хронической критической ишемией рекомендовано применение синтетических протезов выше щели коленного сустава. Это объясняется целесообразностью сохранения аутовены для дальнейших реконструкций и для возможного аорто-коронарного шунтирования.
Анализируя результаты суммарно были получены следующие результаты:
| Артериальный сегмент |
Положительный результат через 1 год (в % от общего количества оперированных) |
| Аорто-подвздошно-бедренные реконструкции | 90% |
| Бедренно-подколенное шунтирование выше щели коленного сустава (аутовеной) | 75% |
| Бедренно-подколенное шунтирование выше щели коленного сустава (синтетическим протезом) | 65% |
| Бедренно-подколенное шунтирование ниже щели коленного сустава (аутовеной) | 70% |
| Бедренно-подколенное шунтирование ниже щели коленного сустава (синтетическим протезом) | 60% |
| Бедренно-тибиальное шунтирование (аутовеной) | 70% |
| Бедренно-тибиальное шунтирование (синтетическим протезом) | 40% |
Более подробно методы купирования ишемии конечностей изложены в других лекциях, поэтому авторы не считают целесообразным подробно останавливаться на данной проблеме.
Значительно больший интерес, по мнению авторов, представляют методы консервативного лечения. В последние десятилетия широко пропагандируется и применяется в клинической практике инфузия альпростадила (ПГЕ1).
Мнение различных авторов и результаты крупных исследований, посвященных эффективности данного препарата, не однозначно, что, по видимому, побудило авторов заключительных материалов не рекомендовать ПГЕ1 для широкого применения. Анализируя крупные исследования, результаты которых представлены в 16 литературных источниках, видно, что в 11 исследованиях получен однозначно положительный эффект, а в 5 результат был либо спорный либо отрицательный. В рекомендации 30 отдельно указано, что применение препаратов данной группы целесообразно, когда нет возможности выполнить реваскуляризирующую полноценную операцию и существует реальная угроза ампутации. В этом случае применение препаратов типа вазопростана является альтернативой ампутации. Однако собственный опыт и опыт многих клиник России свидетельствует о большой эффективности данного препарата. Препарат широко рекламируется различными ведущими клиниками и научно-исследовательскими институтами.
Учитывая скудную информацию, предоставляемую не специалистам и обывателям,
АВТОРЫ СОЧЛИ ЦЕЛЕСООБРАЗНЫМ БОЛЕЕ ПОДРОБНО ОСТАНОВИТЬСЯ НА ДАННОМ ЛЕКАРСТВЕННОМ СРЕДСТВЕ, СЧИТАЯ, ЧТО ЭТО МОЖЕТ БЫТЬ ИНТЕРЕСНО, СПЕЦИАЛИСТАМ, ПАЦИЕНТАМ И ИХ РОДСТВЕННИКАМ.
Простагландин Е1 представляет собой окисленный метаболит полинасыщенной жирной кислоты - ДГЛА - составной части фосфолипидов клеточной мембраны. В настоящий момент известно, что данное вещество синтезируется в организме человека и присутствует в некоторых эндогенных жидкостях. При поступлении в кровоток простагландин быстро инактивируется ферментами.

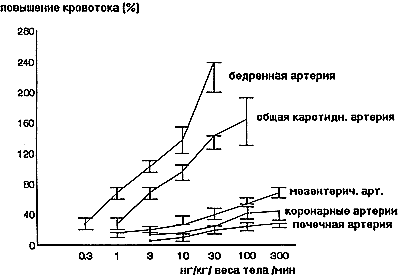
В 1960 году Бергстром и Севалл впервые выделили и очистили ПГЕ1, этими же авторами в 1963 году была определена структура данного вещества. В 1968 году уже были развернуты широкомасштабные исследования. В 1969 году были получены первые результаты, свидетельствующие о профилактики склеивания тромбоцитов и наличия вазоспастического эффекта. Примерно в это же время препарат стал использоваться в клинической практике. Одновременно проводились разнообразные исследования, направленные на выявление более тонких механизмов действия данного вещества. Как это наиболее часто встречается в научной медицинской практике первые исследования проводились на собаках. Результаты обнадежили исследователей. Так при исследовании скорости кровотока было выявлено, что применение ПГЕ1 в качестве внутривенного введения позволило увеличить объемную скорость кровотока во всех жизненно важных органов (в приносящих сосудах). Был отмечен эффект увеличения потока крови в зависимости от введенной дозы . Не менее важными явились исследования влияния ПГЕ1 на центральную гемодинамику. Исследования так же проводились на животных.
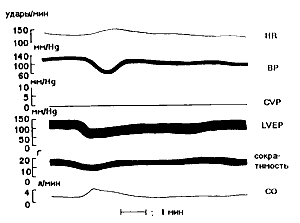
На графике:
HR- частота сердечных сокращений, BR- артериальное давление, CVP- центральное венозное давление, LVEP - конечно-диастлический объем левого желудочка. Исследования продемонстрировали, что значительных изменений не происходит, что позволило рекомендовать данный препарат больным пожилого возраста и тяжелой сопутствующей патологией. В целом эффект можно охарактеризовать как снижение артериального давления и повышение сердечного выброса. Этот эффект объясняется уменьшением периферического сопротивления, наступающего как следствие расширения артериол, прекаппилярных сфинктеров и посткаппилярных венул. Суммарно биологический эффект ПГЕ1 можно представить следующей схемой
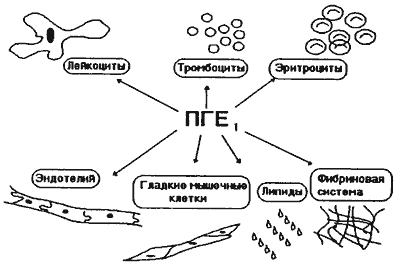
Подобно другим простагландинам, ПГЕ1 реализует своет действие путем активизации рецепторов. Шефер с сотрудниками выявили ПГЕ1/ПГИ2 рецепторы на тромбоцитах. (следует отметить, что в последнее время появилось много работ, в которых основной точкой приложения в лечении ишемии отводится воздействию на тромбоциты). При анализе литературных источников выявляется, что ПГЕ1 специфически связывается с мембранами эритроцитов, тимоцитов, мембранами мозгового слоя надпочечников, желтого тела, матки, и печени.
Первая лицензия на промышленный выпуск ПГЕ был получен в 1979 году в Японии.
Естественно будучи тесно связанным с органами отвечающими за поддержание гемостаза данное вещество не может не иметь прямого влияния на данную, крайне важную для нормальной жизнедеятельности, систему. Проведенные Кручли и другими исследователями исследования показали, что при исследовании влияния простагландинов на фибробластовые культуры клеток человека происходит стимуляция фибринолитической активности, причем ПГЕ1 обладает наиболее выраженным эффектом.
Рассматривая лечебное действие ПГЕ1 (коммерческое название препарата вазопростан) было выявлено увеличение объемного кровотока по сосудам конечности. В экспериментальных исследованиях, при создании моделей тромбозов, было выявлено меньшее количество эмболий и подавление образования микротромбов, вызванных лазерным облучением. Зиммерман с соавторами при введении ПГЕ1 из расчета 1мкг/кг/час получили снижение частоты артериальных и венозных тромбозов на 70%. Синзингер и Фича обнаружили эффект снижения аккумуляции тромбоцитов на атеросклеротических бляшках человека. Эти исследования косвенно подтверждают гипотезу, что ПГЕ1 в меньшей степени препятствует агрегации тромбоцитов и в большей степени препятствует прилипанию тромбоцитов к субэндотелиальной ткани. Схематично действие вещества на тромбоциты можно представить какк следующую последовательность - подавление активации тромбоцитов путем уменьшения количества ионов свободного кальция в тромбоцитах, понижение агрегации тромбоцитов, подавление скопления тромбоцитов на поврежденной стенке сосуда, путем ослабления адгезии тромбоцитов к субэндотелиальным тканям, уменьшение образования тромбов.
Ключевым моментом в любом воспалении, а ишемия всегда сопровождается воспалением, является активация полиморфноядерных нейтрофильных гранулоцитов, которые после своей активизации начинают продуцировать токсические метаболиты. Геккер с соавторами убедительно доказали, что ПГЕ1 является мощным супрессором стимулированной дегрануляции и опосредованного рецепторами выделения клетками лейкотреина. Таким образом ПГЕ1 подавляет активацию нейтрофилов и адгезии к эндотелиальным клеткам. За счет этого нивелируется эффект повреждения тканей.
Основной функцией системы кровообращения в организме человека является функция транспорта кислорода. Данный эффект реализуется посредством эритроцитов. Способность эритроцитов доставлять кислород в периферические ткани во многом определяется возможностью эритроцитов к деформации. Воздействие на это свойство эритроцитов тем более важно у больных с нарушенным магистральным притоком крови. Ямагочу с сотрудниками выявили, что применение ПГЕ1 у больных с окклюзией (полная не проходимость магистрального сосуда конечности) позволило добиться значительного возрастания деформируемости эритроцитов.
Конечной целью любого воздействия на орган, является увеличение его способности адаптироваться к изменению метаболизма. Наиболее простым способом оценки ишемического метаболизма является оценка показателя концентрации лактата крови. Рексрт с соавторами провели любопытный эксперимент на здоровых добровольцах. Эксперимент заключался в изучении показателя лактата крови взятого из артерии и вены у людей в покое и при нагрузке. Исследования показали, что происходит снижение лактатного ацидоза. Подобные данные получил и Рудовски с соавторами. Следует отметить, что существует гипотеза, согласно которой именно лактатный ацидоз вызывает сильные боли в ишемизированной конечности.
Следующим маркером ишемии, особенно поверхностных тканей, является определение напряжения кислорода в тканях, как в мышцах tpo2 так и в поверхностных тканях tcpo2. Крейциг наглядно показали улучшение этих показателей при применении ПГЕ1. Подобные результаты были получены в 1984 году Форстом с сотрудниками.
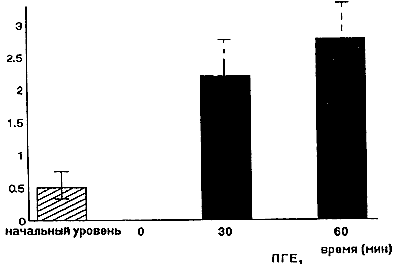
Любопытно, что применение ПГЕ1 увеличивает утилизацию глюкозы мышцами. Стиглер и другие исследователи выявили, что при применении ПГЕ1 в дозе 0.03 мкг/кг/мин при внутриартериальном введении увеличивает утилизацию глюкозы мышечной тканью, что и представлено на рисунке.
В подавляющем количестве случаев хроническая критическая ишемия нижних конечностей вызывается атеросклерозом, поэтому исследователи естественно не могли пройти мимо исследования влияния ПГЕ1 на атеросклеротический процесс. Экспериментальные исследования показали, что у кроликов с искусственно вызванной гиперхолестериномией применение ПГЕ1 уменьшало содержание холестерина в стенке артерии на 30%. В целом ПГЕ1 подавляет митотическую активность и пролиферацию клеток гладкой мускулатуры, подавляет синтез ДНК, коллагена и глюкозамина, подавляет биосинтез холестерина. За счет этих процессов достигается антиатеросклеротический эффект.
Авторы не считают необходимым подробно останавливаться на критериях ишемии нижних конечностей, т.к. это подробно изложено в предыдущих материалах, посвященных хронической критической ишемии нижних конечностей. Поэтому мы приступим к изложению собственно клинического материала. По тексту хроническая критическая ишемия нижних конечностей будет обозначаться как ХКИНК.
Шеффлер с соавторами изучали эффект действия при введении возрастающих доз ПГЕ1 больным с ХКИНК и здоровым добровольцам. Испытуемым вводили по 40мкг и 60 мкг вазопростана, с перерывами в одни сутки. Для оценки кровотока использовался прибор, основанный на эффекте Допплера. Максимальное увеличение объемной скорости кровотока у добровольцев при введении 40 мкг составляло 68%, при дозе 60 мкг - 79%. Через 30 минут кровоток превышал исходный на 47% и 53% соответственно. В группе больных с заболеванием сосудов нижних конечностей и клиническими проявлениями перемежающейся хромоты вводили 20мкг, 40 мкг и 60 мкг. При введении 20 мкг увеличение кровотока составляло 60%, при введении 40 мкг - 128%, при 60 мкг - 161%. Данный эффект сохранялся на протяжении 3-х часов. Максимальный эффект наблюдался через 15-20 минут после окончания инфузии. Исследования показателей напряжения кислорода в к тканях так же продемонстрировало увеличение данного показателя на 100 - 120%. Максимальный прирост был получен в группе больных с инфузией в дозе 60 мкг. Максимальный эффект наблюдался через 20-120 минут после окончания инфузии, с сохранением эффекта до 4-х часов.
В 70-х годах группами Карлсона и Олссона провели исследование влияния ПГЕ1 на периферическое кровообращение у больных с крайне тяжелыми степенями ишемии. В ходе лечения полностью или частично зажили 90% трофических язв, ампутация потребовалась только у 10% больных.
Анализируя динамику потребления обезболивающих средств прослеживается следующая динамика - примерно у 69% больных с инфузией вазопростана в течении 4-х недель наблюдалось снижение потребления анальгетиков, только 17% пациентов, по истечению 4-х недельного срока, к первоначальным дозировкам обезболивающих средств. В других группах (другие методы воздействия) через 4 недели возвращались к первоначальным дозировкам обезболивающих средств 50% и более.
Суммарные результаты представлены в следующей таблице
| Внутриартериальное введение | Внутривенное введение | |
| Боли покоя | ||
| Общее число больных | 202 | 199 |
| Полное исчезновение болей | 50% | 48% |
| Уменьшение | 34% | 37% |
| Без изменений | 13% | 9% |
| Ухудшение | 3% | 6% |
| Трофические язвы | ||
| Общее число больных | 167 | 131 |
| Полное заживление | 19% | 11% |
| Частичное заживление | 39% | 51% |
| Без изменений | 27% | 22% |
| Ухудшение | 16% | 16% |
Похожие результаты получены у больных с с сахарным диабетом, хотя при исследовании больших групп больных результаты несколько хуже.