Биологические резервуары как ответная реакция организма на повреждение и обоснование для метаболической коррекции при язвенных гастродуоденальных кровотечениях у больных с высоким операционно-анестезиологическим риском
Тимен Л.Я.1, Трубицына И. Е.2, Стоногин С.В.3
- ГКБ им. А.К. Ерамишанцева ДЗ г. Москвы
- МКНЦ ЦНИИГ ДЗ г. Москвы
- ГБУЗ ДГКБ имени З.А. Башляевой ДЗ г. Москвы
BIOLOGICAL RESERVOIRS AS A THE RESPONSE OF THE ORGANISM TO INJURY AND PROOF FOR METABOLIC CORRECTION IN GASTRODUODENAL HEMORRHAGE IN PATIENTS WITH HIGH OPERATING-ANESTHETIC RISK
Тимен Леонид Яковлевич
Timen Leonid Ya teemen@mail.ru
Timen L. Ya., Trubitsyna I.E., Stonogin S.V.
По мнению авторов в ответ на повреждение (нарушение гомеостаза) организм в процессе саморегуляции для сохранения постоянства внутренней среды реагирует образованием биологических резервуаров. В случаях декомпенсации и истощения этих резервуаров необходима метаболическая коррекция, о чем свидетельствуют результаты выполнения эндоскопического превентивного метаболического гемостаза при язвенных гастродуоденальных кровотечениях у больных с высоким операционно-анестезиологическим риском. Ключевые слова: язвенные гастродуоденальные кровотечения, эндоскопический гемостаз.
Summary
In the authors opinion in the process of self-regulation the human body creates some biological reservoirs in response to damage (disturbance of homeostasis) for constant internal environment In cases of decompensation and depletion of these pools metabolic correction is necessary. This opinion was based on the results of the endoscopic metabolic hemostasis in ulcer gastroduodenal bleeding in patients with high operational and anesthetic risk. Keywords: gastroduodenal ulcer bleeding, endoscopic hemostasis.
Язвенную болезнь (ЯБ) вследствие различной этиологии, клинических особенностей и результатов лечения следует рассматривать как гетерогенное заболевание. Рассуждения о «плохом и хорошем» Нр, абсолютное признание либо отрицание Нр, а также ацидопептического фактора как ключевого звена в патогенезе ЯБ подтверждают представления В.Х. Василенко о ЯБ как о «Ноевом ковчеге, который никак не может достичь мирной гавани» [1,2,3,4]. В связи с этим осуществление саногенеза, т.е. адаптивной саморегуляции организма на всех этапах заболевания, как безусловной биологической закономерности, имеющей место при любом патологическом процессе, можно считать принципом, объединяющим все концепции этого ковчега [5,6]. Функциональные системы саморегуляции определяют жизненные возможности организма и характер взаимоотношений с внешней средой, обеспечивающей его питанием с трансформацией потенциальной энергии белков, жиров и углеводов пищевых продуктов в механическую, химическую, электрическую и тепловую энергию. Основное условие существования высоко организованного организма (открытой термодинамической системы) - непрерывный обмен веществом и энергией с окружающей средой. В процессе обмена веществ и энергии на основании второго закона термодинамики происходит превращение полезной химической энергии в бесполезную тепловую. При этом организация биологической системы становится неупорядоченной (хаотичной). Энтропия, т.е. степень хаотичности замкнутой системы, возрастает, а количество полезной энергии убывает. Поэтому для поддержки структурного и функционального состояния, постоянства внутренней среды необходим постоянный обмен веществ и энергии живого организма с окружающей средой [7]. Представления о базовых механизмах обмена веществ в организме человека составили основу предложенного Л.Я. Тименом метода эндоскопического программированного гемостаза при язвенных гастродуоденальных кровотечениях (ЯГДК) у больных с высоким операционно-анестезиологическим риском (ВОАР) и разработанного в соответствии с патогенетическими особенностями течения ЯБ [8]. При этом патоморфологические исследования 38 пациентов, погибших от ЯГДК, осложненных тяжелой кровопотерей и геморрагическим шоком (ТК и ГШ), показали, что у 29 больных смерть наступила от тяжелейших деструктивных повреждений, наступивших в результате гипоксии, гиповолемии, последствий постгеморрагической анемии и белково-энергетической недостаточности. В 9 наблюдениях (смерть в первые 2 часа от начала кровотечения) обнаружен апоптоз при отсутствии значительных изменений внутренних органов. Просветление и прозрачность цитоплазмы гепатоцитов, а также практически полное отсутствие полиаминосахаридов в эпителии, железистом аппарате, строме желудка и двенадцатиперстной кишки при PAS-реакции свидетельствовали об отсутствии запасов гликогена в печени, белковой дистрофии и катаболических процессах, приведших к энергетической катастрофе (рис.1)
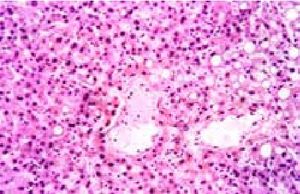
Рисунок 1. Печень. Циркуляторные расстройства в печени: разъединение клеточных элементов и плазмы крови в центральной вене. Просветление и зернистость цитоплазмы гепатоцитов. Некроз гепатоцитов. Преобладание средне- и крупнокапельной жировой дистрофии. Гематоксинин-эозин ×200.
На основании выполненных исследований (8) был сделан вывод о том, что при ТК и ГШ с целью восстановления гомеостаза [9] организм в ответ на повреждение в процессе саморегуляции реагирует формированием биологических резервуаров (депо), включающих вещества - источники полезной энергии, антиоксиданты и репаранты, потребляемые «on demand» для восстановления постоянства гомеостатической среды, согласно закону Claude Bernard [10]. В настоящем сообщении мы посчитали целесообразным акцентировать внимание клиницистов на эти факты, указывающие на необходимость клинической метаболической реабилитации пациентов при тяжелых повреждениях, и привести в связи с этим некоторые положения полученных доказательств. При изучении конечных продуктов обмена пуриновых оснований и основных пуриновых метаболитов в экспериментально сформированных язвах тела желудка по методу S. Okabe и перифокальной зоне методом «высокоэффективной жидкостной хроматографии» была дана оценка состояния и динамики структурного метаболизма при неосложненном и осложненном течении ЯБ в связи с одинаковым характером базовых повреждений при деструктивных процессах [11,12]. Из пуриновых соединений определяли: гипоксантин (Hyp), ксантин (Xan), мочевую кислоту (AU), а также аденозинмонофосфат (АМР), гуанозинмонофосфат (GМР) и инозинмонофосфат (IМР). Пуриновые нуклеотиды выполняют ключевые функции в по- строении структурного метаболизма. IMP является первоисточником возникновения и накопления энергии, необходимой для образования AMP и GMP. Осуществление адекватного пуринового обмена, а также синтез IMP и его производных происходит только при поступлении достаточного количества аденозинтрифосфата (АТР). АМР участвует в регуляции гликолиза и биосинтезе белка в рибосомах. Это «метаболический усилитель» и индикатор энергетического состояния клетки. Концентрация АМР падает при дефиците энергообеспечения. АМР оказывает сосудорасширяющее и антиагрегантное воздействие, тем самым улучшая микро- и макроциркуляцию; cAMP об- разуется из ATP. Повышение концентрации сАМР приводит к блокаде медиаторов воспаления, т.е. к ингибированию воспалительного процесса. Наряду с аскорбатом сАМР катализирует синтез серотонина и мелатонина с образованием оксида азота из триптофана в процессе заживления язв. Падение уровня сАМР в крае язвы наступает в результате снижения резистентности слизистой оболочки желудка к повреждающим факторам, репаративной недостаточности и хронизации процесса. Не менее важное значение в регуляции структурного метаболизма принадлежит GMP и cGMP, участвующих в передаче клетке внеклеточных сигналов, стимуляции клеточной регенерации и репаративных процессов, предупреждении агрегации тромбоцитов и нормализации мышечного тонуса [7, 13]. Согласно нашим исследованиям (рис.2 и 3),
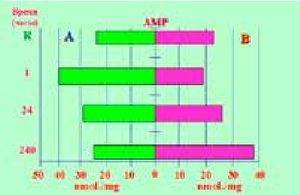 Рисунок 2. Содержание AMP в слизистой оболочке тела желудка (А) и краях язвы (В) в разные сроки язвенного процесса.
Рисунок 2. Содержание AMP в слизистой оболочке тела желудка (А) и краях язвы (В) в разные сроки язвенного процесса.
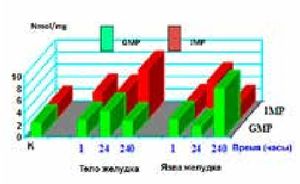 Рисунок 3.Содержание IMP и GMP в слизистой оболочке тела желудка и краях язвы в разные сроки язвенного процесса.
Рисунок 3.Содержание IMP и GMP в слизистой оболочке тела желудка и краях язвы в разные сроки язвенного процесса.
в остром периоде повреждения, т.е. в первые 24 часа «общего адаптационного синдрома» [14] на фоне снижения факторов защиты и падения уровней АМР и GMP происходила мобилизация аварийных ресурсов организма с активным накоплением и последующим потреблением энергии (IMP) в краях язвенных дефектов. На 10-е сутки рубцевания экспериментальных язв отмечено значительное увеличение концентраций АМР и GMP и низкий порог IMP вследствие больших энергозатрат на обеспечение репаративной активности. При этом на периферии язвенного поля рубцевание язв сопровождалось депонированием энергетического субстрата (↑IMP), потребляемого в ходе заживления язв желудка (↓IMP). Мочевая кислота - конечный продукт обмена пуриновых оснований. Ее образование осуществляется последовательно: Hyp → Xan → AU. Повышение конечных продуктов обмена пуриновых оснований связано с превалированием катаболических процессов и интенсивным распадом нуклеотидов, т.е. с повреждением структурного метаболизма. Подобные состояния характерны и для ЯБ, ТК и ГШ вследствие ишемии, гипоксии, снижения синтеза АТР и содержания в клетках макроэрга, нарушений микроциркуляции и оксидативного стресса. Концентрация гипоксантина при ГШ повышается в 10–20 раз. Реперфузия и восстановление микроциркуляции в процессе лечения ГШ активизируют выброс активных форм кислорода. При этом происходит трансформация гипоксантина в мочевую кислоту и нарастает выброс супероксиданион-радикалов кислорода и гидроксильных радикалов [15]. Высокие параметры гипоксантина, ксантина и мочевой кислоты, зарегистрированные в краях рубцующихся ЯЖ (рис.4, 5)
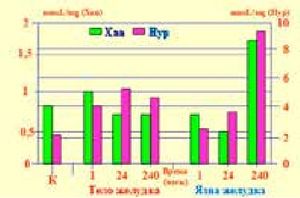 Рисунок 4.Содержание гипоксантина (Hyp) и ксантина (Xan) в слизистой оболочке тела желудка и краях язвы в разные сроки язвенного процесса.
Рисунок 4.Содержание гипоксантина (Hyp) и ксантина (Xan) в слизистой оболочке тела желудка и краях язвы в разные сроки язвенного процесса.
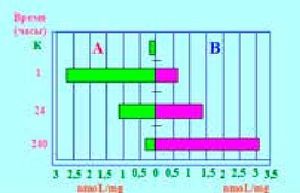 Рисунок 5.Содержание мочевой кислоты (AU) в слизистой оболочке тела желудка (А) и краях язвы (В) в разные сроки язвенного процесса.
Рисунок 5.Содержание мочевой кислоты (AU) в слизистой оболочке тела желудка (А) и краях язвы (В) в разные сроки язвенного процесса.
свидетельствовали о том, что катаболические и анаболические процессы в динамике заживлении язв протекают параллельно, т.е. в соответствии с патофизиологическими особенностями течения стадий воспаления. При этом возникает парадоксальная ситуация: в краях рубцующихся язв происходит накопление (депонирование) мочевой кислоты. Очевидно, это было связано с адаптивной реакцией организма в ответ на повреждение и гиперпродукцию активных форм кислорода, поскольку мочевая кислота - это не только детергент, но и антиоксидант, перехватчик свободных радикалов и стабилизатор мембран клеток [8]. Таким образом, на основании результатов патоморфологических исследований и изучения структурного метаболизма в экспериментальных язвах желудка был сделан вывод о целесообразности введения при местном лечении ЯБ в регион язвенного поля энергоносителей, антиоксидантов и веществ, обладающих репаративной активностью. Поскольку нарушения метаболизма при ТК и ГШ достигают критического уровня, мы предположили, что рецидивы кровотечений (РК) у больных с ВОАР могут быть обусловлены последствиями этих нарушений, а также в результате воздействия агрессивных компонентов ЭГ на язвенный субстрат. Поэтому дефицит энергообеспечения, оксидативный стресс и репаративная недостаточность были выделены нами как ключевые факторы патогенеза РК, представляющие мишень для лечебного воздействия. В связи с указанными обстоятельствами Л.Я. Тименым [8,16] для профилактики РК и защиты тканей в процессе выполнения ЭГ был разработан метод эндоскопического превентивного метаболического гемо и гомеостаза (ЭПМГ) с включением источников энергообеспечения (5% -ный раствор глюкозы), репарантов-антиоксидантов с функцией «кислородной ловушки» (5% -ный раствор аскорбиновой кислоты) и дыхательных хромогенов (1%-ный раствор метиленового синего). При оценке результатов воздействия ингредиентов ЭПМГ на заживление экспериментальных ЯЖ и экспериментальных ран, а также в случаях лечебной эндоскопии, в том числе, при длительно не рубцующихся, а также гигантских язвах и стойком болевом синдроме, был отмечен высокий репаративный эффект с продолжительным (более 5 суток) депонированием в тканях 5% -ных растворов глюкозы и аскорбиновой кислоты (рис.6,7).
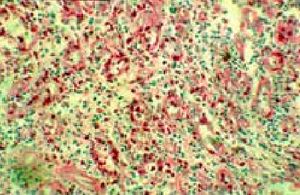 Рисунок 6. Лечебная эндоскопия. 5 %-ный раствор глюкозы.Язва желудка. Фаза рубцевания. Зрелая грануляционная ткань с множественными глыбками полиаминосахаридов.
Рисунок 6. Лечебная эндоскопия. 5 %-ный раствор глюкозы.Язва желудка. Фаза рубцевания. Зрелая грануляционная ткань с множественными глыбками полиаминосахаридов.
4 сутки. PAS-реакция, ×140.
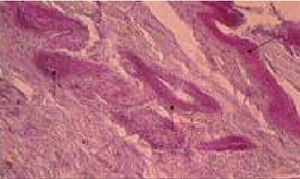 Рисунок 7. Местное лечение экспериментальной раны. 5 %-ный раствор глюкозы. Депонирование полиаминосахаридов в эпителии и строме раны. 6-е сутки. PAS-реакция, ×250
Рисунок 7. Местное лечение экспериментальной раны. 5 %-ный раствор глюкозы. Депонирование полиаминосахаридов в эпителии и строме раны. 6-е сутки. PAS-реакция, ×250
В процессе одновременной лечебной эндоскопии-гастросцинтиграфии с использованием технеция Тс99m-пертехнетата 5%-ные растворы глюкозы и аскорбиновой кислоты вводились под края язвенных дефектов тела и антрального отделов желудка, а их контуры насыщения (т.е. депо) были обнаружены дистальнее зоны исходной инфильтрации, а также на значительном расстоянии - в тканях двенадцатиперстной кишки (рис.8)
 Рисунок 8. Пролонгированная локальная и регионарная радиоактивность 5 % р-ра аскорбиновой кислоты. 1–2 сутки.
Рисунок 8. Пролонгированная локальная и регионарная радиоактивность 5 % р-ра аскорбиновой кислоты. 1–2 сутки.
и сохранялись более 1 суток при периоде полураспада Тс99m-пертехнетата около 6 часов. По предположению Л.Я. Тимена [8] накопление и потребление индикаторов пуринового обмена AMP, GMP и IMP, также полиаминосахаридов и аскорбиновой кислоты (рис.2,3,6,7,8) было обусловлено необходимостью восстановления и сохранения гомеостаза [9] образованием самим организмом биологических резервуаров, включающих вещества-источники полезной энергии, антиоксиданты и репаранты, потребляемые «on demand» для восстановления постоянства гомеостатической среды, согласно закону Claude Bernard [10]. В связи с указанным обстоятельством и в соответствии с 2-м законом термодинамики было принято решение [8] о целесообразности формирования при выполнении ЭПМГ питательной среды, т.е. искусственных биологических резервуаров, в виде перифокального инфильтрационного депо из 5%-ных растворов глюкозы и аскорбиновой кислоты (рис.9).
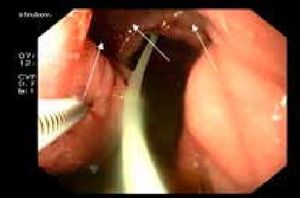 Рисунок 9.Эндоскопический превентивный метаболический гемо- и гомеостаз. Формирование перифокального инфильтрационного депо проксимально от язвенного кратера.
Рисунок 9.Эндоскопический превентивный метаболический гемо- и гомеостаз. Формирование перифокального инфильтрационного депо проксимально от язвенного кратера.
В настоящем сообщении мы хотели обратить внимание клиницистов на приоритетные функции глюкозы и аскорбиновой кислоты в восстановлении гомеостаза у пациентов с ВОАР. Глюкозе принадлежит ведущая роль в осуществлении физиологического и структурного метаболизма с помощью двух главных функций: макроэргической и стимуляции инсулиноподобного фактора роста. Окисление одной молекулы глюкозы сопровождается синтезом 32 молекул АТР. Аскорбиновая кислота — антиоксидант, «фундамент физиологии человека». Благодаря дифенольной группе (– СОН= =СОН- ) аскорбат обладает сильно выраженными восстановительными свойствами и принимает активное участие в усвоении железа, регуляции углеводного обмена (через синтез триптофана), образовании стероидных гормонов, тормозит избыточную активность протеаз и амилазы поджелудочной железы, способствует накоплению гликогена в печени, усиливает детоксикационную функцию печени и др. Главными функциями аскорбиновой кислоты являются ее участие в построении антиоксидантной защиты (перехват радикалов кислорода, восстановление глутатиона и витамина Е), регенерации убихинона, реакциях окислительного фосфорилирования и защиты митохондрий от окислительного стресса для обеспечения дыхательной функции клеток. Нами была установлена важнейшая роль аскорбиновой кислоты в стабилизации свободнорадикального статуса, обусловленная не только антиоксидантными, но и прооксидантными компонентами биофизического воздействия на патологические процессы, благодаря которым осуществляются нейро-эндокринные и иммунные функции организма [8,16].Ведущая роль принадлежит аскорбату и в осуществлении «качественного восстановления» поврежденных тканей путем стабилизации стенок капилляров и синтеза проколлагена и коллагена I, III типов [7]. Синтез аскорбата (из глюкозы) происходит только у животных, а его потребности у человека покрываются за счет поступлений извне. Аскорбат и глюкоза постоянно взаимодействуют и «помогают» друг другу. Так, аскорбат активирует фермент гексокиназу, обеспечивающий метаболизм глюкозы в клетке, и входит в митохондрии через транспортер глюкозы GLUTI. Пути их пересечения прослеживаются в комбинациях различных реакций. Но главное место встречи-матрикс внутренней митохондриальной мембраны, где глюкоза (макроэрг и донатор Н+ ) и аскорбат (акцептор и донатор Н+ ) участвуют в сопряжении гликолиза, окислительного фосфорилирования, синтеза АТР и восстановления О2 , т.е. в осуществлении клеточного дыхания. Без Н+ ионов, аккумуляторов огромного энергетического потенциала, невозможны процессы окислительного фосфорилирования и синтеза АТР. Утрата эритроцитами способности к деформации при снижении содержания в них АТР только на 15% значительно ухудшает реологические свойства крови и качество микроциркуляции [7]. Поэтому мы оставляем за рамками этой статьи обсуждение о целесообразности применения ИПП при кровотечениях у больных с ГШ. Общее содержание АТФ в организме 30–50 г. Каждая молекула АТФ в клетке «живёт» меньше минуты. В связи с отсутствием запасов АТР в клетке необходимо постоянное и полноценное обеспечение организма полезной энергией. В результате использования ЭПМГ в лечении ЯГДК, осложненных ТК и ГШ, в случаях полного выполнения программы ЭГ оперативных вмешательств не было. У 5,5% пациентов возникли РК. Летальность 22,2% была обусловлена постгеморрагической анемией, полиорганной недостаточностью и РДСВ. Таким образом, по нашему мнению формирование «биологических резервуаров» - это результат адаптивной реакции организма на ТК и ГШ, свидетельствующий о необходимости адекватной метаболической поддержки при неизбежных высоких энергетических затратах, обусловленных патогенетическими закономерностями течения ГШ с ключевыми синдромами катаболического каскада- системного воспалительного ответа (SIRS) и последующего гиперметаболического ответа на тяжелое повреждение [8].
Литература
1. Schwartz K. Beitrage uber penetrierende Magen-und Jejunalgeschwure. Klin. Chir. 1910; 57: 96–128
2. Graham D.Y. Campylobacter pylory and peptic ulcer disease. Gastroenterol. 1989; 96(Suppl.): 615–625
3. Циммерман Я.С. Язвенная болезнь: актуальные проблемы этиологии, патогенеза, дифференцированного лечения. Клин. мед. 2012. № 8 стр. 11–18
4. Василенко В.Х. Чего мы не знаем о язвенной болезни (пути изучения проблемы). В кн.: Актуальные вопросы гастроэнтерологии.М.,1970; вып.3: 3–17)
5. Чернух А.М. Предболезнь, начало болезни и выздоровление (общепатологические аспекты проблемы). В кн.: 18-й Всесоюзный съезд терапевтов.; т. 1: 118–121.
6. Sircus W. Modern management of peptic ulcer with special reference to the placebo phenomenon. Ital. J. Gastrroenterol. 1980; 12(4): 315–323)
7. Murrey R., Granner D., Mayes P., Rodwell V.// Harper’s biochemistry. — 2004. — v. I, II
8. Тимен Л.Я., Трубицына И. Е., Чикунова Б. З. Принципиальные особенности эндоскопического программированного гемостаза при язвенных гастродуоденальных кровотечениях у больных с высоким операционно-анестезиологическим риском. Экспер и клин гастроэнтерол 2013. —№ 12. — стр 65–74)
9. Сannon W. The wisdon of the body \ W. Cannon. — Ny; Norton and Co.1939 10. Bernard C.I. Balliere Lecons de Physilogie Experimentale. — Paris. — 1859 11. Amasage K., Okabe S. Acetic acid ulcers: a new method for producing solitary chronic ulcers in rat stomachs by intraluminal application of acetic acid solution // Inflammopharmacology. — 2002. — Vol. 10. — N4–6. — P. 385–389)
12. Насонов Д.Н. Местная реакция протоплазмы и распространяющееся возбуждение. \ 2изд. М. — Л, 1962)
13. Соколова Г.Н., Потапова В. Г., Трубицына И.Е. и др. Роль местных факторов в хронизации язвенного процесса в желудке. // Эксперим. и клин. гастроэнтерол. 2003. —№ 1. — С. 109–110.
14. Selye H. A Syndrome Produced by Diverse Nocuous Agents. //Nature. vol. 138, July 4 (1936), p. 32
15. Толстых П.И. Клебанов Г.И., Шехтер А.Б. и др. Антиоксиданты и лазерное излучение в терапии ран и трофических язв. Издательский дом «ЭКО». Москва. —2002. — С. 14–16.
16. Тимен Л.Я., Мачнева Т. В., Варданян Э.С., Шерцингер А.Г., Жигалова С.Б. Аскорбиновая кислота и глюкоза в коррекции процессов свободнорадикального окисления. Экспериментальное исследование. Части I и II. //Экспериментальная и клиническая гастроэнтерология. —2005. —№ 5. — стр. 74–78 и 2006. — № 5. стр.52–58