
|
|
||
|
|
||
|
|
||
|
|
||
|
|
||
|
|
||
|
|
||
|
|
||
|
|
||
|
|
||
|
|
||
|
|
||
|
|
||
|
|
||
|
|
УДК 616.992.282
Проблемы медицинской микологии, 2007, Т.9, №4, С. 4-11
ГРИБЫ РОДА CANDIDA В КИШЕЧНИКЕ: КЛИНИЧЕСКИЕ АСПЕКТЫ (ОБЗОР)
Шевяков М.А.1, Авалуева Е.Б.2, Барышникова Н.В.2
1Кафедра клинической микологии, аллергологии и иммунологии НИИ медицинской микологии СанктПетербургской медицинской академии последипломного образования, Россия; 2Кафедра гастроэнтерологии СанктПетербургской государственной медицинской академии им. И.И.Мечникова, Россия.
©Коллектив авторов, 2007
Обзор содержит современные данные о роли грибов рода Candida в развитии ряда патологических процессов у человека. Обсуждается патогенез, клинические проявления, диагностика и лечение кандидоза кишечника.
Ключевые слова: дисбиоз, кандидоз, кишечник, колит, натамицин, Candida.
INTESTINAL CANDIDA SPP.: CLINICAL ASPECTS (REVIEW)
Shevyakov M.A.1, Avalueva E.B.2, Baryshnikova N.V.2
1Chair of Clinical Mycology, Allergology and Immunology of Kashkin Research Institute of Medical Mycology of SEI APE SPb MAPE, Saint Petersburg, Russia; 2Faculty of Gastroenterology of the St.Petersburg Mechnikov State Medical Academy, Russia
© Collective of authors, 2007
The review contains the modern data of the role of Candida spp. in development of some pathological processes. The pathogenesis, clinical displays, diagnostics and treatment of a candidosis of intestines have been discussed.
Key words: dysbiosis, candidosis, intestine, colitis, natamycin, Candida.
Слизистые оболочки являются «открытыми системами» макроорганизма, непрерывно контактирующими с окружающей средой. Контакт слизистых оболочек человека и грибов рода Candida объясняет значительную распространенность транзиторного кандиданосительства в человеческой популяции. Клиническое значение обнаружения грибов рода Candida в стуле пациента неоднозначно, поскольку может свидетельствовать как о норме, так и о патологии.
Спектр болезней, вызываемых Candida spp., достаточно широк и варьирует от поверхностных поражений слизистых оболочек до висцеральных микотических поражений. Поражение слизистых оболочек органов пищеварения, вызываемое Candida spp., является частой инфекцией, особенно у пациентов с иммунодефицитными состояниями.
Известно, что все многоклеточные живые организмы (Metozoa) колонизированы мириадами одноклеточных микробных организмов, составляющих эндогенную микробиоту. Большие площади покровов млекопитающих контактируют с внешней средой (например, ротовая полость, гениталии, кожа), но и большое количество разнообразных видов эндогенной бактериобиоты присутствует в дистальной части их пищеварительного тракта, в особенности в толстой кишке. Метаболизм питательных веществ и органических субстратов, поддержка метаболизма кишечного эпителия, сосудов и лимфоидной ткани, сотрудничество в создании колонизационной резистентности к патогенным организмам, участие в формировании местного и системного иммунного статуса макроорганизма вот важнейшие функции кишечной микробиоты, играющей очевидную роль в физиологических и патофизиологических процессах желудочнокишечного тракта. Известно, что кишечная микробиота человека представлена пристеночным (mucousassociated) и просветным (planctonic) пулами [Florey H., 1955].
Эпителиальная поверхность гастроинтестинального тракта человека покрыта слоем слизи. Этот вязкоэластический гель [Allen A., 1981] осуществляет защиту слизистой оболочки против адгезии и инвазии различных патогенных микроорганизмов, бактериальных токсинов, конечных продуктов метаболизма, панкреатических эндопептидаз, микробных антигенов и различных других повреждающих агентов, присутствующих в просвете кишки [Allen A., 1981]. Муциновый гель колонизирован комплексной бактериальной популяцией (т.н. мукозоассоциированная бактериобиота).
Кишечная бактериальная популяция, растущая на поверхности муцина (пристеночная), отличается от просветной микробиоты более интенсивным заселением и ростом. Среди всех микроорганизмов кишечника человека преобладают факультативные анаэробы [15]. Мукозоассоциированная бактериобиота и муцин находятся в кооперативных трофических связях, неотделимых от функционирования всей кишечной микробиоты [2,3]. Так, например, муцин является источником карбогидратов для сахаролитических бактерий, растущих в толстой кишке, особенно в дистальной его части, где общее количество способных к брожению карбогидратов обычно ограничено [Macfarlane G. T., et al., 1992]. Муцин и другие продуцируемые организмом гликопротеины способны поддерживать рост комплексных бактериальных сообществ в толстой кишке в отсутствии пищевых субстратов, т.е. даже при голодании [Miller T. L., et al, 1984]. В эксперименте и in vivo показано, что бифидобактерии заселяют муциновый слой медленнее в то время как анаэробные бактерии группы Bacteroides fragilis, клостридии и энтеробактерии - быстрее[6].
Всю микробиоту кишечника человека условно подразделяют на облигатную (или постоянную, нормальную), факультативную (или непостоянную, балластную) и транзиторную (или условнопатогенную, оппортунистическую). Несмотря на условность такого деления, изменение качественного и количественного состава микробиоты, в данном случае кишечной, носит название дисбиоза.
Видовой состав микробиоты кишечника человека чувствителен к различным влияниям. Он меняется при различных патологических состояниях, связанных с иммуносупрессией (например, прием иммуносупрессивных препаратов, трансплантация органов и тканей, онкологические болезни, гемодиализ, оперативные вмешательства, радиоактивное облучение), при приеме лекарственных средств (антибиотики, глюкокортикостероидные гормоны), при длительном парентеральном питании, голодании, ишемии и гипоксии кишки, тяжелых и хронических болезнях. При этом происходит нарушение метаболических процессов в муциновом слое, что повышает его чувствительность к литическим энзимам, вырабатываемым микробиотой кишки, и способствует размножению условнопатогенных и патогенных бактерий, увеличению их представительства в кишечнике и транслокации через мезентериальные лимфатические узлы в портальный тракт, что неизбежно приводит к диссеминации патологического процесса.
Во врачебной практике среди различных форм кандидозного поражения слизистых оболочек пищеварительного тракта кандидозный дисбиоз кишечника встречается достаточно часто. Полагают также, что при системном кандидозе кишечник может служить источником инфекции, где Candida spp. часто обнаруживают в составе кишечной микробиоты, и поражение желудочнокишечного тракта часто предшествует инвазивному системному кандидозу [7]. Например, при аутопсии онкологических пациентов с системным кандидозом показано, что у 20% таких больных обнаружены кандидозные поражения тонкой и толстой кишки [8]. Спонтанная перфорация слепой кишки ассоциируется с системным кандидозом у недоношенных детей другой популяционной группы риска [9].
Несмотря на видимую связь кишечного поражения и системного кандидоза, кандидоз желудочнокишечного тракта не является хорошо изученным. Взаимодействие C. albicans со слизистой оболочкой пищеварительного тракта в полной мере не изучено, также не идентифицированы полностью механизмы инвазии и лимфогематогенной диссеминации. Данные литературы, особенно экспериментальные, подчас противоречивы. При изучении повреждения пищеварительного тракта при оральной инокуляции C. albicans на биологических моделях, таких как новорожденные мыши, мыши, получавшие антибиотики или иммуносупрессивные препараты, иммуносупрессивные мыши, кролики, поросята, наблюдали связь колонизации кишечника и определенного уровня диссеминации Candida [10]. Выявили развитие кандидоза кожи и слизистых оболочек, интестинального кандидоза и диссеминация инфекции при оральной инокуляции C. albicans иммуносупрессивным поросятам как высоко чувствительной к различным энтеральным патогенам экспериментальной модели. Причем язвеннонекротические области поражения желудочнокишечного тракта наблюдали, преимущественно, в тощей кишке, а в толстом кишечнике встречались реже [9].
1. В противовес этим исследованиям продемонстрировали экспериментальное развитие системного кандидоза при оральном введении C. albicans иммуносупрессивным кроликам, но без повреждения кишечника [Walsh T. J., et al, 1992]. Актуален ли кандидоз кишечника как источник диссеминации инфекции у пациентов с иммунодефицитами, остается неясным. Однако следует заметить, что Candida spp., в основном, инвазируют слизистые оболочки, представленные многослойным плоским эпителием, и поэтому чаще в клинической практике встречается кандидоз полости рта, пищевода, влагалища, кожи. Инвазия нитчатой формы Candida spp. в однослойный эпителий (например, матки, бронха, кишечника) встречается значительно реже. Следует предположить, что «сопротивляемость инвазии» у однослойного эпителия выше, чем у многослойного, и согласно этой логике, при иммунодефицитах проникновение гриба в «закрытые» тканевые пространства произойдет скорее вследствие, например, орофарингеального кандидоза, а не кандидоза кишечника.
Проводили сравнение состояния слизистой оболочки слепой кишки у мышей, получавших и не получавших лечение антибиотиками. Было показано, что у мышей, которым давали антибиотики, имеет место не только не только пенетрация муцинового слоя грибами рода Candida, но и нарушение равновесия мукозоассоциированной бактериобиоты на всем протяжении слизистой оболочки кишечника с преимущественным поражением слепой кишки [Kennedy M.J., et al, 1987].
Кандидозный дисбиоз можно представить как увеличение представительства грибов рода Candida в составе микробиоты желудочнокишечного тракта на фоне устойчивого дефицита нормальной бактериобиоты. В исследованиях in vitro показано, что на поверхности триптозного агара лактобациллы и дрожжеподобные грибы могут образовывать смешанный газон, в составе которого Lactobacillus plantarum не проявляют фунгицидную активность и их рост ингибируется Candida spp.[11].
Развитию кандидозного дисбиоза кишечника как варианта кандидоза слизистых оболочек, способствовала широко распространенная практика применения антибактериальной терапии, создающая условия для уничтожения естественных конкурентов грибов – бактерий, а также увеличение числа пациентов с иммунодефицитными состояниями различного генеза.
Сложность рассматриваемой проблемы лишний раз подчеркивает тот факт, что до сих пор нет единства в вопросе нозологической терминологии, касающейся кандидоза кишечника. Так, нам удалось обнаружить в литературе несколько терминов, применяемых для обозначения состояний, ассоциированных с обнаружением грибов в кишечнике: избыточный интестинальный рост Candida (intestinal candida overgrowth), кандидаассоциированная диаррея (candidaassociated diarrhea), кандидаассоциированный синдром (candidaassociated syndrom), синдром кандидозной гиперчувствительности (сandidiasis hypersensitivity syndrome), кандидозный энтерит (в МКБ-10), просветочный предынвазивный кандидоз или кандидаколонопатия, дисбиоз кишечника с повышенной (или избыточной) пролиферацией Candida spp.
Патогенез кандидоза слизистых оболочек пищеварительного тракта характеризуется последовательным прохождением всех следующих этапов – адгезии, инвазии, кандидемии, висцеральных поражений. На первом этапе микромицеты адгезируются к эпителиоцитам какоголибо участка слизистой оболочки. Исследования, проведенные на экспериментальной модели (мышах, получавших антибиотики) показали, что C. albicans соединяется со слизистой оболочкой толстого кишечника, по меньшей мере, посредством пяти различных механизмов. Данные механизмы включают: адгезию к кишечному эпителию, адгезию к слизи, коадгезию к адгезированным грибам, коадгезию к адгезированным бактериям, встраивание в структуры слизистого геля, лежащие выше эпителия [Kennedy M.J., et al, 1987].
В дальнейшем, дефекты в системе резистентности позволяют микромицетам через трансформацию в псевдомицелий внедряться (инвазироваться) в слизистую оболочку и подлежащие ткани. Цитопения решающий фактор, который позволяет инвазирующимся грибам достигать стенки сосуда, затем происходит транслокация возбудителя в мезентеральные лимфатические узлы, а затем по системе портальной вены в системный кровоток и внутренние органы [12].
Способность к пенетрации долгое время считалась основным фактором вирулентности Candida spp., так как, будучи комменсальным микроорганизмом слизистых оболочек и непосредственно кишечной, клетки Candida могут служить источником инвазивной инфекции [13]. Однако способность Candida заселять поверхности и образовывать биопленки в настоящее время считается не менее значимым признаком вирулентности гриба [14,15].
Три механизма помогают объяснить феномен транслокации: нарушение кишечной барьерной функции, избыточный рост оппортунистической микробиоты кишечника, нарушение защитных механизмов макроорганизма [16]. Уникальность сосудистой анатомии кишечника, предрасположенность к ишемии и гипоксии слизистой оболочки, нарушение моторноэвакуаторной функции усугубляет процесс транслокации в условиях увеличения продукции токсинов и, соответственно, их резорбции [17]. Массивная транслокация грибов из кишечника в условиях нарушенного интестинального кровотока приводит к развитию кандидемии. В отсутствие адекватной терапии кандидемия приводит к образованию очагов инвазивного кандидоза в висцеральных органах легких, эндокарде, печени, центральной нервной системе.
Все же клинически феномен роста грибов в кишечнике может представлять собой либо носительство, либо неинвазивный микотический процесс (дисбиоз) или специфический вариант воспаления слизистой оболочки кишечника кандидозный колит, обусловленный инвазией нитчатых форм гриба в ткани кишечника. Иногда эти отдельные клинические формы представляют соответствующие этапы развития кандидозной инфекции.
Грибы рода Candida широко распространены в окружающей среде, часто контаминируют продукты питания, питьевую воду, кожу и слизистые оболочки лицносителей, что делает контакт человека с Candida spp. ординарным фактом [18]. Дальнейшая судьба микромицетов, проникнувших в «открытые системы» макроорганизма (т.е. на кожу и слизистые оболочки), определяется состоянием системы антифунгальной резистентности последнего.
Микромицеты Candida spp. как типичные возбудители оппортунистической инфекции проявляют свой патогенный потенциал при условии нарушений в системе антимикробной резистентности хозяина. Факторы патогенности микромицетов Candida spp. можно представить в следующем виде [19-21]:
- способность к адгезии на тканях хозяина и образованию «биопленок» на полимерном покрытии медицинского оборудования;
- способность к трансформации в псевдомицелий, инвазирующий ткани хозяина;
- микогенная сенсибилизация за счет алкогольдегидрогеназы и кислого Р2протеина;
- синтез гидролитических энзимов, таких как секретируемые аспартилпротеиназы и фосфолипазы, вызывающих повреждение тканей хозяина;
- фенотипическая изменчивость, которая может играть роль в процессах адаптации грибов к различным анатомическим нишам хозяина и приобретения резистентности к антифунгальным препаратам;
- иммуномодуляторные эффекты, повреждающие эффективность систем антимикробной резистентности хозяина;
- токсигенность за счет гемолизина и эндотоксинов;
- подавление облигатной бактериобиоты слизистых оболочек хозяина и формирование микстинфекции.
При оптимальной реакции механизмов антифунгальной резистентности хозяина клетки микромицетов будут уничтожены или после короткого присутствия отторгнуты с выделением во внешнюю среду (т.н. спонтанная элиминация или транзиторное кандиданосительство соответственно). При относительно легких поломах в системе антифунгальной резистентности макроорганизма (в основе которых чаще лежит дисбиоз) грибы могут колонизировать обширные площади «открытых систем» с формированием т.н. персистирующего кандиданосительства, или колонизации. Клиническое значение этого феномена еще предстоит уточнить, однако уже сейчас ясно, что принципиально возможно возникновение клинически значимой микогенной сенсибилизации в результате персистирующего контакта антигенных структур гриба с иммунокомпетентными клетками слизистой оболочки человека. При выраженных нарушениях в системе антифунгальной резистентности организма (иммунодефицитных состояниях) возможна трансформация микромицетов в нитевидную форму (псевдомицелий) и внедрение грибов в ткани микроорганизма, что собственно и определяет развитие кандидоза. Таким образом, микогенная сенсибилизация и аллергия к Candida spp. могут сформироваться как при кандидозе, так и при колонизации слизистых оболочек макроорганизма [22].
Антигены Candida spp. обладают различными аллергенными свойствами. Протеинсодержащие компоненты клетки микромицетов (цитоплазматические белки, алкогольдегидрогеназа, кислый Р2протеин) индуцируют преимущественно развитие немедленного (I) и замедленного (IV) типов аллергических реакций, гликопротеины клеточной стенки в большей степени стимулируют синтез нереагиновых антител и могут вызывать иммунокомплексный (III) тип реакции [23].
Умеренная сенсибилизация к аллергенам Candida spp. – довольно распространенное явление. В то же время повышенный уровень специфических реагиновых антител к Candida spp. у больных, страдающих различными аллергозами, также отмечают часто. Например, у больных бронхиальной астмой сенсибилизацию к антигенам дрожжеподобных грибов обнаруживают в 10-55% случаев [24,25].
Положительные результаты радиоаллергосорбентного теста с аллергенами Candida spp. были выявлены у 22% больных с атопическим дерматитом [26]. У 25% больных, страдающих хронической крапивницей, выявляют повышенный уровень реагиновых антител к Candida spp. [27].
Сложным остается вопрос о влиянии сенсибилизации к Candida spp. на течение аллергических заболеваний. Суммируя литературные данные и собственные наблюдения, можно указать на четыре звена патогенеза кандидоза кишечника, отягощающих течение аллергозов и псевдоаллергических заболеваний:
- сенсибилизация к аллергену Candida spp.;
- индукция псевдоаллергических реакций за счет повышения внутрикишечной концентрации биологически активных веществ и продуктов аномальной ферментации, дестабилизирующих мембрану иммунокомпетентных клеток;
- нарушение инактивации внутрикишечного гистамина облигатной микробиотой кишечника, подавляемой избыточным ростом Candida spp.;
- ухудшение качества жизни больного при дисбиозе в целом.
Инвазивный кандидоз кишечника, связанный с трансформацией грибов в псевдомицелий и внедрением последнего в ткани кишечника, развивается у больных с глубокими иммунодефицитными состояниями. В группе риска по инвазивному кандидозу находятся больные СПИД, а также пациенты, длительно получающие терапию системными глюкокртикостероидами и иммунодепрессантами, лица с генетическидетерминированными иммунодефицитами [27]. Клиническая картина при инвазивном кандидозе кишечника характеризуется тяжелым состоянием больного, выраженной интоксикацией, абдоминальным болевым синдромом, диареей (но не всегда!), лихорадкой. При эндоскопическом исследовании выявляют выраженный эрозивнофибринозный колит. Характерно, что кандидозный колит «включен» в картину кандидасепсиса, то есть одновременно выявляют специфические поражения легких, кожи, полости рта и пищевода, гепатоспленарный кандидоз. При морфологическом исследовании слизистых оболочек обнаруживают нитевидные формы Candida spp. Инвазивный кандидоз кишечника у иммунокомпетентных субъектов маловероятен [Jarvis, W. R.,1995].
Течение язвенной болезни ДПК или язвенного колита также может осложниться кандидозом. При этом инвазия псевдомицелия Candida spp. происходит исключительно в участках кишечника, деэпителизированных вследствие основного заболевания. Такие формы поражения называют инвазивными фокальными [28].
Однако в практике терапевта чаще встречается неинвазивное поражение дисбиоз кишечника с избыточным ростом Candida spp. Этот вариант заболевания не связан с трансформацией грибов в нити псевдомицелия и внедрением в слизистую оболочку кишечника. В его основе лежит действие метаболитов грибов, резорбируемых в кишечнике при массивном росте последних в просвете кишки. Около 36% всех дисбиозов кишечника протекают с избыточным интестинальным ростом Candida spp. [29]. При кандидозном дисбиозе кишечника состояние больных, как правило, удовлетворительное. Симптомы заболевания: флатуленция, умеренный абдоминальный дискомфорт, изменения в консистенции и частоте стула (обычно стул кашицеобразный, чаще 2-3 раз в сутки), признаки умеренной интоксикации и тенденция к обострению аллергических и псевдоаллергических заболеваний [30-32].
В чем разница между терминами «дисбиоз кишечника с повышенной пролиферацией грибов рода Candida» и «синдром раздраженного кишечника»? Общность этих нозологических единиц состоит в отсутствии выраженных морфологических изменений кишечника, но патогенез и лечение их существенно разнятся. Повидимому, определенная часть больных с синдромом раздраженного кишечника страдают дисбиозом, и коррекция последнего улучшает качество их жизни.
Важно отметить, что кандидоз слизистых оболочек часто протекает как микстинфекция. Это происходит изза того, что дисбиоз (т.е. дефицит облигатных бифидумбактерий и лактобацилл) создает условия для адгезии на слизистой оболочке кишечника не только дрожжеподобных грибов, но и условнопатогенной бактериобиоты. Так, частота микстинфекции при дисбиозе кишечника с повышенной пролиферацией грибов рода Candida составляет 63%. При этом чаще обнаруживают ассоциацию со значительным количеством бактерий с так называемым протеолитическим основным путем метаболизма (условнопатогенными) Esherichia coli, Ristella, Clostridium perfringens, Klebsiella, Morganella, Bacteroides, Staphilococcus aureus, Pseudomonas aeruginosa. Колонизация кишечника условнопатогенными бактериями существенно повышает риск бактериальной сенсибилизации у больных с аллергозами.
У 14,6% пациентов с кандидозом кишечника обнаруживают повышение уровня сывороточных IgEантител к Candida spp., что достоверно выше, чем в контрольной группе (5,5%) [20].
Заподозрить кандидозное поражение кишечника позволяет наличие характерных факторов риска. К факторам риска кандидоза пищеварительного тракта относят: детский возраст (недоношенные дети, дети со сниженной массой тела), старческий возраст, лечение антибактериальными препаратами и глюкокортикостероидами, интенсивную цитостатическую полихимиотерапию, лучевую терапию, сахарный диабет и другие заболевания эндокринной системы, синдром приобретенного иммунодефицита (СПИД), гемодиализ, тяжелые и хронические истощающие заболевания, нарушения трофологического статуса, генетически детерминированные иммунодефициты. Сочетание особых факторов, таких как массивная колонизация кишечника Candida spp. при лечении широкоспектральными антибиотиками с анаэробной активностью, применение третьей генерации цефалоспоринов, а также антибиотиков, интенсивно концентрирующихся в собственной пластинке кишечника, первичное повреждение кишечника, гипохлоргидрия желудка, снижение кишечной перистальтики, цитотоксическая химиотерапия, длительное парентеральное питание могут привести к развитию кандидемии [3335].
Клинические варианты течения кишечного дисбиоза и связь их с факторами риска представлены в таблице 1.
Таблица 1.
Клинические варианты проявления роста микромицетов Candida spp. в кишечнике
|
Клинический вариант |
Основной патогенетический признак |
Группа риска |
|
Кандиданосительство |
Транзиторность |
65-80% общей популяции |
|
Дисбиоз кишечника с избыточным ростом Candida spp. |
Избыточный персистирующий рост микромицетов в просвете кишечника на фоне дефицита нормобиоты. |
Терапия антибиотиками, острые кишечные инфекции, ферментные энтеропатии. |
|
Кандидозный колит |
Трансформация гриба в псевдомицелий и инвазия тканей кишечника на фоне цитопенического синдрома с развитием воспалительных изменений кишечной стенки разной степени тяжести. |
СПИД, ВИЧ-инфекция, высокодозная поли-химиотерапия, генетически детерминированые иммунодефициты, инсулино-зависимый сахарный диабет, гемодиализ, трансплантация органов, неспецифический язвенный колит, колоректальный рак. |
Интересен анализ изменений кишечной микробиоты у пациентов с язвенной болезнью, получающих хеликобактерэрадикационную терапию первой линии (два антибактериальных препарата – амоксициллин и кларитромицин в сочетании с блокатором протоновой помпы). У всех больных до лечения определяли изменения микробиоты толстой кишки разной степени выраженности. Средние значения показателей находились в пределах референтных значений, но изменения наблюдали в качественном и количественном составе E. coli (E. coli с измененными ферментативными свойствами выявляли у 70% пациентов). Условнопатогенные микроорганизмы определяли у 15% пациентов, преимущественно различные стафилококки и Enterobacter spp., Candida spp. у 4 пациентов (1%). После проведенного лечения нарушения кишечного микробиоценоза усугубились: отмечали снижение уровня лактобактерий, кишечной палочки с нормальными ферментативными свойствами (ухудшение показателя имело место у 70% больных), наблюдали увеличение количества эшерихий с измененными свойствами, сохранялись гемолитические микроорганизмы, увеличилось количество Candida spp. и другой условнопатогенной микробиоты. Условнопатогенные бактерии, таких родов как Enterobacter, Klebsiella, Citrobacter, Proteus, были выделены после лечения у 26% пациентов, причем у всех больных отмечали сочетание как минимум двух оппортунистических микроорганизмов. Представительство Candida spp. возросло до 30%, то есть у каждого третьего пациента в фекалиях определяли данный оппортунистический микроорганизм. При оценке сочетаний Candida spp. и других условнопатогенных микроорганизмов, у 8 пациентов из 12 имеющих увеличение представительства грибов в кишечнике высевали сочетания как минимум трех представителей условнопатогенной микробиоты и грибов [36]. Полученные данные отражены на рисунке.
Механизмы формирования микстинфекции при кандидозе кишечника сложны и мало изучены. Повидимому, в основе формирования таких поражений лежат:
- во-первых, взаимное усиление патогенности оппортунистических грибов и бактерий;
- во-вторых, угнетающе влияние микромицетов на местный иммунный статус;
- в-третьих, угнетающее влияние микромицетов на облигатную микробиоту кишечника, активизирующее рост различных представителей оппортунистической бактериобиоты.
При изучении различных симптомов и заболеваний более чем у 300 больных показано, что достоверно чаще дрожжеподобные грибы обнаруживали в стуле больных кандидозным вульвовагинитом, с пищевой аллергией и аллергозами в целом, а также у курильщиков [37]. По результатам одних исследований, при хроническом гастродуодените, ассоциированном с Helicobacter pylori (HP), степень контаминации этим микроорганизмом слизистой оболочки желудка увеличивалась по мере повышения количества Candida spp. в толстой кишке, что было справедливо как для тела (r=0,28, p=0,032), так и для антрального отдела желудка (r=0,30, p=0,006) [38]. В других исследованиях при язвенной болезни луковицы двенадцатиперстной кишки выявляли прямую зависимость между степенью контаминации слизистой оболочки антрального отдела желудка НР и содержанием дрожжеподобных грибов в составе кишечной микробиоты (r=0,62, p=0,043) [39].
Однако остается неизученным характер такой связи – причинноследственный или конкурирующий. Другими словами, присутствие грибов рода Candida в кишечнике вызывает болезнь или является лишь отражением основного заболевания?
Эта дилемма обусловливает основные сложности в практике клинициста, где нередки клинические ситуации, когда вопросы дифференциального диагноза кандидоза кишечника и кандиданосительства, оценки значения микогенной сенсибилизации, выбора антифунгального препарата затруднены.
Дифференциальный диагноз кандидоза и кандиданосительства в кишечнике может представлять трудности. Довольно частая ошибка – постановка диагноза «кандидоз» только на основании выявления факта роста дрожжеподобных грибов в фекалиях. Между тем, этот факт может отражать транзиторное кандиданосительство. Для диагностики кандидоза, впрочем, равно как и для любой другой оппортунистической инфекции, важно не только продемонстрировать возбудитель, но и доказать его участие в патологическом процессе [30]. Один из принципиальных критериев диагноза оппортунистической инфекции – наличие поломов в системе антимикробной резистентности, а для рассматриваемой нами формы поражения это дефицит облигатной бактериобиоты – естественных конкурентов микромицетов. Таким образом, диагноз дисбиоза кишечника с избыточным ростом Candida spp. устанавливают при наличии следующих критериев:
- синдром кишечной диспепсии;
- лабораторно подтвержденный дисбиоз кишечника;
- рост Candida spp. свыше 1000 КОЕ/г при посеве кала.
Эндоскопические исследования с цитологическим изучением препаратов мало информативны, так как чаще всего патологических изменений не выявляют [20]. Дифференциальный диагноз кандидоза кишечника проводят также с хроническими инфекционными колитами, ферментопатиями (лактазной, глютеновой), опухолями, синдромом раздраженной толстой кишки.
Часть пациентов с кандидозом кишечника отмечают явления перианального кандидоза. Это заболевание появляется упорно рецидивирующим анальным зудом и жжением. При осмотре врач выявляет гиперемию и мацерацию перианальной области, резко ограниченные от окружающей кожи, а также шелушение, поверхностные трещины и эрозии. Диагноз перианального кандидоза подтверждают обнаружением псевдомицелия Candida spp. при микроскопии кожных чешуек перианальной области [40].
Диагностика кандидоза кишечника у человека представляет иногда значительные проблемы, связанные с недостаточной осведомленностью врачей в области клинической микологии, и трудности дифференциального диагноза между кандидозом слизистых оболочек и кандиданосительством. Между тем, этот факт может отражать только транзиторное кандиданосительство, часто встречающееся в популяции. Лечение же кандидоза связано с проблемой не только решения рационального выбора антифунгального препарата, но с необходимостью оценивать влияние на течение микотического поражения основного заболевания и ряда иммунопатологических факторов.
При кандидозе органов пищеварения для постановки диагноза требуется комплексное клиниколабораторное обследование. Такой диагностический комплекс включает выявление предрасполагающих факторов, объективных клинических и эндоскопических признаков кандидоза, обнаружение Candida spp. в серии биосубстратов и биопсийных материалах (с подтверждением их участия в данном инфекционном процессе).
План обследования пациента с подозрением на кандидоз кишечника и микогенную аллергию должен дополнительно включать исследование кала на дисбиоз, копрограмму, определение уровня специфических противокандидозных IgE антител и общего IgE, а также кожные пробы с аллергеном Candida (в период ремиссии аллергологической патологии). Особо следует подчеркнуть значение тщательного сбора анамнеза и выявление характерных черт заболевания, в частности, связь обострения аллергозависимой патологии с применением антибактериальной терапии или обострением кишечной симптоматики.
В плане лечения пациента с кандидозом кишечника необходимо предусмотреть следующие терапевтические направления:
- лечение основного заболевания согласно принятым стандартам;
- селективная деконтаминация кишечника, направленная на устранение причины заболевания – грибов рода Candida;
- назначение про и пребиотиков препаратов, способствующих восстановлению естественной антимикробной резистентности слизистой оболочки кишечника с целью предотвращения рецидивов дисбиоза;
- симптоматическая терапия и модификация диеты.
Во время лечения больным рекомендован пищевой рацион с ограничением простых углеводов (сахара, сладких фруктов и ягод, кондитерских изделий, меда, молока, яблок, винограда, белокочанной капусты, бобовых, кваса, пива). По показаниям допускается применение ферментных препаратов, энтеросорбентов, спазмолитиков, антибактериальных энтеросептиков.
Терапия кандидозного колита, связанного, как было указано выше, с инвазией гриба в ткани кишечника, требует назначения резорбируемых антифунгальных средств (например, азоловых) или внутривенного введения амфотерицина В. Лечение кандидозного дисбиоза кишечника не требует назначения резорбируемых азоловых антимикотиков. Показано, что лечение, например, флуконазолом, может угнетать рост Candida spp. в кишечнике: до 1/3 пациентов полностью санируются, а у остальных происходит снижение степени контаминации фекалий более чем в 6 раз. В то же время у 2/3 пациентов полной деконтаминации кишечника от дрожжеподобных грибов не происходит. Вероятно, это связано с тем, что около 80% активных метаболитов флуконазола выводятся из макроорганизма с мочой, а в просвете кишечника данный антифунгальный препарат накапливается мало [41].
Чаще всего для селективной деконтаминации кишечника от микромицетов рода Candida назначают нистатин и натамицин (Пимафуцин). Интересно, что в СССР с целью профилактики кандидозного дисбиоза кишечника, вызываемого применением антибиотиков, даже выпускали комбинированную лекарственную форму – таблетки тетрациклина с нистатином.
В отличие от имидазаловых антимикотиков, нистатин и натамицин (Пимафуцин) практически не резорбируются в кишечнике. Это их свойство, с одной стороны, делает лечение относительно безопасным. С другой стороны, отсутствие резорбции обусловливает стабильно высокую концентрацию нистатина и натамицина (Пимафуцина) именно в просвете кишечника, что является залогом успешного лечения дисбиоза кишечника с избыточным ростом Candida spp. Самым частым нежелательным эффектом при назначении этих средств является раздражение слизистых оболочек и обусловленная этим тошнота и диарея. Необходимо отметить, что у Пимафуцина эти явления выражены в меньшей степени, чем у нистатина. В отличие от нистатина, натамицин (Пимафуцин) разрешен для применения у беременных, кормящих, новорожденных, а также при язвенной болезни и панкреатите. Натамицин (Пимафуцин) назначают в таблетках взрослым по 100 мг четыре раза в день, а детям по 100 мг 2 раза в день. Курсы лечения этим средством длительностью 510 дней обычно приводят к элиминации дрожжеподобных грибов из кишечника, однако при сохранении факторов, снижающих эффективность местных антифунгальных барьеров, возможна реинфекция кандидоза [42-44].
Успешное решение первой задачи – селективной деконтаминации – позволяет рассчитывать на успех в деле восстановления и консолидации эубиоза – т.е. стойкого устранения дефицита нормобиоты кишечника. С этой целью традиционно используют про и пребиотики. Выбор пребиотиков, т.е. стимуляторов интестинального роста резидентной нормобиоты, не содержащих живые культуры нормобиоты, сегодня достаточно широк. Действующим началом таких средств может являться лактулоза, пектин, некоторые биологическиактивные продукты обмена облигатных бактерий и другие.
Для лечения перианального кандидоза местно применяют мази и кремы, содержащие антифунгальные средства, например, натамицин или другие. Однако одна только местная терапия не предотвращает рецидивов дерматита, поскольку не может осуществить селективную деконтаминацию основного резервуара кандидозной инфекции – кишечника. Поэтому при перианальном кандидозе необходимо одновременно проводить терапию кандидоза кишечника согласно принципам, изложенным выше [40].
Ведение пациента с микозами и микогенной аллергией обычно представляет значительные трудности, поэтому целесообразно наблюдение такого больного у клинического миколога.
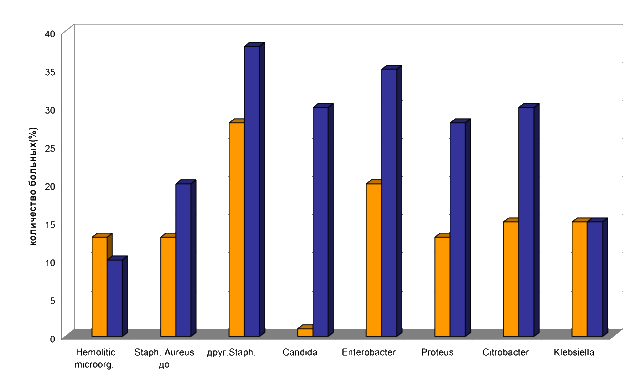
Рис. Количество больных с увеличением представителей условнопатогенной микобиоты до и на фоне проведения эрадикационной терапии
ЛИТЕРАТУРА
1. Macfarlane G.T., and Macfarlane S. Activities of human colonic mucin degrading bacteria on surfaces and in biofilms/In: A. Corfield (ed.), Mucin, methods and protocols. Humana Press, Totowa, N. J. 2000. Р. 7187.
2. Macfarlane S. and Macfarlane G.T. Bacterial diversity in the human gut //Adv. Appl. Microbiol. 2004. Vol. 54. P.261289.
3. Macfarlane S., Cummings J.H. and Macfarlane G.T. Bacterial colonization of surfaces in the large intestine/ In: G.R. Gibson and M. Roberfroid (ed.). Colonic microflora, nutrition and health. Chapman & Hall, London, United Kingdom. 1999. P. 7187.
4. Macfarlane S., Furrie E., Cummings J.H., and Macfarlane G.T. // Chemotaxonomic analysis of bacterial populations colonizing the rectal mucosa in patients with ulcerative colitis // Clin. Infect. Dis. 2004. Vol. 38. P.16911699.
5. Macfarlane S., Woodmansey E.J. and Macfarlane G.T. Colonization of Mucin by Human Intestinal Bacteria and Establishment of Biofilm Communities in a TwoStage Continuous Culture System//Appl. and Environ. Microbiol. – 2005. Vol. 71, №11. P. 74837492.
6. Poxton I. R., Brown R., Sawyer A. and Ferguson A. Mucosaassociated bacterial flora of the human colon // J. Med. Microbiol. 1997. Vol. 46. P.8591.
7. Cole G.T., Halawa A.A. and Anaissie E.J. The role of the gastrointestinal tract in hematogenous candidiasis: from the laboratory to the bedside //Clin. Infect. Dis. 1996. Vol. 22, Suppl. 2. P.S73S88.
8. Adderson E.E., Pappin A. and Pavia A.T. Spontaneous intestinal perforation in premature infants: a distinct clinical entity associated with systemic candidiasis//J. Pediatr. Surg. 1998. Vol. 33. P.14631467.
9. Andrutis K., Riggle P.J., Kumamoto C.A. and Tzipori S. Intestinal Lesions Associated with Disseminated Candidiasis in an Experimental Animal Model //J. of Clin. Microbiol.2000. Vol. 38, №6 . P. 23172323.
10. Pawlik B., Macura A.B., BialekKaleta J. Presence of fungi in stool of children //Med Dosw. Microbiol. 2002. Vol. 54, №3. P.2739.
11. Ермоленко Е.И., ЖданПушкина С.Х., Суворов А.Н. Взаимодействие Candida albicans и Lactobacillus plantarum in vitro // Ж. Проблемы медицинской микологии. 2004. Т.6, №2. С.4954.
12. Farthmann E. H. and Schoffel U. Epidemiology and pathophysiology of intraabdominal infections (IAI) // Infection. – 1998.Vol. 26, №5. P.32934.
13. Gow N.A., Brown A.J., and Odds F.C. Fungal morphogenesis and host invasion// Curr. Opin. Microbiol. 2002.Vol. 5. P.366371.
14. Douglas L. J. Candida biofilms and their role in infection// Trends Microbiol. 2003. Vol. 11. P.3036.
15. Kojic E.M. and Darouiche R. Candida infections of medical devices// Clin. Microbiol. Rev. – 2004. Vol. 17. P.255267.
16. O'Boyle C.J., MacFie J., Dave K., et al. Alterations in intestinal barrier function do not predispose to translocation of enteric bacteria in gastroenterologic patients// J. Nutrition. 1998. Vol. 14, №4. P.35862.
17. Taylor D.E. Revving the motor of multiple organ dysfunction syndrome. Gut dysfunction in AIDS and multiorgan failure // Respir. Care Clin. N. Am. 1998. Vol. 4, №4. P.61131.
18. Реброва Р.Н. Грибы рода Candida при заболеваниях негрибковой этиологии. – М.: Медицина, 1989. 128 c.
19. Елинов Н.П. Токсигенные грибы в патологии человека //Проблемы медицинской микологии. 2002. Т.4, №4. С.37.
20. Шевяков М.А. Кандидоз органов пищеварения: клиника, диагностика и лечение: Aвтореф. дисc…докт.мед.наук. – СПб., 2000. – 41 с.
21. Gow N.A., Brown A.J., and Odds F.C. Fungal morphogenesis and host invasion //Curr. Opin. Microbiol. 2002. – Vol. 5. P.366371.
22. Соболев А.В. Аллергические заболевания органов дыхания, вызываемые грибами: Aвтореф. дисc…докт.мед.наук. – СПб., 1997. – 41 с.
23. Лебедева Т.Н. Патогенез аллергии к Candida species (обзор) //Проблемы медицинской микологии. 2004. Том 6, №1. С 38.
24. Tsai J.J., Chen W.C. Different age of asthmatic patients affected by different aeroallergens // J.Microbiol.Immunol.Infect. – 1999. – Vol.32. – P.283288.
25. Ковзель Е.Ф., Соболев А.В., Митрофанов В.С. Характер микогенной сенсибилизации у больных бронхиальной астмой, проживающих в Новгородской области //Проблемы медицинской микологии. 2003. Т.5, №3. С. 1719.
26. Атопический дерматит: Руководство для врачей (под. ред. Ю.В.Сергеева). М.: Медицина для всех, 2002. 183 с.
27. Соболев А.В., Шевяков М.А., Козлова Я.И. Микозы и микогенная аллергия у больных хронической кра¬пивницей: отягощающий или независимый фактор? //Проблемы меди¬цинской микологии. 2002. Т.4, № 4. С. 1921.
28. Климко Н.Н. Микозы легких. Пособие для врачей. – М.: Премьер МТ, 2005. 96 с.
29. Шевяков М.А., Колб З.К., Савельева О.Г., Борзова Ю.В. Характер нарушений интестинального микробоценоза у пациентов с синдромом раздраженного кишечника. (Тез. докладов на 6 научнопрактической конференции по медицинской микологии (6 Кашкинские чтения) // Проблемы медицинской микологии. 2003. Т.5, №2. С. 4344.
30. Хмельницкий О.К. О кандидозе слизистых оболочек// Архив патологии. 2000. – Т.62, N6. С 310.
31. Успенский Ю.П., Шевяков М.А. Заболевания, ассоциированные с Helicobacter pylori и Candida spp.: Клиническая логика совместного изучения // Экспериментальная и клиническая гастроэнтерология 2005. №3. С 1619.
32. Эйберман А.С. Достижения и проблемы диагностики и лечения дисбиозов// Гастроэнтерология СанктПетербурга.2002. №4. С.2629.
33. Romani L. Immunity to fungal infections// Nat. Rev. Immunol. 2004. Vol. 4. P.113.
34. Van’t Wout J.W, Linde I., Leijh P.C.J., and Van Furth R. Contribution of granulocytes and monocytes to resistance against experimental disseminated Candida albicans infection//Eur. J. Clin.Microbiol. Infect. Dis. 1998. Vol. 7. P.7641.
35. Zaremba M.L. The essence of infection by opportunistic microorganisms// Przegl Epidemiol. 2001. Vol. 55, Suppl. 3. P.919.
36. Шевяков М.А., Авалуева Е.Б. Кандидозный дисбиоз, как особая форма дисбиоза кишечника. Глава 7 в: «Дисбиоз кишечника. Руководство по диагностике и лечению / Под редакцией проф. Е.И.Ткаченко и проф. А.Н.Суворова. – СПб.: СпецЛит, 2007. – 238 с.
37. Jobst D., Kraft K. Candida species in stool, symptoms and complaints in general practice a crosssectional study of 308 outpatients //Mycoses. 2006. Vol. 49. P. 415420.
38. Барышникова Н.В. Клиникомикробиологическая характеристика микробиоценоза кишечника и коррекция его нарушений у больных хроническим гастродуоденитом, ассоциированным с Нelicobacter pylori.: Автореф. дисc..канд.мед.наук. СПб., 2006. – 24 с.
39. Захарченко, М.М. Диагностика и коррекция нарушений кишечного микробиоценоза у больных язвенной болезнью двенадцатиперстной кишки неосложненного течения.: Автореф. дисc..канд.мед.наук. – СПб., 2003. – 24 с.
40. Шевяков М.А.,. Медведева Т.В., Тимошенко Н.А. и др. Диагностика и лечение перианального кандидоза. (Тез. докладов 7х Кашкинских чтений) // Проблемы медицинской микологии. 2004. Т.6., №2. С. 131 132.
41. Шевяков М.А., Митрофанов В.С., Десятик Е.А., Спиридонова Е.А. Эффективен ли флуконазол как средство деконтаминации кишечника от Candida spp.? // Материалы 8го Международного Славянобалтийского научного форума «СанктПетербург – Гастро2006» //Гастроэнтерология СанктПетербурга. 2006, №12. М171.
42. Гриневич В.Б., Успенский Ю.П., Сас Е.И. Клиническая эффективность пимафуцина в составе комплесной эрадикационной терапии язвенной болезни // Фарматека. 2003. №7. С.1719.
43. Успенский Ю.П. Клиническая эффективность натамицина (пимафуцина) в комплексной эрадикационной терапии язвенной болезни// Проблемы медицинской микологии.2003. №7. С.17.
44. Шевяков М.А. Антибиотикассоциированная диарея и кандидоз кишечника: возможности лечения и профилактики // Антибиотики и химиотерапия. 2004. Т. 49, №10. С.2629.
Поступила в редакцию журнала 10.12.07
Рецензент: В.Б. Антонов