
Pulmonary aspergillosis: a clinical update
O.S. ZMEILI, A.O. SOUBANI
Division of Pulmonary, Allergy, Critical Care and Sleep, Wayne State University School of Medicine,Detroit, USA
Q J Med 2007; 100:317–334
Введение:
Aspergillus spp. – вездесущие грибы, споры которых могут ингаляционно попадать в дыхательные пути и вызывать жизненно-опасные инфекции главным образом у лиц с иммунодефицитами. Aspergillus spp. часто выделяют из почвы, растительного дебриса и внутри помещений, включая больницы. Болезни легких, вызываемые Aspergillus spp., главным образом A. fumigatus, представлены целым спектром клинических синдромов легких (рисунок 1.)
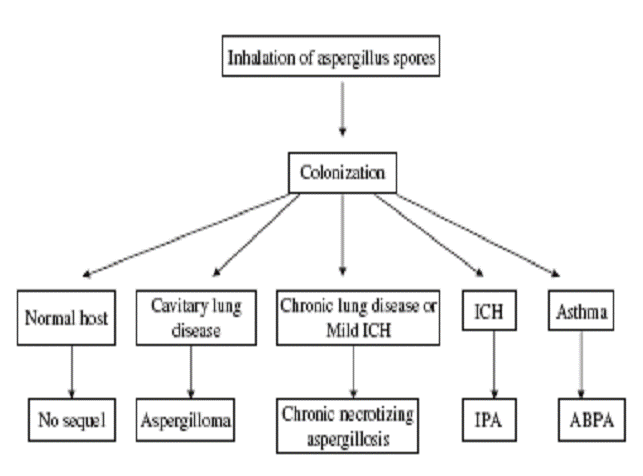
Рисунок 1. Клинический спектр состояний, возникающих в результате ингалирования спор грибов Aspergillus. ICH - иммунодефицитные состояния; IPA – инвазивный аспергиллез легких; ABPA – аллергический бронхолегочный аспергиллез.
Инвазивный аспергиллез легких (ИАЛ) – тяжелое заболевание и в большинстве случаев летальное у тяжелых иммуноскопрометированных больных. У критических больных без злокачественных заболеваний также может развиваться ИАЛ даже без наличия классических факторов риска. Хронический некротический легочный аспергиллез (ХНЛА), при котором имеет место локальная инвазия – другое заболевание легких, вызываемое Aspergillus spp. ХНЛА чаще всего наблюдают у пациентов с умеренной степенью иммуносупрессии или имеющих хронические заболевания легких. Аспергиллема и аллергический бронхолегочный аспергиллез (АБЛА) – неинвазивные заболевания легких, вызываемые грибами рода Aspergillus; аспергиллема – грибной комок, который формируется в предлежащей полости в легочной паренхиме, в то время как АБЛА – гиперчувствительное заболевание обычно поражающее пациентов с астмой и муковисцидозом.
Целью этого обзора является систематическое описание основных клинических синдромов, связанных с аспергиллезом легких, в соответствии с их встречаемостью, факторами риска, клиническими проявлениями, рентгенологической картиной, диагностическими критериями, принципами лечения и исходом. Когда мы его делали, мы использовали всю доступную литературу в Pubmed/Medline, ипользуя фразу «аспергиллез легких». Нами были просмотрены все статьи до декабря 2006 и клинически значимые из них, которые удовлетворяют этим требованиям, были рассмотрены. Список этих избранных работ представлен. Мы также использовали статьи из личных файлов авторов.
Инвазивный аспергиллез легких (ИАЛ).
ИАЛ впервые был описан в 1953 году [2]. Частота ИАЛ возросла в течение последних двух десятилетий вследствие широкого применения химиотерапии и иммуносупрессивных препаратов [3]. Groll et al., сообщили, что частота инвазивных микозов увеличилась от 0,4 до 3,1% всех аутопсий, проведенных за период между 1978 и 1992 г. [4]. К тому же частота непосредственно инвазивного аспергиллеза возросла от 17% всех микозов, обнаруженных при аутопсии в начале исследования, до 60% в конце этого 14-летнего периода исследования. Уровень летальности при ИАЛ превышает 50% у пациентов с нейтропенией и 90% у реципиентов с пересадками стволовых гематопоэтических клеток [5,6].
Факторы риска.
ИАЛ возникает преимущественно у иммуноскопрометированных пациентов. Главные факторы риска для ИАЛ (таблица 1) включают: нейтропению, пересадки гематопоэтических стволовых клеток и солидных органов, длительную и высокодозную кортикостероидную терапию, злокачественные заболевания крови, цитотоксическую терапию, развившийся СПИД и хроническая гранулематозная болезнь (ХГБ) [1,7,8].
Нейтропения, особенно абсолютная, когда количество нейтрофилов менее 500 кл/мм3 самый важный фактор риска и ИАЛ напрямую связано с длительностью и степенью нейтропении. Риск ИАЛ у больных с нейтропенией оценивается в 1% в день в течение первых трех недель, а затем он возрастает до 4% в день [7]. Пересадки солидных органов, особенно трансплантации легких и ХГБ также являются существенным фактором риска для развития ИАЛ [9,10]. Имеются несколько факторов, которые предрасполагают к ИАЛ после проведения трансплантации: множественные иммунные дефекты, включая длительную нейтропению до пересадки стволовых клеток, применение терапии против отторжения и болезни «трансплантат против хозяина», такой как кортикостероиды и циклоспорин, парентерального питания, массивной антибактериальной терапии и длительную госпитализацию.
В случаях болезни «трансплантат против хозяина» ИАЛ является главной проблемой в связи с постоянным ростом случаев ИАЛ, следующих за трансплантациями. Риск ИАЛ значительно выше при аллогенной трансплантации, чем при аутотрансплантации (0,5-4% при аутотрансплантации и 2,3-15% при аллогенной) [6,11-14]. При аллогенной пересадке наиболее высокий риск у пациентов с выраженной болезнью «трансплантат против хозяина» (уровень доказательств III-IV). У таких больных шкала частоты ИАЛ соответствует бимодальному распределению с пиком в первый месяц после пересадки стволовых клеток, который связан с нейтропенией. Второй пик происходит в течение болезни «трансплантат против хозяина» (медиана 78-112 дней после трансплантации) [6,12,15]. Первый пик в настоящее время менее значим, потому что обычное применение для трансплантации стволовых клеток вместо костного мозга, немиелоаблативные режимы, использование колониестимулирующего фактора в период нейтропении, а также широкое применение антифунгальных препаратов привело к значительному снижению эпизодов ИАЛ в течение этого периода [12,16].
С другой стороны возникновение ИАЛ в хоте терапии болезни «трансплантат против хозяина» становится более существенным, и наибольшую частоту отмечают при болезни «трансплантат против хозяина» связанной с неродственной аллогенной трансплантацией и интенсивной иммуносупрессивной терапией, включая кортикостероиды, циклоспорин А и препараты против фактора некроза опухоли [12,13,17-19]. В исследовании Marr et al., вероятность ИАЛ достигала 5% в первые 2 месяца, 9% за шесть месяцев и 10% за первый год после пересадки стволовых клеток, на третий год после трансплантации вероятность развития ИАЛ слегка возрастает до 11,1% [13]. Также очевидно, что риск развития ИАЛ увеличивается при наличии у этих больных цитомегаловирусной инфекции [13,20]. По некоторым данным уровень риска для развития ИАЛ при цитомегаловирусной инфекции возрастает в 13,3 раза [6].
Нейтрофильная дисфункция, которую наблюдают при ХГБ, является следующим фактором риска для ИАЛ, и ИАЛ является существенной причиной смерти этих пациентов [21].
С другой стороны ИАЛ относительно редко встречается у больных с ВИЧ инфекцией, особенно при использовании высокоактивной антиретровирусной терапии. По недавним сообщениям частота ИАЛ у ВИЧ-инфицированных больных с выделенными из мокроты грибами Aspergillus составила 2% [22]. Почти при всех случаях аспергиллеза, связанного со СПИДом, отмечено низкое количество CD4, обычно менее 100 кл/мм3 и у 50% ВИЧ-инфицированных больных с ИАЛ имела место нейтропения или же они получали кортикостероиды. В результате можно сказать, что в этих случаях нет других факторов риска, нежели прогрессирующий СПИД [23-25]. у этих пациентов в дополнение к обычной клинической картине ИАЛ имеет место большая частота случаев трахеобронхиальных поражений [26,26]. Гистопатологическое подтверждение диагноза обычно необходимо в установлении диагноза ИАЛ у больных СПИДом, так как просто выделение грибов Aspergillus из респираторных секретов является недостаточным для предположения инвазивного заболевания [27]. Такие пациенты обычно плохо отвечают на лечение [22-25,27].
Недавние сообщения представили описания случаев ИАЛ у иммунокомпетентных больных. Выделяют две группы риска: пациенты с тяжелым течением ХОБЛ и очень тяжелые больные. Из 13 случаев ИАЛ, диагностированного у больных ХОБЛ, поступивших в отделение интенсивной терапии с острым респираторным дистрессом, единственным фактором риска была кортикостероидная терапия [28]. Больные ХОБЛ имеют повышенную склонность к ИАЛ по нескольким причинам, включая структурные изменения легочной архитектуры, длительное применение кортикостероидов, частые госпитализации, антибактериальную терапию и сопутствующие заболевания, такие как сахарный диабет, алкоголизм и недоедание. Подавляющее большинство случаев, описанных в литературе, имели летальный исход [28-30].
ИАЛ становится значимой инфекцией у больных, находящихся в отделениях интенсивной терапии и не имеющих классических факторов риска для этого состояния. Aspergillus spp. выделяли из нижних дыхательных путей в 0,7-7% тяжелых больных и примерно у половины из этих пациентов диагностировали ИАЛ [31-35]. В одном ретроспективном исследовании 89 случаев (70%) ивазивного аспергиллеза было выявлено у пациентов, поступивших в отделение интенсивной терапии без лейкоза или злокачественных онкологических заболеваний [34]. В другом исследовании из 172 тяжелых больных, у которых в мокроте выделяли грибы Aspergillus, 83 имели инвазивное заболевание и 60% из них не имели классических факторов риска для ИАЛ. Наиболее частыми предрасполагающими факторами у этих пациентов были ХОБЛ и кортикостероидная терапия [31]. Хотя многие из критических больных с ИАЛ не имели классических факторов риска для ИАЛ (нейтропения, лейкоз, пересадки стволовых клеток), у них были состояния, повреждающие их иммунную систему, такие как ХОБЛ, системная кортикостероидная терапия, не-гематологические злокачественные заболевания, повреждения функции печени, сахарный диабет или обширные ожоги [31-34].
Клинические проявления, симптомы ИАЛ и рентгенологическая картина у больных в отделениях интенсивной терапии часто неспецифичны и обнаружение Aspergillus spp. в материале, полученном из дыхательных путей, не следует сразу же расценивать как колонизацию, даже если эти пациенты иммунокомпетентны [31]. При подозрении на ИАЛ у критических больных следует проводить дальнейшие диагностические мероприятия и рассмотреть вопрос проведения ранней антифунгальной терапии [36,37]. Летальность при ИАЛ в этой группе больных составляет 18,9% [34]. Предполагают, что выделение Aspergillus из нижних дыхательных путей связано с плохим исходом пребывания в отделениях интенсивной терапии вне зависимости от того, выявлен ли у этих пациентов ИАЛ или имеет место просто колонизация [38].
Клинические проявления.
Наиболее часто грибы рода Aspergillus попадают в нижние дыхательные пути вследствие ингалирования спор. Менее часто ИАЛ может начинаться из других мест, например придаточных пазух носа, желудочно-кишечного тракта или кожи (катетеры, длительных кожный контакт с адгезивными материалами или ожоги) [39-42].
Симптомы заболевания обычно неспецифические и выглядят как бронхопневмония: лихорадка, не отвечающая на антибактериальную терапию, кашель с мокротой, одышка. Пациенты могут также отмечать плевральные боли в грудной клетке (вследствие инвазии в сосуды, приводящие к небольшим инфарктам легкого) и кровохарканье, которое обычно умеренное, хотя в отдельных случаях может быть и массивным. ИАЛ – одна из наиболее частых причин кровохарканья у больных с нейтропенией, которая может быть связана с формированием полостей, возникающих в период восстановления числа нейтрофилов [43]. Грибы Aspergillus могут вызывать трахеобронхиты с выраженной воспалительной реакцией дыхательных путей, с изъязвлением и образованием пленок, чаще всего у больных со СПИДом и у лиц, перенесших пересадки легких [44,45]. Инфекция, вызываемая Aspergillus, может также диссеминировать и распространяться гематогенно в другие органы, наиболее часто в мозг (вызывает припадки, очаговые поражения, церебральные инфаркты, интракраниальные кровоизлияния, менингиты и эпидуральные абсцессы), менее часто в процесс вовлекаются другие органы, такие, как кожа, почки, плевра, сердце, пищевод и печень.
Диагностика.
Диагностика ИАЛ требует существенных усилий. Ранний диагноз ИАЛ у больных с тяжелыми иммунодефицитами труден, поэтому у больных с факторами риска инвазивных заболеваний всегда необходимо помнить о возможности развития таких процессов.
«Золотым стандартом» в диагностике ИАЛ остается гистологический диагноз, полученный при исследовании легочной ткани, полученной после торакоскопии или открытой биопсии [47]. Наличие перегородок в ветвящемся под острым углом мицелии проникающем в легочную ткань с выделением из этого патматериала культуры Aspergillus это и есть достоверная диагностика ИАЛ (рис.3). Гистологическое исследование позволяет исключить другие диагнозы, такие как злокачественные опухоли или негрибковые инфекции. Как было установлено совсем недавно, гистологические исследования при ИАЛ могут различаться в зависимости от предлежащего заболевания. У больных с аллогенной трансплантацией стволовых клеток и болезнью «трансплантат против хозяина» имело место интенсивное воспаление с нейтрофильной инфильтрацией, обширным коагуляционным некрозом, связанным с инвазией мицелия в сосуды и большим количеством грибов. В обеих этих группах одинаково интенсивно происходила диссеминация в другие органы [3].
Значимость выделения Aspergillus spp. из мокроты зависит от иммунного статуса организма. У иммунокомпетентных больных выделение Aspergillus spp. из мокроты почти всегда представляет собой колонизацию и клинически незначимо. В исследовании 66 стационарных больных пожилого возраста с выделением Aspergillus из мокроты, 92% из них имели колонизацию и только у 4,5% выявили ИАЛ [48]. Схожие данные были опубликованы другими авторами [49-51]. Иммунокомпетентным больным с выделением Aspergillus из мокроты антифунгальная терапия обычно не показана, однако для исключения ИАЛ должно быть обязательно проведено соответствующее обследование. С другой стороны, у больных с иммунодефицитами выделение Aspergillus spp. из мокроты является важным прогностическим признаком наличия инвазивного процесса. Исследования показали, что если только в мокроте у пациентов лейкозом или перенесших трансплантацию стволовых клеток выделены грибы Aspergillus, это является прогностическим признаком в 80-90% случаев [50,52,53]. Тем не менее, если культуры в мокроте не получено, это вовсе не исключает ИАЛ, поскольку отрицательный анализ мокроты отмечен у 70% пациентов с подтвержденным ИАЛ [53,54]. Культуральное исследование крови у пациентов с подтвержденным ИАЛ редко дает положительные результаты [55].
Рентгенография грудной клетки на ранних стадиях заболевания мало информативна, так как очень высока частота выявления неспецифических проявлений. Обычно выявляют округлые уплотнения, предлежащие к плевре инфильтраты, напоминающие легочные инфаркты и полости. Плевральный выпот отмечается редко [56,57]. Наиболее полезным методом исследования считается КТ легких, особенно высокого разрешения. Использование КТ высокого разрешения на ранних стадиях ИАЛ обычно ведет к ранней диагностике и улучшает исход заболевания у этих больных [58,59]. Также полезны дальнейшие диагностические мероприятия, такие как бронхоскопия и открытая биопсия легких [60]. Типичная КТ-картина больного с подозрение на ИАЛ включает множественные узлы и симптом венчика (halo sigh), который можно наблюдать главным образом у больных с нейтропенией на раннем этапе течения инфекции (особенно на первой неделе) и представляет собой зону «разжижения» вследствие кровоизлияния вокруг легочного узла (рис.4). Другой более поздний рентгенологический симптом это «симптом мениска» (crescent-sigh), который представлен мениско-подобным просветлением в области узла после некроза [57,61]. В то же время нет никаких особых патогмоничных или сенситивных симптомов для ИАЛ. Симптом венчика можно наблюдать и как результат местастазирования, бронхоальвеолярной карциномы, облитерирующего бронхиолита, пневмонии, эозинофильной пневмонии или других грибковых инфекций [62]. Green и соавторы обнаружили, часто 94% из 235 больных с подтвержденным диагнозом ИАЛ имели по крайней мере одно очаговое поражение [63]. В другом сообщении при трансплантации стволовых клеток у больного с нейтропенией и пневмонией, данные обследования грудной клетки выявили плохо определенные узлы (67%), симптом матового стекла (56%) и участки консолидации (44%) [64]. В ретроспективном исследовании 45 больных ни одни из ранних симптомов при трансплантации стволовых клеток (узлы, консолидация, перибронхиальная инфильтрация) не явились прогностическими для определения исхода заболевания или развития легочного кровотечения [65]. Тем не менее, легочное кровотечение позволяет предполагать формирование большого узла с его деструкцией или консолидацией рядом с крупными легочными сосудами.
Бронхоскопия с проведением бронхоальвеолярного лаважа (БАЛ) в большинстве случаев полезна в диагностике ИАЛ, особенно у больных с диффузными поражениями легких. Чувствительность и специфичность положительных результатов исследования промывной жидкости бронхов составляет примерно 50% и 97% соответственно. Впрочем, эти данные довольно ненадежны, поскольку имеются много данных и о значительно меньшей пользе от этих исследований [50,52,66-70]. Исследование БАЛ, тем не менее, является безопасным и полезным методом диагностики у пациентов группы высокого риска с подозрением на ИАЛ. В добавок, получение материала позволяет провести культуральное микологическое исследование, а также может быть полезным в определении антигена Aspergillus в БАЛ и исключить другие инфекции. Трахеобронхиальная биопсия в диагностике ИАЛ обычно не помогает и связана с увеличением риска кровотечения, поэтому ее производят редко [52].
В постановке диагноза ИАЛ важно получить на исследование мокроту, БАЛ или ткань легкого, как для культурального, так и гистологического исследования, потому что другие грибы, такие как зигомицеты, сцедоспориум, псевдоаллешерия и фузариум могут иметь схожие с аспергиллезом гистологические проявления [71]. Кроме того, причиной ИАЛ могут быть различные виды Aspergillus. Хотя A. fumigatus и является наиболее частым возбудителем при ИАЛ, отмечен рост числа сообщений о случаях ИАЛ у онкологических больных, которые были вызваны другими видами, такими как A. niger, A. terreus и A. flavus [72-76]. Некоторые из этих видов (такие как A. terreus и A. nidulans) резистентны к амфотерицину В [73,76].
В обзоре 300 случаев вероятного ИАЛ A. terreus был вторым по частоте видом, выделенным с частотой 23%. Факторы риска и прогноз заболевания, вызванного A. terreus схожи с теми, которые вызваны A. fumigatus, но источник инфицирования чаще нозокомиальный и тут более вероятна резистентность к амфотерицину В [75].Новые антифунгальные триазолы, такие как вориконазол и позаконазол имеют значительно большую эффективность против A. terreus [73,74,77].
Последние успехи в диагностике ИАЛ связывают с определением антигена Aspergillus в биологических жидкостях. Галактоманнан является полисахаридным компонентом клеточной стенки, который высвобождается во время роста Aspergillus. Иммуноферментный анализ для определения галактоманнана по принципу «двойного бутерброда» был недавно одобрен FDA для диагностики ИАЛ в концентрации 0,5 нг/мл. Сывороточный галактоманнан можно обнаружить за несколько дней до начала клинических проявлений, появления изменений на рентгенограмме и выделения культур гриба. Это позволяет значительно раньше подтвердить диагноз и определение сывороточного галактоманнана может быть полезным в оценке эволюции инфекции в период лечения [78,79].
Pfeiffer и соавт. провели мета-анализ исследований с оценкой эффективности теста на галактоманнан для диагностики ИАЛ. Были включены двадцать семь исследований за период с 1996 по 2005 годы и диагноз ИАЛ устанавливали согласно критериям Группы по изучению микозов Европейской организации по исследованию и лечению рака. В целом была определена чувствительность 71% и специфичность 89% для доказанных случаев инвазивного аспергиллеза. Отрицательный прогностический уровень составил 92-98% и положительный предсказательный уровень 25-62% [80]. Pfeiffer и соавторы сделали вывод, что тест на галактоманнан более полезен для диагностики у пациентов, которые имеют злокачественные заболевания крови и лиц, у перенесших аллогенную трансплантацию стволовых клеток, чем у реципиентов солидных органов или у больных без нейтропении.
Галактоманнан обнаруживают в пище, и он может всасываться в пищеварительном тракте, особенно у пациентов с мукозитом после химиотерапии, что может давать ложноположительные реакции. Также некоторые медикаменты, такие как бета-лактамные антибиотики (например, пиперациллин/тазобактам) могут быть связанными с ложно-положительными тестами, в то время как антифунгальные препараты, активные против Aspergillus, напротив, могут вести к ложно-отрицательным результатам [81-84].
Одним из существенных ограничений теста на галактоманнан является его видовая неспецифичность. В конечном итоге невозможно исключить наличие других плесневых грибов, таких как Fusarium, Zygomycetes и феоидными грибы [85]. Таким оборазом, определение галактоманнана не устраняет необходимость проведения тщательного микробиологического и клинического обследования.
Очевидно, что галактоманнан, определяется и в других жидкостях тела, таких как БАЛ, моча и цереброспинальная жидкость, и эти тесты могут стать положительными до клинических и рентгенологических предположений на ИАЛ [85-88]. Однако, для изучения и сравнения проведения определения антигена Aspergillus в образцах других, нежели сыворотка, необходимы проспективные исследования. В ретроспективном исследовании совместный галактоманнановый тест и ПЦР в стандартной бронхоальвеолярнолаважной жидкости позволил повысить значимость бронхоскопической идентификации Aspergillus spp. как причины легочного заболевания у реципиентов стволовых клеток [86].
Полимеразная цепная реакция (ПЦР) – другой путь диагностики ИАЛ, при котором определяют ДНК Aspergillus в бронхоальвеолярной жидкости и в сыворотке крови. Положительный тест на ДНК Aspergillus предполагает чувствительность 67-100% и специфичность 55-95% для ИАЛ [89]. Специфичность и чувствительность ПЦР была также доложена как 100% и 65-92% соответственно в образцах сыворотки крови [89-92]. Тем не менее этот тест часто связывают с ложно-положительными результатами, поскольку он не дает различия между колонизацией и инфекцией. Определение ПЦР для нуклеиновой кислоты Aspergillus ограничено специализированными лабораториями и не может рассматриваться как рутинное исследования.
Определение сывороточного 1,3-бета-D-глюкана, компонента грибковой стенки, недавно получило одобрение FDA и является высоко чувствительным и специфичным тестом для глубоких инвазивных микозов, включая кандидоз, фузариоз и аспергиллез и может быть с пользой применен у больных с иммунодефицитами [93]. Тем не менее, использование этого теста у пациентов без нейтропении и у реципиентов аллогенных стволовых клеток, входящих в группы высокого риска ИАЛ, пока не ясна.
Роль определения галактоманнана и других серологических тестов в диагностике ИАЛ продолжает изучаться. Кроме того, их ценность у различных лиц в качестве контрольных тестов и значимость для определения прогноза у больных инвазивными микозами пока остается неясной. Проводимые проспективные исследования пытаются определиться с этими вопросами, однако до тех пор, пока достоверные данные не будут доступны, эти тесты должны рассматриваться как дополнительные диагностические исследования и не должны заменять клинические и рентгенологические (в отдельных случаях и инвазивные) процедуры для подтверждения диагноза ИАЛ.
Группа по изучению микозов Европейской организации по исследованию и лечению рака предложила несколько критериев для диагностики инвазивных грибковых инфекций [94]. Эти критерии включают факторы самого организма, микробиологические факторы и малые и большие клинические критерии (таблица 2). Два последовательных положительных теста на галактоманнан в сыворотке при соответствующей клинике могут рассматриваться как «вероятный» ИАЛ [94]. Тем не менее, критерии Группы по изучению микозов Европейской организации по исследованию и лечению рака не основаны на принципах доказательности и также могут быть не подтверждены в будущем. Их следует применять как руководство для клинических и эпидемиологических исследований и они не обязательно должны быть использованы у каждого больного.
Таблица 2. Диагностические критерии для ИАЛ.
|
Диагноз |
Критерии |
|
Доказанный ИАЛ |
Гистологическое и цитологическое исследование легочной ткани, полученное при пункционной биопсии аспирационной иглой с определением мицелия или получение биоптата с очевидным ассоциированным тканевым поражением; ИЛИ высев культуры Aspergillus из образца полученного в ходе стерильной процедуры из легких или другого места клинически и рентгенологически соответствующего инфекции. |
|
Вероятный ИАЛ |
Наличие факторов риска (таблица 1); ПЛЮС микробиологические критерии (положительная микроскопия на Aspergillus или получение культуры гриба при исследовании мокроты или бронхоальвеолярной жидкости, или положительный тест на галактоманнан); ПЛЮС клинические критерии, соответствующие инфекции (один большой или два малых критерия*). |
|
Возможный ИАЛ |
Наличие факторов риска (см. таблицу 1) ПЛЮС микробиологические критерии (положительная микроскопия мокроты на Aspergillus или выделение культуры из мокроты или бронхоальвеолярной жидкости или положительный тест на галактоманнан); ИЛИ клинические критерии соответствующие инфекции (один большой или два малых *). |
* Большой клинический критерий: новые характерные инфильтраты на КТ (симптом венчика, мениска или полость внутри участка консолидации). Малые критерии: симптомы инфекции нижних дыхательных путей (кашель, боли в грудной клетке, кровохарканье или одышка); физикальные проявления шума трения плевры; какие-либо новые инфильтраты, не соответствующие большим критериям; плевральный выпот.
Лечение.
Лечение ИАЛ является трудной задачей и смертность при этом заболевании остается очень высокой, несмотря не внедрение в практику нескольких новых антифунгальных препаратов. Лечение должно начинаться сразу же как только возникает клинические подозрение на наличие ИАЛ и все время пока разрабатывается последующая тактика. Многие годы препаратом первой линии для лечения ИАЛ был амфотерицин В в рекомендуемых дозах 1-1,5 мг/кг/день. Тем не менее амфотерицин В имеет серьезные побочные эффекты, включая нефротоксичность, электролитные нарушения и гиперчувствительность. В связи с этим для снижения этих побочных эффектов в практику были введены новые липид-ассоциированные формы амфотерицина В (например, липомомальный амфотерицин В и липидный комплекс амфотерицина В). Для антифунгальной эквивалетности со старой формой препарата требуется назначение более высоких дозы липидассоциированных.
Вориконазол - новый триазол широкого спектра действия был одобрен для первоначальной терапии инвазивного аспергиллеза и в настоящее время рассматривается как препарат выбора для многих больных с ИАЛ [95-97]. В больших проспективных рандомизированных многоцентровых исследованиях вориконазол сравнили с амфотерицином В в качестве первоначальной терапии ИАЛ [98]. Пациенты, получавшие вориконазол, имели значительно лучший ответ в течение 12 недель лечения (53% против 32%, получавших амфотерицин В) и более высокую 12-недельную выживаемость (71% против 58%). Вориконазол доступен в форме как для внутривенного так и перорального приема. Рекомендуемые дозы составляют 6мг/кг два раза в день внутривенно в первый день, затем доза составляет 4мг/кг/день. После семи дней терапии рассматривается возможность перейти на пероральный прием 200 мг 2 раза в день. Вориконазол имеет меньше побочных эффектов и переносится значительно лучше, чем амфотерицин В. Наиболее частые побочные эффекты нарушение зрения, описанные как туманное зрение, светобоязнь и нарушение цветового восприятия. Реже встречаются нарушение тестов функции печени и кожные реакции. Вориконазол, тем не менее, связан с большим числом лекарственных взаимодействий, в частности с такими препаратами, как циклоспорин, варфарин, терфенадин, карбамазепин, хинидин, рифампин, статины и сульфанилуреаза [95].
Позаконазол - другой триазол широкого спектра действия, который эффективен и безопасен как препарат второй линии у больных с инвазивным аспергиллезом, рефрактерным к стандартной антифунгальной терапии [21,77,79].
Дериваты эфинокандинов, такие как каспофунгин, микафунгин и анидулафунгин являются эффективными средствами для лечения ИАЛ рефрактерного к стандартному лечению или у пациентов, которые не переносят препараты первой линии [100,101]. В отличие от полиенов и азолов, мишенью которых является клеточная мембрана, эхинокандины ингибируют 1,3–бета-D-глюкан – одни из компонентов стенки грибной клетки, поэтому комбинация этих препаратов оправдана для лечения рефрактерного ИАЛ [102,103]. В настоящее время не имеется проспективных рандомизированных исследований, которые бы показывали улучшение эффективности при использовании комбинированного лечения (то есть действие лучше, чем один препарат) в первичной терапии ИАЛ. Тем не менее имеются исследования in vitro и ограниченные клинические данные (отдельные наблюдения и ретроспективные серии случаев), которые позволяют предположить улучшение от назначения комбинации антифунгальных препаратов в качестве «терапии спасения» (второй линии) при рефрактерном течении ИАЛ [103-106]. Комбинация каспофунгина и липосомального амфотерицина В как средство «терапии спасения» показала хороший ответ на лечение в 42% случаев, хотя пациенты с доказанным прогрессирующим ИАЛ ответили на лечении только в 18% [103]. Улучшение выживаемости при комбинации вориконазол плюс каспофунгин по сравнению с только вориконазолом была представлена в одном ретроспективном исследовании «терапии спасения» (второй линии) при ИАЛ [105]. С другой стороны, другие сообщения не показали разницы в ответе меду больными, получавшими только микафунгин или теми, которые получали его в комбинации с другими антифунгальными препаратами при первичном лечении и при «терапии спасения» (второй линии) при остром ИАЛ [107]. Комбинация эхинокандина с либо липидассоциированным амфотерицином В или триазолом довольно многообещающа, но не может быть рекомендована в качестве обычного лечения первичного ИАЛ. Для определения значимости этих подходов необходимы контролируемые рандомизированые проспективные исследования. Так как галактоманнан ковалентно связан с 1,3-бета-D-глюканом в клеточной стенке, начальное повышение циркулирующего галактоманнана можно ожидать и у пациентов, которых лечат эхинокандинами [108]. Хирургическая резекция имеет ограниченное значение в лечении пациентов с ИАЛ, но может быть рассмотрена в случаях массивных кровохарканий или легочных поражений, примыкающих к крупным сосудам или перикарду, или для удаления остаточных локализованных легочных очагов у пациентов с продолжающейся иммуносупрессией или у тех, которых ожидают иммуносупрессивная терапия в будущем. Несколько докладов показали относительную эффективность и безопасность оперативных вмешательств (в добавок к антифунгальной терапии) в подобных ситуациях [59,109-114].
Иммуномодулирующая терапия, такая как использование колоние-стимулирующего фактора (например, гранулоцито-стимулирующего фактора, гранулоцито- макрофаго- колониестимулирующей терапии) или интерферона-гамма может быть использована для снижения степени иммуносупрессии и как приложение к антифунгальной терапии для лечения ИАЛ. Колоние-стимулирующий фактор стимулирует костный мозг для продукции большего количества нейтрофилов, и было показано усиление фагоцитарной активности нейтрофилов против грибов, включая Aspergillus spp. [115-117]. Имеется теоретическая польза от добавления этих агентов к лечению больных с нейтропенией с подозрением на ИАЛ.
В одном рандомизированном исследовании пациентов, получающих химиотерапию про поводу острого миелогенного лейкоза, назначение с целью профилактики гранулоцито- макрофаго- колониестимулирующего фактора привело к снижению частоты фатальной грибковой инфекции по сравнению с плацебо (1,9 против 19% соответственно) и снижению общей смертности [118]. Возможность назначения колоние-стимулирующих факторов рекомендуется рассматривать у больных с нейтропенией при серьезных инфекциях, однако окончательных исследований, которые бы доказывали улучшение у больных конкретно с ИАЛ, пока нет [119].
Интерферон-гамма другой цитокин, который, как показано in vitro и на экспериментальных моделях, усиливает иммунный ответ за счет увеличения активности нейтрофилов и моноцитов против Aspergillus [116,120,121] и может снижать риск аспергиллезной инфекции у больных хронической гранулематозной болезнью [122]. Однако очевидность значимости добавления интерферона-гамма в качестве дополнительной терапии ИАЛ ограничена лишь отдельными сообщениями и малым их количеством и практических руководств по их значению в лечении ИАЛ пока нет [123]. Имеются определенные опасения по поводу возможности применения интерферона-гамма у реципиентов аллогенных трансплантатов стволовых клеток, так как это может ухудшать течение болезни «трансплантат против хозяина», тем не менее, недавние испытания показали что в течение этой терапии болезнь «трансплантат против хозяина» улучшилась [124].
Трансфузии гранулоцитов - другая потенциальная поддерживающая терапия больным с пролонгированной нейтропенией и жизненно-опасными инфекциями, рефрактерными к обычной терапии. Показано, что она безопасна для потенциальных доноров, сдающих нейтрофилы через гранулоцитофорез, однако нет рандомизированных исследований, которые доказывают улучшение от дополнительной гранулоцитарной трансфузии в лечении ИАЛ [125]. Также важно у пациентов с ИАЛ, когда это возможно, снизить дозу системных кортикостероидов и иммуносупрессивных агентов.
Лечение ИАЛ является трудной задачей и важным подходом к этой проблеме является его профилактика у пациентов с повышенным риском. Следует исключить госпитализацию пациентов в помещения, где ведутся ремонтные работы, надо использовать высоко-эффективные очистители воздуха с или без ламинарной вентиляции, поскольку доказано, что обе системы полезны [126]. Мета-анализ показал, что для предупреждения грибковых инфекций у больных с нейтропенией был эффективен итраконазол [127]. Предварительные данные также позволяют предполагать эффективность позаконазола для профилактики ИАЛ у больных с острым миелогенным лейкозом или миелодиспластическим синдромом [128]. В настоящее время в процессе разработки находятся исследования по профилактике ИАЛ у пациентов высокого риска другими противогрибковыми агентами, такими как вориконазол, каспофунгин и микафунгин.
Хронический некротический аспергиллез.
Хронический некротический аспергиллез, также еще называемый полуинвазивный или подострый инвазивный аспергиллез впервые был описан Gefter и соавт. и Binder и соавт. в 1981 году [129, 130]. Это вялотекущий, с образованием полостей в легочной паренхиме инфекционный процесс вторичный к локальной инвазии грибами рода Aspergillus, обычно A. fumigatus [131]. В отличие от ИАЛ, ХНА имеет медленно прогрессирующее течение от недель до месяцев и сосудистая инвазия или диссеминация в другие органы для него нетипична. Этот синдром встречается редко, и доступные данные основываются на описаниях отдельных случаев или небольших сериях наблюдений [129-131].
Факторы риска.
ХНА обычно встречается в среднем или пожилом возрасте с поврежденной местной защитой, связанной с предлежащими хроническими заболеваниями легких, такими как ХОБЛ, ранее перенесенный туберкулез легких, последствия оперативных вмешательств, лучевая терапия, пневмокониозы, муковисцидоз, инфаркты легкого и (менее часто) саркоидоз [132]. Он может также встречаться у пациентов с умеренными иммунодефицитами вследствие сахарного диабета, алкоголизма, хронических заболеваний печени, низкодозной терапии кортикостероидами, недоеданием и заболеваниями соединительной ткани, такими как ревматоидный артрит и анкилозирующий спондилит [130].
Бывает довольно трудно отличить ХНА от аспергиллемы, особенно если недоступны предыдущие рентгенограммы [133]. Тем не менее, при ХНА имеется локальная инвазия легочной ткани и наличие предшествующей полости вовсе не обязательно, хотя полость с грибковым комком может развиваться в легких как вторичный феномен вследствие деструкции грибами легочной ткани. В недавнем сообщении об аспергиллемах при СПИДе отмечено прогрессирование их со временем с существенной морбидностью и некоторой летальностью [133]. Это возможно отражает возможность того, что аспергиллема может инвазировать в стенку полости, вызывая локальную паренхимальную деструкцию, которую и наблюдают у пациентов с ХНА [131].
Клинические проявления и диагностика.
Пациенты часто жалуются на конституциональные симптомы, такие как лихорадка, потеря веса длительность 1-6 месяцев, недомогание, утомляемость в добавок хронический продуктивный кашель и кровохарканье, которые варьируют от легкой до сильной степени [133]. Изредка пациенты могут быть вообще не иметь никаких симптомов.
Рентгенография грудной клетки и КТ обычно показывает уплотнение, утолщение плевры и полостные поражения в верхних долях легких. Аспергиллему можно наблюдать примерно у 50% больных ХНА [130]. Смежное плевральное утолщение, которое может прогрессировать в бронхо-плевральную фистулу, считают ранним указанием на локальный инвазивный процесс [129,134]. Характерно для этих изменений, что они имеют тенденцию прогрессировать от недель до месяцев [134]. Абсолютное большинство пациентов с ХНА имеют положительные IgG антитела к A. fumigatus в сыворотке, которые меняются в течение времени и могут быть отрицательными в некоторые периоды течения заболевания [133]. Немедленная кожная реактивность на антиген Aspergillus может быть полезным, но не диагностическим тестом. В мокрота и бронхоскопическом материале можно выделить грибы Aspergillus [133].
Чтобы подтверждить диагноз необходима гистологическая демонстрация тканевой инвазии грибами и определение роста грибов Aspergillus в культуре. Гистологически ХНА характеризуется некрозом легочной ткани, острым и хроническим воспалением стенки полости и наличием мицелиального содержимого с Aspergillus spp. [135]. Тем не менее, диагностическая ценность бронхиальной биопсии или чрезкожной аспирационной биопсии относительно низкая, поэтому торакоскопии или открытая биопсия легких у таких больных проводятся редко. Подтверждение диагноза остается делом трудным и часто происходит задержка диагноза, которая может усиливать морбидность и летальность, связанную с ХНА. Поэтому для раннего диагноза необходим высокий индекс подозрения. Комбинация характерных клинических и рентгенологических проявлений или же серологические результаты, положительные на Aspergillus или выделение Aspergillus из дыхательных путей, с высокой вероятностью указывает на ХНА [136]. Denning и соавт. предложили критерии для диагноза ХНА, которые могут быть полезными в ранней диагностике и лечении ХНА и могут улучшить прогноз для больных с этим заболеванием [136] (таблица 3).
Таблица 3. Диагностические критерии ХНА
|
Диагностические критерии |
Характеристика |
|
Клинические |
Хроническое (более 1 месяца) легочные или системные симптомы, включая, по крайней мере одни из следующих: потеря веса, продуктивный кашель, кровохарканье. |
|
Рентгенологические |
Полостные легочные поражения с наличие паракавитарных инфильтратов. Образование новых полостей и увеличение размера полостей со временем. |
|
Лабораторные |
Повышенный уровень маркеров воспаления (С-реактивный белок, вязкость плазмы или СОЭ). Выделение Aspergillus spp. из легочной или плевральной полости или положительная реакция преципитация на Aspergillus. Исключение других легочных патогенов с проведением соответствующих культуральных и серологических тестов, которые связаны с проявлениями таких заболеваний, включая микобактерии и эндемические грибы. |
Лечение.
Антифунгальная терапия является основой лечения больных с ХНА. Амфотерицин В применялся изначально в дозе 0,5-1 мг/кг/день (4-5 мг/кг/день для липидассоциированных форм) с благоприятными результатами [130,131]. Итраконазол появился позднее как эффективная альтернатива относительно токсичному амфотерицину В [131,137] и совсем недавно вориконазол вошел как первичная терапия ХНА. В недавнем проспективном исследовании, где вориконазол 200 мг давали два раза в день в период от 4 до 24-х недель как первичную или терапию второй линии 39 больным с ХНА [96], полный или частичный ответ наблюдали у 43% пациентов и улучшение или стабилизацию у 80%. Авторы делают заключение, что вориконазол являлся безопасным и эффективным лечением и может быть использован для первичной терапии или в качестве препарата второй линии для лечения пациентов с ХНА.
Лечение лучше оценивать последующими клиническими, рентгенологическими, серологическими и микробиологическими параметрами [133]. Полезные параметры ответа включают прибавку веса и повышение тонуса, улучшения легочных симптомов, снижении маркеров воспаления и общего уровня IgE, улучшения в паракавитарных инфильтратах и в итоге уменьшение размера полости [133].
Хирургическая резекция играет незначительную роль в лечении ХНА и остается в качестве запасного варианта для в целом здоровых молодых пациентов с локальным заболеванием и хорошими легочными резервами, для пациентов, не переносящих антифунгальную терапию и для пациентов с остаточным локализованным, но активным процессом, несмотря на антифунгальную терапию. Binder и соавт. сообщили, что 90% пациентов, которые перенесли хирургическую резекцию, имели хороший ответ, однако оперативное лечение было связано со значительными послеоперационными осложнениями [130].
Сообщения о смертности от ХНА широко варьируют и может быть был ограничена неполным наблюдением в динамике [133]. Смертность была 39% у американских авторов, но менее 10% у европейских, которые использовали в лечении итраконазол [131].
Аспергиллема.
Аспергиллема – самая частая и лучше всего распознаваемая форма легочных поражений, вызванных грибами Aspergillus. Аспергиллема легких обычно развивается в предшествующей полости в легком. Аспергиллема (грибной комок) состоит из мицелия гриба, воспалительных клеток, фибрина, слизи и тканевого дебриса. Наиболее частые виды грибов Aspergillus, выделенные из таких поражений это A. fumigatus; тем не менее и другие грибы могут вызвать формирование грибных комков, такие как Zygomycetes и Fusarium. Аспергиллемами осложняются многие полостные легочные поражения, включая туберкулез, саркоидоз, бронхоэктазы, бронхиальные кисты и буллы, анкилозирующицй спондилит, новообразования и легочные инфекции [138,139]; из которых туберкулез является наиболее часто ассоциированным состоянием [140]. В исследовании 544 пациентов с легочными полостями, вторичными к туберкулезу, 11% имели рентгенологически очевидные аспергиллемы [141]. Менее часто аспергиллема была описана в полостях, обусловленных другими грибковыми инфекциями [142, 143].
Предположительно росту Aspergillus на стенке полости способствует неадекватный дренаж. Грибные комки могут перемещаться в пределах полости, но обычно не инвазируют в окружающую легочную паренхиму и кровеносные сосуды, хотя описаны и исключения [144,145]. В большинстве случаев поражение остается стабильным, но в 10% случаев аспергиллема может уменьшаться в размерах или спонтанно разрешаться без лечения [146]. Аспергиллема редко увеличивается в размерах.
Клинические проявления.
Большинство больных с аспергиллемой асимптоматичны. Когда симптомы присутствуют, то большинство больных отмечают умеренное кровохарканье, хотя могут случаться и тяжелые и жизненно опасные кровохарканья, особенно при предлежащем туберкулезе [147]. Кровотечения обычно осуществляются из бронхиальных сосудов и могут быть следствием локальной инвазии в кровеносные сосуды, устилающие стенки полости, эндотоксины, выделяющиеся из грибов или механического раздражения незащищенной сосудистой сети внутри полости перемещающимся грибковым комком [144,148,149].
Смертность от кровохарканья, вызванного наличием аспергиллемы, составляет от 2 до 14% [150-154].
Реже у пациентов может развиваться кашель, одышка, которая вероятно связана в большей степени с предлежащими легочными заболеваниями, лихорадка, которая может быть вторичной к имеющемуся предлежащему легочному заболевания или бактериальной суперинфекцией в полости.
Имеются некоторые факторы риска, которые определяют плохой прогноз аспергиллемы. Они включают тяжесть предлежащего заболевания, нарастание размеров или количества поражений как это видно на рентгенограмме легких, иммуносупрессию (включая кортикостероиды), нарастание специфических к Aspergillus титров IgG антител, рецидивирующие кровохарканья большого объема, наличие предлежащего саркоидоза и ВИЧ-инфекцию [155].
Диагностика.
Диагностика легочного аспергиллеза основывается на клинических и рентгенологических проявлениями в комбинации с серологическими и микробиологическими свидетельствами наличия Aspergillus spp. Рентгенограмма легких полезна в определении масс в предлежащей полости. Аспергиллема предполагается при локализации в верхней доле, подвижная, определяется полость с содержимым и с воздушным мениском на периферии [156]. Изменение позиции грибного комка после положения больного на спину или при наклоне интересный, но очень вариабельный симптом [157]. Для визуализации аспергиллемы может быть необходима КТ грудной клетки, которую не видно на обычной рентгенограмме [157]. Схожие рентгенологические проявления можно наблюдать при других разнообразных состояниях, таких как гематома, опухоли, абсцесс, эхинококкоз и гранулематоз Вегенера, причем аспергиллема может сосуществовать с вышеупомянутыми состояниями [158,159]. Выделить культуру Aspergillus из мокроты получается только в 50% случаев [160]. Сывороточные IgG антитела к Aspergillus положительны почти всегда, но могут быть отрицательными у пациентов, получающих лечение кортикостероидами [145]. Хотя аспергиллезный антиген и обнаруживали в бронхоальвеолярном лаваже у пациентов с аспергиллемой, однако диагностическая ценность этого исследования вариабельна [161,162].
Лечение.
Какой-либо консенсус по лечению аспергиллемы отсутствует. Лечение рассматривается только тогда, когда пациенты имеют симптомы, особенно кровохарканье. Ингаляционные, внутриполостные и интрабронхиальные инстилляции антифунгальных агентов были использованы и описаны в малом количестве больных и без стойкого эффекта [153,163,164].
При аспергиллеме особенно у пациентов с массивным кровохарканьем может быть эффективным введение амфотерицина В чрезкожно под контролем КТ, что дает прекращение кровохарканья в течение нескольких дней [165,166]. Значение внутривенного введения амфотерицина В не определено, однако в небольшом количестве исследований эта методика не дало никакого улучшения [167].
В лечении использовали и пероральный итраконазол с рентгенологическими и симптоматическим улучшением от половины до двух третей пациентов и иногда отмечали полный эффект [168-170]. Итраконазол - полезный препарат для лечения аспергиллемы, поскольку обладает высоким проникновением в ткани. В недавнем исследовании значительный уровень итраконазола в аспергиллеме был показан после применения стандартной дозы итраконазола (100-200 мг/день) [171]. Основным ограничением в применении итраконазола является то, что он работает медленно и бесполезен в случаях жизненно-опасных кровохарканий [161].
Хирургическая резекция полости и удаление грибного комка обычно показано у больных с повторными кровохарканьями, если легочная функция достаточна для проведения операции. Хирургическое лечение связано с относительно высокой смертностью на уровне от 7 до 23% [149-151,172-175]. Наиболее частые причины смерти в послеоперационном периоде это тяжелые предлежащие заболевания, пневмония, острый инфаркт миокарда и ИАЛ [153, 175]. Другие послеоперационные осложнения, включают кровотечения, остаточные плевральные полости, бронхоальвеолярные фистулы, эмпиему и респираторные нарушения.
Бронхиальная артериальная эмболизация должна быть рассмотрена лишь как временная мера у больных с жизненно-опасными кровохарканьями, так как кровохарканье из-за наличия массивных коллатеральных кровеносных сосудов обычно рецидивирует [176]. Роль новейших антифунгальных азолов, таких как вориконазол в лечении аспергиллемы все еще определяется.
Аллергический бронхолегочный аспергиллез (АБЛА).
АБЛА – заболевание легких, формирующее в результате гиперчувствительности к антигену Aspergillus, преимущественно к A. fumigatus. Большинство случаев АБЛА отмечено у больных с астмой и муковисцидозом. Предполагается, что АБЛА развивается у 7-14% пациентов гормонозависимой астмы и в 6% случаев муковисцидоза [177,178]. Патогенез АБЛА понятен не до конца: Aspergillus-специфический IgE-опосредованный тип I гиперчувствительных реакций, специфический IgG-опосредованный тип III гиперчувствительных реакций и патологический Т-клеточный иммунный ответ – все это является играет важную роль в его патогенезе [179-182]. В одном исследовании было получено 18 образцов патологического материала от больных с диагнозом АБЛА и в большинстве случаев выявлено поражение бронхов и бронхиол с бронхоцентрическими гранулемами у 15 и мукоидной закупоркой у 11 [183]. Другие проявления включали гранулематозное воспаление состоящие из окружающих гистиоцитов окруженных лимфоцитами, плазматические клетки и эозинофилы. Мицелий гриба тоже обнаруживали, но без признаков инвазии в ткани [183].
Клинические проявления и диагностика.
АБЛА обычно предполагают по клиническим проявлениями, а подтверждают диагноз рентгенологическими и серологическими исследованиями. Почти все больные имеют клинику астмы, также для таких больных обычны периодические хрипы и кашель с мокротой, содержащей коричневые пробки, плевральные боли и лихорадка [184]. Рентгенограмма грудной клетки на ранней стадии заболевания может быть нормальная. В течение обострения характерны летучие легочные инфильтраты, которые имеют тенденцию к верхним долям и центру. Определяются транзиторные участки типа «матового стекла», которые могут быть вызваны мукоидной закупоркой воздухопроводящих путей и напоминают полосы, идущие от ворот легких с округлыми дистальными краями (перчаточные пальцы) [185]. Симптом кольца и «трамвайные рельсы» являются рентгенологическими симптомами, которые показывают утолщение и воспаление бронхов, и которые можно наблюдать на рентгенограммах грудной клетки. В поздних стадиях могут развиваться центральные бронхоэктазы и легочный фиброз. КТ грудной клетки с высоким разрешением помогает лучше определить бронхоэктазы и более чувствительно в обнаружении вышеописанных изменений (рис. 5). Обычно отмечается подъем общего IgE и в мокроте определяют Aspergillus spp. Уровень IgE в сыворотке может быть использован как маркер обострения и ответа на терапию [186]. Получение высева грибов из мокроты не обязательно для диагностики АБЛА. Обычно отмечается Немедленная кожная реактивность к антигену A. fumigatus и повышенный уровень сывороточного IgG и IgE антител к Aspergillus [179]. Биопсия легких проводится редко, так как диагноз АБЛА обычно предполагают по клиническим проявлениям. Greenberger и Patterson предложили стандартные критерии диагноза АБЛА (таблица 4) [184,186], но не все из них необходимы, чтобы установить диагноз.
Таблица 4. Диагностические критерии АБЛА
|
Астма |
|
Немедленные кожные реакции к Aspergillus. |
|
Преципитины в сыворотке к A.fumigatus |
|
Повышенный уровень сывороточного IgE и IgG к A. fumigatus |
|
Уровень общего IgE более 1000 нг/мл |
|
Наличие в настоящее время или ранее инфильтратов в легких. |
|
Центальные бронхоэктазы. |
|
Периферическая эозинофилия крови (1000 кл/мкл). |
Ранняя диагностика и лечение АБЛА до развития всех клинических симптомов и бронхоэктазов очень важна, поскольку затяжка с лечением может привести к необратимым легочным повреждениям. Поэтому больных с АБЛА можно подразделить на две группы: пациенты с центральными бронхоэктазами или без них (АБЛА-ЦБ и АБЛА-серопозитивные, соответственно) [1]. Минимальные основные критерии для диагностики пациентов с АБЛА с центральными бронхоэктазами включают астму, немедленную кожную реакцию на антиген Aspergillus, уровень общего IgE сыворотке крови более 1000 нг/мл и наличие центральных бронхоэктазов. С другой стороны минимальные критерии для АБЛА-серопозитивных пациентов включают астму, немедленную кожную реактивность на антиген Aspergillus, высокий уровень сывороточного IgE более 1000 нг/мл, историю легочных инфильтратов и повышенный уровень сывороточного IgE и IgG антител к A. fumigatus [187].
Patterson и соавт. выделили в клиническом течении АБЛА пять стадий, что помогает в ведении этого заболевания [188]. Эти стадии не идут по порядку. Четыре первых потенциально обратимы и в перспективе не имеют длительных последствий. Стадия I (острая стадия) начинается в острые проявления в виде астмы, подъема уровня IgE, периферической эозинофилии, легочных инфильтратов и IgE и IgG антител к A. fumigatus. На практике пациенты редко идентифицируются в этой стадии. На II стадии (стадия ремиссии) IgE падает, но обычно остается повышенным, эозинофилия отсутствует, и рентгенограмма грудной клетки без инфильтратов. Сывороточные антитела к антигену Aspergillus могут быть слегка повышены. Стадия III (стадия обострения) возвращение некоторых проявлений, как в стадии I у больных с установленным диагнозом АБЛА. Уровень IgE повышается по меньше мере вдвое по отношению к основному уровню. Стадия IV (стероидозависимая стадия) случается у пациентов с астмой, у которых контроль симптомов зависит от постоянного применения высоких доз кортикостероидов и обострения характеризуются усилением симптомов астмы, рентгенологическими изменениями и увеличением уровня IgE. Часто на КТ грудной клетки обнаруживают центральные бронхоэктазы. К несчастью большинство больных диагностируется именно в этой стадии [189]. На V стадии (стадия фиброза) развиваются бронхоэктазы и фиброз, которые обычно ведут к необратимым легочным изменениям. Пациенты в этой стадии могут иметь одышку, цианоз, хрипы и легочное сердце. Могут отмечаться и «барабанные палочки». Уровень IgE и эозинофилов может быть и низким и высоким. К счастью, лишь небольшое число пациентов переходит в эту стадию.
Лечение.
Целью терапии АБЛА является купирование обострений заболевания и торможение прогрессирования фиброза и развития бронхоэктазов. Пероральное лечение кортикостероидами направленное на подавление гиперчувствительности является основным подходом в лечении АБЛА. Кортикостероиды скорее подавляются воспалительный ответ, вызванный A. fumigatus, чем способствуют эрадикации этого микроорганизма из легких. Лечение кортикостероидами приводит к снятию бронхоспазма, разрешению рентгенологических инфильтратов, снижению общего уровня IgE в сыворотке крови и периферической эозинофилии [190,191]. При появлении новых инфильтратов при АБЛА рекомендуется две недели ежедневной терапии преднизолоном (0,5мг/кг/день) с последующим постепенным снижением [192,193]. Длительность терапии определяется индивидуально в зависимости от клинического состояния пациента. Тем не менее, большинство больных нуждается в длительной низкодозной кортикостероидной терапии для контроля симптомов и снижения частоты обострений [192,193]. Уровень общего IgE в сыворотке может быть использован как маркер активности АБЛА и его следует измерять через 6-8 недель после начала терапии, и затем каждые 8 недель в течение первого года после чего определить базисный уровень, индивидуальный для каждого больного [194]. Ингаляционные кортикостероиды могут помочь контролировать симптомы астмы, однако небольшое количество исследований не выявило эффективности ингаляционных кортикостероидов в предупреждении прогрессирования легочных повреждений у больных с АБЛА [195,196].
Несколько исследований показали пользу от итраконазола в ведении пациентов с АБЛА. Итраконазол был эффективен в улучшении симптомов, облегчает отмену кортикостероидов, снижает титры Aspergillus, улучшает рентгенологические изменения и легочную функцию [161]. Рандомизированное, двойное слепое, плацебо-контролируемое исследование итраконазола 200 мг дважды в день в течение 16 недель для больных с АБЛА, постоянно получающих кортикостероиды, было недавно проведено Stevens и соавторами [197]. Сорок шесть процентов больных, пролеченных итраконазолом, показали значительный ответ, который определяли как снижение, по меньшей мере, на 50% дозы кортикостероидов, падение, по меньше мере, на 25% концентрации IgE в сыворотке и одно из следующего: 25% улучшения в переносимости физической нагрузки или результатов легочных тестов, или частичное или полное разрешение инфильтратов в легких. Тем не менее, важно помнить, что итраконазол может усиливать активность кортикостероидов через ингибицию их метаболизма, что может вести к патологической стимуляции АКТГ и надпочечниковой недостаточности [198]. Рандомизированные исследования вориконазола в лечении АБЛА отсутствуют, но одно исследование небольшого количества детей с муковисцидозом и АБЛА, которых лечили вориконазолом, показало значительное клиническое и серологическое улучшение [199].
Литература:
1. Soubani AO, Chandrasekar PH. The clinical spectrum of pulmonary aspergillosis. Chest 2002; 121:1988–99.
2. Rankin NE. Disseminated aspergillosis and moniliasis associated with agranulocytosis and antibiotic therapy. Br Med J 1953; 1:918–19.
3. Chamilos G, Luna M, Lewis RE, et al. Invasive fungal infections in patients with hematologic malignancies in a tertiary care cancer center: an autopsy study over a 15-year period (1989–2003). Haematologica 2006; 91:986–9.
4. Groll AH, Shah PM, Mentzel C, Schneider M, Just- Nuebling G, Huebner K. Trends in the postmortem epidemiology of invasive fungal infections at a university hospital. J Infect 1996; 33:23–32.
5. Yeghen T, Kibbler CC, Prentice HG, et al. Management of invasive pulmonary aspergillosis in hematology patients: a review of 87 consecutive cases at a single institution. Clin Infect Dis 2000; 31:859–68.
6. Fukuda T, Boeckh M, Carter RA, et al. Risks and outcomes of invasive fungal infections in recipients of allogeneic hematopoietic stem cell transplants after nonmyeloablative conditioning. Blood 2003; 102:827–33.
7. Gerson SL, Talbot GH, Hurwitz S, Strom BL, Lusk EJ, Cassileth PA. Prolonged granulocytopenia: the major risk factor for invasive pulmonary aspergillosis in patients with acute leukemia. Ann Intern Med 1984; 100:345–51.
8. Segal BH, Walsh TJ. Current approaches to diagnosis and treatment of invasive aspergillosis. Am J Respir Crit Care Med 2006; 173:707–17.
9. Soubani AO, Miller KB, Hassoun PM. Pulmonary complications of bone marrow transplantation. Chest 1996; 109:1066–77.
10. Kotloff RM, Ahya VN, Crawford SW. Pulmonary complications of solid organ and hematopoietic stem cell transplantation. Am J Respir Crit Care Med 2004; 170:22–48.
11. Morgan J, Wannemuehler KA, Marr KA, et al. Incidence of invasive aspergillosis following hematopoietic stem cell and solid organ transplantation: interim results of a prospective multicenter surveillance program. Med Mycol 2005; 43(Suppl. 1):S49–58.
12. Wald A, Leisenring W, van Burik JA, Bowden RA. Epidemiology of Aspergillus infections in a large cohort of patients undergoing bone marrow transplantation. J Infect Dis 1997; 175:1459–66.
13. Marr KA, Carter RA, Boeckh M, Martin P, Corey L. Invasive aspergillosis in allogeneic stem cell transplant recipients: changes in epidemiology and risk factors. Blood 2002; 100:4358–66.
14. Marr KA, Carter RA, Crippa F, Wald A, Corey L. Epidemiology and outcome of mould infections in hematopoietic stem cell transplant recipients. Clin Infect Dis 2002; 34:909–17.
15. Baddley JW, Stroud TP, Salzman D, Pappas PG. Invasive mold infections in allogeneic bone marrow transplant recipients. Clin Infect Dis 2001; 32:1319–24.
16. Junghanss C, Marr KA, Carter RA, et al. Incidence and outcome of bacterial and fungal infections following nonmyeloablative compared with myeloablative allogeneic hematopoietic stem cell transplantation: a matched control study. Biol Blood Marrow Transplant 2002; 8:512–20.
17. Warris A, Bjorneklett A, Gaustad P. Invasive pulmonary aspergillosis associated with infliximab therapy. N Engl J Med 2001; 344:1099–100.
18. Cordonnier C, Ribaud P, Herbrecht R, et al. Prognostic factors for death due to invasive aspergillosis after hematopoietic stem cell transplantation: a 1-year retrospective study of consecutive patients at French transplantation centers. Clin Infect Dis 2006; 42:955–63.
19. Ribaud P, Chastang C, Latge JP, et al. Survival and prognostic factors of invasive aspergillosis after allogeneic bone marrow transplantation. Clin Infect Dis 1999; 28:322–30.
20. Nichols WG, Corey L, Gooley T, Davis C, Boeckh M. High risk of death due to bacterial and fungal infection among cytomegalovirus (CMV)-seronegative recipients of stem cell transplants from seropositive donors: evidence for indirect effects of primary CMV infection. J Infect Dis 2002; 185:273–82.
21. Segal BH, Barnhart LA, Anderson VL, Walsh TJ, Malech HL, Holland SM. Posaconazole as salvage therapy in patients with chronic granulomatous disease and invasive filamentous fungal infection. Clin Infect Dis 2005; 40:1684–8.
22. Libanore M, Prini E, Mazzetti M, et al. Invasive Aspergillosis in Italian AIDS patients. Infection 2002; 30:341–5.
23. Denning DW, Follansbee SE, Scolaro M, Norris S, Edelstein H, Stevens DA. Pulmonary aspergillosis in the acquired immunodeficiency syndrome. N Engl J Med 1991; 324:654–62.
24. Lortholary O, Meyohas MC, Dupont B, et al. Invasive aspergillosis in patients with acquired immunodeficiency syndrome: report of 33 cases. French Cooperative Study Group on Aspergillosis in AIDS. Am J Med 1993; 95:177–87.
25. Mylonakis E, Barlam TF, Flanigan T, Rich JD. Pulmonary aspergillosis and invasive disease in AIDS: review of 342 cases. Chest 1998; 114:251–62.
26. Kemper CA, Hostetler JS, Follansbee SE, et al. Ulcerative and plaque-like tracheobronchitis due to infection with Aspergillus in patients with AIDS. Clin Infect Dis 1993; 17:344–52.
27. Wallace JM, Lim R, Browdy BL, et al. Risk factors and outcomes associated with identification of Aspergillus in respiratory specimens from persons with HIV disease. Pulmonary Complications of HIV Infection Study Group. Chest 1998; 114:131–7.
28. Ader F, Nseir S, Le Berre R, et al. Invasive pulmonary aspergillosis in chronic obstructive pulmonary disease: an emerging fungal pathogen. Clin Microbiol Infect 2005; 11:427–9.
29. Carrascosa Porras M, Herreras Martinez R, Corral Mones J, Ares Ares M, Zabaleta Murguiondo M, Ruchel R. Fatal Aspergillus myocarditis following short-term corticosteroid therapy for chronic obstructive pulmonary disease. Scand J Infect Dis 2002; 34:224–7.
30. Bulpa PA, Dive AM, Garrino MG, et al. Chronic obstructive pulmonary disease patients with invasive pulmonary aspergillosis: benefits of intensive care? Intensive Care Med 2001; 27:59–67.
Pulmonary aspergillosis 329
31. Vandewoude KH, Blot SI, Depuydt P, et al. Clinical relevance of Aspergillus isolation from respiratory tract samples in critically ill patients. Crit Care 2006; 10:R31.
32. Dimopoulos G, Piagnerelli M, Berre J, Eddafali B, Salmon I, Vincent JL. Disseminated aspergillosis in intensive care unit patients: an autopsy study. J Chemother 2003; 15:71–5.
33. Vandewoude KH, Blot SI, Benoit D, Colardyn F, Vogelaers D. Invasive aspergillosis in critically ill patients: attributable mortality and excesses in length of ICU stay and ventilator dependence. J Hosp Infect 2004; 56:269–76.
34. Meersseman W, Vandecasteele SJ, Wilmer A, Verbeken E, Peetermans WE, Van Wijngaerden E. Invasive aspergillosis in critically ill patients without malignancy. Am J Respir Crit Care Med 2004; 170:621–5.
35. Janssen JJ, Strack van Schijndel RJ, van der Poest Clement EH, Ossenkoppele GJ, Thijs LG, Huijgens PC. Outcome of ICU treatment in invasive aspergillosis. Intensive Care Med 1996; 22:1315–22.
36. Garnacho-Montero J, Amaya-Villar R, Ortiz-Leyba C, et al. Isolation of Aspergillus spp. from the respiratory tract in critically ill patients: risk factors, clinical presentation and outcome. Crit Care 2005; 9:R191–9.
37. Garnacho-Montero J, Amaya-Villar R. A validated clinical approach for the management of aspergillosis in critically ill patients: ready, steady, go! Crit Care 2006; 10:132.
38. Khasawneh F, Mohamad T, Moughrabieh MK, Lai Z, Ager J, Soubani AO. Isolation of Aspergillus in critically ill patients: a potential marker of poor outcome. J Crit Care 2006; 21:322–7.
39. Iwen PC, Rupp ME, Langnas AN, Reed EC, Hinrichs SH. Invasive pulmonary aspergillosis due to Aspergillus terreus: 12-year experience and review of the literature. Clin Infect Dis 1998; 26:1092–7.
40. Young RC, Bennett JE, Vogel CL, Carbone PP, DeVita VT. Aspergillosis. The spectrum of the disease in 98 patients. Medicine (Baltimore) 1970; 49:147–73.
41. Prystowsky SD, Vogelstein B, Ettinger DS, et al. Invasive aspergillosis. N Engl J Med 1976; 295:655–8.
42. Allo MD, Miller J, Townsend T, Tan C. Primary cutaneous aspergillosis associated with Hickman intravenous catheters. N Engl J Med 1987; 317:1105–8.
43. Albelda SM, Talbot GH, Gerson SL, Miller WT, Cassileth PA. Pulmonary cavitation and massive hemoptysis in invasive pulmonary aspergillosis. Influence of bone marrow recovery in patients with acute leukemia. Am Rev Respir Dis 1985; 131:115–20.
44. Judson MA, Sahn SA. Endobronchial lesions in HIV-infected individuals. Chest 1994; 105:1314–23.
45. Nathan SD, Shorr AF, Schmidt ME, Burton NA. Aspergillus and endobronchial abnormalities in lung transplant recipients. Chest 2000; 118:403–7.
46. Denning DW. Invasive aspergillosis. Clin Infect Dis 1998; 26:781–803.
47. Ruhnke M, Bohme A, Buchheidt D, et al. Diagnosis of invasive fungal infections in hematology and oncology– guidelines of the Infectious Diseases Working Party (AGIHO) of the German Society of Hematology and Oncology (DGHO). Ann Hematol 2003; 82(Suppl. 2):S141–8.
48. Soubani AO, Khanchandani G, Ahmed HP. Clinical significance of lower respiratory tract Aspergillus culture in elderly hospitalized patients. Eur J Clin Microbiol Infect Dis 2004; 23:491–4.
49. Nalesnik MA, Myerowitz RL, Jenkins R, Lenkey J, Herbert D. Significance of Aspergillus species isolated from respiratory secretions in the diagnosis of invasive pulmonary aspergillosis. J Clin Microbiol 1980; 11:370–6.
50. Horvath JA, Dummer S. The use of respiratory-tract cultures in the diagnosis of invasive pulmonary aspergillosis. Am J Med 1996; 100:171–8.
51. Treger TR, Visscher DW, Bartlett MS, Smith JW. Diagnosis of pulmonary infection caused by Aspergillus: usefulness of respiratory cultures. J Infect Dis 1985; 152:572–6.
52. Soubani AO, Qureshi MA. Invasive pulmonary aspergillosis following bone marrow transplantation: risk factors and diagnostic aspect. Haematologia 2002; 32:427–37.
53. Yu VL, Muder RR, Poorsattar A. Significance of isolation of Aspergillus from the respiratory tract in diagnosis of invasive pulmonary aspergillosis. Results from a three-year prospective study. Am J Med 1986; 81:249–54.
54. Tang CM, Cohen J. Diagnosing fungal infections in immunocompromised hosts. J Clin Pathol 1992; 45:1–5.
55. Duthie R, Denning DW. Aspergillus fungemia: report of two cases and review. Clin Infect Dis 1995; 20:598–605.
56. Libshitz HI, Pagani JJ. Aspergillosis and mucormycosis: two types of opportunistic fungal pneumonia. Radiology 1981; 140:301–6.
57. Kuhlman JE, Fishman EK, Siegelman SS. Invasive pulmonary aspergillosis in acute leukemia: characteristic findings on CT, the CT halo sign, and the role of CT in early diagnosis. Radiology 1985; 157:611–14.
58. Caillot D, Casasnovas O, Bernard A, et al. Improved management of invasive pulmonary aspergillosis in neutropenic patients using early thoracic computed tomographic scan and surgery. J Clin Oncol 1997; 15:139–47.
59. Caillot D, Mannone L, Cuisenier B, Couaillier JF. Role of early diagnosis and aggressive surgery in the management of invasive pulmonary aspergillosis in neutropenic patients. Clin Microbiol Infect 2001; 7(Suppl. 2):54–61.
60. Kuhlman JE, Fishman EK, Burch PA, Karp JE, Zerhouni EA, Siegelman SS. Invasive pulmonary aspergillosis in acute leukemia. The contribution of CT to early diagnosis and aggressive management. Chest 1987; 92:95–9.
61. Curtis AM, Smith GJ, Ravin CE. Air crescent sign of invasive aspergillosis. Radiology 1979; 133:17–21.
62. Gaeta M, Blandino A, Scribano E, Minutoli F, Volta S, Pandolfo I. Computed tomography halo sign in pulmonary nodules: frequency and diagnostic value. J Thorac Imaging 1999; 14:109–13.
63. Greene R. The radiological spectrum of pulmonary aspergillosis. Med Mycol 2005; 43(Suppl. 1):S147–54.
64. Heussel CP, Kauczor HU, Heussel GE, et al. Pneumonia in febrile neutropenic patients and in bone marrow and blood stem-cell transplant recipients: use of high-resolution computed tomography. J Clin Oncol 1999; 17:796–805.
65. Horger M, Hebart H, Einsele H, et al. Initial CT manifestations of invasive pulmonary aspergillosis in 45 non-HIV immunocompromised patients: association with patient outcome? Eur J Radiol 2005; 55:437–44.
66. Albelda SM, Talbot GH, Gerson SL, Miller WT, Cassileth PA. Role of fiberoptic bronchoscopy in the diagnosis of invasive pulmonary aspergillosis in patients with acute leukemia. Am J Med 1984; 76:1027–34.
67. Kahn FW, Jones JM, England DM. The role of bronchoalveolar lavage in the diagnosis of invasive pulmonary aspergillosis. Am J Clin Pathol 1986; 86:518–23.
68. Levy H, Horak DA, Tegtmeier BR, Yokota SB, Forman SJ. The value of bronchoalveolar lavage and bronchial washings in the diagnosis of invasive pulmonary aspergillosis. Respir Med 1992; 86:243–8.
69. Reichenberger F, Habicht J, Matt P, et al. Diagnostic yield of bronchoscopy in histologically proven invasive pulmonary aspergillosis. Bone Marrow Transplant 1999; 24:1195–9.
70. Maschmeyer G, Beinert T, Buchheidt D, et al. Diagnosis and antimicrobial therapy of pulmonary infiltrates in febrile neutropenic patients–guidelines of the Infectious Diseases Working Party (AGIHO) of the German Society of Hematology and Oncology (DGHO). Ann Hematol 2003;
82(Suppl. 2):S118–26.
71. Panackal AA, Marr KA. Scedosporium/Pseudallescheria infections. Semin Respir Crit Care Med 2004; 25:171–81.
72. Walsh TJ, Groll AH. Overview: non-fumigatus species of Aspergillus: perspectives on emerging pathogens in immunocompromised hosts. Curr Opin Investig Drugs 2001; 2:1366–7.
73. Lass-Florl C, Griff K, Mayr A, et al. Epidemiology and outcome of infections due to Aspergillus terreus: 10-year single centre experience. Br J Haematol 2005; 131:201–7.
74. Steinbach WJ, Benjamin DK, Jr., Kontoyiannis DP, et al. Infections due to Aspergillus terreus: a multicenter retrospective analysis of 83 cases. Clin Infect Dis 2004; 39:192–8.
75. Hachem RY, Kontoyiannis DP, Boktour MR, et al. Aspergillus terreus: an emerging amphotericin B-resistant opportunistic mold in patients with hematologic malignancies. Cancer 2004; 101:1594–600.
76. Kontoyiannis DP, Lewis RE, May GS, Osherov N, Rinaldi MG. Aspergillus nidulans is frequently resistant to amphotericin B. Mycoses 2002; 45:406–7.
77. Walsh TJ, Raad I, Patterson TF, et al. Treatment of invasive aspergillosis with posaconazole in patients who are refractory to or intolerant of conventional therapy: an externally controlled trial. Clin Infect Dis 2007; 44:2–12.
78. Boutboul F, Alberti C, Leblanc T, et al. Invasive aspergillosis in allogeneic stem cell transplant recipients: increasing antigenemia is associated with progressive disease. Clin Infect Dis 2002; 34:939–43.
79. Marr KA, Balajee SA, McLaughlin L, Tabouret M, Bentsen C, Walsh TJ. Detection of galactomannan antigenemia by enzyme immunoassay for the diagnosis of invasive aspergillosis: variables that affect performance. J Infect Dis 2004; 190:641–9.
80. Pfeiffer CD, Fine JP, Safdar N. Diagnosis of invasive aspergillosis using a galactomannan assay: a meta-analysis. Clin Infect Dis 2006; 42:1417–27.
81. Herbrecht R, Letscher-Bru V, Oprea C, et al. Aspergillus galactomannan detection in the diagnosis of invasive aspergillosis in cancer patients. J Clin Oncol 2002; 20:1898–906.
82. Singh N, Obman A, Husain S, Aspinall S, Mietzner S, Stout JE. Reactivity of platelia Aspergillus galactomannan antigen with piperacillin-tazobactam: clinical implications based on achievable concentrations in serum. Antimicrob Agents Chemother 2004; 48:1989–92.
83. Marr KA, Laverdiere M, Gugel A, Leisenring W. Antifungal therapy decreases sensitivity of the Aspergillus galactomannan enzyme immunoassay. Clin Infect Dis 2005; 40:1762–9.
84. Ansorg R, van den Boom R, Rath PM. Detection of Aspergillus galactomannan antigen in foods and antibiotics. Mycoses 1997; 40:353–7.
85. Busca A, Locatelli F, Barbui A, et al. Usefulness of sequential Aspergillus galactomannan antigen detection combined with early radiologic evaluation for diagnosis of invasive pulmonary aspergillosis in patients undergoing allogeneic stem cell transplantation. Transplant Proc 2006; 38:1610–13.
86. Musher B, Fredricks D, Leisenring W, Balajee SA, Smith C, Marr KA. Aspergillus galactomannan enzyme immunoassay and quantitative PCR for diagnosis of invasive aspergillosis with bronchoalveolar lavage fluid. J Clin Microbiol 2004; 42:5517–22.
87. Klont RR, Mennink-Kersten MA, Verweij PE. Utility of Aspergillus antigen detection in specimens other than serum specimens. Clin Infect Dis 2004; 39:1467–74.
88. Salonen J, Lehtonen OP, Terasjarvi MR, Nikoskelainen J. Aspergillus antigen in serum, urine and bronchoalveolar lavage specimens of neutropenic patients in relation to clinical outcome. Scand J Infect Dis 2000; 32:485–90.
89. Hizel K, Kokturk N, Kalkanci A, Ozturk C, Kustimur S, Tufan M. Polymerase chain reaction in the diagnosis of invasive aspergillosis. Mycoses 2004; 47:338–42.
90. Buchheidt D, Baust C, Skladny H, et al. Detection of Aspergillus species in blood and bronchoalveolar lavage samples from immunocompromised patients by means of 2-step polymerase chain reaction: clinical results. Clin Infect Dis 2001; 33:428–35.
91. Loeffler J, Kloepfer K, Hebart H, et al. Polymerase chain reaction detection of aspergillus DNA in experimental models of invasive aspergillosis. J Infect Dis 2002; 185:1203–6.
92. Halliday C, Hoile R, Sorrell T, et al. Role of prospective screening of blood for invasive aspergillosis by polymerase chain reaction in febrile neutropenic recipients of haematopoietic stem cell transplants and patients with acute leukaemia. Br J Haematol 2006; 132:478–86.
93. Obayashi T, Yoshida M, Mori T, et al. Plasma (1–43)-beta- D-glucan measurement in diagnosis of invasive deep mycosis and fungal febrile episodes. Lancet 1995; 345:17–20.
94. Ascioglu S, Rex JH, de Pauw B, et al. Defining opportunistic invasive fungal infections in immunocompromised patients with cancer and hematopoietic stem cell transplants: an international consensus. Clin Infect Dis 2002; 34:7–14.
95. Johnson LB, Kauffman CA. Voriconazole: a new triazole antifungal agent. Clin Infect Dis 2003; 36:630–7.
96. Sambatakou H, Dupont B, Lode H, Denning DW. Voriconazole treatment for subacute invasive and chronic pulmonary aspergillosis. Am J Med 2006; 119:527.e17–24.
97. Ghannoum MA, Kuhn DM. Voriconazole – better chances for patients with invasive mycoses. Eur J Med Res 2002; 7:242–56.
98. Herbrecht R, Denning DW, Patterson TF, et al. Voriconazole versus amphotericin B for primary therapy of invasive aspergillosis. N Engl J Med 2002; 347:408–15.
99. Pitisuttithum P, Negroni R, Graybill JR, et al. Activity of posaconazole in the treatment of central nervous system fungal infections. J Antimicrob Chemother 2005; 56:745–55.
100. Spanakis EK, Aperis G, Mylonakis E. New agents for the treatment of fungal infections: clinical efficacy and gaps in coverage. Clin Infect Dis 2006; 43:1060–8.
101. Cohen-Wolkowiez M, Benjamin DK, Jr., Steinbach WJ, Smith PB. Anidulafungin: a new echinocandin for the treatment of fungal infections. Drugs Today (Barc) 2006; 42:533–44.
102. Aliff TB, Maslak PG, Jurcic JG, et al. Refractory Aspergillus pneumonia in patients with acute leukemia: successful therapy with combination caspofungin and liposomal amphotericin. Cancer 2003; 97:1025–32.
103. Kontoyiannis DP, Hachem R, Lewis RE, et al. Efficacy and toxicity of caspofungin in combination with liposomal amphotericin B as primary or salvage treatment of invasive aspergillosis in patients with hematologic malignancies. Cancer 2003; 98:292–9.
104. Graybill JR, Bocanegra R, Gonzalez GM, Najvar LK. Combination antifungal therapy of murine aspergillosis: liposomal amphotericin B and micafungin. J Antimicrob Chemother 2003; 52:656–62.
105. Marr KA, Boeckh M, Carter RA, Kim HW, Corey L. Combination antifungal therapy for invasive aspergillosis. Clin Infect Dis 2004; 39:797–802.
106. Perea S, Gonzalez G, Fothergill AW, Kirkpatrick WR, Rinaldi MG, Patterson TF. In vitro interaction of caspofungin acetate with voriconazole against clinical isolates of Aspergillus spp. Antimicrob Agents Chemother 2002; 46:3039–41.
107. Denning DW, Marr KA, Lau WM, et al. Micafungin (FK463), alone or in combination with other systemic antifungal agents, for the treatment of acute invasive aspergillosis. J Infect 2006; 53:337–49.
108. Klont RR, Mennink-Kersten MA, Ruegebrink D, et al. Paradoxical increase in circulating Aspergillus antigen during treatment with caspofungin in a patient with pulmonary aspergillosis. Clin Infect Dis 2006; 43:e23–5.
109. Moreau P, Zahar JR, Milpied N, et al. Localized invasive pulmonary aspergillosis in patients with neutropenia. Effectiveness of surgical resection. Cancer 1993; 72:3223–6.
110. Reichenberger F, Habicht J, Kaim A, et al. Lung resection for invasive pulmonary aspergillosis in neutropenic patients with hematologic diseases. Am J Respir Crit Care Med 1998; 158:885–90.
111. Habicht JM, Reichenberger F, Gratwohl A, Zerkowski HR, Tamm M. Surgical aspects of resection for suspected invasive pulmonary fungal infection in neutropenic patients. Ann Thorac Surg 1999; 68:321–5.
112. Pidhorecky I, Urschel J, Anderson T. Resection of invasive pulmonary aspergillosis in immunocompromised patients. Ann Surg Oncol 2000; 7:312–17.
113. Matt P, Bernet F, Habicht J, et al. Predicting outcome after lung resection for invasive pulmonary aspergillosis in patients with neutropenia. Chest 2004; 126:1783–8.
114. Baron O, Guillaume B, Moreau P, et al. Aggressive surgical management in localized pulmonary mycotic and nonmycotic infections for neutropenic patients with acute leukemia: report of eighteen cases. J Thorac Cardiovasc Surg 1998; 115:63–8.
115. Giles FJ. Monocyte-macrophages, granulocyte-macrophagecolony-stimulating factor, and prolonged survival among patients with acute myeloid leukemia and stem cell transplants. Clin Infect Dis 1998; 26:1282–9.
116. Roilides E, Holmes A, Blake C, Venzon D, Pizzo PA, Walsh TJ. Antifungal activity of elutriated human monocytes against Aspergillus fumigatus hyphae: enhancement by granulocyte-macrophage colony-stimulating factor and interferon-gamma. J Infect Dis 1994; 170:894–9.
117. Roilides E, Sein T, Holmes A, et al. Effects of macrophage colony-stimulating factor on antifungal activity of mononuclear phagocytes against Aspergillus fumigatus. J Infect Dis 1995; 172:1028–34.
118. Rowe JM, Andersen JW, Mazza JJ, et al. A randomized placebo-controlled phase III study of granulocyte-macrophage colony-stimulating factor in adult patients (455 to 70 years of age) with acute myelogenous leukemia: a study of the Eastern Cooperative Oncology Group (E1490). Blood
1995; 86:457–62.
119. Ozer H, Armitage JO, Bennett CL, et al. 2000 update of recommendations for the use of hematopoietic colonystimulating factors: evidence-based, clinical practice guidelines. American Society of Clinical Oncology Growth Factors Expert Panel. J Clin Oncol 2000; 18:3558–85.
120. Roilides E, Uhlig K, Venzon D, Pizzo PA, Walsh TJ. Prevention of corticosteroid-induced suppression of human polymorphonuclear leukocyte-induced damage of Aspergillus fumigatus hyphae by granulocyte colonystimulating factor and gamma interferon. Infect Immun 1993; 61:4870–7.
121. Nagai H, Guo J, Choi H, Kurup V. Interferon-gamma and tumor necrosis factor-alpha protect mice from invasive aspergillosis. J Infect Dis 1995; 172:1554–60.
122. A controlled trial of interferon gamma to prevent infection in chronic granulomatous disease. The International Chronic Granulomatous Disease Cooperative Study Group. N Engl J Med 1991; 324:509–16.
123. Safdar A. Strategies to enhance immune function in hematopoietic transplantation recipients who have fungal infections. Bone Marrow Transplant 2006; 38:327–37.
124. Safdar A, Rodriguez G, Ohmagari N, et al. The safety of interferon-gamma-1b therapy for invasive fungal infections after hematopoietic stem cell transplantation. Cancer 2005; 103:731–9.
125. Price TH, Bowden RA, Boeckh M, et al. Phase I/II trial of neutrophil transfusions from donors stimulated with G-CSF and dexamethasone for treatment of patients with infections in hematopoietic stem cell transplantation. Blood 2000; 95:3302–9.
126. Sherertz RJ, Belani A, Kramer BS, et al. Impact of air filtration on nosocomial Aspergillus infections. Unique risk of bone marrow transplant recipients. Am J Med 1987; 83:709–18.
127. Mattiuzzi GN, Kantarjian H, O’Brien S, et al. Intravenous itraconazole for prophylaxis of systemic fungal infections in patients with acute myelogenous leukemia and high-risk myelodysplastic syndrome undergoing induction chemotherapy. Cancer 2004; 100:568–73.
128. Ullmann AJ, Cornely OA. Antifungal prophylaxis for invasive mycoses in high risk patients. Curr Opin Infect Dis 2006; 19:571–6.
129. Gefter WB, Weingrad TR, Epstein DM, Ochs RH, Miller WT. “Semi-invasive” pulmonary aspergillosis: a new look at the spectrum of aspergillus infections of the lung. Radiology 1981; 140:313–21.
130. Binder RE, Faling LJ, Pugatch RD, Mahasaen C, Snider GL. Chronic necrotizing pulmonary aspergillosis: a discrete clinical entity. Medicine (Baltimore) 1982; 61:109–24.
131. Saraceno JL, Phelps DT, Ferro TJ, Futerfas R, Schwartz DB. Chronic necrotizing pulmonary aspergillosis: approach to management. Chest 1997; 112:541–8.
132. Grahame-Clarke CN, Roberts CM, Empey DW. Chronic necrotizing pulmonary aspergillosis and pulmonary phycomycosis in cystic fibrosis. Respir Med 1994; 88:465–8.
133. Denning DW. Chronic forms of pulmonary aspergillosis. Clin Microbiol Infect 2001; 7(Suppl. 2):25–31.
134. Kim SY, Lee KS, Han J, et al. Semiinvasive pulmonary aspergillosis: CT and pathologic findings in six patients. AJR Am J Roentgenol 2000; 174:795–8.
135. Parra I, Remacha A, Rezusta A, et al. Chronic necrotizing pulmonary aspergillosis. Med Mycol 2004; 42:369–71.
136. Denning DW, Riniotis K, Dobrashian R, Sambatakou H. Chronic cavitary and fibrosing pulmonary and pleural aspergillosis: case series, proposed nomenclature change, and review. Clin Infect Dis 2003; 37(Suppl. 3):S265–80.
137. Caras WE, Pluss JL. Chronic necrotizing pulmonary aspergillosis: pathologic outcome after itraconazole therapy. Mayo Clin Proc 1996; 71:25–30.
138. Kauffman CA. Quandary about treatment of aspergillomas persists. Lancet 1996; 347:1640.
139. Zizzo G, Castriota-Scanderbeg A, Zarrelli N, Nardella G, Daly J, Cammisa M. Pulmonary aspergillosis complicating ankylosing spondylitis. Radiol Med 1996; 91:817–8.
140. Kawamura S, Maesaki S, Tomono K, Tashiro T, Kohno S. Clinical evaluation of 61 patients with pulmonary aspergilloma. Intern Med 2000; 39:209–12.
141. Aspergilloma and residual tuberculous cavities–the results of a resurvey. Tubercle 1970; 51:227–45.
142. Rosenheim SH, Schwarz J. Cavitary pulmonary cryptococcosis complicated by aspergilloma. Am Rev Respir Dis 1975; 111:549–53.
143. Sarosi GA, Silberfarb PM, Saliba NA, Huggin PM, Tosh FE. Aspergillomas occurring in blastomycotic cavities. Am Rev Respir Dis 1971; 104:581–4.
144. Tomee JF, van der Werf TS, Latge JP, Koeter GH, Dubois AE, Kauffman HF. Serologic monitoring of disease and treatment in a patient with pulmonary aspergilloma. Am J Respir Crit Care Med 1995; 151:199–204.
145. Rafferty P, Biggs BA, Crompton GK, Grant IW. What happens to patients with pulmonary aspergilloma? Analysis of 23 cases. Thorax 1983; 38:579–83.
146. Gefter WB. The spectrum of pulmonary aspergillosis. J Thorac Imaging 1992; 7:56–74.
147. Faulkner SL, Vernon R, Brown PP, Fisher RD, Bender HW, Jr. Hemoptysis and pulmonary aspergilloma: operative versus nonoperative treatment. Ann Thorac Surg 1978; 25:389–92.
148. Addrizzo-Harris DJ, Harkin TJ, McGuinness G, Naidich DP, Rom WN. Pulmonary aspergilloma and AIDS. A comparison of HIV-infected and HIV-negative individuals. Chest 1997; 111:612–18.
149. Aslam PA, Eastridge CE, Hughes FA Jr. Aspergillosis of the lung–an eighteen-year experience. Chest 1971;
59:28–32.
150. Garvey J, Crastnopol P, Weisz D, Khan F. The surgical treatment of pulmonary aspergillomas. J Thorac Cardiovasc Surg 1977; 74:542–7.
151. Daly RC, Pairolero PC, Piehler JM, Trastek VF, Payne WS, Bernatz PE. Pulmonary aspergilloma. Results of surgical treatment. J Thorac Cardiovasc Surg 1986; 92:981–8.
152. Karas A, Hankins JR, Attar S, Miller JE, McLaughlin JS. Pulmonary aspergillosis: an analysis of 41 patients. Ann Thorac Surg 1976; 22:1–7.
153. Jewkes J, Kay PH, Paneth M, Citron KM. Pulmonary aspergilloma: analysis of prognosis in relation to haemoptysis and survey of treatment. Thorax 1983; 38:572–8.
154. Glimp RA, Bayer AS. Pulmonary aspergilloma. Diagnostic and therapeutic considerations. Arch Intern Med 1983; 143:303–8.
155. Stevens DA, Kan VL, Judson MA, et al. Practice guidelines for diseases caused by Aspergillus. Infectious Diseases Society of America. Clin Infect Dis 2000; 30:696–709.
156. Tuncel E. Pulmonary air meniscus sign. Respiration 1984; 46:139–44.
157. Roberts CM, Citron KM, Strickland B. Intrathoracic aspergilloma: role of CT in diagnosis and treatment. Radiology 1987; 165:123–8.
158. Bandoh S, Fujita J, Fukunaga Y, et al. Cavitary lung cancer with an aspergilloma-like shadow. Lung Cancer 1999; 26:195–8.
159. Le Thi Huong D, Wechsler B, Chamuzeau JP, Bisson A, Godeau P. Pulmonary aspergilloma complicating Wegener’s granulomatosis. Scand J Rheumatol 1995; 24:260.
160. McCarthy DS, Pepys J. Pulmonary aspergilloma–clinical immunology. Clin Allergy 1973; 3:57–70.
161. Judson MA. Noninvasive Aspergillus pulmonary disease. Semin Respir Crit Care Med 2004; 25:203–19.
162. Andrews CP, Weiner MH. Aspergillus antigen detection in bronchoalveolar lavage fluid from patients with invasive aspergillosis and aspergillomas. Am J Med 1982; 73:372–80.
163. Yamada H, Kohno S, Koga H, Maesaki S, Kaku M. Topical treatment of pulmonary aspergilloma by antifungals. Relationship between duration of the disease and efficacy of therapy. Chest 1993; 103:1421–5.
164. Munk PL, Vellet AD, Rankin RN, Muller NL, Ahmad D. Intracavitary aspergilloma: transthoracic percutaneous injection of amphotericin gelatin solution. Radiology 1993; 188:821–3.
165. Lee KS, Kim HT, Kim YH, Choe KO. Treatment of hemoptysis in patients with cavitary aspergilloma of the lung: value of percutaneous instillation of amphotericin B. AJR Am J Roentgenol 1993; 161:727–31.
166. Klein JS, Fang K, Chang MC. Percutaneous transcatheter treatment of an intracavitary aspergilloma. Cardiovasc Intervent Radiol 1993; 16:321–4.
167. Hammerman KJ, Sarosi GA, Tosh FE. Amphotericin B in the treatment of saprophytic forms of pulmonary aspergillosis. Am Rev Respir Dis 1974; 109:57–62.
168. Campbell JH, Winter JH, Richardson MD, Shankland GS, Banham SW. Treatment of pulmonary aspergilloma with itraconazole. Thorax 1991; 46:839–41.
169. Dupont B. Itraconazole therapy in aspergillosis: study in 49 patients. J Am Acad Dermatol 1990; 23:607–14.
170. Impens N, De Greve J, De Beule K, Meysman M, De Beuckelaere S, Schandevyl W. Oral treatment with itraconazole of aspergilloma in cavitary lung cancer. Eur Respir J 1990; 3:837–9.
171. Tsubura E. [Multicenter clinical trial of itraconazole in the treatment of pulmonary aspergilloma. Pulmonary Aspergilloma Study Group]. Kekkaku 1997; 72:557–64 (Abstract).
172. Soltanzadeh H, Wychulis AR, Sadr F, Bolanowski PJ, Neville WE. Surgical treatment of pulmonary aspergilloma. Ann Surg 1977; 186:13–16.
173. Massard G, Roeslin N, Wihlm JM, Dumont P, Witz JP, Morand G. Pleuropulmonary aspergilloma: clinical spectrum and results of surgical treatment. Ann Thorac Surg 1992; 54:1159–64.
174. Kilman JW, Ahn C, Andrews NC, Klassen K. Surgery for pulmonary aspergillosis. J Thorac Cardiovasc Surg 1969; 57:642–7.
175. Chen JC, Chang YL, Luh SP, Lee JM, Lee YC. Surgical treatment for pulmonary aspergilloma: a 28 year experience. Thorax 1997; 52:810–13.
176. Uflacker R, Kaemmerer A, Picon PD, et al. Bronchial artery embolization in the management of hemoptysis: technical aspects and long-term results. Radiology 1985; 157:637–44.
177. Basich JE, Graves TS, Baz MN, et al. Allergic bronchopulmonary aspergillosis in corticosteroid-dependent asthmatics. J Allergy Clin Immunol 1981; 68:98–102.
178. Mroueh S, Spock A. Allergic bronchopulmonary aspergillosis in patients with cystic fibrosis. Chest 1994; 105:32–6.
179. Wang JL, Patterson R, Rosenberg M, Roberts M, Cooper BJ. Serum IgE and IgG antibody activity against Aspergillus fumigatus as a diagnostic aid in allergic bronchopulmonary aspergillosis. Am Rev Respir Dis 1978; 117:917–27.
180. Cockrill BA, Hales CA. Allergic bronchopulmonary aspergillosis. Annu Rev Med 1999; 50:303–16.
181. Knutsen AP, Slavin RG. In vitro T cell responses in patients with cystic fibrosis and allergic bronchopulmonary aspergillosis. J Lab Clin Med 1989; 113:428–35.
182. Chauhan B, Santiago L, Kirschmann DA, et al. The association of HLA-DR alleles and T cell activation with allergic bronchopulmonary aspergillosis. J Immunol 1997; 159:4072–6.
183. Bosken CH, Myers JL, Greenberger PA, Katzenstein AL. Pathologic features of allergic bronchopulmonary aspergillosis. Am J Surg Pathol 1988; 12:216–22.
184. Rosenberg M, Patterson R, Mintzer R, Cooper BJ, Roberts M, Harris KE. Clinical and immunologic criteria for the diagnosis of allergic bronchopulmonary aspergillosis. Ann Intern Med 1977; 86:405–14.
185. Mintzer RA, Rogers LF, Kruglik GD, Rosenberg M, Neiman HL, Patterson R. The spectrum of radiologic findings in allergic bronchopulmonary aspergillosis. Radiology 1978; 127:301–7.
186. Greenberger PA, Patterson R. Diagnosis and management of allergic bronchopulmonary aspergillosis. Ann Allergy 1986; 56:444–8.
187. Greenberger PA. Immunologic aspects of lung diseases and cystic fibrosis. Jama 1997; 278:1924–30.
188. Patterson R, Greenberger PA, Radin RC, Roberts M. Allergic bronchopulmonary aspergillosis: staging as an aid to management. Ann Intern Med 1982; 96:286–91.
189. Patterson R, Greenberger PA, Halwig JM, Liotta JL, Roberts M. Allergic bronchopulmonary aspergillosis. Natural history and classification of early disease by serologic and roentgenographic studies. Arch Intern Med 1986; 146:916–18.
190. Rosenberg M, Patterson R, Roberts M, Wang J. The assessment of immunologic and clinical changes occurring during corticosteroid therapy for allergic bronchopulmonary aspergillosis. Am J Med 1978; 64:599–606.
191. Wang JL, Patterson R, Roberts M, Ghory AC. The management of allergic bronchopulmonary aspergillosis. Am Rev Respir Dis 1979; 120:87–92.
192. Capewell S, Chapman BJ, Alexander F, Greening AP, Crompton GK. Corticosteroid treatment and prognosis in pulmonary eosinophilia. Thorax 1989; 44:925–9.
193. Safirstein BH, D’Souza MF, Simon G, Tai EH, Pepys J. Fiveyear follow-up of allergic bronchopulmonary aspergillosis. Am Rev Respir Dis 1973; 108:450–9.
194. Mikita CP, Mikita JA. Allergic bronchopulmonary aspergillosis. Allergy Asthma Proc 2006; 27:82–4.
195. Hilton AM, Chatterjee SS. Bronchopulmonary aspergillosis– treatment with beclomethasone dipropionate. Postgrad Med J 1975; 51(Suppl. 4):98–103.
196. Seaton A, Seaton RA, Wightman AJ. Management of allergic bronchopulmonary aspergillosis without maintenance oral corticosteroids: a fifteen-year follow-up. Q J Med 1994; 87:529–37.
197. Stevens DA, Schwartz HJ, Lee JY, et al. A randomized trial of itraconazole in allergic bronchopulmonary aspergillosis. N Engl J Med 2000; 342:756–62.
198. Skov M, Main KM, Sillesen IB, Muller J, Koch C, Lanng S. Iatrogenic adrenal insufficiency as a side-effect of combined treatment of itraconazole and budesonide. Eur Respir J 2002; 20:127–33.
199. Hilliard T, Edwards S, Buchdahl R, et al. Voriconazole therapy in children with cystic fibrosis. J Cyst Fibros 2005;4:215–20.