Эффективность препарата каберголин в лечении гиперпролактинемии
|
Актуальность проблемы лечения гиперпролактинемии обусловлена широкой распространенностью заболевания, возможной ролью опухолевого процесса в ее генезе, а также значительным влиянием на репродуктивную систему.
Гиперпролактинемия наблюдается у 15–30% женщин с вторичной аменореей и почти у 70% страдающих бесплодием. При этом опухоли гипофиза при гиперпролактинемии обнаруживаются в 32% случаев [1, 3, 5, 6]. Медикаментозные средства для лечения гиперпролактинемии в течение последних 30 лет постоянно совершенствовались. Однако несмотря на высокую (64–100%) эффективность большинства лекарственных средств – аналогов дофамина, у ряда больных отмечается резистентность к лечению, либо плохая их переносимость [2, 4]. Так, резистентность к наиболее распространенному агонисту дофамина – бромокриптину (парлоделу) отмечается у 17%, плохая переносимость – у 10–70%. Необходимость многократного приема в течение дня приводит к отказу от лечения приблизительно у 5–20% пациенток [11, 15, 18]. Это обусловило появление нового агониста дофамина каберголина (достинекса), производного деривата спорыньи, относящегося к III поколению препаратов для лечения гиперпролактинемии. Каберголин является высокоселективным, мощным и пролонгированным ингибитором секреции пролактина. По данным литературы, каберголин эффективен у 90% пациенток, резистентных к лечению бромокриптином, и у 70% – резистентных к лечению квинаголидом [7, 8, 10]. Целью настоящего исследования явилось изучение эффективности (с учетом оценки изменения уровня пролактина, восстановления менструального цикла, овуляций и/или наступления беременности) и переносимости каберголина в лечении пациенток с гиперпролактинемией. Материал и методы Исследуемую группу составили 24 пациентки в возрасте 23–45 лет (средний возраст 32,7±1,2 года) с олиго- или аменореей и уровнем пролактина (ПРЛ), превышающим верхнюю границу нормы в 2 раза и более (от 1100 до 9000 мкМЕ/мл) при двукратном определении. Критериями исключения явились наличие синдрома поликистозных яичников, нарушение функции щитовидной железы и коры надпочечников, тяжелые острые или хронические заболевания, терапия препаратами, влияющими на секрецию ПРЛ, и др. Проведены общеклинические исследования (клинические анализы крови и мочи, биохимический анализ крови), ультразвуковые исследования (УЗИ) органов малого таза, гормональное исследование, электрокардиография, магнитно-резонансная томография (МРТ), определение артериального давления (АД), частоты сердечных сокращений (ЧСС), Rt. Концентрации гормонов (ПРЛ, ЛГ, ФСГ, ТТГ, Т) определяли методом иммуноферментного анализа (ИФА) с помощью соответствующих тест-систем на автоматическом анализаторе Cobas Core II. МРТ проводилась на оборудовании Magnetom Impact (Siemens) c использованием контрастного вещества (Magnevit). Cтатистическая обработка полученных данных осуществлялась с использованием пакета программного обеспечения Microsoft Excel (Версия 7.0). Различия в полученных показателях считались достоверными при p меньше 0,05. Начальная недельная дозировка каберголина составляла 0,5 мг (1 таблетка) – по 1/2 таблетки 2 раза в неделю. При необходимости (отсутствие нормализации уровня ПРЛ) доза увеличивалась каждые 4 нед на 0,5 мг. Максимальная доза в неделю в исследовании составила 2 мг. Продолжительность терапии 24 нед, длительность последующего наблюдения 6 мес после прекращения лечения. Результаты исследования Опухолевые формы, по данным МРТ, выявлены у 91,6%, при этом микроаденомы у 79,1%, макроаденомы у 12,5%, у остальных 8,4% пациенток диагностирован симптом пустого" турецкого седла. В клинической картине гиперпролактиновых состояний преобладали нарушения функций яичников: аменорея – у 21 (87,5%), олигоменорея – у 3 (12,5%). Длительность аменореи составила в среднем 2,3±0,74 года. Бесплодие отмечено у 18 (75%), галакторея – у 23 (95,8%) женщин. У 21 (87,5%) пациентки имелись жалобы на головную боль, у 7 (29,1%) – на боли в молочных железах, у 1 (4,2%) – на головокружение, у 13 (54,2%) – на прибавку массы тела, у 18 (75%) – на снижение либидо. Средний возраст наступления менархе в среднем составил 13±0,2 года. Дебют нарушения менструального цикла в среднем проявился к 25±1,6-летнему возрасту. Длительность нарушения менструального цикла составила 8,2±1,3 года. Начало нарушения менструального цикла протекало по типу олигоменореи с постепенным увеличением интервалов между менструациями – у 19 (79,2%), в то время как внезапное возникновение аменореи отмечено у 5 (20,8%). У 5 (20,8%) пациенток в среднем после года приема оральных контрацептивов и у 3 (12,5%) после перенесенных тяжелых стрессовых ситуаций появились нарушения менструального цикла и выявлена гиперпролактинемия. По данным репродуктивного анамнеза, в группе имелось 35 беременностей, которые закончились нормальными родами в 37,1% случаев, искусственными абортами в 48,6%, самопроизвольными выкидышами в 11,4%, внематочной беременностью в 2,9%, что не превышает соответствующие показатели в общей популяции. Бесплодие имелось у 18 (75%) пациенток, частота первичного и вторичного бесплодия распредилилась поровну – по 50%. Галакторея выявлена у 23 (95,8%) женщин, средняя выраженность галактореи составила 2 балла, длительность галактореи 4±0,9 года. В исследуемой группе увеличение массы тела в сравнении с нормативными показателями отмечено у большинства пациенток: индекс массы тела (ИМТ) больше 26 у 14 (58,3%) пациенток, причем ИМТ выше 29 – у 10 (41,7%). Исходный уровень ПРЛ превышал значения верхней границы нормы в среднем в 6 раз: 3155,7±369,5 и 3192,4±359,6 мкМЕ/мл в двух определениях. Исходный уровень других гипофизарных гормонов (за исключением ЛГ, уровень которого был несколько снижен – 3,3±0,6 мМЕ/мл) был в пределах нормы: ФСГ – 6,5±0,6 мМЕ/мл, ТТГ – 2,2±0,3 мкМЕ/мл; уровень Т соответствовал нормальным показателям – 1,2±0,1нмоль/л. Курс терапии каберголина составил 24 нед, доза препарата подбиралась в соответствии с нормализацией уровня ПРЛ: 0,5 мг каберголина получали 9 (37,5%) пациенток, 1 мг – 10 (45,8%), 1,5 мг – 1 (4,2%), 2 мг – 3 (12,5%). На фоне лечения каберголином нормализация уровня ПРЛ произошла у 22 (91,6%) пациенток, причем к 4-й неделе лечения – у 9 (37,5%), к 8-й неделе – у 20 (83,5%), с 16-й недели – у 22 (91,6%). Однако сохранение нормальных значений пролактина через 6 месяцев после отмены терапии выявлено только у 1 (4,2%) больной. Динамика снижения уровня ПРЛ свидетельствовала о почти трехкратном уменьшении его после начала приема препарата уже через месяц (p меньше 0,0001) (табл. 1). Таблица 1. Динамика снижения уровня ПРЛ на фоне лечения каберголином (M±m; p меньше 0,0001)
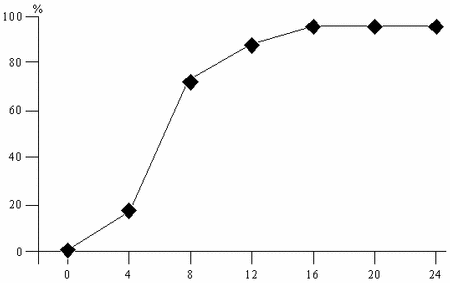
Значения ПРЛ через 6 мес наблюдения (после отмены терапии) составили 2617,1±423,1 мкМЕ/мл, что свидетельствует о тенденции к снижению его уровня в сравнении с исходными значениями (p больше 0,05). Восстановление ритма менструаций на фоне лечения каберголином наблюдалось у всех больных, за исключением 1 пациентки, у которой имелось сочетание гиперпролактинемии и гипергонадотропной аменореи. Менструальный цикл восстановился у большинства пациенток с 8-й недели лечения [на 4-й неделе – у 4 (16,6%), на 8-й неделе – у 17 (70,8%), на 12-й неделе – у 21 (87,5%), с 16-й недели – у 24 (95,8%) пациенток (рис. 1).
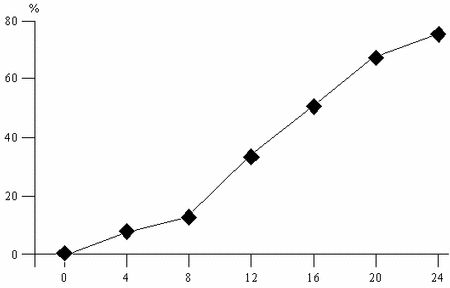
После отмены терапии регулярность менструального цикла постепенно исчезала. Так, на 28-й неделе (1-й месяц отмены каберголина) регулярный ритм менструаций сохранялся у 20 (84,2%) пациенток, на 32-й и 36-й неделях – у 19 (78,9%), на 40-й неделе – у 10 (42,1%), на 44-й неделе – у 8 (33,3%), на 48-й неделе – лишь у 5 (20,8%). До лечения у всех пациенток отмечалась стойкая ановуляция. На фоне лечения каберголином удалось достичь овуляторных циклов у 18 (75%) пациенток. На 4-й неделе лечения овуляторные циклы отмечались только у 2 (8,3%) пациенток, на 8-й неделе – у 3 (12,5%), на 12-й неделе – у 8 (33,3%), на 16-й неделе – у 12 (50%), на 20-й неделе – у 16 (66,6%), на 24-й неделе – у 18 (75%) (рис. 2).
В исследуемой группе беременность наступила у 6 пациенток, заинтересованных в беременности. У 3 пациенток беременность завершилась рождением здоровых, доношенных детей (1 девочка и 2 мальчика), у 1 пациентки – самопроизвольным выкидышем в срок 7–8 нед, у 1 пациентки прерыванием беременности по медицинским показаниям (патология развития плода) в 13 нед, у 1 пациентки – искусственным абортом в срок 7–8 нед. Если до лечения галакторея наблюдалась у абсолютного большинства пациенток – у 23 (95,8%), к концу курса лечения каберголином прекращения галактореи удалось достичь у 19 (82,6%) пациенток. К 24-й неделе лечения галакторея сохранилась у 4 (17,4%) пациенток, при этом выраженность галактореи у больных снизилась и составила в среднем 1 балл. К концу периода последующего наблюдения, через 6 мес после отмены терапии галакторея отмечалась менее чем у половины больных – у 10 (41,6%). Положительная динамика, по данным МРТ, отмечена у 18 (75,4%) пациенток: у 15 (62,5%) – тенденция к уменьшению размеров аденомы гипофиза и у 3 (12,5%) – образование кисты (табл. 2). Таблица 2. Динамика размеров аденомы гипофиза на фоне лечения каберголином (данные МРТ)
Примечание. p больше 0,05 в сравнении с показателями до лечения. При УЗИ гениталий у 1 пациентки выявлена миома матки, у 1 – внутриматочные синехии, у 1 – полип эндометрия, у 2 – картина хронического эндометрита. М-эхо до лечения в подавляющем большинстве случаев было линейным. На фоне проводимой терапии средние значения М-эхо составили 6 мм, что косвенно свидетельствовало о стимуляции функции яичников. В ходе исследования (до лечения и на фоне терапии) всем пациенткам проводилось общеклиническое обследование, включавшее клинический анализ крови, мочи, биохимический анализ крови, запись ЭКГ. В исследуемой группе не выявлено существенных отклонений исходных показателей, также отсутствовали сколь-либо значимые изменения показателей на фоне лечения. На протяжении всего исследования осуществлялся мониторинг АД и ЧСС. Артериальная гипотензия выявлена у 4 (16,6%) пациенток, артериальная гипертензия – у 1 (4,2%). Средние цифры АД у наблюдавшихся больных составили 110/70 мм рт. ст. На фоне лечения отмечалась тенденция к снижению систолического АД на 10 мм рт. ст., диастолического АД на 5 мм рт. ст. (p больше 0,05). Из побочных явлений на фоне приема каберголина наблюдались: слабость – у 8 (33,3%), головокружение – у 2 (8,4%), головная боль – у 1 (4,2%), сонливость – у 8 (33,3%), тошнота – у 2 (8,4%), боли в эпигастрии – у 1 (4,2%) пациенток. У 33% пациенток побочные явления прекратились в первый месяц приема препарата, у 76% наблюдались в процессе лечения в виде транзиторных, слабовыраженных явлений прекращения терапии в этих случаях не требовалось. Обращала на себя внимание низкая частота побочных эффектов со стороны желудочно-кишечного тракта. Желудочно-кишечные расстройства были крайне слабо выражены и прекратились у всех пациенток в первый месяц приема препарата. Побочные эффекты, включающие симптомы вегетососудистой дистонии (слабость, головокружение и др.) встречались у пациенток, склонных к артериальной гипотензии – с исходной гипотонией, либо у пациенток, у которых на фоне лечения произошло некоторое понижение АД. Обсуждение Действие аналогов дофамина при лечении гиперпролактинемии основано на их связывании со специфическими дофаминергическими Д2 рецепторами на поверхности лактотрофов (дофаминергическое действие). Это приводит к снижению уровня цАМФ и внутриклеточного Са++, и, таким образом, к подавлению секреции ПРЛ (быстрый эффект, наблюдаемый через несколько часов), а также снижению транскрипции гена ПРЛ и синтеза ПРЛ (медленный эффект, наблюдаемый через несколько дней) [9]. Исследования "бромокриптин-, квинаголид-устойчивых" пациентов выявило наличие различного числа и типов рецепторов или пострецепторных дефектов, вызывающих резистентность к лечению аналогами дофамина. Исследования культуры клеток этих аденом показали, что в них снижено число дофаминсвязующих участков и структурно изменены рецепторы. При соединении рецепторов с бромокриптином и квинаголидом в этих случаях закономерного ингибирования аденилатциклазы не происходит. Исследование кодирующего гена Д2 рецептора хромосомы 11 показало наличие 2 подтипов Д2 рецепторов Д2А и Д2В, которые кодируются отдельными экзонами и различаются по степени подавления аденилатциклазы. Это может объяснять наличие гетерогенности Д2 рецепторов, различие ответных реакций резистентных клеток аденомы. Эффективность лечения гиперпролактинемии оценивается по нормализации уровня ПРЛ (лабораторная или биохимическая эффективность), а также по восстановлению нарушений репродуктивной системы (клиническая эффективность): восстановление ритма менструации, овуляторных циклов, наступление беременности. Высокая эффективность каберголина может объясняться высоким (20-кратным) сродством рецепторов дофамина по сравнению с бромокриптином и выраженным пролонгированным действием. По нашим данным, снижение уровня ПРЛ более чем в 2 раза при лечении каберголином произошло у 24 (100 %) пациенток, отсутствие нормализации уровня ПРЛ условно отмечено у 2 (8,4%), причем об отсутствии нормализации с уверенностью можно говорить только в одном случае, так как у второй пациентки имелось лишь незначительное повышение содержания ПРЛ (806 мкМЕ/мл, при исходных цифрах 3785 мкМЕ/мл) после 3 мес нормализации уровня ПРЛ и приема конечной дозировки 1 мг в неделю. Как отмечено выше, дозировка каберголина варьировала от 0,5 до 2 мг в неделю, подбиралась индивидуально с учетом показателей содержания ПРЛ в сыворотке крови. Средняя дозировка каберголина составила 1±0,1мг в неделю. Контроль клинической эффективности показал восстановление регулярных менструальных циклов у большинства (у 70,8%) больных с 8-й недели лечения, а с 16-й недели – у абсолютного большинства пациенток (у 95,8%). В течение 3 мес отмены регулярность менструального цикла сохранялась у большинства женщин – у 19 (78%). Овуляции наступили у 75% пациенток, что полностью соответствует данным зарубежных авторов, которые выявили, что восстановление овуляторных менструальных циклов в течение 6-месячного периода у 71% пациенток, принимавших каберголин [15]. Наши исследования показали, что у большинства женщин – у 18 (75%) – овуляторные циклы восстановились только после 24-й недели приема препарата. Следовательно, прием препарата можно рекомендовать не менее 6 мес, а учитывая его пролонгированность действия, только через месяц после его отмены можно разрешать наступление беременности. Экспериментальные исследования показали, что каберголин не вызывает тератогенных или эмбриотоксических эффектов. Зарубежная литература представлена обнадеживающими, однако разрозненными и недостаточными данными по течению и исходам беременностей, индуцированных каберголином. Проведенные исследования не выявили увеличения частоты самопроизвольных абортов (10,2% от общего количества беременностей), не отмечено увеличения частоты врожденных аномалий развития (2,4%). Динамическое наблюдение за 107 детьми не выявило каких-либо отклонений в физическом и психическом развитии [17]. Наши данные продемонстрировали высокую эффективность каберголина в плане наступления беременности. Принимая во внимание, что через 1 мес после отмены терапии от беременности не предохранялись лишь 12 (50%) пациенток, а также наличие у 4 из них сочетанной (трубно-перитонеальной) формы бесплодия, можно говорить о том, что беременность наступила у 6 (75%) из 8 пациенток с изолированно эндокринной формой бесплодия, либо у 50% всех женщин, заинтересованных в беременности. Из 6 беременностей, индуцированных каберголином, 3 закончились рождением здоровых детей (в 1 случае через естественные родовые пути, в 2 случаях произведено оперативное родоразрешение в связи со слабостью родовой деятельности и миопией высокой степени тяжести), 1 закончилась самопроизвольным выкидышем в срок 7–8 нед, 2 – искусственным абортом. В 1 случае искусственный аборт произведен по медицинским показаниям на 13-й неделе беременности по поводу патологии развития плода. Данная первая беременность наступила у пациентки 37 лет, у которой диагностированы седловидная матка – опущение почки, а также первичный эпизод генитального герпеса. Отечественная и зарубежная литература представлена разнородными данными о частоте встречаемости галактореи у пациенток с гиперпролактинемией. В исследуемой нами группе абсолютное большинство пациенток (95,8%) предъявляли жалобы на наличие галактореи. К концу лечения у 4 (17,4%) из них сохранилась галакторея, причем выраженность последней значительно снизилась. Безусловно позитивным моментом является стойкое подавление галактореи у 14 (60,8%) пациенток и через 6 мес после отмены терапии. При динамическом МРТ-исследовании не получено достоверного, статистически значимого уменьшения размеров аденомы гипофиза на фоне лечения, однако выявлена тенденция к уменьшению размеров опухоли гипофиза. В то же время, по данным иностранной литературы, у большинства пациенток (у 85%) с макропролактиномами гипофиза при лечении каберголином происходит сокращение размеров опухоли вплоть до полного ее исчезновения у 82,3% пациенток [12]. По-видимому, эффективность консервативного лечения аденом гипофиза зависит от исходных размеров образования – чем больше размеры образования, тем будет более ощутима динамика. Нами выявлена некоторая корреляция между размером пролактиномы и степенью ее уменьшения. Так, отмечена прямая корреляция между разницей (динамика) размеров аденомы и исходными абсолютными значениями вертикальных/горизонтальных/сагиттальных размеров (по вертикальному размеру r = 0,5, по горизонтальному – r = 0,6, по сагиттальному отмечена слабая корреляция – r = 0,3). Примечательным и для многих пациенток позитивным моментом явилось снижение массы тела на фоне приема каберголина. Имелась тенденция к снижению ИМТ у наших пациенток при лечении каберголином в среднем на 1 кг/м2, однако динамика статистически недостоверна (p больше 0,05). Различная переносимость бромокриптина и каберголина объясняется селективностью их действия. Идентифицированы несколько подтипов дофаминергических рецепторов (D1 и D2 рецепторы в ЦНС и DA1 и DA2 рецепторы в кардиоваскулярной системе). Каждый дофаминергический препарат обладает сродством к определенным подтипам рецепторов, в связи с чем оказывает индивидуальное действие на эндокринную, центральную нервную и кардиоваскулярную системы [14]. Неселективность действия бромокриптина, обусловленная антагонистическим действием на D1-рецепторы, a1-адренорецепторы, серотониновые рецепторы, может приводить к появлению у 10–70% пациенток ряда побочных эффектов, таких как сонливость, головная боль, головокружение, ортостатический коллапс, тошнота, рвота, боли в эпигастрии [13]. Селективность аналогов дофамина II поколения (квинаголид) и в особенности высокая селективность к Д2 рецепторам лактотрофов современного агониста дофамина III поколения каберголина позволила значительно снизить частоту побочных эффектов и сократить частоту отказа от лечения до минимума. Согласно нашим данным, переносимость каберголина была значительно выше, чем бромокриптина: слабость отмечалась у 33,3% в сравнении с 64,7% пациенток при приеме бромокриптина, головокружение – у 8,3 и 35,3% соответственно, обмороков при лечении каберголином не отмечено, в то время как при лечении бромокриптином у 11,8% пациенток имелись обмороки, тошнота отмечалась – у 8,3 и 64,7%, боли в эпигастрии – у 4,2 и 11,8%. Выраженная пролонгированность действия каберголина обусловлена особенностями его фармококинетики, которая характеризуется быстрой абсорбцией его после однократного приема (концентрация ПРЛ в плазме здоровых людей значительно снижалась уже через 3 ч после назначения каберголина в дозе 0,2–0,6 мг), и медленной экскрецией препарата и его метаболитов. Достигнутый уровень ПРЛ сохранялся в течение 96 ч после назначения 0,2 мг и 168 ч после назначения 0,4 мг каберголина [16]. Каберголин обладает наибольшей пролонгированностью действия в сравнении с другими аналогами дофамина: продолжительность действия бромокриптина в среднем 8 ч, квинаголида 24 ч, каберголина более 168 ч. Значительная длительность действия каберголина позволяет назначать данный препарат 2 раза в неделю в отличие от схемы назначения бромокриптина (несколько раз в день). Это, в свою очередь, оптимизирует режим следования приему препарата. Так, согласно нашим данным, пропуски приема бромокриптина отмечали 30% женщин, в то время как пропусков приема каберголина не отмечалось; по данным литературы, пропуски приема препарата обнаружены у 44 и 18% пациенток соответственно [15]. Заключение В настоящее время препаратом выбора для лечения гиперпролактинемии, особенно опухолевого генеза, является современный аналог дофамина III поколения каберголин. Каберголин обладает рядом крайне важных терапевтических свойств: большой продолжительностью действия, высокой эффективностью, снижением частоты побочных эффектов. Это позволяет успешно назначать его пациенткам с гиперпролактинемией, в том числе с резистентностью к бромокриптину и квинаголиду или их непереносимостью. Однако требуются дальнейшие исследования, посвященные изучению влияния каберголина на плод и исход беременности. Крайне важно помнить, что на фоне приема каберголина и в течение ближайшего месяца после его отмены показано предохранение от беременности. Целесообразен индивидуальный подбор дозировки препарата (0,5–2 мг в неделю) с обязательным ежемесячным определением уровня ПРЛ. Длительность приема каберголина у пациенток с гиперпролактинемией при лечении бесплодия, учитывая сроки восстановления овуляций, должна составлять 6 мес, при лечении пролактином гипофиза либо при выраженнной гипофункции яичников – 1–2 года. Создание нового агониста дофамина каберголина позволило эффективно контролировать уровень ПРЛ и корригировать измененные функции репродуктивной системы у пациенток с гиперпролактинемией, в особенности опухолевого генеза. В.П. Сметник, Л.А. Марченко, А.А. Осипова Научный центр акушерства, гинекологии и перинатологии РАМН, Москва Литература 1. Вихляева Е.М. В кн.: Руководство по эндокринной гинекологии. М 1997; 343–360. 2. Герасимов Г.А. Дифференциальная диагностика и лечение аденом гипофиза и синдрома гиперпролактинемии. Автореф. дис. ... док. мед. наук. М 1990. 3. Дедов И.И., Мельниченко Г.А. Персистирующая галакторея-аменорея. М: Медицина 1985; 253. 4. Мельниченко Г.А., Серебрянский О.Ю., Романцова Т.И. Норпролак – новый агонист дофамина. Медицина для всех 1997; 1: 22–24. 5. Овсянникова Т.В. Патогенез, клиника, диагностика и отдаленные результаты лечения бесплодия при гиперпролактинемии у женщин. Дис. на соиск. ученой степени док. мед. наук. М 1990. 6. Сметник В.П., Тумилович Л.Г. Руководство Неоперативная гинекология . М 1998. 7. Colao A., Lombardi G., Landi M.C. et al. J Clin Endocrinol Metabol 1997; . 82 8: 2756. 8. Colao A., Loche S., Cappa M. et al. J Clin Endocrinol Metabol 1998; 83: 8: 2777–2780. 9. Conner P., Fried G. Acta Obstetrica and Gynecologica Scandinavica. 1998; 249–262. 10. Delgrange E., Maiter D., Donckier J. European Journal of Endocrinol 1996; 134: 4: 454–456. 11. Espinos J.J., Rodriguez-Espinosa J., Webb S.M., Calaf-Alsina J. FeRtil Steril 1994; 62: 926–931. 12. Ferrari C.I., Abs R., Bevan J.S. et al. Clinical Endocrinol 1997; 46: 4: 409–413. 13. Molitch M.E. Endocrinol Metab Clin NoRth Am 1992; 21: 877–901. 14. Philosophe R., Seibel M.M. Current Opinion in Obstetrics and Gynecology 1991; 3: 336–342. 15. Piscitelli G., Scanlon M.F., Polli A. Chester 1993. 16. Pontiroli A.E., VibeRti G.C., Mangili R. et al. British Journal of Clinical Pharmacology 1987; 23: 433–438. 17. RobeRt E., Musatti L., Piscitelli G., Ferrari C. Reproductive toxicology 1996; 10: 4: 333–337. 18. Sarapura V., Schlaff W. Curr Opin Obstet Gynecol 1993; 5: 360–367. 19. Webster J., Piscitelli G., Polli A. et al. N Engl J Med 1994; 331: 904–909. |
|||||||||||||||||||||||||||||||||||||||