
Информация для специалистов || Суперинфекции
ВАЖНЕЙШИЕ СУПЕРИНФЕКЦИИ ВИЧ/СПИД
Проф. Е.С.Белозеров
Классические инфекционные болезни вызывают патогенные микроорганизмы, представленные бактериями (в которую входят бактерии, кокки, спирохеты, актиномицеты, риккетции, микоплазмы), вирусами (входят вирусы семейств поквирусов, герпесвирусов, аденовирусов, паповавирусов, парвовирусов, ортомиксовирусов, парамиксовирусов, ретровирусов, буньявирусов, тогавирусов, коронавирусов, пикорнавирусов, ареновирусов и рабдовирусов), грибами (оомицеты, аскомицеты, базидиомицеты, дейтеромицеты) и простейшими (жгутиковые, саркодовые, споровики, ресничные). Помимо патогенных микроорганизмов существует группа условнопатогенных возбудителей, способных вызывать патологический процесс только у лиц с проявлениями иммунодефицита (оппортунистические инфекции). При этом прослеживается определенная связь между характером иммунодефицита и видом возбудителя оппортунистической инфекции (табл.56).
Таблица 56. Иммунодефицит и суперинфекции
|
И м м у н о д е ф и ц и т |
|
|
клеточный: - вирусы - простейшие - грибы |
гуморальный: - бактерии |
Определенная четко очерченная группа возбудителей ряда инфекций ассоциирует с развитой стадией ВИЧ-инфекции, она получила название “СПИД-ассоциируемые” заболевания, которые правильнее надо рассматривать как суперинфекции, ибо в каждом регионе имеют место свои особенности суперинфицирования. К примеру, едва ли классических в США представителей СПИД-ассоциируемой патологии – изоспориоз и гистоплазмоз можно отнести к постоянным спутникам ВИЧ-инфекции в России.
Среди суперинфекций ведущее место занимают микозы (пневмоцистоз, вызванный пневмоцистой сarinii, кандидоз, криптококкоз, кокцидиоидоз), заболевания, обусловленные группой герпесвирусов (простой герпес, опоясывающий герпес, цитомегаловиорусная инфекция, Эпштейна-Барр-вирусная инфекция, саркома Капоши), бактериальная инфекция (туберкулез, атипические микобактериозы, сальмонеллез), паразитозы (токсоплазмоз, криптоспоридиоз). По данным многих авторов, примерно у половины больных в клинике доминирует пневмоцистная пневмония, у четверти - саркома Капоши. Около 6% больных одновременно страдают и пневмоцистной пневмонией и саркомой Капоши. Часто встречаются инфекция, вызванная вирусами герпетической группы и кандидоз, но и нередки в клинике герпесвирусные инфекции, кандидоз, туберкулез и другие заболевания сочетаются с пневмоцистной пневмонией или саркомой Капоши.
В связи с тем. что наиболее характерные для ВИЧ/СПИД суперинфекции вызываются возбудителями разной степени патогенности, прослеживается определенная зависимость развития суперинфекций от степени иммунодефицита (рис. 22).
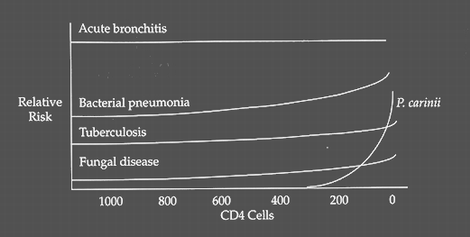
Рис.22. Взаимосвязь суперинфекций легких и степени иммунодефицита у больных ВИЧ/СПИД
ЗАБОЛЕВАНИЯ ГЕРПЕСВИРУСНОЙ ГРУППЫ
Герпесвирусные инфекции относятся к наиболее распространенным среди суперинфекций у больных ВИЧ/СПИД. Обусловленные вирусами простого герпеса (HSV), опоясывающего герпеса (HZV), цитомегаловируса (CMV) инфекционные заболевания были среди первых, выявленных при ВИЧ-инфекции. Вся группа герпесвирусов рассматривается как патогенетически связанная с ВИЧ-инфекцией. К особенности патологии, вызванной вирусами этой группы относится длительная латентная фаза после острого периода со способностью активизироваться в более позднее время с клиникой, специфичной для каждого вида вируса. Так, HSV I и II типов обусловливает рецидивы с поражением кожи и слизистых оболочек рта, гениталий и ректальной области с образованием язв, а также возможностью вируса диссеминировать с поражением центральной нервной системы. Именно с пандемией ВИЧ-инфекции связан рост генитального герпеса. CMV может обусловить пневмонию, энцефалит, ретинит, гастроэнтерит, поражение адреналовой системы у больных ВИЧ-инфекцией. Реактивация на фоне иммуносупресии HZV может обусловить диссеминацию, а вирус Эпштейна-Барр (EBV) нередко становится причиной волосатой лейкоплакии и лимфопролиферативного синдрома. Первичное заражение EBV больных ВИЧ-инфекцией может привести к малигнизации мышечной ткани. В табл. 57 представлены наиболее часто встречаются заболевания, обусловленные вирусами семейства Herpesviridae.
В целом семейство Herpesviridae представлено более видами 60 вирусов, из которых 6 видов вызывают заболевания у человека. Вирусы этой группы относятся к самым распространенным патогенам человека. По данным сероэпидемиологических исследований антитела к вирусам простого герпеса выявляются у 70-100 % взрослого населения, к вирусу Эпштейна-Барр - в 95%, цитомегаловирусу - в 60%. Герпесвирусная инфекция, как причина смерти от вирусных инфекций, занимает второе место (15,8%), уступая только ОРВИ (35,8%).
Инфекционный процесс, обусловленный вирусами этой группы также играет ведущую роль как причина непосредственной смерти у больных СПИД. Так летальность от герпетического энцефалита достигает 85%.
Трудность верификации герпесвирусной инфекции у больных СПИДом обусловлена в первую очередь тем обстоятельством, что в большинстве случаев вирусы находятся в организме в скрытой форме - бессимптомное вирусоносительство. Во-вторых, вирусы этой группы могут вызвать особую форму инфекционного процесса - медленную инфекцию.
Таблица 57. Клинические формы заболеваний, обусловленных вирусами группы Herpes
( по Schacker T., Corey L.,1997)
|
Вирус |
Первичная инфекция |
Реактивация после латенции |
| HSV- I |
Первичный HSV гингивостоматит HSV-энцефалит (редко) Неонатальная HSV-инфекция Генитальная HSV-инфекция |
Рецидивирующий орально-лабиальный герпес Рецидивирующий аногенитальный герпес HSV-энцефалит HSV-эзофагит HSV-гепатит |
|
HSV-II |
Генитально-ректальный герпес Неонатальный герпес Менингоэнцефалит Крестцовый радикулит Субклиническая инфекция |
Генитальный герпес HSV-менингит HSV-энцефалит (редко) Хроническая кожно-слизистая форма |
|
CMV |
Субклиническая инфекция Гетерофильно-негативный мононуклеоз |
CMV-ретинит CMV-колит/холангит CMV-пневмония (редко) CMV-адреналовая недостаточность Нарушение функции костного мозга |
| HHV-6 | Розеолезная сыпь |
Возможен гепатит Возможна интерстициальная пневмония у лиц с иммунодефицитом |
|
HHV-7 |
Возможна у детей экзантема |
Не идентифицировано |
|
EBV |
Инфекционный мононуклеоз Саркома мышц Энцефалит у новорожденныхЛимфоидная интерстициальная пневмония у детей |
EBV-ассоциированный лимфопролиферативный синдром EBV-обусловленная лимфома ЦНС |
|
KSHV (HHV-8) |
Не известно |
Ассоциация с саркомой Капоши Лимфома Болезнь Коссельмана |
Примечание: HSV - вирус простого герпеса; CMV - цитомегаловирус, HHV - человеческий герпесвирус; KSHV - с саркомой Капоши ассоциированный человеческий вирус.
Так, вирус простого герпеса является этиологическим фактором подострого герпетического энцефалита, вирус Эпштейна-Барр – хронического инфекционного мононуклеоза, CMV - вирусного поражения мозга.
Диагностика инфекции, вызванной герпесвирусами, на ранних стадиях развития заболевания, т.е. до появления клиники поражения жизненно важных органов, таких как печень, почки, легкие, весьма сложна. И вообще для всей группы герпесвирусов характерно или генерализованная форма болезни или отсутствие клиники. Поэтому без комплексного лабораторного подтверждения ранняя диагностика герпесвирусной инфекции у больных СПИДом практически невозможна. Выявление вируса или его компонентов является основным, а антител к вирусу - вспомогательным методом диагностики группы герпесвирусных инфекций.
Инфекция, вызванная вирусом простого герпеса - самая распространенная среди людей - 80-95% взрослого населения являются пожизненными носителями вируса. Поэтому на фоне вторичного иммунодефицита, вызванного ВИЧ, инфекционный процесс у взрослых и детей старше 1 мес., обусловленный эндогенным вирусом простого герпеса, приобретает генерализованный характер в виде герпетического бронхита, пневмонии, эзофагита и относится к СПИД-ассоциируемой патологии. Обычную локализованную форму - Herpes labialis при длительности, превышающей 1 мес. также следует рассматривать как СПИД-индикаторное заболевание. В диагностике помогает динамическое наблюдение за титром вирусспецифических антител.
В группе вирусных СПИД-индикаторных заболеваний наиболее трудна диагностика цитомегаловирусной инфекции, хотя и встречается она у ВИЧ-инфицированных довольно часто. Цитомегаловирусная инфекция относится к одному из самых тяжелых оппортунистических заболеваний при СПИД, выявляется у 20-40% больных СПИДом и у каждого пятого является непосредственной причиной смерти. Однако клиника CMV-инфекции довольно полиморфна, часто не имеет специфических черт и протекает под маской других заболеваний. По данным В.И.Шахгильдян и соавт.(1996) манифестация CMV-инфекции носит генерализованный характер и наиболее часто проявляется ретинитом, миелитом, эрозивным язвенным колитом. Ранним проявлением активации CMV является тромбоцитопения.
Для выявления CMV-инфекции предложен ряд серологических, вирусологических, морфологических методик, но большинство их малоинформативно, тем более, что нужно не только выявить вирус, но и доказать его этиологическую роль в клинике болезни и необходимости противовирусной терапии.
В диагностике у ВИЧ-инфицированных наиболее информативно наличие в крови ДНК CMV в высокой или средней степени концентрации, но в сочетании с длительной, свыше 3 мес. персистенцией анти-CMV класса IgM и обнаружение вируса в моче.
Таким образом, вирусы герпетической группы, широко распространенные в виде латентной формы инфекционного процесса среди населения, в условиях иммунодефицита, вызванного ВИЧ, приобретают генерализованное течение и часто служат непосредственной причиной смерти больных СПИДом.
Опоясывающий герпес. Нerpes zoster вызывается Varicella-zoster virus. Это вирус герпеса тип 3, являющийся одновременно возбудителем ветряной оспы. Вирус является нейродермотропным, поражая клетки центральной и периферической нервной системы. Первично или после перенесенной ветряной оспы вирус через кожу и слизистые и далее по лимфатической и кровеносной системам проникает в межпозвоночные узлы и задние корешки спинного мозга, где он может длительное время сохраняться в латентном состоянии, как это доказано при инфекции простого герпеса.
При снижении иммунологической резистентности организма под влиянием каких-либо заболеваний, интоксикации, приема иммунодепрессантов латентная инфекция активизируется. Наиболее тяжелые генерализованные формы опоясывающего герпеса наблюдаются у больных лейкозами, лимфогранулематозом, злокачественными новообразованиями, ВИЧ-инфекцией, а также у лиц, получавших кортикостероиды или рентгенотерапию. Активация инфекции сопровождается развитием вирусного ганглионеврита с поражением межпозвоночных ганглиев или ганглиев черепных нервов, а также задних корешков. В тяжелых случаях в процесс вовлекаются передние и задние рога, белое вещество спинного мозга, головной мозг, обусловливая менингоэнцефалит. Вирус опоясывающего герпеса может поражать вегетативные ганглии, вызывая нарушения функции внутренних органов.
Таким образом, при опоясывающем герпесе на первый план выступают нейротропные свойства вируса, в отличие от ветряной оспы, при которой более выражена эпителиотропность. Изменения в эпителии и дерме при опоясывающем герпесе аналогичны изменениям при простом герпесе. В нервной системе - воспалительная инфильтрация лимфоцитами, плазматическими клетками и кровоизлияниями в нервных узлах, с последующим развитием дистрофии ганглиозных клеток и нервных волокон.
Инкубационный период при опоясывающем герпесе может составлять многие годы от момента, когда вирус впервые попадает в организм. В клинике к основным проявлениям болезни относят болевой синдром по ходу пораженных нервных ветвей, повышение температуры, ощущение покалывания, жжения, зуда, слабости, головную боль. По ходу отдельных нервов появляются ограниченные розовые пятна до 3-5 см в диаметре. К концу первых или на вторые сутки сыпь претерпевает эволюцию от папулы до тесно расположенных пузырьков величиной 0,1-0,3 см и более, наполненных прозрачным содержимым. Появление пузырьков может происходить одновременно, в результате чего общий вид высыпаний может быть полиморфным. Количество очагов поражения колеблется от одного до нескольких, тесно прилегающих друг к другу, образуя сплошную ленту. Через несколько дней содержимое пузырьков мутнеет, эритематозный фон бледнеет. К 6-8 дню пузырьки подсыхают, образуя корочки, которые к 3-4 неделе отпадают, оставляя легкую инфильтрацию. У части больных (чаще в пожилом возрасте) неврологические боли могут продолжаться в области поражения нерва в течение нескольких месяцев после заживления кожных проявлений. Кожные элементы, как правило, сопровождаются увеличением и болезненностью регионарных лимфоузлов. В зависимости о превалирования тех или иных симптомов различают следующие формы болезни: ганглиокожная, гангренозная (некротическая), опоясывающий герпес с поражением вегетативных ганглиев, ушная и глазная, менингоэнцефалитическая, диссеминированная.
Наиболее распространена ганглиокожная форма. Заболевание начинается остро, с повышения температуры, появлением симптомов общей интоксикации и интенсивных жгучих болей по месту будущих высыпаний. Локализация болей и появление характерной сыпи соответствуют пораженным нервам, чаще межреберным, и носят опоясывающих характер. Интенсивность болей усиливается при малейшем прикосновении к коже, при движении, охлаждении. Содержимое пузырьков прозрачно, но в последующем мутнеет из-за появления в жидкости большого количества нейтрофилов. В дальнейшем пузырьки засыхают и превращаются в корочки, часть которых может самопроизвольно или в результате травмирования вскрыться с образованием эрозий. После того как корочки отпадают и наступает эпителизация эрозий, на коже остается временное покраснение. У некоторых пациентов отсутствует болевой синдром, а иногда болезнь характеризуется неврологическими болям при отсутствии сыпи.
Второе место по частоте локализации болезни занимает кожа лица и головы, особенно ветви тройничного нерва. Заболевание начинается остро, с общих симптомов интоксикации и повышения температуры. При глазной форме поражается гассеров узел, поэтому высыпания локализуются по ходу ветвей тройничного нерва на слизистых глаза, носа, коже лица. Могут развиться кератит, ирит, глаукома. У части больных наблюдается паралич лицевого нерва и невральгия тройничного нерва с продолжительностью несколько недель.
Гангренозная форма возникает в случае резкого угнетения иммунитета. Характеризуется выраженными болями, глубоким поражением кожи с последующим рубцеванием, образованием мелких тесно сгруппированных струпов или сплошного черного струпа на фоне розовых пятен. Течение гангренозной формы длительное, до 6-8 недель.
Менингоэнцефалит, вызванный вирусом опоясывающего герпеса встречается редко и является вторичным проявлением. У большинства больных отмечается повышение температуры до 38° С. Головная боль может проявиться еще до высыпания и носить постоянный характер. Заболевание проявляются общемозговыми и очаговыми симптомами разной выраженности. Летальность до 60%.
Простой герпес (Herpes simplex) - вирусное заболевание, передающееся контактно-половым, воздушно-капельным путями и характеризующееся поражением кожи, слизистых оболочек, нередко тяжелым поражением центральной нервной системы, глаз и внутренних органов. Возбудитель (Herpes virus) относится к семейству герпеса. Наиболее распространены 2 типа HSV (HSV-1 и HSV-2). Вирусы развиваются внутриклеточно, образуя внутриклеточные включения (рис. 49 и 50). В естесственных условиях источником инфекции является только человек. Входные ворота - неповрежденные или травмированные кожные покровы и слизистые оболочки губ и ротовой полости, желудочно-кишечного тракта, носа, конъюнктивы, гениталий. Передача возбудителя как вертикальная (врожденная трансплацентарная инфекция), так и горизонтальная - воздушно-капельным, контактно-бытовым, а также половым путем. Восприимчивость населения к HSV необычайно высока. Первичное заражение обычно происходит внутриутробно или в раннем возрасте, и у большинства протекает бессимптомно, лишь у 1% заразившихся клиническая картина развивается сразу после заражения. В дальнейшем до 90% взрослого населения к 50 годам, инфицированного в раннем детском возрасте или в более позднее время, становится пожизненными носителями вируса. Определенное эпидемиологическое значение в распространении герпетической инфекции могут иметь различного рода медицинские манипуляции. Современные сложные хирургические операции, особенно пересадки органов и костного мозга, сопровождающиеся массивными переливаниями свежей крови, а также длительная иммунодепрессивная и лучевая терапия нередко приводят либо к активации латентной HSV-инфекции, либо к первичному заражению больных при контакте с вирусоносителями или инфицированным материалом. Заболевание выявляется повсеместно, в виде спорадических случаев, с максимумом заболеваемости в холодные месяцы. Эпидемии не наблюдается, за исключением небольших вспышек в дошкольных учреждениях, школах, больницах.
Возбудитель проникает в организм через слизистые оболочки или поврежденные и травмированные кожные покровы. На месте входных ворот образуются везикулярные высыпания. В дальнейшем, независимо от механизма заражения, развивается первичная вирусемия. В гематогенном распространении вируса важную роль играют эритроциты и лейкоциты. В лейкоцитах HSV можно персистировать длительное время. Гематогенная диссеминация вируса может привести к развитию генерализованного герпеса, особенно у лиц с первичным или вторичным иммунодефицитами.
После вторичной вирусемии HSV активно размножается в чувствительных органах и тканях. Выброс вируса из пораженных органов и тканей в кровяное русло приводит к развитию вторичной вирусемии и острой стадии герпетической инфекции. Длительность острой стадии обычно колеблется 7-14 дней. В большинстве случаев у лиц, перенесших острую стадию первичной герпетической инфекции, наступает полное клиническое выздоровление. В организме стимулируется гуморальный и клеточный иммунитет, что однако, не освобождает организм от вируса. Первичная герпетическая инфекция, независимо от клинической формы проявления и места локализации поражения, сопровождается проникновением HSV в ганглии дорсальных корешков, и, реже, в вегетативные ганглии и завершается их острой инфекцией, с последующим установлением латентности в нейронах. Механизмы перехода острой герпетической инфекции в латентную, в которой HSV способен к длительному существованию в таком состоянии, точно не установлены. Переход в латентную форму обусловлен действием ряда факторов как со стороны вируса, так и организма хозяина, выработавшихся в течение длительной эволюции взаимоотношений. Нарушение равновесия между клеткой и вирусом, под влиянием провоцирующих факторов, приводит к увеличению репликации HSV, что выражается в обострении инфекции. Затем между вирусом и клеткой устанавливается новое равновесие, в результате чего образование HSV прекращается.
Клинически наблюдается герпетическое поражение кожи, слизистых оболочек с образованием язв, а также острые респираторные заболевания, генитальный герпес, герпетические поражения глаз, герпетический энцефалит, висцеральные формы герпетической инфекции.
Герпетическое поражение кожи может наблюдаться на любом участке кожного покрова. Однако наиболее характерными местами локализации высыпаний являются губы, крылья носа, щеки, лоб, уши, ягодицы, задняя и внутренняя поверхность бедер, предплечья, кисти. Типичная форма заболевания характеризуется мелкими сгруппированными везикулярными высыпаниями. До начала высыпаний нередко беспокоит чувство зуда, жжения, болезненности. Герпетические пузырьки содержат серозную жидкость, которые вскрываются, образуя медленно эпителизирующие эрозии. Через 6-9 дней на месте высыпаний остается розовое пятно, со временем исчезающее. Герпетические высыпания могут сопровождаться явлениями регионарного лимфаденита.
К атипичным формам герпеса относятся абортивная, отечная и эостериформная. Абортивная форма протекает без образования пузырьков и ограничивается появлением на коже округлых розовых пятен с нечеткими границами. Иногда на этих местах ощущается зуд, чувство жжения, но сыпь не появляется. При папулезной форме высыпания имеют форму ярко-розовых узелков величиной с булавочную головку. Отечная форма кожного герпеса характеризуется четко очерченной отечностью тканей без образования везикул. Зостериформный кожный герпес характеризуется образованием элементов высыпаний по ходу нерва и сопровождается невральгией. Наиболее редко встречаются, но тяжело протекают геморрагически-некротическая и эрозивно-язвенная формы заболеваний. Отличительная особенность этих форм - длительно незаживающие обширные язвенные поверхности. Такая форм герпеса имеет, как правило, внезапное острое начало - подъем температуры до 40° С, появление симптомов интоксикации, вплоть до нарушения сознания. Высыпания занимают обширные поверхности и сопровождаются зудом, жжением, лимфангитом. Высыпания превращаются в пустулы. Нередко в патологический процесс вовлекаются слизистые оболочки и внутренние органы.
Герпетическое поражение слизистых чаще всего протекает в виде острого герпетического стоматита или хронического рецидивирующего герпетического стоматита. Наиболее часто встречается острый стоматит у детей. Заболевание длится 10-16 дней и характеризуется симптомами общей интоксикации и местными проявлениями слизистой полости рта. При легкой форме- это гиперемии, небольшой отек десен, единичные элементы в виде некроза эпителия. Среднетяжелая форма характеризуется выраженной интоксикацией, лимфаденитом, повышением температуры. Элементы множественны, высыпают как в полости рта, так и на коже. Характерны выраженный гингивит, кровоточивость десен.
Хронический герпетический стоматит характеризуется постоянной болезненностью слизистой оболочки полости рта. Элементы сгруппированы, отмечаются гиперсаливация, гиперемия, гингивит.
Герпетические поражения гениталий мужчин и женщин распространены во всех странах мира, отмечается тенденция роста их количества. По особенностям клинической картины и течения процесса генитальный герпес делят на острый (первичный), хронический (рецидивирующий) и атипичный.
Острый генитальный герпес у женщин характеризуется типичными герпетическими высыпаниями на коже больших и малых половых губ, промежности, слизистой влагалища, шейки матки, а у мужчин- на коже и слизистой полового члена, мошонки и промежности. Генитальный герпес проявляется гиперемией, отечностью, язвами различной величины, контактными кровотечениями. Длительность заболевания 8-10 дней.
Хронический рецидивирующий генитальный герпес характеризуется длительным и упорным течением. Клиническая картина характеризуется частыми обострениями и периодами ремиссии. Эксудативные процессы выражены менее интенсивно, однако заживление язв протекает более длительно. Ряд исследователей относят генитальный герпес к так называемым "болезням поведения", т.к. его распространению способствуют беспорядочная половая жизнь, алкоголизм и т.д. Особенно важен социальный аспект заболевания, поскольку генитальный герпес наиболее опасен для беременных женщин в связи с возможностью генерализованной инфекции у новорожденных.
В настоящее время подробно изучены и описаны следующие герпетические заболевания глаз: кератоиридоциклиты (кератоувеиты), иридоциклиты, увеиты, хориоретиниты, флеботромбозы, невриты зрительного нерва. Для этих тяжелых герпетических поражений глаз характерны ряд общие признаки: частая связь заболеваний глаз с инфекционным заболеванием, сопровождающимся лихорадкой; наличием сопутствующих герпетических высыпаний на коже лица и слизистых губ; нейротрофический характер поражения (понижение чувствительности роговицы глаза при кератите); невральгические боли по ходу ветвей тройничного нерва.; замедленная регенерация; безуспешность антибактериальной терапии; склонность к рецидивам.
Энцефалиты вирусной природы не так часты, но тяжесть клиники, летальность исхода и высокий процент инвалидности среди выживших определяют исключительную их актуальность. Вирусные энцефалиты распространяются в основном спорадически и их этиологическими факторами являются вирусы простого герпеса, опоясывающего герпеса, герпеса обезьян, цитомегаловирус, вирус Эпштейна-Барр и другие.
В странах умеренного климата герпетический энцефалит встречается наиболее часто. Но с низким уровнем вирусологической диагностики они, как правило, не расшифровываются. Тем более, что ранний и достоверный диагноз может быть установлен только при исследовании биопсийного материала мозга или жидкости из мозговых желудочков. Прогноз болезни зависит от сроков диагностики и своевременности лечения.
Клинически герпетические поражения центральной нервной системы протекают в одной из пяти форм: а) субклиническая; б) герпетический менингит; в) слабовыраженный диффузный энцефалит; г) тяжелый диффузный менингоэнцефалит; д) локальный энцефалит с плохим прогнозом.
Субклинические, или малые формы герпетической инфекции протекают торпидно, с малой симптоматикой, но со временем могут привести к хроническим нервным заболеваниям, психическим расстройствам. Допускается, что агрессивная психопатия связана с герпетической инфекцией.
Герпетический менингит встречается не часто. Протекает заболевание в виде типичного асептического или лимфоцитарного менингита с минимальным вовлечением в воспалительный процесс вещества мозга. Описаны данные эпидемии из 56 случаев герпетического менингита. Вирус у таких больных выделяется из спинномозговой жидкости, чаще выделяют 1 тип вируса обычного герпеса.
Диффузные энцефалиты обычно протекают доброкачественно и с хорошим прогнозом. Диагностируются они по 4-кратному нарастанию титра антител против вируса простого герпеса. Но при этом возможна и диагностическая ошибка, ибо герпетические инфекции часто наслаиваются на другое заболевание. Избежать диагностической ошибки позволяет выделение вируса из спинномозговой жидкости. Тяжелые диффузные менинго-энцефалиты и локальные энцефалиты с плохим прогнозом составляют группу так называемых истинных герпетических энцефалитов, протекающих тяжело и с летальностью у 60% заболевших. Уже с первых дней заболевание протекает тяжело, что обусловлено явлениями острого некротического энцефалита. В стационар поступают больные, не ориентирующиеся в пространстве, вследствие аффекта в поведении, у них может отсутствовать память, а когда процесс приобретает катастрофический характер, больной поступает в коме. У больных этими тяжелыми формами герпетического энцефалита развивается клиника отека мозга, повышение внутричерепного давления. Клинически в начале болезни трудно дифференцировать герпетический энцефалит с туберкулезным менингитом, абсцессом и опухолью мозга. Проведенная люмбальная пункция помогает провести дифференциальный диагноз. Хотя исследование спинномозговой жидкости не обеспечивает постановку диагноза герпетического энцефалита, но имеет важное значение в исключении других видов инфекции.
Изменения спинномозговой жидкости при герпетическом энцефалите проявляется чрезвычайно нестабильным лимфоцитарным плеоцитозом - от нескольких клеток до 1000 и более в 1 мл.
Хотя интерпретация серологических исследований всегда дискутабельна, тем не менее нарастание антител в сыворотке крови служит определением, облегчающим диагностику. Более достоверно обнаружение антител в спинномозговой жидкости и сравнение соотношения антител в сыворотке крови и спинномозговой жидкости. В норме антитела к вирусу могут быть в сыворотке крови, но их не бывает в спинномозговой жидкости.
Висцеральные формы герпеса - герпетический гепатит, герпетические поражения желудочно-кишечного и респираторного трактов. Развитию герпетического гепатита способствует нарушение иммунного статуса. Клинически герпетический гепатит мало отличается от заболевания, вызванного другими вирусами, но помимо клиники острого гепатита характерно развитие стоматита, лихорадки, лейкопении. Позже присоединяются профузные кровотечения и развитие ДВС-синдрома.
Герпетические поражения респираторного тракта проявляются очаговой и интерстициальной пневмонией. Заболевание начинается с появления герпетических высыпаний на коже и слизистых. Затем развивается картина пневмонии - повышение температуры выше 38,5° С, кашель с мокротой, боли различной интенсивности, одышка, слабость. Герпетическая пневмония часто сочетается с герпетическим трахеитом, трахеобронхитом, эзофагитом.
Поражение желудочно-кишечного тракта чаще протекает в виде герпетического эзофагита, клинически он характеризуется гиперемией, отечностью слизистой, кровоизлияниями в слизистую оболочку, эрозиями, некрозом. Больные жалуются на изжогу, чувство жжения за грудиной, дисфагию, снижение массы тела. Наиболее опасными осложнениями являются - кровотечение и перфорация.
Диагностика герпетической инфекции основывается на характерной симптоматике и подтверждается серологическими или выделением вируса. Поверхностные герпетические поражения кожи и слизистых оболочек обычно легко распознаются. Наиболее информативными являются серологические методы. при энцефалите антитела обнаруживаются в спинномозговой жидкости.
Лечение герпесвирусных инфекций базируется на химиотерапии, иммунотерапии и их комбинаций. Новым направлением антивирусной терапии последних лет является синтез соединений, способных утилизировать вирусспецифические ферменты. Последние в зависимости от механизма действия классифицируются на группы: а) аномальные нуклеотиды, превращающиеся в активные при помощи вирусспецифической тимидинкиназы; б) ингибиторы активности вирусспецифической ДНК-полимеразы и синтеза вирусных ДНК: в) ингибиторы с другими механизмами противовирусного действия.
Аномальные нуклеозиды являются антиметаболитами, это неприродные соединения, способные включаться в синтез вирусной ДНК, приводя к образованию дефектного генома вируса. Первым из этой группы синтетических нуклеозидов был и остается ведущим до сих пор ацикловир (зовиракс), синтетический аналог гуанозина (ациклогуанозин), созданный в 1974 году. Так как гуанозин относится к одному из самых частых концевых и внутренних нуклеозидов ДНК герпесвирусов, ацикловир оказывает высокую терапевтическую активность. В организме инфицированного герпесвирусами человека ацикловир влияет на репликационные ферменты герпесвирусов, обеспечивающих воспроизводство новых вирусных ДНК, при этом: а) он высокоспецифичен ферментам только герпесвирусов, чем обусловлена высокая избирательность его противогерпетического действия и невмешательство в биохимические процессы клеток организма; б) тимидинкиназа (гуанилаткиназа) герпесвирусов в тысячи раз быстрее, чем клеточная, связывается с ацикловиром, в связи с чем препарат накапливается толко в инфицированных клетках (в неинфицированных клетках его содеожание не более1%) и этим объясняется полное отсутствие у ацикловира цитотоксических, тератогенных и мутагенных свойств; в) ДНК-полимераза герпесвирусов ошибочно включает фосфорилированный ацикловир вместо естественного дезоксигуанозинтрифосфата в концевые участки синтезируемых новых вирусных ДНК.
Даже если ацикловир поступает в организм не в первые 2 суток инфекционного процесса, т.е. не на начальных этапах синтеза ДНК, он попадает в состав других, не концевых участков цепи “дочерней” ДНК, в силу чего образуются дефектные – ДНК вирусные частицы, не способны реплицироваться, а поэтому процесс репродукции герпесвирусов останавливается, новые генерации вирусов не образуются, распространение инфекции прекращается.
К сожалению, особенности тимидинкиназы отдельных штаммов герпесвирусов или недостаточная биодоступность ацикловира при пероральном приеме препятствуют эффективности его у всех больных. Ацикловир-резистентные штаммы герпесвирусов выявляются у 3-5% иммунокомпетентных больных с острым и рецидивирующими герпесвирусными заболеваниями, а у больных с иммунодефицитами ацикловир-резистентные штаммы герпесвирусов выявляются в 2 раза чаще (у 7,6-10%), у больных ВИЧ-инфекцией - в 18%.
Вторую группу препаратов, применяемых в терапии герпесвирусных инфекций, представляют лекарственные средства, которые не действуют непосредственно на вирус, но изменяют метаболизм клетки так, что репродукция вируса становится невозможной. Наиболее часто, используемые для этой цели интерферон и его индукторы отличаются универсальным противовирусным эффектом. В последние годы разработана довольно большая группа индукторов эндогенного интерферона, которые все чаще используют вместо самих интерферонов. У больных ВИЧ-инфекцией они имеют предпочтение перед самими интенферонами в связи с тем, что помимо провивовирусного обладают иммуномодулирующим эффектом и прекрасно сочетаются с другими медикаментозными средствами.
Наиболее распространенные средства терапии и профилактики герпетической инфекции представлены в табл. 58.
Таблица 58. Средства терапии и профилактики герпетической инфекции
|
I. Противовирусные препараты |
|
|
А. Аномальные нуклеотиды |
Б. Специфические ингибиторы |
| Ацикловир (Виролекс, Зовиракс) | Бонафтон, Риодоксол, Флореналь, |
| Валцикловир (Валтрекс) | Оксолин, Алпизарин, Флакозид, |
| Фамцикловир (Пенцикловир) | Тромантодин, Дезоксирибонуклеаза, |
| Ганцикловир, Видарабин, Цитарабин, | Полирем, Теброфен, Пандавир, |
| Рибавирин, Идоксиуридин, | Хелепин |
| Трифтортимидин, Фоскарнет |
|
|
II. Средства иммунозаместительной и интерферонозаместительной терапии |
|
|
А. Специфические гамма- и иммуноглобулины |
Б. Интерфероны и их индукторы |
| Человеческий иммуноглобулин | Человеческий лейкоцитарный интерферон |
| Цитотек (ФРГ) | Реаферон, Ларифан, Ридостин, |
| Интраглобулин (ФРГ) | Циклоферон, Лейкинферон, Камедон, |
| Пентаглобулин (ФРГ) | Интрон А (США), Роферон-А (Швейцария) |
| Везикбулин (Болгария) | Веллферон (Великобритания), Кагоцел |
|
III. Герпетические вакцины |
|
|
(а) Живые; (б) Инактивированные; (в) Рекомбинантные |
|
Разработано несколько комплексных программ по контролю за тяжелыми и рецидивирующими герпесвирусными заболеваниями, основанные на сочетании или последовательном применении химиотерапии и иммунотерапии герпесвирусных болезней. В качестве примера приводим программу комплексной системной терапии герпетической инфекций (табл. 4), разработанную группой Санкт-Петербургских специалистов (Исаков В.А. (1991).
Таблица 59. Принципы этапного лечения и профилактики герпетической инфекции
| Этапы | Мероприятия |
| I этап – лечение в острый период болезни (рецидив) |
1. Противогерпетические препараты (внутривенно, перорально, местно).
Обязательное увеличение дозы противогерпетических химиопрепаратов (в 2
раза по сравнению с лицами с нормальной иммунной системой) и
продолжительности курса лечения и профилактики (недели, месяцы) у лиц с
ИДС. 2. Природные антиоксиданты (витамины Е и С), курс 10-14 дней. 3. В случае выраженного экссудативного компонента показаны ингибиторы простогландинов (Индометацин и др.), курс 10-14 дней. 4. Антивирусные (этиотропные) химиопрпараты с различным механизмом действия применяется в сочетании с иммунобиологическими средствами: препараты ИФН или его индукторы (циклоферон), иммуномодуляторы. |
| II Этап – терапия в стадии ремиссии, после стихания основных клинических проявлений (ранняя реконвалесценция) |
Основная цель – подготовка больного к вакцинотерапии. Иммуномодуляторы (возможно те же, что и в остром периоде). Адаптогены растительного происхождения. При выраженной иммуносупрессии – гормоны тимуса (Тималин и др.) коротким курсом. |
|
III Этап – специфическая профилактика рецидивов герпетической инфекции с использованием герпетических вакцин (инактивированных, рекомбинантных) |
Цел вакцинации – активация клетосного иммунитета, его иммунокоррекция и специфическая десенсибилизация организма. Этот этап наступает после достижения стойкой клинико-иммунологической ремиссии (если это оказывается возможным). |
|
IV – Диспансерное наблюдение и реабилитация больных герпетической инфекцией |
|
Преимущества комплексной терапии герпетической инфекции заключаются в следующем: а) сочетанное применение противогерпетических химиопрепаратов и иммунобиологических средств обеспечивает синергидный эффект; б) снижение дозы противовирусного химиопрепарата, а, следовательно, сокращение вероятности развития побочных эффектов, уменьшение токсического воздействия на организм больного; в) снижение вероятности возникновения устойчивых штаммов герпесвирусов к данному препарату; г)достижение иммунокорригирующего эффекта; д)сокращение продолжительности острого периода болезни и сроков лечения.
Цитомегаловирусная инфекция (СМV-инфекция). ХотяCMV-инфекция известна давно, вирус выделен в 1956 году. отличительная особенность CMV – образовывать гигантские (цитомегаловирусные) клетки, содержащие тельца включений.
Заболевание относится к одной из самых тяжелых суперинфекций СПИДа, выявляется у 20-40% больных и у каждого пятого является непосредственной причиной смерти (Landini M.,1993). Однако клиника CMV-инфекции довольно полиморфна, часто не имеет специфических черт и протекает под маской других заболеваний. У человека с нормальной функцией иммунной системы CMV-инфекция имеет преимущественно латентное течение, а манифестация характеризующееся чрезвычайным многообразием клинических проявлений. Вирус цитомегалии может вызвать как системное заболевание (мононуклеоз, генерализованная цитомегалия), так и поражения отдельных органов: печень, легкие, головной мозг, сердце, мочеполовые органы, слизистую желудочно-кишечного тракта и др.
Резервуаром и источником цитомегаловирусной инфекции является больной человек и вирусоноситель. Вирус может выделяться в окружающую среду со слюной, материнским молоком, спермой, обнаружен в вагинальном секрете, слезах, крови. Обнаружение CMV в сперме и вагинальном секрете, а также распространение его по типу венерических заболеваний подтверждает возможность передачи вируса по "вертикали". Доказан трансплацентарный путь передачи инфекции, не исключается передача вируса при переливании крови и при трансплантации органов. Заражение ребенка CMV может происходить и перинатально во время родов, у рожениц в случае поражения CMV-инфекцией шейки матки. Заболеваемость цитомегаловирусной инфекцией эндемична и не подвержена сезонным колебаниям.
Цитомегаловирусная инфекция широко распространена, у 50-80% взрослых обнаруживаются антитела к CMV. У умерших детей новорожденного и раннего возраста в 5-15% выявляется цитомегаловирусная инфекция в виде генерализованной формы и в 10-30% в виде локализованной. CMV способен длительное время сохраняться в организме человека в латентной и субклинической формах. При этом инфицированные лица могут годами заражать окружающих.
CMV проникает в организм через верхние отделы респираторного тракта и слюнные железы, не оставляя на месте внедрения каких-либо изменений. Вирус обладает тропизмом к клеткам слюнных желез, в связи с чем при локализованных формах он обнаруживается в тканях слюнных желез. Проникнув в организм, CMV сохраняется в нем на протяжении всей жизни, выделяясь с мочой и слюной. Установлен тропизм CMV к лейкоцитам крови, который свойственен и многим другим вирусам. Разные органы могут быть поражены неодинаково. В ответ на внедрение развивается иммунная перестройка организма. CMV является слабым индуктором интерферона, что может служить одной из причин хронического заболевания, протекающего бессимптомно или субклинически.
В зависимости от времени инфицирования цитомегаловирусную инфекцию классифицируют на врожденную и париобретенную, по клиническим проявлениям она подразделяется на латентную, субклиническую и клинически выраженную формы. Последняя может протекать по типу острой, подострой и хронической инфекции. Приобретенная цитомегаловирусная инфекция может быть локализованной и генерализованной.
Латентная и субклиническая формы обычно не имеют какой-либо четкой симптоматики. Наблюдаются симптомы, напоминающие легкое течение гриппа или неясный субфебрилитет. Диагностика этих форм основывается на данных лабораторных исследований.
Приобретенная инфекция у взрослых и детей не сопровождается поражением ЦНС (как это свойственно врожденной форме) и часто протекает по типу мононуклеозоподобного варианта, сопровождаеся лихорадкой, катаральными явлениями, увеличением шейных и подчелюстных лимфоузлов, а также отеком и болезненностью околоушных слюнных желез. В крови - лейкоцитоз с увеличением как нейтрофилов, так и атипичных лимфо-моноцитов, при отрицательных серологических пробах на инфекционных мононуклеоз.
Клиническая диагностика CMV-инфекции представляет большие трудности. Сходную клиническую картину могут давать многие заболевания, в том числе токсоплазмоз, листериоз, сифилис, гемолитическая болезнь и др. Распознавание цитомегалии основано на клинических и лабораторных данных. Для выявления CMV-инфекции предложен рад серологических, вирусологических, морфологических методик, но большинство их малоинформативно, тем более, что нужно не только выявить вирус, но и доказать его этиологическую роль в клинике болезни и необходимости противовирусной терапии (Yarrish R. 1992). В диагностике у ВИЧ-инфицированных наиболее информативно наличие в крови ДНК CMV в высокой или средней степени концентрации, но в сочетании с длительной, свыше 3 мес. персистенцией анти-CMV класса IgM и обнаружение вируса в моче.
По данным В.И.Шахгильдян и соавт. (1996) манифестация CMV-инфекции носит генерализованный характер и наиболее часто проявляется ретинитом, миелитом, эрозивным язвенным колитом. Ранним проявлением активации CMV является тромбоцитопения.
Терапия CMV-инфекции у больных ВИЧ/СПИД требует сочетанного применения препаратов против ВИЧ и CMV. У больных ВИЧ/СПИД проводится моно- или комбинированная терапия CMV-инфекции ганцикловиром и фоскарнетом (табл. 60). Длительность терапии и дозы препаратов зависят от тяжести болезни.
Таблица 60. Терапия CMV-инфекции у ВИЧ+ лиц
|
Препарат |
Дозы |
Курс |
|
Монотерапия |
||
|
Ганцикловир 40 мг/кг в/в через 8 ч |
5 мг/кг в/в через 12 ч 40 мг/кг в/в через 8 ч |
14 дней 10-21 день |
|
Комбинированная терапия ганцикловиром и фоскарнетом |
||
|
Ганцикловир Фоскарнет |
5 мг/кг в/в через 12 ч 60 мг/кг в/в через 8 ч |
14-21 день 14-21 день |
При врожденной CMV-инфекции проводят комплексное патогенетическое лечение в зависимости от клинических проявлений. При желтухе и поражении печени применяют принципы терапии вирусного гепатита. Широкое применение глюкокортикостероидов нецелесообразно, т.к. может ухудшить патологический процесс и вызвать ряд осложнений. В лечении используются также интерферон и интерфероногены различного происхождения.
Прогноз серьезный, особенно при врожденной цитомегалии с поражением ЦНС. Возможны различные остаточные явления. При приобретенной генерализованной цитомегалии прогноз определяется основным заболеванием.
ПРОТОЗОЙНЫЕ ЗАБОЛЕВАНИЯ
Токсоплазмоз. Возбудитель токсоплазмоза - Toxoplasms gondii относися к классу Sporozoea, вызывает паразитарную инфекцию приобретенного или врожденного генеза, является одной из причин акушерской и детской патологии, характеризуется поражение нервной и лимфатической систем, глаз, скелетных мышц, сердца и других органов. Инфицированность населения колеблется от 4 до 68%, нарастая с возрастом.
Toxoplasms gondii – внутриклеточный паразит, внешнее напоминая дольку апельсина длиной 4-7 мкм. заражение человека происходит алиментарным путем при наличии в пище (мясные продукты, овощи) ооцист или тканевых цист. Ооцисты, выделяемые с испражненями основного хозяина – кошек, хорошо сохраняются в почве.
До недавнего времени токсоплазмоз интересовал лишь акушеров и педиатров, наиболее часто с ним встречающихся. Но в связи с появлением ВИЧ-инфекции возрос интерес к токсоплазмозу, как СПИД-ассоциированному заболеванию.
Рзличают врожденный токсоплазмоз, возникающий в результате внутриутробного заражения, и приобретенный - формирующийся после рождения. При первом происходит передача инфекции через плаценту в различные периоды внутриутробного развития плода, при втором - всеми возможными путями. Но заболевание возникает далеко не во всех случаях попадания паразита в организм, что зависит от количества возбудителей, их биологических свойств, путей передачи, состояния иммунной системы макроорганизма.
Для острого токсоплазмоза характерно образовавние псевдоцист – скопление токсоплазм в пораженных клетках. рзрашение псевдоцист токсоплазмы инвазируют соседние клетки. Острый токсоплазмоз сопрорвождается паразитемией.
При хроническом токсоплазмозе формируются истинные цисты размером около 100 мкм, в каждой такой цисте содержатся свыше 100 паразитов – брадизоидов.
Начальная стадия инфекции обычно не распознается, протекая под диагнозом гриппа, ангины, энтероколита и других заболеваний. Вместе с тем у ослабленных людей. особенно у детей, при остром приобретенном токсоплазмозе встречается септическое течение болезни с высокой температурой, выраженной общей интоксикацией и поражением внутренних органов, а также явлениями энцефалита. Но чаще процесс ограничивается местными изменениями. первичная диссеминация бывает небольшой и протекает без выраженных поражений внутренних органов. В этот период в печени, селезенке, мышцах, головном мозгу выявляется большое количество паразитов, расположенных вне- и внутриклеточно. При хроническом течении болезни тосоплазмы расположены внутриклеточно. Образование цист происходит как при клинически выраженных, так и при субклинических формах болезни. Цисты представляют собой очаги тлеющей инфекции, обострение или рецидив которых может наступить через несколько лет или даже десятилетий. В виде цист токсоплазмы сохраняются до 10-15 лет, преимущественно в тканях головного мозга, глаз, внутренних органов. В неблагоприятных для организма условиях оболочки цист могут разрушаться, и высвободившиеся паразиты, размножаясь, поражают рядом расположенные клетки и поступают в ток крови. Этим объясняется рецидивирующее течение хронического токсоплазмоза.
В патогенезе острого и хронического токсоплазмоза определенную роль играют выделяемые паразитами токсические продукты, которые способствуют повреждению клеток различных тканей, и в первую очередь, клеток центральной нервной системы и глаз. Повторное поступление токсических веществ, выделяемых токсоплазмами, вызывает сенсибилизацию организма с развитием специфической аллергии. Аллергические и токсические факторы обусловливают патологические процессы в различных органах: интерстициальная пневмония, поражение печени, лимфатических узлов, матки и других органов.
Патоморфологические изменения при токсоплазмозе имеют фазовый характер. В первичной фазе, паразитемической, токсоплазмы поступают в региональные лимфатические узлы и проникают в кровеносное русло. С током лимфы и крови они распространяются по многим органам и тканям. Во второй - токсоплазмы фиксируются в висцеральных органах, вызывая в них некротические и воспалительные изменения с образованием мелких гранулем. В третьей - заключительной, токсоплазмы образуют в тканях истинные цисты, воспалительная реакция исчезает, очаги некроза подвергаются обызвествлению.
Хотя токсоплазмы могут поражать все органы и ткани, однако, почти в каждом случае удается выявить преимущественное поражение определенных органов и систем. Существующие классификации характеризуются главным образом органной или системной патологией.
Наиболее широкое распространение получила классификация, в которой включается пять основных форм проявления токсоплазмоза:1) лимфаденопатическая (с повышением температуры и увеличением лимфатических узлов); 2) экзантемная, сопровождается повышением температуры до высокого уровня, обильной макуло-папулезной сыпью по вему телу, за исключением головы, ладоней и подошв. По клиническому течению эта форма токсоплазмоза напоминает сыпной тиф. Лихорадка иногда остается на протяжении 4-5 нед., при этом отмечается поражение центральной нервной системы и мышцы сердца. Течение заболевания тяжелое, иногда со смертельным исходом; 3) с поражением центральной нервной системы, характеризующаяся повышением температуры и признаками менингоэнцефалита; 4) с преимущественным поражением глаз (хориоретинит, увеит, иридоциклит и др.);5) с поражением сердца и различными изменениями сердечно-сосудистой системы.
Как врожденный, так и приобретенный токсоплазмоз может быть острым и хроническим.
Острый и хронический приобретенный токсоплазмоз может протекать с явлениями преимущественного поражения лимфатической системы (лимфогландулярная форма), тяжелой общей интоксикации и кожных высыпаний (экзантемная форма), поражения центральной нервной системы (менингоэнцефалитическая форма), глаз, внутренних органов (мышц, печени, легких, сердца) в виде стертых субклинических форм со слабо выраженными изменениями со стороны нервной системы и внутренних органов. Хронический приобретенный токсоплазмоз кроме того может протекать в виде латентно-бессимптомного носительства.
Инкубационный период при токсоплазмозе может длиться от нескольких дней до нескольких недель. Заболевание начинается с продромальных явлений. Отмечается общая слабость, головная боль, нарушается аппетит, снижается трудоспособность, больной жалуется на боли во всем теле, повышенную температуру. Затем на первое место выступают симптомы, связанные с преимущественной локализацией возбудителя.
По частоте поражения органов и систем на первом месте находятся лимфатическая, нервная, сердечно-сосудистая и гепатобилиарная системы.
Поражение лимфатической системы - наиболее частое проявление хронического приобретенного токсоплазмоза. Чаще протекает по типу полиаденита с поражением шейных и затылочных лимфатических узлов, реже увеличиваются подмышечные и паховые лимфатические узлы, достигая размеров от горошины до грецкого ореха. Они подвижны, эластичной консистенции, кожа над ними не изменена, болезненны в первые дни заболевания и при реакциях.
Железистая форма протекает с рецидивами. Наблюдается повышение температуры до высокого уровня, общая слабость, быстрая утомляемость, головная боль, нарушение аппетита, болезненность при пальпации, иногда увеличение лимфатических узлов. Лимфаденопатия может быть единственным проявлением токсоплазмоза, но нередко она сочетается с поражением нервной системы, глаз, внутренних органов. Рзличают лихорадочный, безлихорадочный и субклинический варианты железистых форм токсоплазмоза. Боли в животе у таких больных симулируют иногда клинику аппендицита, они обусловлены поражением мезентериальных лимфатических узлов. Имеет место увеличение бронхо-пульиональных лимфатических узлов. Увеличение лимфатических узлов при токсоплазмозе нередко дает сонование для ошибочного диагноза туберкулеза, лимфогранулематоза, заболеваний лимфатических узлов неясной этиологии, инфекционного мононуклеоза.
Поражение внутренних органов наблюдается у 80-90% больных как при острых, так и при хронических формах приобретенного токсоплазмоза. Поражение сердечной деятельности стоит на первом месте по частоте различных изменений внутренних органов. Больные предъявляют жалобы на одышку, сердцебиение, частые боли в области сердца. Поражение миокарда может не сопровождаться особыми клиническими проявлениями. Наличие одышки, сердцебиения, болей в области сердца, глухости тонов, систолического шума, расширения поперечника сердца, а также электрокардиографические и баллистокардиографические данные говорят о поражении мышцы сердца, при этом имеют место дистрофические (миокардиодистрофия) и воспалительные (миокардит) изменения. Патологоанатомические исследования выявляют псевдоцист в мышце сердца. Токсоплазмозные миокардиты могут быть очаговыми и диффузными. Очаговые миокардиты обычно не сопровождаются выраженными клиническими проявлениями. При них редко развивается сердечно-сосудистая недостаточность. При диффузном миокардите чаще наблюдается тяжелое течение с грозными проявлениями сердечно-сосудистой недостаточности.
Токсоплазменное поражение легких чаще протекает по типу очаговой пневмонии, хронического бронхита, плеврита. Но наиболее характерна интерстициальная пневмония. Она протекает с повышением температуры и явлениями общей интоксикации. Интерстициальные пневмонии не диагностируются как токсоплазменные и, естественно, неправильно лечатся. Диагноз токсоплазмоза определяется обнаружением паразитов в легочной ткани умерших от токсоплазмоза.
Изменения в печени при токсоплазмозе наблюдаются у 40% больных и характеризуются ее увеличением, болезненностью, иногда небольшой или резко выраженной желтухой, нарушением функционального состояния.
При приобретенном токсоплазмозе описаны острые энтериты, энтероколиты, которые не имеют никаких специфических особенностей, поэтому очень часто остаются нераспознанными или расматриваются как энтериты другой этиологии.
Поражение глаз при приобретенном токсоплазмозе протекает в виде очагов воспаления по типу центрального хориоретинита, центрального эксудативного ретинита или центрального серозного ретинита. Часто страдают сосуды сетчатки, которые обычно сочетаются с очаговыми изменениями. Однако процесс в сетчатке этим не ограничивается, постепенно распространяется на сосудистую оболочку и развивается картина хориоретинита. Ни одно из описанных изменений не является патогмоничным для токсоплазмоза.
Поражение нервной системы при приобретенном токсоплазмозе занимает значительное место в клинической картине заболевания. Он может быть причиной острых, подострых и хронических заболеваний нервной системы, приводящих к тяжелым неврологическим нарушениям. Острый токсоплазмоз особенно тяжело протекает в случае развития менингоэнцефалита. На первое место в клинике выступают симптомы менингита с ликворной гипертензией, лимфоцитарным плеоцитозом. Поражение мозга в основном касается ствола и мозжечка с вовлечением черепномозговых нервов, напоминая клинику весенне-летнего клещевого энцефалита.
Чаще всего неврологические нарушения возникают при хронических формах приобретенного токсоплазмоза. Характеризуясь полиморфизмом неврологической симптоматики, нейротоксоплазмоз в основном протекает по типу гипертензионно-гидроцефального синдрома (поражения оболочек и сосудов головного мозга, гипоталамуса и периферических нервов). Часты диффузные арахноидиты. Нарушение функций гипоталамуса протекает с клиникой гипоталамического (диэнцефального) синдрома. Последним объясняется частое развитие у больных эндокринопатий, в частности, повышение андрогенной, снижение глюкокортикостероидной и минералокортикоидной функции надпочечников, регуляции углеводного обмена. Характерный для токсоплазмоза артральгический синдром объясняется полиневритом и полиневральгиями.
А.Г.Пап и соавт. (1974) выделяют следующие формы нейротоксоплазмоза:
-
1. Распространенные поражения нервной системы: а) менингоэнцефаломиелит; б) случаи с преимущественной локализацией процесса в гипотоламусе (диэнцефалит);
-
2. Церебральные: а) менингоэнцефалит; б) менингоэнцефалит с эпилептическим синдромом; в) васкулит;
-
3. Синдромы поражения периферических нервов: а) полиневриты и полиневралгии; б) мононевриты.
У больных СПИД токсоплазмоз развивается преимущественно в виде патологии центральной нервной системы и относится к одной из ведущих оппортунистических инфекций. Он развивается в случаях снижения количества CD4+ клеток до 100 и менее в 1 мм3 и протекает в одних случаях в виде латентной инфекции, в других в виде диссеминированных форм, преимущественно как токсоплазменный энцефалит, хореоретинит, пневмония.
У больных ВИЧ-инфекцией окончательный диагноз токсоплазменного энцефалита ставится при обнаружении в биоптатах гистоморфологическими методами в ткани мозга T. gondii. Обнаруживаются тахизоиды, окруженные воспалительной реакцией. Для идентификации токсоплазм в ьиоптате используется пероксидазно-антипероксидазная методика и полимеразная цепная реакция. Но к биопсии мозга прибегают в случаях, когда другие методы не позволяют подтвердить диагноз токсоплазмоза при наличии клиники.
Токсоплазм иногда удается обнаружить также в спинно-мозговой жидкости, жидкости, полученной при бронхо-альвеолярном леваже при окраске масков.
Несмотря на многочисленные исследования в направлении изыскания высокоэффективных средств для лечения токсоплазмоза, практический арсенал этиотропных препаратов, которыми пользуются у больных СПИДом, ограничивается комбинацией пириметамина с сульфадиазином, эффективными при токсоплазменном энцефалите (табл.61. Комбинация этих лекарственных средств блокирует метаболизм фолиевой кислоты. Первая, ударная доза пириметамина используется, чтобы обеспечить достаточный уровень его в крови. Среди побочных эффектов лечения отмечается токсическое действие на кровь пириметамина, нарушение функции желудочно-кишечного тракта при лечении клиндамицином. Примерно 40% больных СПИДом при лечении токсоплазменного энцефалита дают побочные реакции.
Получены положительные результаты применения в терапии этих больных иммуноактивных препаратов, в частности интерферонов, но как дополнение к этиотропной терапии.
Кортикостероиды показаны у больных с повышенным внутричерепным давлением, но их применение оправдано только с случаях клинической необходимости.
Таблица 61. Лечение токсоплазменного энцефалита
|
Препараты |
Общая дневная доза |
Путь введения |
Интервал |
|
Стандартная терапия |
|||
|
Пириметамин +
фолиниказид + сульфадиазин или |
200 мг враз, в пос- ледующем по 50-75 мг 10-20 мг 4-6 гр 1,35-1,8 гр |
per os
per os per os per os |
24 ч
24 ч 6 ч 8 ч |
|
Альтернативная терапия |
|||
|
Дапсоне Кларитромицин Атоваквен Азитромицин |
100 мг 2 гр 3 гр 1,2-1,5 гр |
per os per os per os per os |
24 ч 12 ч 6 ч 24 ч |
Рецидивы наблюдаются в 100% у тех больных, токсоплазма у которых находится в форме цист, ибо пириметамин и сульфадиазин эффективны против пролиферативных форм и не действуют на цист.
Проведение первичной медикаментозной профилактики пириметамином токсоплазменного энцефалита оправдано у больных СПИДом при количестве CD4+ клеток менее 100 в 1 мм3 и среди тех больных, которые серопозитивны к T. gondii. Убедительное доказывают эффективность профилактики токсоплазменного энцефалита триметопримом в сочетании с сульфаметоксазолом наблюдения по профилактике пневмоцистной пневмонии. По данным литературы в ретроспективном трехлетнем изучении результатов у 155 пациентов, получавших комбинацию триметоприма с сульфаметоксазолом, оказавшихся эффективными также и для предупреждения токсоплазмоза. Так, ни у одного из 22 больных, серопозитивных к Т. gondii, никто не заболел токсоплазмозом, в то время как у 12 из 36 серопозитивных, получавших пентамидин, развился токсоплазменный энцефалит.
Профилактика заражения токсоплазмами больных ВИЧ-инфекцией предусматривает в основном исключение инфицирования через плохо термически обработанное мясо и исключение контакта с кошками, выделяющими токсоплазм с калом.
Криптоспоридиоз. В группе представителей простейших, вызывающих поражение желудочно-кишечного тракта у больных ВИЧ-инфнекцией криптоспоридии, микроспоридии и изоспры занимают ведущее место.
С начала пандемии ВИЧ-инфекции криптоспоридии стали нередкой причиной диарейного синдрома у этих больных. У 10-15% больных СПИДом криптоспоридиоз выявляется в США и в 30-50% в других странах.
После того, как ооцисты с пищей проникают в тонкую кишку, они превращаются в спорозоиды. Хотя паразит локализуется преимущественно в тонкой кишке, он обнаруживается и в других отделах кишечника.
Приобретая хроническое течение, криптоспоридиоз обычно развивается у больных при снижении количества CD4+ лимфоцитов менее 100 в 1 мм3 , приобретая характер упорной диареи. Стул у больных профузный, водянистый с большим количеством лейкоцитов, со слизью, но без крови. Диарея часто сопровождается спастическими болями в животе. Больные жалуются на усталость, тошноту, исчезновение аппетита и периодическую рвоту.
Диагностируется криптоспоридиоз путем обнаружения ооцист при исследовании свежего кала. В диагностике также используются серологические реакции, в частности методом моноклональных антител и энзиммеченной иммуноабсорбции.
Изоспороз. Возбудитель изоспороза относится к группе кокцидий, паразитирует в клетках эпителия тонкого кишечника. Выделено более 200 видов изоспор, но для человека патогенны только Isospora belli и иногда – Isospora natalensis. Источник инфекции – больной человек. Заражение происходит оральным путем ооцистой, в кишечнике из которой выходят спорозоиты, проникающие в эпителиальные клетки двенадцатиперстной и тощей кишки, где через фазы трофозоита, шизонта, мерозоита идет их созревание в микро- и макрогаметы. Повторяющийся процесс бесполого размножения ведет к поражению эпителиального слоя слизистой оболочки кишечника с клиникой диарейного синдрома. Заболевание начинается, как острая форма энтерита или энтероколита, стул диффузный, водянистый с примесью слизи и крови. Диарея сопровождается лихорадкой, тошнотой, рвотой. Эта фаза соответствует внутриклеточному развитию изоспор, поэтому этиологическая диагностика затруднена. Заподозрить диагноз помогает выраженная, нарастающая эозинофилия, достигающая 60% (Авдюхина Т.И.,1997). С переходом мерозоиты выходят из эпителиальных клеток в просвет кишечника, особенно у больных с иммунодефицитом, заболевание переходит в хроническую фазу с клиникой хронической диареи и потери массы тела.
По данным J.A. De Hovitz et all. (1986) среди больных СПИДом гаитян в 1983 году изоспороз выявлялся в 84%, однако H.Masur et al.(1997) сообщает, что среди больных СПИДом, жителей Гаити и Африки он обнаруживается в 15-20%.
Диагноз изоспороза базируется на выявлении паразита в фекалиях методом обогащения, в частности флотационными методами Фюллеборна или Дарлинга.
Лечение требует дальнейшего совершенствования, так как существующие подходы с использованием ко-тримоксазола имеют относительный успех.
Микроспоридиоз. С начала пандемии СПИДа микроспоридиоз стал одной из ведущих оппортунистических инфекций, встречаясь у 15-20% больных и обусловливая диарейный синдром. Как и криптоспоридия, микроспоридия может поселяться в кишечнике у ВИЧ-инфицированных людей людей, не вызывая клинических проявлений болезни, если количество CD4+ клеток в пределах нормы, но только у больных с выраженным иммунодефицитом обусловливает манифестную форму болезни.
Микроспоридия - облигативное внутриклеточное спорообразующее простейшее, локализуется преимущественно в тонкой кишке, но возможно заселение и других отделов желудочно-кишечного тракта. Так, заселяя желчные ходы, она может быть причиной некалькулезного холецицистита.
Заболевание характеризуется диарейным синдромом, но стул без примеси крови. Больных беспокоит отсутствие аппетита, имеется повышение температуры, стойкий диарейный синдром определяет потерю массы тела.
Диагностика трудна в силу малого знакомства врачей-лаборантов с данной патологией и недооценки клиники болезни лечащим врачом в связи со стертой клинической картиной болезни, наслаивающейся на фон ВИЧ-инфекции со всеми прочими оппортунистическими инфекциями. Многократные отрицательные исследования стала на простейшие, бактерии, грибы и др. возбудителей, обусловливающих диарейный синдром дают основание заподозрить микроспоридиоз. Исследование биоптата тонкой кишки в электронном микроскопе позволяет диагностировать заболевание.
Терапия микроспоридиоза требует дальнейшего совершенствования.
М И К О З Ы
Грибы - эукариотические организмы, в большинстве сапрофиты, из многих тысяч их представителей лишь около 100 патогенны для человека, характеризуясь низкой вирулентностью. Выделяют два вида грибов - дрожжевой и плесневый (гифальный). Большинство микозов у человека обусловлено несовершенными грибами. Структурная вегетирующая единица плесневых грибов - гифа, представляющая разветвленную микроскопическую нить. Гифы образуют тело гриба - грибницу, совокупность гиф грибницы - мицелий. Дрожжи и дрожжеподобные грибы представлены одноклеточными организмами сфеорической или овальной формы.
Вызванные грибами заболевания клинически проявляются в виде: а) поверхностных микозов (отрубевидный, желтый и черный лишай, белая и черная пьедра), б) микозы кожи и ее придатков - дерматомикозы, в) подкожнве микозы, чаще развиваются при попадании микроорганизмов при травме, г) системные (респираторные) микозы, развиваются при ингаляции спор из воздуха; чаще протекают в виде патологии легких, течение легкое и заболевание проходят спонтанно, но могут принимать диссеминоровнные формы с полиорганностью - глубокие микозы, д) оппортунистические микозы, их вызывают преимущественно сапрофиты из внешней среды (Aspergillus, Mucor) или в виде эндоинфекции (Candida); оппортунистические микозы характерны для больных ВИЧ-инфекцией, ожоговых больных или других видов патологии, сопровождающейся нарушением местной резистентности
Среди микозов у человека чаще встречаются актиномикоз, аспергиллез, бластомикозы (бластомикоз Гилкриста, бластомикоз Буссе-Бушке, или криптококкоз, южно-американский бластомикоз), гистоплазмоз, кандидозы, кокцидиоидомикоз, нокардиоз и мукромикоз. В связи с пандемией ВИЧ-инфекции резко увеличилась заболеваемость пневмоцистозом.
Пневмоцистоз. Впервые связь между P.сarinii и поражением легких у недоношенных детей из приюта была установлена во время второй мировой войны. До этого кистозное поражение легких было описано у свинок и крыс (Chagas,1909, Carinii,1910) с выделением у животных протозоидных форм возбудителя, получившего в последующем название P.сarinii.
P. сarinii первоначально по морфологическим признакам отнесли к классу простейших, но последние достижения в молекулярной биологии позволили филогенетически P.сarinii отнести к грибам (Decker K.F., Masur H.,1997). Пневмоциста имеет тонкую капсулу, может быть круглой или серповидной формы. Ее при световой микроскопии ошибочно можно принять за дрожжи или эритроциты.
Инфекционная единица P. сarinii – спорозоит, в ткани легкого превращающийся в трофозоит, размножающийся делением.
Передается пневмоциста контактным путем, широко распространена среди здорового населения, заселяя легкие с раннего детства. Заболевание развивается в эксперименте у животных после введения глюкокортикостероидов, вызывающих иммуносупрессию, а также у недоношенных детей с явлениями иммунодефицита, у людей, длительно находящихся на глюкокортикостероидной терапии или лечившихся иммуносупрессивными препаратами по поводу опухолей. Чаще же всего пневмоцистоз развивается у детей в возрасте до 1 года с явлениями иммунодефицита, обычно врожденного с Т-лимфоцитарным дефектом или слабым гуморальным иммунным ответом за счет В-лимфоцитарного иммунодефицита. У взрослых в настоящее время в основном пневмоцистоз связан с ВИЧ-инфекций. Хотя успехи в лечении и профилактике пневмоцистоза существенно уменьшили его роль в структуре и причинах смерти у больных СПИДом, пневмоцистная пневмония остается по-прежнему одной из ведущих патологий у этих пациентов. Обычно она развивается при показателе CD4+ лимфоцитов менее 200 в 1 мм3. Поэтому и медикаментозную профилактику пневмоцистоза у больных СПИДом проводят, основываясь на показателе СD4+ клеток. Правда пациентам с оро-фарингеальным кандидозом или при наличии лихорадки свыше 2 недель профилактика пневмоцистоза проводится и при количестве CD4+ лимфоцитов, превышающих 200 клеток в 1 мм3 .
P.carinii – внеклеточный паразит со строгим тропизмом к легочной ткани, в просвете альвеол она осуществляет весь жизненный цикл. В результате жизнедеятельности P.carinii в легких происходит инфильтрация стенки альвеол мононуклеарами, а интерстициальной ткани плазматическими клетками. Микроскопически пневмоцисты обнаруживаются в эксудате каждой альвеолы. Все это ведет к 10-20 – кратному увеличению альвеолярной стенки, обусловливающему альвеолярно-капиллярный блок с клиникой тяжелой дыхательной недостаточности. Пневмоцитсная пневмония относится к одной из распространенных суперинфекций ВИЧ/CПИД (рис. 23).
К наиболее характерным клиническим проявлениям пневмоцистной пневмонии относятся лихорадка, стойкий кашель, одышка, затрудненное дыхание. Больных беспокоит усталость, при длительном течении болезни падает масса тела. У больных СПИДом в отличии от лиц, пневмоцистоз у которых развился в связи с другими причинами, течение болезни более торпидное, длительное, с явлениями выраженной клиники
У недоношенных детей гистологически пневмоцистоз характеризуется интерстициальной пневмонией. У взрослых, получавших иммунодепрессанты, намного реже наблюдается интерстициальная плазмоклеточная инфильтрация, процесс чаще носит характер интраальвеолярный, диффузный, чем отличается от инфильтративного поражения легких при иммунодефицитах иной этиологии.
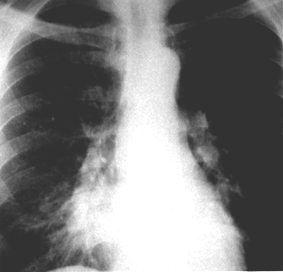
Рис. 23. Рентгенограмма. Пневмоцистная пневмония у больного ВИЧ-инфекцией
Пневмоцистная пневмония относится к поздним СПИД-ассоциируемым заболеваниям, она, обычно, развивается у больных с выраженным иммунодефицитом, когда количество CD4+лимфоцитов падает ниже 200 в 1 мкл. Именно поэтому у больных ВИЧ-инфекцией с клиникой оро-фаренгиального кандидоза падение количества CD4+лимфоцитов ниже 200 в мкл. является показанием для проведения медикаментозной профилактики пневмоцистной пневмонии.
Клинически пневмоцистоз диагностировать трудно, так как он проявляется как и при интерстициальных пневмониях иной этиологии нарастающей усталостью, плохим аппетитом, появлением кашля, одышки, цианозом губ, хотя температура субфебрильная или нормальная, признаки пневмонии не выражены.
Диссеминация P. сarinii, наблюдаемая у больных в стадии СПИДа, ведет к плоражению других органов и течение приобретает фатальный характер со 100% летальностью.
Стандартное обследование больных мало что дает для диагностики пневмоцистной пневмонии. Обычные лабораторные тесты также малоинформативны. Эффект рентгенологического обследования зависит от стадии болезни. До 20% больных имеют мало выраженную клинику и рентгенологическое обследование не выявляет патологии. В типичных случаях при рентгенографии выявляется диффузное и симметричное интерстициальное воспаление с очагами инфильтрации. Фокальные очаги в верхних долях выявляются чаще у больных, получавших с профилактической целью пентамидин. Плевральный выпот и увеличение периаортальных лимфатических узлов для пневмоцистоза не характерно, если они не вызваны другими сопутствующими факторами. Такие же признаки поражения легких наблюдаются при цитомегаловирусной пневмонии, нокардиозе, аспергиллезе, лимфогенном распространении опухолей, послерадиационном облучении, микоплазменной пневмонии, вирусных и бактериальных пневмониях, вызванных как грамположительными, так и грамотрицательными микробами.
Диагностика пневмоцистной пневмонии начинается с исследования слюны. Если в ней P.сarinii не обнаруживается, прибегают к более сложным методам. Окончательный диагноз ставится по данным обнаружения цист или трофозоидов, выделенных из легких. Раньше, до пандемии СПИД, для диагностики требовалась биопсия легкого. Увеличение количества больных позволило разработать методику трансбронхиальной биопсии. Поэтому сегодня бронхоскопия с бронхоальвеолярным леважем в сочетании с трансбронхиальной биопсией является наиболее эффективным и достоверным методом диагностики пневмоцистной пневмонии, позволяющим почти в 100% выявлять пненвмоцистоз. Правда у пациентов, получавших лечение пентамидином эффективность диагностики с использованием бронхоальвеолярного леважа снижается до 60%.
Окончательный диагноз пневмоцистоза ставится при обнаружении цист или трофозоидов в ткани или альвеолярной жидкости. Только биопсия ткани легкого дает абсолютное подтверждение диагноза. Увеличившаяся в последние годы трансплантация органов и тканей, терапия опухолей иммуносупрессивными препаратами, СПИД обусловили расширение проведения таких инструментальных методов диагностики, как бронхоскопия с бронхоальвеолярным леважем и трансбронхиальную биопсию. Пандемия ВИЧ способствовала широкому внедрению прямой биопсии легких для диагностики пневмоцистной пневмонии. Но риск получения диссеминации при всех видах биопсии, от идеальной в плане диагностики открытой легочной биопсии до бронхоскопической биопсии, бронхоальвеолярного лаважа, чрезкожной трансторакальной игольной биопсии, сдерживает раннюю диагностику пневмоцистоза. Поэтому принят принцип - всех больных с диффузной пневмонией лечить эмпирически, и только больных с тяжелым легочным процессом подвергать легочной биопсии. Без специфического лечения пневмоцистоза летальность достигает 50% недоношенных детей и 100% с иммунодефицитами. Долгосрочный прогноз зависит от фонового состояния, ибо без восстановления иммунного статуса у 15% болезнь возобновляется.
Многие годы пентамидин был единственным доступным препаратом для лечения пневмоцистоза, сегодня он расценивается как альтернатива для комбинации триметаприма с сульфаметоксазолом. Для лечения пневмоцистной пневмонии больным назначается пентамидин, сочетание триметоприма и сульфаметоксазола, или пириметамина с сульфанамидом. Пентамидин назначается (в дозе 4 мг/кг в день) внутримышечно. В зависимости от тяжести заболевания лечение длится 10-20 дней, доза вводится однократно в день. При наличии геморрагического диатеза пентамидин вводится в вену медленно, осторожно, под постоянным контролем артериального давления. Лицам с массой тела свыше 50 кг пентамидин вводится в два участка тела.
Примерно у 60% больных СПИДом пентамидин дает медикаментозные осложнения, ибо обладает гипо- или гипергликемическим, гипотензионным, нейтропеническим эффектом, а также оказывает токсическое действие на почки и поджелудочную железу. При его применении наблюдается также нарушение функции печени, может развиться азотемия. Описан выраженный гипогликемичекский эффект с летальным исходом, ибо пентамидин может обусловить интенсивный выброс инсулина. Гипергликемия под его влиянием может приобрести необратимый зарактер с развитием сахарного диабета. Большинство побочных эффектов при лечении пентамидином развивается между 7-14 днями терапии. Побочные реакции включают помимо острой сердечно-сосудистой недостаточности, также гипогликемию, тахикардию, эритему, тошноту, рвоту, возможно развитие плевритов. Примерно у 1/4 наблюдается как реакция почечные приступы, у 1/4 - другие реакции, в том числе гепатотоксичность. В месте введения возможны стерильные абсцессы, гематомы.
Комбинация триметаприма с сульфаметаксазолом в соответствии 1:5 применяется внутрь и внутривенно. Доза внутрь для детей и взрослых составляет 20 мг триметаприма (с 10 мг сульфаметаксазола) на кг массы тела в день на три равные порции через 8 часов. Так как всасывается комбинация лекарств из кишечника с трудом, предпочтительно внутривенное введение. Терапия продолжается 1-3 недели.
По эффективности пентамидин и комбинация (триметаприм с сульфаметаксазолом) одинаковы, но пентамидин более токсичен, поэтому комбинация триметоприма с сульфаметаксазолом является препаратом первого выбора. Меньше накоплено опыта по лечению пневмоцистоза комбинацией пириметамина с сульфанамидом, к тому же побочное действие на костный мозг этой комбинации намного чаще, чем сочетание триметаприма с сульфаметаксазолом.
Сегодня первостепенными препаратами лечения пневмоцистоза является комбинация триметоприма с сульфаметоксазолом (табл.62). К побочным эффектам терапии этими препаратами относятся лихорадка, сыпь, головная боль, тошнота, а также подавление функции костного мозга, повышение активности трансаминаз крови, гипокалиемия. Сочетание
Таблица 62.Лекарственная терапия пневмоцистоза
| Препараты | Общая дневная доза | Путь введения | Интервал | Курс лечения в днях |
|
Триметоприм + сульфаметоксазол |
15-20 мг/кг 75-100 мг/кг |
в/в или per os | 6-8 ч | 21 |
| Пентамидин | 4 мг/кг | в/в | 24 ч | 21 |
|
Триметоприм + дапсоне |
15-20 мг/кг 100 мг |
per os per os |
8 ч 24 ч |
21 21 |
|
примаквин |
1,35-1,80 г 15-30 мг |
per os per os |
8 24 ч |
21 21 |
|
Атоваквон |
2250 мг |
per os |
8 ч |
21 |
|
Триметрексат |
45 мг/ м2 |
в/в |
24 ч |
21 |
|
Дополнительные средства |
||||
|
Преднизон |
20-40 мг |
per os |
12- 24 ч |
5-11 |
триметоприма и сульфаметоксазола с зидовудином у ряда больных вызывает миелосупрессию. Токсический синдром обычно развивается на 6-10 день терапии, около 1/4 больных не могут до конца получить курс лечения триметоприма с сульфаметоксазолом из-за токсических проявлений.
Дапсоне при лечении пневмоцистоза в 40% приходится отменять из-за отсутствия эффекта. Но в комбинации с триметопримом эффективность значительно возрастает. К дапсоне прибегают в случаях непереносимости больными комбинации триметоприма с сульфаметоксазолом. Отрицательные эффекты дапсоне включают лихорадку, сыпь, нарушение функции печени, тошноту, метгемоглобулинемию.
Комбинация клиндамицина с примаквином используется при необходимости отмены стандартного лечения. Исследования показали, что по эффективности комбинация сравнима с триметопримом+сульфаметоксазол. К отрицательным медикаментозным эффектам относятся быстро развивающаяся у больных реакции типа кожной сыпи, диареи, гепатита.
Предпринимаются попытки лечения пневмоцистоза иммуноактивными препаратами.
Среди дополнительных средств лечения к антимикробным препаратам в терапии первое место занимают глюкокортикостероиды, особенно в случаях развития гипоксемии.
Принято считать, что при снижении количества CD4+ клеток ниже 200 в 1 мм3 необходимо осуществлять профилактику пневмоцистной пневмонии. Так, наблюдения за 1665 ВИЧ-инфицированными показали, что если имеется постоянная температура свыше 37,7° С в течение 2 недель или оро-фарингеальный кандидоз, не связанный с лечением антибиотиками или глюкокортикостероидами, необходимо проводить медикаментозную профилактику пневмоцистной пневмонии (Phair J. et al.,1990). Обычно для этих целей
используется пентамидин аэрозольно. Для профилактики пневмоцистной пневмонии проводят терапию также триметопримом в сочетании с сульфаметоксазолом или другими лекарственными средствами (табл.63). В этих же целях применяют дапсоне, который к тому же более удобен в дозировке, чем пентамидин, так как применяется per os, но менее эффективен, чем комбинация триметоприма с сульфаметоксазолом.
Таблица 63. Схема медикаментозной профилактики пневоцистоза
| Препарат | Общая доза в мг | Путь введения | Частота |
|
Триметоприм + сульфаметаксазол |
160/880 160/800 |
per os per os |
ежедневно дважды в день |
| Пентамидин |
80/400 300 60 |
per os аэрозоль аэрозоль |
ежедневно ежемесячно еженедельно |
|
Пириметамин + сульфадоксин |
50/100 | per os | еженедельно |
| Дапсоне | 100 | per os | ежедневно 1-2 дозы |
|
Пириметамин +
дапсоне |
75/200 | per os | ежемесячно |
Кандидоз.
Кандидоз является грибковым заболеванием, вызываемым дрожжеподобным грибком Candida. Располагаясь на коже и слизистых оболочках организма, грибок разрастаются и начинают вторгаться в его ткани, вызывая инфекционное заболевание.
Кандидоз в настоящее время стал распространенным, так как население все больше страдает заболеваниями либо непосредственно иммунной системы, либо другими, неблагоприятно отражающимися на иммунной системе, интенсивно принимает антибактериальные средства.
Заселяя внутренние полости организма человека, Candida вызывает дисбактериоз, чем нарушает защитные функции нормальной микробной флоры. Так как кандидозные инфекции варьируются, от бессимптомных до относящихся к септицемии, трудно осознать роль кандидозной инфекции в общей патологии человека.
Кандидоз – наиболее частая грибковая инфекция у ВИЧ-инфицированных и весьма редкая у здорового человека. Уже в начале пандемии ВИЧ-инфекции было установлено, что оральный кандидоз является ранним маркерным заболеванием у больных ВИЧ/СПИД и прогностический показатель для развития других оппортунистических инфекций. Кандидозный эзофагит, трахеит, бронхит и поражение легких относятся к индикаторным болезням для фазы СПИДа. Офаренгиальный кандидоз, вагинальный кандидоз у женщин постоянно встречаются у больных ВИЧ-инфекцией с количеством CD4+клеток >200 в 1 мкл., кандидозный эзофагит развивается в случаях, когда CD4+клеток менее 100 в 1 мкл.
Наконец, является ассоциированным заболеванием, и развивающаяся пандемия ВИЧ-инфекции ставит кандидоз в актуальнейшую проблему ближайших десятилетий.
Candida - диморфные грибы овальной формы, которые растут как почкующиеся дрожжевые клетки - бластоконидия (почки) и представляют цепь связанных, вытянутой формы клеток (псевдо- и натуральные гифы Известно боле 150 разновидностей Candida и по крайней мере 10 вызывают кандидоз у человека. Наиболее патогенные C. albicans var. albicans, C. albicans var. stellatridea и C. tropicals. Менее патогенные, но тем не менее способные вызывать заболевание (C. parapsilosis, C. quillarmondi, C. krusei, C. pseudotropicals, C. viswanatbii, C. zeylanoides, C. paratropicals), существуют в организме в дрожжевой форме.
Стенки клеток Candida представляют многослойную структуру, состоящую в большей части из полисахаридов с некоторым содержание протеинов и липоидов.
Candida быстро развивается при концентрации водородных ионов (рН) от 3 до 8, при температуре 200-400 С или без ислорода, вырабатывая характерный запах дрожжей. Мягкие, кремового цвета скопления микробов вырастают на кровяном и глюкозном агаре, одновременно образуя псевдонатуральные гифы. Хотя большинство кандидных тел не образуют аскоспоры, у некоторых из них (например, C. quillermondi и krusei), были обнаружены аскогрибковые телеморфы.
Человеческий организм является носителем Candida и обычным источником заражения.
Трудно провести границу между присутствием Candida в организме и заражением им. Наблюдения показывают, что в особенности C. albicans присутствует у 50% людей в ротовой полости, в желудочно-кишечном содержимом, как устойчивый компонент микрофлоры. Частота обнаружения Candida в ротовой полости увеличивается у больных диабетом, при зубном протезировании и курении. C.albicans считается обычным компонентом вагинальной микрофлоры по меньшей мере у 20% небеременных и 30% беременных женщин. Кожа менее подвержена влиянию Candida, на ней обнаруживается всего 20%. Другие разновидности гриба обнаруживаются на участках кожи и слизистых, однако, встречаются реже, чем С.albicans в ротовой полости, желудочно-кишечном тракте и вагине.
Вторжение C. albicans обычно начинается про рождении, когда плод проходит через родовые пути. Это зачастую ведет к ограниченно оральной инфекции, вызывая молочницу, которая может стать источником распространения C. albicans на других детей. Заражение Candida на более поздних порах жизни является результатом переноса грибка от человека к человеку. Перенос от животного к человеку тоже возможен, так как птицы и млекопитающие являются носителями грибков. Так как Candida не размножается в воздухе и почве, заражение через загрязненные фекалии и окружающую среду мало вероятно.
Спектр кандидозной инфекции включает поражения кожи, слизистой полости рта, желудочно-кишечного тракта, вагины, систематическое вовлечение в инфекционный процесс внутренних органов. Заболевание, вызванное C. albicans, наблюдается преимущественно у больных диабетом, лейкемией, патологией лимфатической системы, иммунодефицитами, лечащихся антибактериальными средствами, глюкокортикостероидами или иммуноподавляющими лекарствами. В большинстве своем процесс носит местный характер и только при интенсивном размножении Candida проникает в кровь и обусловливает поражение внутренних органов. Это может быть следствием распространения грибков из кишечного тракта, попадания в ток крови через зараженные внутривенные катетеры, нестерильные инфекционные материалы и зараженные питательные растворы. Результатом может быть эндокардит - самое грозное осложнение ятрогенной инфекции, хотя возможно поражение и любого органа.
Мочевые катетеры могут также стать причиной заболевания кандидозом. Такой путь заражения характерен для госпитализированных больных, пользующихся постоянно катетером и антибактериальными средствами.
Кожное проявление кандидоза выражается в виде сыпи у младенцев и паранохиального воспаления у домохозяек, чьи руки часто соприкасаются с водой. Очень редкая форма заболевания кожи и ротовой полости называется хроническим кожно-слизистым кандидозом. Болезнь начинается в первые 10 лет жизни, особенно до 2-х летнего возраста у детей, страдающих пониженной функцией эндокринной системы или жестким иммунодефицитом, швейцарской разновидностью гаммаглобулинемии или нарушением роста вилочковой железы при дефиците Т-клеточного иммунитета.
Почти все формы кандидоза (слизистой рта, желудочно-кишечного, вагинального, общего и кожного) обусловлены C. albicans, хотя отмечается все возрастающее влияние C. albicans var. albicans, обусловленное его способностью разрастаться в тканях в форме гифы, более устойчивой к сопротивлению организма, чем бластоконидия. Хотя разновидности C. albicans var. stellatoidea также способны образовывать псевдогифы в тканях, по своей патогенности они занимают срединную позицию между C. albicans, C. parapsilosis или C. quillermoudii, не превращающихся в гифы - микроскопические простые или разветвленные нити, из которых формируются вегетативные и плодовые тела грибков
Таким образом, имеется зависимость между морфологическими признаками и вирулентностью Candida, хотя это не является абсолютным требованием, так как бластоконидия и гифа (или псевдогифа) присутствуют вместе на пораженном участке, а условия жизнедеятельности благоприятствуют образованию нитей при температуре боле 350С. Не доказано, что Candida способна образовывать токсины.
Развитию кандидоза благоприятствует увеличение количества принимаемых глюкокортикостероидных средств, антибактериальное лечение, подавление защитной функции, иммуноподавляющие лекарства.
Количество дрожжей в полости рта, желудочно-кишечном тракте и вагинальной секреции определяется в первую очередь содержанием в них глюкозы. Увеличение концентрации глюкозы, которое происходит при диабете и лечении глюкокортикостероидами, благоприятствует развитию грибков. Лекарства, предупреждающие развитие микробов, например, тетрациклин, тоже увеличивают количество глюкозы, способствуя размножению грибков.
Как правило, нетронутые слизистые оболочки препятствуют вторжению Candida в ткани.
Хотя механизмы, отвечающие за предупреждение инфекции еще до конца не поняты, известно, что нейтрофилы и макрофаги активно убивают грибки, вторгающиеся в подслизистые ткани. Важное значение фагоцитарной способности доказывается распространения грибков у лиц, чье клеточное сопротивление снижено иммуноподавляющей терапией.
Поскольку все внутренние органы чувствительны к заражению Candida, на основании данных обследования можно построить нисходящую подверженности органов: пищеварительный тракт, почки, легкие, мозг, сердце, селезенка, печень.
Кожный кандидоз и эндокардит являются атрибутами местных аномалий в организме. Инфекция кожи локализуется на влажных ее участках, за исключением случаев с ожогами. Раны от ожогов могут также служить местом поражения грибками с переходом на внутренние органы. Однако несмотря на то, что повреждения кожи захватывают большие участки, распространение инфекции на внутренние органы происходит редко.
Эндокардит возникает, если Candida из крови проникает на нормальные, деформированные или протезированные сердечные клапаны. Этот род инфекции не зависит от системы защиты организма.
Первичный кожный кандидоз является поверхностным заражением, появляющимся на ногах у человека и таких зонах, как подмышечные впадины, паховые области, складки, межпальцевые участки, половой член, пупок. В этих зонах могут появиться эритемные пятна неясного очертания, покрытые чешуйками, иногда экссудатом. Чешуйчатые и узелковые образования окружены по краям эритемной сыпью. Характерна повышенная чувствительность, покраснение и припухлость, иногда ассоциируемые с гноем под ногтями и почернением самих ногтей.
Поверхностные заражения полостных и вагинальных слизистых отражаются только на слизистой оболочке, в непосредственной близи с этими участками тела. Заражение полости рта выражается в появлении бесчисленного количества разрозненных и сливающихся пятен кремового цвета на слизистой рта, языка и глотки. Эти поражения бессимптомны, но могут быть и болезненны, у детей младенческого возраста они могут препятствовать дыханию. Симптомами вагинального поражения является зуд и влагалищные выделения, а также серые или белые пятна, окружаемые гиперемией.
Хроническое слизисто-кожное поражение начинается с инфекций во рту, которые распространяются на губы, гортань и редко - пищевод. В неблагоприятных случаях кожа на пальцах, руках, плечах, шее, лице, ушах, черепе и в паху может стать шелушащейся, трескающейся, и даже похожей на гранулему.
Следствием глубокого поражения органов или систем является нарушение функции их деятельности. Так, при поражении пищевода самым важным симптомом является загрудинная боль, усиливающаяся при глотании. Кандидоз в пищеварительном тракте не имеет очерченных симптомов.
Предположение о том, что сверхчувствительность к Candida может свидетельствовать о наличии бронхиальной или легочной аллергии, еще не получило убедительного подтверждения.
Заражение мочевых путей Candida сопровождается обычно наличием более 50 000 грибков в мл мочи. У больного кандидозным пиелонефритом появляются лихорадка, боль в боковых отделах живота, тошнота, а иногда расстройство мочеиспускания.
Кандидозный эндофтальмит характеризуется симптомами глазной и окологлазной боли, расплывчатого видения. Во время офтальмоскопического обследования выявляются участки воспаления в виде круглых, маленьких и белых окаймленных гиперемией. Впоследствии участки гиперемии могут увеличиваться в размерах. Осложнением является интраокулярный кандидоз.
Симптомы поражения центральной нервной системы включают головную боль, затылочную оцепенелость, отек, воспаление соска зрительного нерва и фокальные неврологические аномалии.
Гематогенное распространение Candida может проявляется симптомами тяжелой бактериальной инфекции: ознобом, лихорадкой, пониженным артериального давлением, прострацией.
Кандидоз относится к наиболее частой грибковой суперинфекции у больных ВИЧ-инфекцией. Заболевание у них почти исключительно ограничивается слизистыми, системная форма патологического процесса возникает в поздних стадиях. Орофаренгиальный кандидоз встречается примерно у ¾ всех больных, у 1/3 из них кандидоз имеет тенденцию рецидивировать и прогрессировать по тяжести течения по мере усугубления иммунодефицита. У 20-40% больных СПИДом развивается кандидозный эзофагит и в основном у лиц с низким уровнем CD4+ клеток. Как и при других суперинфекциях, после внедрения активной антиретровирусной терапии частота развития кандидоза снизилась на 65-70%.
Вульвовагинальный кандидоз встречается примерно у 30-40% больных ВИЧ-инфекцией женщин. ВИЧ/СПИД считается фактором риска для развития вульвовагинального кандидоза.
Ведущим этиологическим агентом кандидоза слизистых оболочек у больных ВИЧ-инфекцией является Candida albicans, на его долю приходится почти весь кандидоз у больных ВИЧ-инфекцией и в 75-90% рецидивов. У половины больных рецидивы обусловлены теми же штаммами С.albicans, у остальных – другими штаммами С.albicans или новыми видами, среди последних чаще выявляется С.parapsilosis.
В основном (80%) у больных ВИЧ-инфекцией распространение кандидоза идет из флоры рта. Этому способствует применение антибактериальных соредств.
У больных ВИЧ-инфекцией клинические проявления кандидоза зависят от уровня иммунодефицита. При оро-фаренгиальной форме в процесс вовлекается слизистая полости рта с клиникой кандидозной ангины, стоматита. В случаях прогрессирования процесс переходит на слизистые оболочки половых органов с клиникой вульвовагинита и баланопростита. При выраженных формах иммунодефицита, когда количество CD4+ клеток падает ниже 200 в 1 мкл, процесс из слизистой полости рта спускается вниз с поражением пищевода, трахеи, бронхов, легких.. Эти формы кандидоза расцениваются как СПИД-индикаторные, так как кандидозный эзофагит редко развивается при количестве CD4+ клеток выше 100 в 1 мкл ( Polis M.A., Kovacs J.A.,1997).
Диагностика кандидоза кожи и видимых слизистых оболочек не вызывает затруднения, но для подтверждения глубоких форм кандидоза уже троебуются инструментальные методы обследования больного. Для анализа берут полученную при бронхоскопии мокроту, но нередко трахеобронхиальные аспираты бывают настолько забиты паразитами, что затрудняют получение мокроты из нижних отделов дыхательных путей. Лишь чрезкожная трансторакальная аспирация или хирургическая биопсия легкого позволяют уточнить диагноз. Цистоскопия дает возможность диагностировать кандидозный цистит. Но без хирургического вмешательства невозможно установитть кандидозную этиологию пиелонефрита, почечного карбункеула или околопочечного абсцесса, ибо нужна биопсия или аспирация гноя. Нельзя диагностировать кандидозную этиологию эндофтальмита, ретинита. При поражении ЦНС помогает мазок спинномозговой жидкости или аспират и биопсия церебральных поражений, уточнить локализацию их помогает компьютерная томография. Аспирация синовиальной жидкости и биопсия костных поражений позволяют диагностировать кандидоз костей и суставов.
Серодиагностика общего кандидоза применялась в течение десятилетий, однако, до сих пор нет четкого метода. Работе, направленной на развитие диагностики путем определения гуморальных антител, воспрепятствовало отсутствие стандартных реактивов между тестами и методами.
Для лечения микозов используется ряд лекарственных средств, среди которых наиболее широко применяются 4-5 препаратов (табл. 64).
Кетоконазол предназначен для лечения слизисто-кожного кандидоза, прием препарата по 200 мг один раз в день приводит к улучшению в течение 6-18 дней и через 6 месяцев к ремиссии. Однако, не исследован до конца вопрос о продолжительности терапии, так как после прекращения лечения часто возникают рецидивы. При вагинальном кандидозе используют крема, содержащие Нистатин или противогрибковый имидазол. Но чтобы наверняка избежать рецидива следует прекратить лечение противомикробными средствами, в частности тетрациклином.
При кандидозе ротовой полости целесообразно использование нистатина и амфотерицина 4-6 раз в день. Прием нистатина и других антигрибковых средств еще не доказали свою эффективность при лечении желудочно-кишечного кандидоза.
Таблица 64. Характеристика некоторых антигрибковых средств
| Характеристики | Амфотерицуин В | 5-флуороцитозин | Миконалол | Кетоконазол |
| Способ применения | Внутривенно | Внутрь | Внутривенно | Внутрь |
| Действие | Антибиотик | Ассимиляция нефункциональной РНК | Антиметаболическое | Антиметаболическое |
| Эффект | Фунгистатический | Фунгистатический | Фунгистатический | Фунгистатический |
| Токсичность | ++++ | ± | + | + |
| Выведение | Желчь | Моча | Катаболизм | Катаболизм |
При кандидозе внутренних органов оправдана общая терапия с использованием антимикробных средств. Так как иммунодепрессанты очень часто провоцируют возникновение кандидоза, то такие противомикробные средства как имидазол играют меньшую роль, чем Амфотерицин В. Последний в общей терапии грибковой инфекции применять стали впервые в 1955 г. Однако препарат имеет свои особенности. Например, 24 часа составляют половину времени действия лекарства в организме. Поэтому нет необходимости принимать его ежедневно. Кроме того, местное раздражение периферических вен приводит к развитию тромбофлебита, исходя из этого следует применять соответствующие концентрации амфотерицина В. При употреблении амфотерицина В могут возникнуть отрицательные реакции, такие как озноб, лихорадка, головная боль, тошнота, слабость, обычно бессимптомная и возникающая после второй дозы, преодолевающаяся путем приема раствора 0,9% хлорида натрия. Иногда из-за нарастающей слабости Амфотерицин В приходится отменять. Наблюдения показывают, что Амфотерицин В может оказывать побочное действие на организм больных. Так, анемия, развившаяся по меньшей мере у 75% пациентов, является результатом подавления эритропоэза и нарушения функции почек. Амфотерицин В может вызывать также нефропатию. При нормальной почечной функции и при дозе лекарств не более 2 г. у 15% больных развивается нефропатия, а если общую дозу увеличить до 5 г., то у 80% больных болезнь развивается в форме гломерулонефрита. Поэтому длительность приема и доза лечения определяются индивидуально. Важно учесть низкую степень проникновения амфотерицина В в ЦНС и мочу.
В таблице 65 представлены наиболее широко применяемые при кандидозе препараты, их лекрственная форма и дозироака.
Таблица 65. Лечение орального и эзофагального кандидоза
|
Препарат |
Лекарственная форма |
Дозировка |
| Нистатин | Суспензия, per оs; пастилки | 4-6 мл 4 раза в день; 1-2 пастилки 4 раза в день |
| Клотримазол | таблетки, 10 мг | 1 табл. 4 раза в день |
| Кетоконазол | таблетки |
200 мг ежедневно; 400-600 мг в день* |
| Флюконазол | таблетки |
50-100 мг в день 200-400 мг в день* |
| Итраконазол | капсулы, суспензия |
200 мг ежедневно 100 мг (10 мл) 2 раза в день |
| Амфотерицин | В вену инфузии; суспензия per os |
0,3-0,5 мг/кг в день 100 мг (1 мл) 3-4 раза в день |
Примечание: *- при кандидозном эзофагите
Средняя продолжительность лечения обычно составляет 7-14 дней. Отдельные больные нуждаются в более высоких дозах препаратов или более продолжительном курсе терапии.
При орофаренгиальном кандидозе большинство больных хорошо реагирует на антифунгальную терапию. Нистатин менее эффективен, чем другие препараты. При далеко зашедших вариантах кандидоза у больных флюконазол и интраконазол предпочтительнее, чем Кетоконазол. У больных ВИЧ-инфекцией при орофаренгиальном кандидозе обычно 7-дневный курс лечения в 90-100% случаев ведет к клиническому выздоровлению, хотя микологический анализ позволяет выявлять С.albicans из полости рта.
Вульвовагинальный кандидоз легко лечится местным применением противогрибковых препаратов. Короткие курсы клотримедазола, миконазола или бутоконазола оказывают хороший эффект. Системная терапия в неосложненных случаях кандидоза не проводится.
Лечение кпандидоза пищевода требует системной антифунгальной терапии. Обычно прибегают к назначению флюконазола. Но применение per os лекарственных препаратах в далеко зашедших случаяъ кандидозного эзофагита может оказаться неэффективным и в таких случаях прибегают к назначению амфотерицина В по 20-30 мг в день в течение 1-2 недель.
У больных ВИЧ-инфекцией характерен кандидоза рецидивирующего течения. Так как во многих случаях рецидив протекает тяжело, прибегают к терапии флюконазолом по 100-200 мг в день и для профилактики вагинального кандидоза по 100 мг в день. К сожалению, длительное прим6енение флюконазола ведет к формированию устойчивых форм С.albicans, что требует увеличения суточной дозы до 800 мг. Особенно это характерно для далеко защедших вариантов ВИЧ-инфекции. До применения активной антиретровирусной терапии у 5-7% больных ВИЧ-инфекцией развивался кандидоз, резистентный к терапии флюконазолом. Активная антиретровирусная терапия меняет ситуацию в лучшую сторону.
Из всех имеющихся антигрибковых средств флуцитозин (5-фторцитозин) способен надежно проникать в ЦНС и спинномозговую жидкость. Если почки функционируют нормально, то доза в 200 мг/кг веса хорошо переносится и достигает пиковой концентрации в сыворотке уже час спустя. Чтобы компенсировать снижение активности почек, каждая шестичасовая доза сокращается в прямой пропорции к клиренсу креатинина.
В связи с тем, что при амфотерапии В имидазолы не достигают эффективного порога концентраций в моче, они менее чем флюцитозин полезны при лечении пиелонефрита, вызванного Candida.
У больных с нормально функционирующими защитными функциями единственно необходимым средством лечения кандидоза может быть изменение механических предрасполагающих факторов, например, перемещение внутривенного катетера, загрязненного Candida.
В виду того, что кандидоз по своему происхождению эндогенен, профилактические меры, прежде всего , следует направлять на сохранение защитных сил организма.
Аспергиллез. Аспергиллез относится к заболеваниям, вызываемым различными видами плесневых грибов рода Aspergillus. Клинически протекает с преимущественным поражением легких, у лиц с иммунодефицитами принимает генерализованное течение в виде тяжелого сепсиса. Среди различного вида грибов рода Aspergillu наибольшее значение в патологии человека имеют A. niger, A. flavus. По структуре они состоят из однотипного мицелия, иногда обнаруживаются “головки” с конидиями. На среде Сабуро растут быстро, образуя плоские колонии, сначала белые, слегка пушистые или бархатистые, затем в зависимости от вида принимают синеватую, коричневую, желтоватую окраску. Аспергиллы отличаются большой биохимической активностью, образуют различные ферменты, в частности протеолитический, сахаролитический, липолитический. Некоторые виды содержат эндотоксины, при введении которых экспериментальным животным развиваются параличи и наступает их гибель.
В природе аспергиллы широко распространены, они постоянно обнаруживаются в почве, зерне, муке, сене (особенно заплесневелых), в пыли помещений, где обрабатываются шкуры, шерсть. В организм человека проникают чаще через воздух с пылью. Ими чаще поражаются работники сельского хозяйства, ткацких и бумагопрядильных предприятий. У лиц с иммунодефицитами аспергиллез может возникнуть и как эндогенная инфекция. В связи с пандемией ВИЧ-инфекции аспергиллез стал актуальной проблемой. Так у лиц с дисфункцией иммунной системы в 20% развиваются микозы, а среди последних более 70% приходится на аспергиллез.
Аспергиллы аэрогенным путем попадает на слизистые оболочки верхних дыхательных путей, инфицирование может произойти и через кожу в случае поражения ее каким-либо другим патологическим процессом. Ведущую роль в патогенезе аспергиллеза играет снижение функции иммунной системы. Поэтому аспергиллез чаще развивается на фоне патологических процессов кожи, слизистых оболочек, внутренних органов. Так, легочные формы аспергиллеза в основном развиваются у больных бронхоэктатической болезнью, абсцессом легкого, туберкулезом, раком легких, хроническим бронхитом. В последние годы аспергиллез стал особенно часто наблюдаться у лиц, получающих противоопухолевую химиотерапию, иммунодепрессанты, у больных ВИЧ-инфицией. Среди глубоких микозов он занимает ведущее место.
У больных ВИЧ-инфекцией вначале поражаются грибом легкие, затем в процесс вовлекаются плевра, лимфатические узлы. Аспергиллы с током крови могут заноситься в другие органы, образуя там специфические гранулемы, которые обычно абсцедируют. Первоначально легочной аспергиллез переходит в генерализованный с клиникой септического процесса, который у половины заболевших ведет к гибели больного. Благоприятный прогноз может быть только у больных, у которых сохранились в какой-то мере функции иммунной системы.
При аспергиллезе инкубационный период точно не установлен. Грибы могут поражать любые органы и ткани. Наиболее часты следующие клинические варианты: 1) бронхолегочный аспергиллез; 2) генерализованный (септический) аспергиллез; 3) аспергиллез ЛОР-органов; 4) аспергиллез глаза; 5) аспергиллез кожи; 6) аспергиллез костей; 7) прочие формы аспергиллеза (поражение слизистых оболочек рта, гениталий, мико-токсикозы и пр.).
Бронхолегочный аспергиллез в начальном периоде проявляется как аспергиллезный бронхит или трахеобронхит. Первоначально аспергиллы находятся в поверхностных слоях слизистой оболочки бронхов, затем процесс распространяется глубже, образуются поверхностные и более глубокие изъязвления. Больного беспокоит общая слабость, кашель с выделением серого цвета мокроты, иногда с прожилками крови. Уже в этот период в мокроте могут обнаруживаться комочки, в которых содержатся аспергиллы. Процесс чаще прогрессирует, аспергиллы обсеменяют легкие, в силу чего развивается аспергиллезная пневмония. Легочная форма из острой может перейти в хроническую. При острых формах повышается температура тела, лихорадка обычно неправильного типа, часто больных беспокоят повторные ознобы, появляется кашель с обильной вязкой слизисто-гнойной или кровянистой мокротой. У части больных мокрота содержит зеленовато-серые комочки, в которых при микроскопии обнаруживаются скопления мицелия и спор гриба. В этот период появляются одышка, боли в груди, ночные поты, нарастает слабость, похудание. При аускультации выявляются мелкопузырчатые влажные хрипы, при переходе процесса на плевру - шум трения плевры. В крови лейкоцитоз до 20х109 /л, эозинофилия, увеличивается СОЭ. Рентгенологически обнаруживается воспалительная инфильтрация в виде инфильтратов, склонных к распаду. Вокруг образующихся полостей виден широкий инфильтративный вал.
В отличие от острых хронические формы легочного аспергиллеза обычно вторичны и наслаиваются на различные поражения легких (бронхоэктазы, каверны, абсцессы). Клиническая картина зависит от симптомов основного заболевания, на проявления которого наслаиваются симптомы, обусловленные аспергиллезной инфекцией. Часть больных отмечают запах плесени изо рта. Для рентгенологической картины характерно заполнение полостей, образовавшихся в результате основного заболевания, своеобразной тенью в виде шара с воздушной прослойкой между тенью шара и стенками полости. Прослойка газа выявляется в виде своеобразной серповидной полости. Септические формы генерализованного аспергиллеза характерны в основном для больных ВИЧ-инфекцией. Они обусловлены гематогенным распространением аспергилл с образованием метастазов в различных органах и тканях. При поражении желудочно-кишечного тракта наблюдаются тошнота, рвота, запах плесени изо рта, жидкий пенистый стул, содержащий большое количество аспергилл. Среди вариантов аспергиллез ЛОР-органов наиболее часто встречаются наружный и средний отит, поражение аспергиллами слизистой оболочки носа и придаточных полостей, гортани.
Среди других локализаций характерны для генерализованного аспергиллеза абсцессы головного мозга, специфические увеиты, множественные поражения кожи в виде своеобразных узлов.
Клинические проявления аспергиллеза у больных ВИЧ-инфекцией сочетаются с клиникой основного заболевания, т.е. клиникой той суперинфекций, на которую наслативается аспергиллез,чаще это генерализованная герпетическая инфекция, пневмоцистная пневмония, саркома Капоши, криптоспороидоз, кандидоз. Наслоение аспергиллезного сепсиса на клинику существующей суперинфекции у больных СПИДом приводит к летальному исходу.
Аспергиллез относится к частым микозам, развивающимся в конце предСПИДа, но чаще уже в фазе СПИДа. Заболевание развивается быстро, протекая в начале в виде легочного аспергиллеза, затем процесс генерализуется, переходит в септическую форму, протекая тяжело.
При диагностие аспергиллеза учитываются клинические проявления болезни, образование характерных инфильтратов с последующим распадом, характер мокроты, лейкоцитоз, эозинофилия. Окончательно диагноз подтверждается лабораторно выделением возбудителя из мокроты, материала, взятого из бронхов, биоптатов пораженных органов. Из крови аспергиллы выделяются очень редко даже при генерализованных формах болезни. В постановке диагноза значение имеет выявление антител к возбудителю при помощи серологических реакций (РСК). Если у лиц с нормальной функцией иммунной системы в диагностике имеют значение кожные пробы со специфическим аспергиллезным антигеном, правда в случаях относительно доброкачественного течения, то у больных ВИЧ-инфекцией уже в стадии предСПИДа реакции ГЗТ становятся отрицательными, что сводит на нет диагностическую значимость кожные пробы.
Аспергиллез необходимо дифференцировать с другими микозами (нокардиоз, гистоплазмоз, кандидоз), туберкулезом легких, абсцессами легких, новообразованиями, хроническим бронхитом клиническая картина и рентгенологические проявления которых в определенной степени сходны.
Лечение легочного и генерализованного аспергиллеза до конца не решено, химиотерапия мало эффективна. При легочном аспергиллезе с ограниченным инфильтратом успешно применяют хирургические методы, в частности лобэктомию с резекцией пораженных участков легкого. У большинства больных операция дает хорошие отдаленные результаты. При распространенном процессе с поражением многих органов хирургические методы используются в комплексе с консервативным лечением. Больным назначают препараты йода внутрь в нарастающих дозах, обычно используют йодид калия или натрия, в начале используют 3% раствор, затем 5 и 10% по 1 столовой ложке 3—4 раза в день, возможно применение 10% настойки йода в молоке от 3 до 30 капель 3 раза в день. Антимикотическая терапия заключается в назначении амфотерицина В в суточной дозе 250 ЕД/кг внутривенно в 5% растворе глюкозы - 50 000 ЕД амфотерицина В в 450 мл раствора глюкозы. Амфотерицин В вводят капельно в течение 4—6 часов, 2—3 раза в неделю с длительностью курса от 4 до 8 нед у лиц с нормальной иммунной системой и дольше у больных ВИЧ-инфекцией. Больным назначают витамины, проводится общеукрепляющее лечение. Антибиотики тетрациклиновой группы и левомицетин противопоказаны, так как они способствуют возникновению аспергиллезов.
В терапии аспергиллезных поражений кожи и слизистых оболочек используют местно противовоспалительные и противомикозные препараты.
При легочных формах летальность составляет 20—35%, у больных ВИЧ-инфекцией около 50%.
Криптококкоз. В группу СПИД-ассоциируемых микозов включен и криптококкоз, внелегочная форма его входит в число СПИД-индикаторных заболеваний. В первые годы пандемии ВИЧ-инфекции примерно у 1/5-1/4 больных ВИЧ-инфекцией выявляли криптококкоз, до того встречавшийся довольно редко. Однако, в последние годы его удельный вес в структуре СПИД-ассоциируемых заболеваний снизился. Так, в США его выявляют у 6-12% больных (Chuck R.A., Sande M.A.,1988; Clark R.A.et al.,1990). CDC сообщает уже о наличии криптококкоза лишь у 1,5 % из 160 тыс. больных СПИДом (Polis M.A., Kovacs J.A., 1997). B.P. Currie и Casadevall A., 1994) показали, что среди ВИЧ-инфицированных с уровнем CD4+лимфоцитов ниже 200 клеток в 1 мкл. криптококкоз встречается в 6,1-8,5%. Из 1115 обследованных гомосексуалистов Сан Франциско, страдающих ВИЧ-инфекцией, криптококкоз диагностирован в 8,6% (Katz M.H. et al., 1994). Вместе с тем, криптококкоз стоит на третьем месте после ВИЧ-энцефалопатии и токсоплазменного энцефалита по причинам поражения ЦНС у больных ВИЧ-инфекцией (Zuger A. еt al.,1986).
Среди большого количества видов криптококков, относящихся к дрожжеподобным грибам рода Cryptococcus только С. neoformans считается патогенным для человека, из остальных лишь С. albidus и C. laurentii изредка вызывают спорадические заболевания.
Криптококки постоянно обнаруживаются во внешней среде, молоке коров, сливочном масле, на различных овощах, в атмосферном воздухе. Ими загрязнена почва. Поэтому человек имеет постоянный контакт с грибом, но содержащиеся в сыворотке крови здорового человека факторы противогрибковой защиты, нормальное функционирование иммунной системы обеспечивает невосприимчивость к криптококку.
C. neoformans существует в виде двух разновидностей: C. neoformans var. neoformans и C. neoformans var. gatti, причем у больных ВИЧ-инфекцией встречается преимущественно первый вариант. С. neoformans существуют в дрожжевой (несовершенной) и половой (совершенной) фазах. Первые представляют собой сферические или овальные клетки со средним размером 5-8 мкм, окруженные слизистой капсулой с вариабельной толщиной от едва заметной до превышающей толщину двух диаметров самой клетки. В совершенной фазе криптококк имеет грифы с большим количеством концевых базидий. Тканевая форма C. neoformans представлена инкапсулированными круглыми или овальными клетками, расположенными группами или по одиночке, одновременно находящихся на различных морфологических стадиях: начальной в виде мелких дрожжеподобных клеток, промежуточной в виде инкапсулированных форм и промежуточных дегенеративных - в виде бескапсульных крупных клеток. Капсула, очевидно, является основным фактором патогенности гриба. Она определяет способность гриба к внедрению, размножению и диссеминации. Капсула обеспечивает и сохранность гриба в организме больного, ибо она тормозит фагоцитоз. Поэтому сильно инкапсулированные штаммы более патогенны, чем слабо инкапсулированные, хотя у больных СПИДом выявляются как те, так и другие, т.е. нет четкой связи между размером капсулы и особенностями клиники.
Капсула является источником растворимого полисахаридного антигена, накопление которого в крови больного обусловливает иммунодепрессивное действие, активизирует Т-супрессоры, обеспечивая в конечном итоге угнетение и клеточного, и гуморального иммунитета.
Хотя С. neoformans может поражать все ткани организма человека, но патогенные штаммы обладают выраженным нейротропизмом. Объясняется это рядом факторов: а) криптококки в спинномозговой жидкости находят хорошую питательную среду, б) в спинномозговой жидкости отсутствует антикриптококковый и фунгинстатический фактор, имеющийся у людей в сыворотке крови, в) мозговая ткань богата тимином, глютаминовой кислотой, углеводами, обеспечивающими размножение гриба. Поэтому при ВИЧ-инфекции различные клинические формы криптококкоза часто завершаются поражением вещества и оболочек головного мозга.
У предрасположенного к криптококкозу человека, особенно с явлениями клеточного иммунодефицита проникший внутрь гриб вызывает формирование первичного очага. Чаще первичным местом локализации служат легкие или лимфатические узлы. Если защитные силы организма человека способны локализовать процесс, возможно обратное развитие его с выздоровлением без специфического лечения, если же иммунодефицит выражен, происходит диссеминация возбудителя с заносом его из первичного очага в различные органы, определяя клинику болезни (табл. 66).
Таблица 66. Частота (%) различных клинических проявлений криптококкоза у больных СПИДом и при отсутствии ВИЧ-инфекции
(цит. по Колуканову И.Е. и соавт., 1990)
| Патологические изменения | СПИД - | СПИД+ |
| Поражение ЦНС | 5-22 | 50 |
| Криптококцемия | 5-22 | 18-50 |
| Экстраневральные поражения | 15-30 | 36-66 |
| Поражения легких | 15-20 | 40-60 |
| Поражения кожи | 5-10 | 10-20 |
При поражении нервной системы у больных ВИЧ-инфекцией криптококковая этиология выявляется у половины-трети больных (Колуканов И.Е. и соавт., 1990, Лысенко А.Я. и соавт., 1996). Криптококковый воспалительный процесс чаще локализуется в оболочках головного мозга и ведет к формированию менингита. Больных беспокоит упорная и выраженная головная боль, чаще локализующаяся в лобной или височных областях, головокружение, тошнота и рвота, раздражительность, ослабление памяти. При прогрессировании изменяются поведенческие реакции вплоть до выраженных психических расстройств. Объективно выявляются снижение остроты зрения, диплопия, нистагм, анизокория, птоз, атрофия зрительного и парез лицевого нерва. Характерны менингиальные симптомы: ригидность затылочных мышц, симптомы Кернига, Брудзинского. Заболевание протекает не так остро, как менингококковый менингит, имеет более торпидное, но прогрессирующее течение с выраженной лихорадкой или субфебрильной температурой. При спинномозговой пункции выявляется повышенное спинно-мозговое давление, спинномозговая жидкость прозрачна или ксантохромна, при ее анализе выявляется повышенное содержание белка и снижение глюкозы, плеоцитоз у 1/3 больных выраженный, у 2/3 - умеренный. И клинически и по картине ликвора криптококковый менингит напоминает картину туберкулезного менингита. Но при дополнительном исследовании в ликворе у 90-100 % больных выявляется криптококковый антиген и часто удается выделить при микроскопии или в культуре при посеве клетки гриба. Наиболее характерные клинические и лабораторные симптомы криптококкового менингита приводят M.A. Polis и J.A. Kovacs (1997), обобщив данные литературы и свои наблюдения (табл. 67).
Таблица 67. Симптомы, синдромы и лабораторные изменения у больных криптококковым менингитом
| Характеристика | Частота, % |
| Головная боль | 67-100 |
| Лихорадка | 62-95 |
| Нарушение психики | 18-28 |
| Менингеальный синдром | 25-30 |
| Припадки | 4-9 |
| Фокальные неврологические изменения | 6-17 |
| Наличие криптококкового антигена в сыворотке крови | 94-100 |
| Наличие криптококкового анитегена в спинномозговой жидкости | 91-100 |
|
Изменение в спинномозговой жидкости: o глюкозы o белка o лейкоцитов |
17-64
35-69
13-35 |
Через несколько месяцев без лечения криптококковый менингит заканчивается смертью. В этих случаях на вскрытии при осмотре головного мозга обнаруживаются незначительные изменения: на основании мозга и мозжечка, в субарахноидальных пространствах имеется эксудат слабо-мутного или кремово-белого цвета.
Криптококкоз легких чаще развивается в результате первичного заражения. В наблюдениях А.Я.Лысенко и соавт. (1996) у больных СПИДом с криптококкозом без поражения ЦНС в 2/3 случаев процесс локализуется в легких, в то время как в случаях криптококкового поражения нервной системы с клиникой менингита патология легких выявляется лишь в 18%.
Клинически криптококковое поражение легких протекает с маловыраженной симптоматикой. На фоне нормальной или субфебрильной температуры появляются боль в грудной клетке, ночные поты, выделение скудной слизистой мокроты, в которой возможна примесь крови. Лишь изредка заболевание приобретает черты типичной бронхопневмонии. Рентгенологически выявляются очаги инфильтрации в нижних долях легкого, иногда рентгенологическая картина напоминает проявления милиарного туберкулеза.
Помимо поражения нервной системы и легких при ВИЧ-инфекции криптококкоз протекает в виде глазной (криптококковый эндофтальмит), кожной (первичный кожный криптококкоз), диссеминированной форм. Кожная форма по клинике напоминает контактный молюск, процесс локализуется на лице, шее, туловище и конечностях. Поражение слизистых оболочек носовых ходов и коньюнктивы глаз может сочетаться с кожными проявлениями или протекать изолированно. На коже процесс может быть и локализованным и распространенным. Изменения на коже носят акнеподобный характер, а на слизистых оболочках носа в виде язвенно-некротических очагов. Диссеминированная форма в связи с генерализацией процесса проявляется вторичными очагами во внутренних органах, на коже и слизистых, в виде генерализованной лимфаденопатии. Как проявление диссеминированной формы могут наблюдаться криптококковые гепатиты, пиелонефриты, миокардиты, перитониты, а также криптококкоз глаз, селезенки и др. органов. Генерализованные формы сопровождаются криптококкемией и гриб удается выделить из крови и мочи.
Диагностика криптококкоза включает микологическое исследование патологического материала, цитологическеое и биохимическое исследование спинномозговой жидкости, выявление антигена и антител к нему в спинномозговой жидкости и сыворотке крови. В диагностике легочной формы помогает рентгенография грудной клетки.
Лечение больных криптококковым менингитом, как СПИД-ассоциируемой патологии, включает начальную терапию амфотерицином В в сочетании с 5-флуцитозином в течение 6-12 недель и поддерживающую терапию амфотерицином В в сочетании с дифлюканом. Существуют и другие комбинации лечения, но все включают Амфотерицин В, 5-флютозин или дифлюкан.
Смертность при криптококковом менингите достигает 10-25%.
БАКТЕРИАЛЬНАЯ ИНФЕКЦИЯ
Туберкулез. Считается, что 1/3 мировой популяции, т.е. около 1,7 млад. человек являются носителями латентного туберкулеза. После внедрения стрептомицина в 1944 году туберкулез не стал столь грозной инфекцией с высокой летальностью. Внедрение плановой вакцинации позволило резко снизить заболеваемость. Но несмотря на то, что туберкулез научились лечить, скорость увеличения туберкулеза в мире составляет 50% каждые 10 лет.
Пандемия ВИЧ-инфекции вновь поставила проблему туберкулеза на уровень актуальной, ибо среди ВИЧ-инфицированных возрастной группы 25-49 лет резко возрос туберкулез, причем ареал распространения туберкулеза совпал с уровнем заболеваемости ВИЧ-инфекцией. В США, где показатель заболеваемости составляет 8,7 случаев на 100 000 населения, до 1985 года заболеваемость снижалась со скоростью 6% в год, однако, на фоне эпидемии ВИЧ-инфекции в 1985-92 г.г. заболеваемость стала расти со скоростью 3% в год, достигнув в 1992 году показателя 10,5 на 100 000. Предпринятые меры позволили снизить показатель заболеваемости в 1997 году до 7,4.
Заболеваемость туберкулезом у больных ВИЧ-инфекцией составляет 2,5-15% в год, что в 50 раз превышает показатель среди общей популяции. Причем, как суперинфекция туберкулез развивается на ранних фазах болезни при относительно высоких показателях CD4+ клеток.
Среди больных СПИДом туберкулез встречается в 10%, а смертность достигает 43-89%. В одной тюрьме США у 56 % больных ВИЧ-инфекцией и СПИДом выявлен туберкулез (Braun M.M. et all., 1989). По прогнозам к 2000 году ожидается около 1,4 млн. больных ВИЧ-инфекцией в ассоциации с туберкулезом.
В связи с тем, что при уменьшении количества CD4+клеток ниже 200 в 1 мкл у больных ВИЧ-инфекцией развивается внелегочная форма туберкулеза, внелегочной туберкулез включен в группу СПИД-индикаторных болезней.
Таким образом, туберкулез возвращается как главная общественная проблема здоровья в развитых странах при сохранении высокого распространения в развивающихся. В последние годы появились устойчивые к лекарственным средствам формы, увеличилась болезненность и смертность. Подъем заболеваемости туберкулезом в определенной степени связан с эпидемией ВИЧ-инфекции. Высокая восприимчивость больных ВИЧ/СПИД к микобактериям уникальна, одновременно создавая много трудностей и в плане диагностики и лечения. ВИЧ-инфекция обусловила эпидемию туберкулеза.
Высок риск реактивации скрытого туберкулеза у больных ВИЧ-инфекцией. Так, по данным М.O. Rigsby and Friedland (1997) у 7 из 49 больных ВИЧ-инфекцией с положительной кожной туберкулиновой пробой за 2 года произошла реактивация туберкулеза, в то время как ни у одного из 62 с положительной кожной пробой, но не инфицированных ВИЧ. Средняя скорость реактивации туберкулеза серопозитивных к ВИЧ – 7,9 % в год.
В нозокоминальном очаге развитие активных форм туберкулеза у ВИЧ-инфицированных составляет 35,7 на 100 человек в год.
Разработана методика дифференцировки реактивации туберкулеза от свежего инфицирования. Использование этих методов показало, что у 1/3 больных ВИЧ-инфекцией с развившимся туберкулезом имеет место реактивация, в остальных случаях – новое заражение. Следовательно, больные ВИЧ-инфекцией с положительной кожной пробой на туберкулез – группа высокого риска реактивации туберкулеза.
Особенностью туберкулеза легких у больных ВИЧ-инфекцией является тяжелое течение с поражением бронхов с образованием свищей, плевры, перикарда, лимфатических узлов. Обычно, в 75-100% туберкулез у больных ВИЧ-инфекцией начинается как легочная форма, но по мере нарастания иммуносупрессии и присоединения оппортунистической инфекции у 25-70% больных идет диссеминация с развитием внелегочных форм (Грейм М.С. и соавт.,1991).
Лечение туберкулеза у больных ВИЧ-инфекцией M.O. Rigsby и G. Friedland (1997) предлагают проводить по следующей схеме (табл. 68).
Таблица 68. Рекомендации лечения туберкулеза
| Препарат | Доза в день | Максималь-мальная дневная доза | Побочный эффект |
| Изониазид |
5 мг/кг внутрь
или в/м |
600 мг | Гепатит, перифереская нейропатия, гиперсенсибилизация |
| Рифамицин | 10 мг/кг внутрь | 600 мг | Тошнота, рвота, подъем температуры, сыпь, гепатит |
| Пирадинамид | 15-25 мг/кг внутрь | 2 г | Гепатит, гиперуремия |
| Этамбутол | 15-25 мг/кг внутрь | 2,5 г | Неврит зрительного нерва, |
| Стрептомицин | 15 мг/кг | 1 г | Ототоксический и нефротоксический эффекты |
В период эпидемии ВИЧ-инфекции появилась проблема множественной устойчивости возбудителя туберкулеза. Под термином “множественная устойчивость” микобактерий туберкулеза подразумеваются штаммы возбудителя, устойчивые к 2 и более из 5 применяемых противотуберкулезных лекарственных средств первой линии (Изониазид, рифампицин, пиразинамид, этамбутол, стрептомицин). Устойчивость наблюдается главным образом в городах и в первое время среди штаммов, выделенных от больных ВИЧ-инфекцией.
Как показали наблюдения, проведенные в Африке, профилактическое лечение триметопримом-сульфаметоксазолом туберкулеза у больных ВИЧ-инфекцией довольно эффективно, эффект выявлен при всех значениях CD4+ клеток, но сильнее выражен при их количестве 0-99 в мкл.
Атипические микобактериозы. Группу возбудителей “нетуберкулезных” микобактериозов составляют представители свыше 40 видов микобактерий, из которых 18 способны вызвать патологию человека, а 4 обладают сравнительно высокой патогенностью для людей и 14 относятся к условно-патогенным. M. avium + M. intracellulare (M. avium complex), M.kansasii вызывают легочные и внелегочные формы патологии, M.marinum - гранулемы кожи, M.scrofulaceum –шейный лимфаденит, M.chelonei – абсцессы кожи и соединительной ткани
Атипический микобактериоз, вызванный Mycjbacterium avium-комплексом (МАС) относится к одной из наиболее распространенных суперинфекций в группе СПИД-ассоциированных опортунистических инфекций. До пандемии ВИЧ-инфекции она встречалась редко, только у лиц с выраженной иммуносупрессией. До 1981 года было известно, что МАС-шейным лимфаденитом и МАС-легочной инфекцией в США переболевает не более соответственно примерно 300 и 3000 человек в год. Иная ситуация сложилась на фонее эпидемии ВИЧ/СПИД. Только в США у больных ВИЧ-инфекцией на поздних стадиях болезни, когда уровень CD4+ клеток составляет менее 100 в мкл, МАС вызывает диссеминированную инфекцию примерно у 20 000 ежегодно. Причем диссеминированная форма МАС-инфекции – единственный и только у больных ВИЧ-инфекцией вариант болезни. У лиц с пересеженными органами и постоянно получающими кортикостероиды, у больных онкопатологией также развивается иммуносупрессия, но для них не характерна диссеминированная форма МАС-инфекции. В то же время у 20% больных в стадии СПИДа в год развивается МАС-инфекция в случае профилактического лечения, а без лечения – в 2 раза чаще.Появление диссеминированной МАС-инфекции у больного – признак приближающейся смерти, лечение ее – продление жизни.
Легочная форма МАС-инфекции обычно развивается у лиц, имеющих хронические поражение легких в виде хронического бронхита, бронхоэктазов, обструктивных процессов, активного туберкулеза легких, пневмокониоза.
Сложилось мнение, что МАК поступает в организм из вне, т.е. идет инфицирование больного микобактериями из вне, хотя до сих пор не определены входные ворота. Так как у больных диссеминированными формами МАС-инфекции наиболее выражена клиника со стороны желудочно-кишечного тракта, можно было полагать, что возбудитель поступает главным образом с пищей и водой. Однако, проведенные в США исследования показали, что в семьях больных ВИЧ-инфекцией МАС были обнаружены только в 1 из 528 проб воды и в 1 из 397 проб пищи, но в 27% из образцов почвы.
В большинстве случаев атипические микобактериозы развиваются или у детей или у лиц с различными видами патологии, снижающей резистентность организма. Обычно протекают они в виде ограниченных поражений кожи, суставов, лимфатических узлов, реже вызывают поражение легких. У больных СПИДом чаще регистрируется микобактериоз птичьего комплекса (M. avium complex), причем частота этого варианта СПИД-ассоциируемой патологии нарастает по мере усугубления иммуносупрессии, уровнем CD4+клеток и в США выявляется у каждого четвертого в терминальной стадии, а на аутопсии – в 53-98% (Fauci A.S.et al.,1984; Hawkins C.C. et al.,1986). Заболевание в терминальной стадии ВИЧ/СПИД протекает в локализованной или генерализованной формах. В первом случае развиваются кожные абсцессы, поражение лимфатических узлов, во втором в виде общеинтоксикационнго, желудочно-кишечного синдромов и синдрома экстрабилиарной обструкции. Общеинтоксикационный синдром характеризуется лихолрадкой, астенизацией, падением массы тела, тяжелой анемией, лейкопенией, повышением АЛТ. Для желудочно-кишечного синдрома характерны хроническая диарея, боли в животе, гепатоспленомегалия, мезаденит, синдром мальабсорбции. Синдром экстрабилиарной обструкции обусловлен перипортальным и перипанкреатическим лимфаденитом, ведущим к билиарному блоку и токсическому гепатиту (Лысенко А.Я. и соат.,1996).
Диагностика атипических микобактериозов базируется на выделении гемокультуры микобактерий, позволяющий в 86-98% выделить возбудитель.
Превентивная терапия МАС. Риск заражения МАС резко возрастает при снижении числа СD4+ клеток ниже 75 в мкл, присоединение к ВИЧ-инфекции МАС утяжеляет тяжесть болезни и определяет смерть больных. Поэтому профилактика МАС у больных ВИЧ-инфекцией при снижении количества СD4+ клеток ниже указанного уровня оправдана и обычно используется 3 препарата:
рифабутин (микобутин) – длительно действующий рифамицин, более активный, чем рифампин. В 1993 году внедрен в практику для профиилактики МАС у больных ВИЧ-инфекцией с числом CD4+ клеток менее 100 в мкл;
- макролиды кларитромицин (би6аксин) и азитромицин (зитромакс).
- При этом кларитромицин снижает заболеваемость пневмоцистозом (Р.carinii).
- Рифабутин назначается по 300 мг в день, азитромицин – пло 1200 мг 1 раз в неделю, кларитромицин по 500 мг 2 раза в день.
В 1997 году в СШАвышли в свет рекомендации по профилактике оппортунистической инфекции у больных ВИЧ/СПИД. Профилактику МАС рекомендуется начинать у лиц с числом CD4+ клеток менее 50 м скл. Азитромицин и кларитромицин рекомендуются как препараты первой линии, а рифабутин 5как альтернатива. Препараты сочетаются с ингибиторами протеазы. Кларитромицин немного более эффективен, чем азитромицин, хотя последний имеет более выгодную схему применения. Итоговые эффекты у обоих препаратов сходные, а азитромицина – ниже.
До начала терапии необходимо убедиться, что больной не имеет МАС-болезни, для чего проводится клиническое обследование и посев крови на бактериологический анализ.
Лечение активного МАС. Как и при туберкулезе монотерапия диссеминированного МАС приводит к возникновению микробной устойчивости обычно в пределах 2-3 мес. Поэтому необходима комбинированная терапия. Установлено, что выделенные из мокроты МАС устойчивы к изониазиду, пиразинамиду и часто к стрептомицину. До появления антибиотиков широкого спектра действия, в часности макролидов кларитромицина и азитромицина в терапии больных ВИЧ-инфекцией для профилактики МАС использовали комбинацию 4-5 препаратов, включая лекарственные средства с высокой токсичностью.
Активная МАС-инфекция должна лечиться минимум 2 препаратами все время, если применяемая схема лечения не эффективна, переходят на новую пару препаратов. Оптимальная доза кларитромицина – 500 мг дважды в день, азитромицин – 600 мг раз в сутки. Два других препарата первой линии – рифабутин (бактериоцидный препарат) и этамбутол (бактериостатический эффект).
Сальмонеллез, как самостоятельное заболевание хорошо известен, публикации о нем всеобъемлющи и нет надобности подробно на нем останавливаться. Лишь в рамках рассматриваемой проблемы следует отметить, что у больных ВИЧ/СПИД он приобретает ряд клинических особенностей, что и позволило включить в число СПИД-ассоциируемых заболеваний. Иммунодефицит способствует генерализации инфекции, развитию септической формы. Патогенетически сальмонеллез у больных ВИЧ-инфекцией приобретает как бы черты брюшного тифа (Белозеров Е.С., Продолобов Н.В., 1978; Котова А.Л., Е.С.Белозеров, 1992), т.е. сальмонелла прорывает кишечный барьер и поступает в кровь, но на фоне иммунодефицита идет диссеминация с образованием абсцессов в легких, мочевыводящих путях, головном мозге и его оболочках, толстой кишке. Заболевание носит рецидивирующий характер.
Анаэробная бактериальная инфекция у больных ВИЧ/СПИД. Бактериальная инфекция занимает важное место в суперинфекции больных ВИЧ/СПИД и в причинах их смерти. Ведущую роль среди них занимают M. tuberculesis, атипические микобактерии (МАС), Salmonella, Legionella, Nocardia asteroides и Listeria monocytogenes.
Изменения в функции В-лимфоцитов (дисбаланс подклассов IgG, неспецифическая поликлональная гипергаммаглобулинемия) прояавляется в заболеваниях, вызываемых Streptococcus pneumoniae, Haemophilus influenzae. Развитию бактериальной инфекции способствуют частые повреждения кожи и слизистых оболочек кишечного и респираторного тракта, применение сосудистых катетеров, опухоли, а также глистные инвазии.
В структуре бактериальных суперинфекций важное значение имеют анаэробные инфекции. В нормальных условиях анаэробы составляют подавляющее большинство резидентной микрофлоры человека, населяя слизистые оболочки ротовой полости, верхних дыхательных путей, желудочно-кишечного тракта, половых путей женщин, а также кожи. Обычно в норме гуморальный иммунитет, фагоцитоз и Т-опосредованный иммунитет противодействуют анаэробам. Иммуносупрессия, особенно у больных ВИЧ-инфекцией обеспечивает формирование анаэробной инфекции. Длительное пребывание больных в стационаре способствует колонизации нозокоминальными патогенами, в том числе и анаэробами. Частая антибактериальная терапия нарушает микробный пейзаж, изменяет баланс нормальной микрофлоры и способствует усилению роста анаэробов. У шприцевых наркоманов, как ведущей группе риска развития ВИЧ-инфекции с 1996 года, имеет место дополнительный фактор, обеспечивающий развитие бактериальной инфекции. У них часты аспирационная пневмония, сепсис, эндокардит, целюлит и абсцессы ЦНС, а возбудителями могут выступать в том числе и анаэробы.
Одной из частых бактериальных инфекций у больных ВИЧ/СПИД являются болезни перадонта, встречающихся по данным различных авторов в 3-69%. Для больных характерны гингивит, быстро прогрессирующий некротизирующий язвенный перидонтит, некротизирующий язвенный стоматит. К развитию их предрасполагают стресс, диета, низкая оральная гигиена, курение, алкоголизм.
У больных гингивитом и гингивальной эритемой слизистая десны ярко-красная, вспухшая с язвами на кончиках межзубных сосочков и вдоль краев десен. Больного беспокоит сильная боль во рту, спонтанные кровотечения из десен. Процесс может быстро прогрессировать, приводя без лечения к острой деструкции парадонта. Некроз мягкий тканей и костей ведет к быстрому и обширному разрушению перидонтального аппарата.
Большинство патогенов у этих больных относятся к грам-отрицательным анаэробам. Чаще всего при бактериологическом исследовании выделяют Porphyromonas gingivalis, Bactereoides intermedius, Actinobacillus actinomycetemcomitans, Actinomyces, Wolinella recta, Staphylococcus epidermalis. Кроме того у больных из десен выделяются экстраоральные кишечные виды патогенов, такие как Enterococcus, Clostridium, Fusobacterium species, оральные виды, а также не часто ассоциируемые с болезнями пародонта – Lactobacillus acidophilus, Streptococcus sanguis, Candida albicans.
Микробиологическая диагностика этих видов болезней пародонта затруднена, так как требует соответствующего технического обеспечения для выявления анаэробов.
При лечении используется местное ощищение, орошение разведенной перекисью водорода. При вывраженном процессе проводится антибактериальная терапия
Гангренозный стоматит, этиологически который связывают с анаэробно-бактериальной инфекцией, начинается в виде маленькой язвы или раны на коже или слизистой оболочке щеки. Процесс может быстро распространяться на губы и щеки и характеризуется зловонным некротическим поражением. Чаще подобное поражение развивается у больных ВИЧ-инфекцией с числом CD4+ Т-лимфоцитов ниже 100 в 1 мкл. Течение болезни острое, подострое или хроническое. Возможны осложнения вторичной инфекцией с распространением процесса на дыхательные пути и желудочно-кишечный тракт с последующими септицемией, обезвоживанием.
Местное лечение (очистка участков поражнения, туалет полости рта, орошение) и антибиотикотерапия (пенициллин, Клиндамицин, метронидазол) способствуют выздоровалению.
Синусит относится также к бактериальной суперинфекции у больных ВИЧ/СПИД. Его чаще вызывают S. pneumoniae, H. influenzae, а также анаэробы Propionibacterium acnes, Veillonella parvula. Предрасполагающим к развитию синусита фактором является лимфоидная гиперплазия, нарушающая дренаж синусов, инфекция ротовой полости. Присоединение синусита проявляется повышением температуры тела, головной болью, гиперемией носа и развивается чаще у больных с числом CD4+ Т-лимфоцитов менее 200 в мкл.
Инфекция респираторного тракта. Пока мало изучена роль анаэробов в патологии органов дыхания у больных ВИЧ-инфекцией. Тем не менее установлено, что анаэробы довольно часто у больных ВИЧ/СПИД вызывают такие виды патологии органов дыхания, как пневмония с наличием или отсутствием признаков некроза, легочных абсцессов, эмпиемы. Предрасполагает к развитию патологии аспирация содержимого рта или глотки, болезни перидонта или гингивит. Особенно часты эти виды патологии у инъекционных наркоманов, страдающих алкоголизмом, у лиц с развившейся неврологической симптоматиой, СПИД-деменцией, различными видами суперинфекций, злокачественными опухолями, метаболическими нарушениями, поражениями глотки, у лиц с обструкцией легких опухолями.
Анаэробы выявляются в 90% случаев аспирационной пневмонии и в 15% случаев нозокоминальной (nosocomium – больница) пневмонии. Анаэробные легочные инфекции требуют особого внимания и профессионального ухода и лечения, а для диагностики – технического обеспечения, позволяющего производить бронхоскопию, биопсию.
Инфекция желудочно-кишечного тракта. Желудочно-кишечный тракт относится к постоянно поражающей системе организма у больных ВИЧ-инфекцией, различные виды патологии с клиникой диареи выявляются в 30-50% случаев у больных развитых стран и в 90% у больных развивающихся стран. Чаще диарея обусловлена прямым действием ВИЧ, токсическим действием лекарств (диданозин, антибиотики), опухолями и наслоением суперинфекции. Среди кишечных патогенов у больных ВИЧ-инфекцикй обнаруживают вирусы, простейшие, грибы, микобактерии и бактерии. Инфекционные агенты выявляются примерно у половины больных ВИЧ-инфекцией с клиникой диареи. У гомосексулистов часто выделяют кишечные спирохеты, в частности, Trepanema hyodysenteriae, Brachyspira aalogri, установлено, что именно они являются причиной диареи. Улучшкние наступает после терапии метранидазолом.
Основной причиной инфекции желудочно-кишечного тракта с клиникой диареи у больных является Clostridium difficile. От асимптоматического носительства до тяжелого, угрожающего жизни псевдомембранозного колита вызывает этот вид клостридий у больных ВИЧ-инфекцией. Антибиотикотерапия (особенно цефалоспоринами, ампициллином, амоксициллином) больных ведет к существенному нарушению нормальной микрофлоры тостой кишки, обеспечивая интенсивный рост клостридий и выделение ими токсинов. Развитию патологии желудочно-кишечного тракта, вызванного С. difficile cпособствуют также противоопухолевые препараты, такие как циклофосфамид или антибиотики типа доксорубацин. Также предрасполагает к патологии, обусловленной С. difficile профилактическая или лечебная терапия суперинфекций. Серьезной проблемой в этом плане является также нозокоминальная инфекция – частое и длительное пребывание больных в стационаре способствует инфимцировани. С. difficile, так как многие находящиеся в стационаре больные загрязнены спорами этих клостридий. Бессимптомная колонизация С. difficile у стационарных больных ВИЧ-инфекцией достигает 15-25%.
Обусловленный С. difficile псевдомембранозный колит выявляется у 12,5% больных в стадии СПИД с клиническими проявлениями диареи. Частота развития его растет в зависимости от продолжительности госпитализации больного. Развитие чаще всего связано с терапией клиндамицином, широко применяемым для вторичной профилактики церебрального токсоплазмоза в комбинации с пириметамином у лиц с аллергией к сульфаниламидам. Установлена высокая частота развития С. difficile ассоцированной диареи у больных, получавших рифабутин для лечения диссеминированного Mycobacterium avium-комплекса. Прослеживается связь развития С. difficile – диареи с приемом ампициллина, эритромицина, цефураксина, цефтазидина, ципрофлоксацина, рифампина, этамбутола, при профилатическом приеме котримоксазола для предупреждения пневмоцистной пневмонии или токсоплазмоза ЦНС. Нарушение гомеостаза микрофлоры толстой (ободочной) кишки может быть обусловлено зидовудином, ацикловиром, фоскарнетом.
Клиника С. difficile – ассоциированной диареи варьирует от легкой утомляемости с редкими эпизодами диареи до тяжелой холероподобной диареи, сопровождающейся интенсивным болевым синдромом, лихорадкой, слабостью, тошнотой, рвотой. В испражнениях обнаруживается слизь, гной, кровь. К тяжелым осложнениям относятся токсический мегаколон, гиперпирексия, лейкемоидная реакция, фульминантный панколит.
Терапия заключаектся назначении ванкомицина или метронидазола, хотя у больных ВИЧ-инфекцией эффект менее выражен, чем у серпонегативных лиц. Почти у трети больных С. difficile – ассоциированная диарея является главной причиной смерти у больных СПИДом.
Инфекции брюшины. У больных периодически развивается аэробная и анаэробная инфекция брюшины, обычно относящаяся к эндогенной микрофлоре желудочно-кишечного тракта. Ее чаще вызывают Bacteroides, Peptostreptocjccus и Clostridium species, наиболее часто выявляется Bacteroides fragilis, составляющая 30-60% от всех случаев выделенных анаэробов. В целом спектр возбудителей внутрибрюшинной инфекции у больных ВИЧ/СПИД не отличается от этиологических факторов, выявляемых в повседневной жизни у не страдающих ВИЧ-инфекцией.
Ранняя диагностика, быстрая антимикробная терапия, а в случае необходимости хирургическое вмешательство лежат в основе лечения инфекции брюшины.
Бактериемия не редко встречается у больных ВИЧ-инфекцией, возбудителями ее являются как аэробы, так и анаэробы. Анаэробы вызывают бактериемию в случае повреждения слизистых оболочек, при инфекционных или хирургических заболеваниях желудочно-кишечного тракта, полости рта, женских половых путей, зубоврачебных процедурах, при опухолях, при инфицировании пролежней.
Анаэробная бактериемия имеет широкий диапазон клинических проявлений от доброкачественной легко протекающей формы до тяжелого сепсиса с возможными осложнениями в виде метастатических абсцессов, гнойных тромбофлебитов, септического шока с ДВС-синдромом, гемолизом эритроцитов и неблагоприятным исходом. К анаэробному сепсису предрасполагают катетеризация сосудов, плохой гигиенический уход за больным, загрязнение пораженных участков кожи и слизистых feces.
Инфекции женских половых органов. У больных ВИЧ-инфекцией женщин велик риск развития инфекций нижних половых путей в виде генитального герпеса, кандиидоза, воспалительных заболеваний таза. Анаэробные инфекции протекают в виде бактериального вагиноза, острой инфекции органов малого таза. Бактериальные вагинозы встречаются у 30-40% больных. Gardnerella vaginalis вызывает язвы слизистой вагины.
Острые воспаления органов малого таза являются восходящей инфекцией женских половых путей, в процесс вовлекается матка, фоллопиевы трубы, придатки. Воспалительный процесс чаще обусловлен гонококками, хламидиями, мтикоплазмой, уреоплазмой и рядом анаэробных и факультативно анаэробных бактерий. Это чаще всего Peptococcus и Peptostreptococcus species, Bacteroides bivius, Bacteroides disines и Bacteroides fragilis. По данным разных авторов анаэробы являются причиной тубо-овариальных абсцессов в 63-100% случаев.
Инфекции кожи и мышц. У 90-95% больных ВИЧ-инфекцией развиваются инфекции кожи. Наиболее характерно поражение в виде бактериальных кожных и подкожных абсцессов, абсцессов мягких тканей. Особенно широко распространены эти виды патологии у больных ВИЧ-инфекцией шприцевых наркоманов, бактериальная инфекция формируется в местах введения инъекций, в местах расположения сосудистого катетера, особенно если эти места загрязняются фекалиями или слюной.
Инфекция мышц проявляется в виде мионекроза, газ-образующей инфекции мягких тканей, вызываемой анаэробами. Мионекроз характеризуется быстрой деструкцией мышц, место определяется крипитация, заболевание протекает с общими системными проявлениями в виде токсемии, обусловленно С. perfringens (в 80% всех случанев клостридиального мионекроза). Развитию анаэробного мионекроза способствуют болезни периферических сосудов, плохое питание, диабет, ожирение, наркомания.
Больные ВИЧ-инфекцией внутривенные наркоманы подвержены высокому риску развития неклостридиального мионекроза, его обычно вызывают бактероиды и стрептококки.