|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
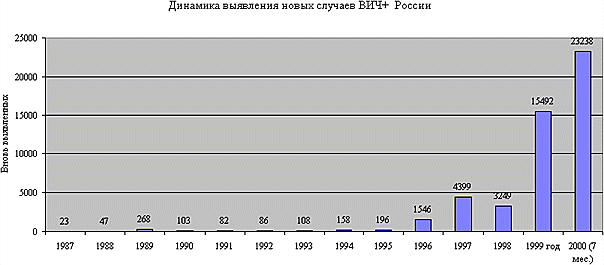
Информация для специалистов || Лечение ВИЧ-инфекцииЛечение ВИЧ-инфекцииПроф. Е.С. Белозеров. Общие вопросы терапии больных ВИЧ-инфекция в России, как и в мире в целом, продолжает набирать темпы. Показатель заболеваемости на май 2000 года составил 3 на 100 000 населения, что в 10 раз выше, чем заболеваемость брюшным тифом, выше показателей заболеваемости риккетсиозами, дифтерией, корью, иерсиниозом, примерно такая же, как заболеваемость менингококковой инфекцией, клещевым энцефалитом. На 1.08.00 в России зарегистрировано свыше 52 тыс. больных ВИЧ-инфекцией, в том числе свыше 23 тыс. (44% от всех инфицированных) заразились за 7 мес. 2000 года (рис. 1).В Санкт-Петербурге, далеко не лидирующем по заболеваемости городе страны, всего с начала эпидемии зарегистрировано около 2 тыс. больных, причем более 1400 – за семь месяцев 2000 года. т.е. больше, чем за предыдущие 9 лет вместе взятых. Все это свидетельствует о необходимости незамедлительно решать проблемупожизненной дорогостоящей терапии миллионов людей в мире и десятки тысяч – в нашей стране. Рис. 1. Взаимодействия при лечении ВИЧ-инфекции Целью терапии больных ВИЧ-инфекцией является максимальное и продолжительное угнетение репликации вируса, восстановление и/или сохранение функции иммунной системы, улучшение качества жизни, снижение связанной со СПИДом заболеваемости и смертности. На сегодняшнем уровне это может быть достигнуто максимальным соблюдением назначенной схемы антиретровирусной терапии, рациональной последовательностью применения препаратов, сохранением резервных схем лечения и препаратов на будущее. Хотя терапия ВИЧ-инфекции остается сложнейшей и нерешеннойпроблемой, определенные успехи, безусловно, имеют место. О наметившихся сдвигах эффективностилекарственной терапии уже в первые годы пандемии свидетельствуют следующие данные: в 1986 году свыше 70% инфицированных в ближайшие 2 года заболели СПИДом или умерли, а среди инфицированных в 1989 году - лишь 20%. ибо в практику лечения больных был внедрен первый антиретровирусный препарат – азидотимидин, ставший базисным для всех последующих схем комбинированной терапии. Сегодня арсенал лекарственных средств позволяет подавить вирусную репликацию у большей части больных на определенный, иногда довольно длительныйсрок, перевести заболевание в хроническое течение. Но, тем не менее, терапией удается лишь продлить жизнь больного и нет возможности полностью остановить инфекционный процесс. По мнению Люка Монтанье (1999) мы научились лечить лишь суперинфекции ВИЧ/СПИД, но не сам СПИД. Для успешного лечения больных необходимо решение следующих вопросов: 1) наличие химиотерапевтических средств, направленных непосредственно на ВИЧ,2) наличие лекарственных препаратов, направленных на ту паразитарную, бактериальную, вирусную, протозойную или грибковую суперинфекцию, в том числе онкопатологию, которая у конкретного больного определяет клинику болезни, 3) коррекциялекарственными средствами иммунодефицита. Теоретически разработка этиотропной терапии ВИЧ-инфекции базируется на ряде принципиальных подходов (табл. 1):
Таблица 1
1) блокада лиганд вируса и в первую очередь gp 120 и gp 41 антилигандами, в частности анти gp120и gp 41 – антителами; 2) создание препаратов, имитирующих рецепторы CD4, которые бы связывались с лигандами вируса и блокировали его возможность соединяться с клетками человека; 3) блокада ферментных систем, обеспечивающих репликацию вируса в клетке-мишени: а) ингибиторы протеаз, осуществляющих “раздевание” вируса, проникшего в цитоплазму клетки-мишени, б) ингибиторы обратной транскриптазы, обеспечивающей транскрипцию РНК вируса в ДНК, в) ингибиторы интегразы, обеспечивающей объединение ДНК вируса с ДНК клетки, г) ингибиторыН-РНК-азы, обеспечивающей деградацию нитей РНК вириона, 4) ингибиторы регуляторных генов tatи rev, нарушающих транскрипцию, трансляцию и рассечение вирусных белков; 5) ингибиторы посттрансляционных процессов, а именно гликолизирования и миристилирования белков. Сегодня с учетом жизненного цикла вирусасозданы препараты, ингибирующие обратную транскриптазу и протеазу. До 1991 года из лекарственных препаратов, непосредственно действующих на ВИЧ, использовался только азидотимидин (фирма Glaxo Wellcome” выпускает его под названием зидовудин, ретровир, в нашей стране торговое название препарата - тимозид). Азидотимидин(АЗТ) – нуклеозид, ингибитор обратной транскриптазы. Он был создан в 1964 году для лечения онкологических больных. С 1987 года сталприменяться при лечении ВИЧ-инфекции, так как за счет ингибирования обратной транскриптазы тормозит репликацию ВИЧ-1, ВИЧ-2, других ретровирусов и вируса Эпштейна-Барр. Уже первые годы применения азидотимидина в терапии больных позволили снизить летальность, а число суперинфекций уменьшилось в 5 раз, более замедленными темпами развивалась CD4+ лимфопения, у больных нарастала масса тела. К недостаткам терапии азидотимидином следует отнести в первую очередь формирование более, чем у половины больных устойчивых штаммов вирусов при приеме препарата свыше 6 мес., при этом прослеживается взаимосвязь формирования устойчивости с фазой болезни: при назначении в ранние сроки болезни устойчивость формируется реже, чем в более поздние фазы. Вновь сформировавшиеся резистентные штаммы порой более агрессивны, чем исходный вариант вируса. Накопленный опыт более чем десятилетнего применения азидотимидина поставил перед клиницистами вопрос, чего больше при монотерапии больных азидотимидином или любым другим антиретровирусным препаратом- пользы или вреда. При терапии этими весьма токсичными препаратами в виде монотерапии быстро развивается устойчивость вируса к ним, противовирусноедействие его прекращается, а токсическое продолжается. Очевидно, при монотерапии больше все же вреда. Проблема, насколько важно усовершенствование методик лечения больных, возникла в 1996 году, когда за рубежом был внедрен в широкую практику тест оценки вирусной нагрузки на плазму – полимеразную цепную реакцию (ПЦР), позволившую прогнозировать прогрессирование болезни. Внедрение новых антиретровирусных препаратов и возможность оценки вирусной нагрузки на плазму позволили сформулировать задачу антиретровирусной терапии - снижение вирусной нагрузки до неопределяемого с помощью ПЦР уровня, т.е. ниже 50 копий/мл, так как при такой нагрузке прекращаетсяразрушение иммунной системы вирусом, предотвращающее развитие суперинфекций, значительно падает угроза формирования резистентных штаммов вируса, хотя репликация последнего не прекращается. Среди активных антиретровирусных препаратов в основном используются аналоги нуклеозидов. Онивстраиваются во вновь синтезируемые молекулы РНК или ДНК вируса, действуют как терминаторы цепи, в силу чего прекращают дальнейший синтез нуклеиновой кислоты вируса. Кроме того, они могут конкурировать с внутриклеточными нулеозидтрифосфатами, в результатевыступают конкурентами ингибитора обратной транскриптазы. Главная цель при подборе и синтезеаналогов нуклеозидов с ретровирусной активностью – максимальное сродство с обратной транскриптазой и минимальное – с ДНК-полимеразой человека. К наиболее перспективным аналогам нуклеозидов с активностью против обратной транскриптазы относятся: диданозин (видекс, ddI, 1991),зальцитабин (хивид, ddC, 1992), ставудин(1994), ламивудин (1995), еще позже появились адефовир, ладанозин (фтористый аналог диданозина), FTC (фтористый аналог ламивудина с более выраженной активностью). Широко в клиническую практику внедрены ненуклеозидные аналоги с активностью против обратной транскриптазы: делавирдин (рескриптаза) и невирапин (вирамун). С 1995-1996 гг. также внедрены ингибиторы протеазы:индинавир,саквинавир,ритонавир, нелфинавир. Пополнился список ненуклеозиных аналогов, по активности не уступающих эффекту протеазы. Как видно из таблицы 2, 1995-1997 г.г. были наиболее плодотворными по внедрению в клиническую практику новых лекарственных препаратов с антиретровирусной активностью и для лечения суперинфекций ВИЧ/СПИД(до 10. 99). Таблица 2
При назначении лекарственных препаратов больному ВИЧ-инфекцией происходит обоюдное взаимодействие между вирусом, лекарственным препаратом и организмом человека (рис. 2).
Цель активной антиретровирусной терапии – достигнуть максимальной и длительной супрессии вируса, чтобы создать условия для восстановления иммунной системы, поврежденной ВИЧ.Последнее позволит иммунной системе осуществлять эффективный контроль за репликацией вируса и этим предотвратит развитие суперинфекции, характерной для СПИД.Сегодня идет изучение пределов, до которых возможно восстановление поврежденной ВИЧ иммунной системы, хотя понятно, что полного восстановления у большинства больных, если не у всех, достичь невозможно, тем более в условиях хронической вирусной инфекции, обусловленной ВИЧ. В 1997 году в США разработано новое руководство по лечению больных ВИЧ-инфекцией взрослых и подростков, включающее несколько основополагающих принципов: – раннее назначение антиретровирусныхпрепаратов – регулярная оценка уровня репликационного процесса – индивидуальный подход к антиретровирусной терапии – назначение антиретровирусных препаратов показано даже в случае вирусной нагрузки на плазму ниже уровня определения ПЦР -лица, выявленные в период острой первичной ВИЧ-инфекции (синдром острой сероконверсии) нуждаются в антиретровирусной терапии без учета уровня вирусной нагрузки на плазму (в том числе ниже определяемого в ПЦР) в целяхсупрессии репликации вируса; – обеспечение длительной супрессии вируса за счет комбинации антиретровирусных препаратов постоянного применения с препаратамикурсового, временного применения; – в комплексной антиретровирусной терапии каждый лекарственный препарат назначается в соответствии с его дозировкой,способом и схемой лечения; – комбинация из имеющихся антиретровирусных препаратов ограничивается механизмом их действия, совместимостью и взаимодействием, явлениями синергизма и антагонизма; – при лечении женщин не обращается внимание на наличие беременности; принципы антиретровирусной терапии детей и подростков сохраняются с учетомособенностей их организма, в том числе иммунной системы и своеобразияреакций на лекарственные средства. Нуклеозидные ингибиторы обратной транскриптазы. Антиретровирусный эффект нуклеозидных ингибиторов обратной транскриптазы можно проследить на примере АЗТ. При приеме внутрь азидотимидин хорошо всасывается, период полувыведения составляет 3-4 ч, выводится через почки. Терапия предусматривает пожизненный пероральный прием по 100 мг через 5 ч или по 200 мг через 8 ч (имеются и другие схемы лечения). Суточная доза при назначении в виде капсул или сиропа (что зависит от переносимости препарата, стадии болезни) составляет 0,3-0,6 г для взрослых и 0,01 г/кг массы тела для детей. Азидотимидинпо структуре близок к нуклеозиду тимидину, входящему в состав ДНК. В клетке азидотимидин подвергается ферментативному фосфорилированию с образованием азидотимидина трифосфата, являющегосяактивной формой препарата, так как азидотимидинтрифосфат является аналогом тимидинтрифосфата - одного из мономеров ДНК. Механизм подавления синтеза вирусной ДНК, очевидно, состоит в конкурентном ингибировании синтеза цепи ДНК. Под конкурентным ингибированием понимается связывание азидотимидинтрифосфата с обратной транскриптазой в том участке, который в норме связывает обычные нуклеозидтрифосфаты. Терминация синтеза цепи ДНК - обратная транскриптаза ошибочно включает азидотимидинтрифосфат в растущую цепь вирусной ДНК вместо тимидинтрифосфата, но присоединение следующего нуклеотида невозможно, так как в молекуле азидотимидинтрифосфата нет гидроксильной группы, которая необходима для образования связи со следующим нуклеотидом. Вирус не в состоянии исправить эту ошибку и синтез ДНК прекращается. Аналогичным образом действуют, по-видимому, другие дидезоксинуклеозиды, обладающие активностью против HIV. Все изученные на сегодня нуклеозиды оказались эффективными против ряда ретровирусов, но только в форме трифосфатов Характеристика лекарственных препаратов, представляющих эту группу приведена в табл. 3. Таблица 3
К недостаткам этих препаратов, как показал накопленный клинический опыт, относятся: а) не полностью подавляют репликацию вируса, б) высокая токсичность, в том числе азидотимидина на костный мозг, диданозина – нейротоксический эффект и способность вызвать тяжелыйгеморрагический панкреатит. Наиболее часто побочные эффекты проявляются анемией, поражением желудочно-кишечного тракта, неврологической симптоматикой,сыпью. К недостаткам всей группы ингибиторов обратной транскриптазы относятся быстрое формирование мутантных форм вируса с появлением у последних резистентности к этим лекарственным препаратам. Ненуклеозидные ингибиторы обратной транскриптазы. Характеристика препаратов этой группы представлена в табл. 4. Таблица 4
Ингибиторы протеазы. Ингибиторы протеазы, проникая в инфицированные вирусом клетки, блокируют активность вирусного фермента протеазы, препятствуют распаду длинных цепей протеинов и энзимов на короткие звенья, необходимые ВИЧ для образования новых копий. Без них вирус дефектен и не можетинфицировать клетку. Ингибиторы протеазы более мощно тормозят репликацию вируса, чем ингибиторы обратной транскриптазы и за 1 мес. лечения снижают вирусную нагрузку на 99%, в силу чего наступает ремиссия болезни, повышается уровень CD4+ лимфоцитов. Действие ингибиторов протеазы осуществляетсяв лимфоидных клетках человекаПоскольку протеаза ВИЧ отличается от протеазы человека, ингибиторы вирусной протеазы действуют избирательно, не блокируя функцию фермента клеток человека.Но к этим препаратам ибыстрее формируются устойчивые клоны вирусов. Таблица 6
Среди ингибиторов протеазы (табл. 6) наиболее широкое распространение получили криксиван и инвираза в связи с низкой связываемостью с белками плазмы, а следовательно возможностью в активной форме в больших концентрациях накопиться в плазме, а также способностью проникать через гематоэнцефалический барьер. Криксиван (индинавира сульфат) обладает активностью против ВИЧ-1. Обычно назначается по 800 мг (2 капсулы по 400 мг) внутрь каждые 8 часов, причем дозировка одинакова как при монотерапии, так и при сочетании с другими антиретровирусными лекарственными средствами. Рекомендуется применять криксиван в следующих ситуациях: больным, ранее не получавшим антиретровирусной терапии назначают криксиван: а) в сочетании с аналогами нуклеозидов, б) или в виде монотерапии для начального лечения (есливключение аналогов нуклеозидов клинически не оправдано), больным, ранее лечившимся антиретровирусными средствами криксиван назначается: а) в сочетании с аналогами нуклеозидов, б) или в качестве монотерапии для лиц получавших или получающих аналоги нуклеозидов. В лечении ВИЧ-инфекции произошел коренной перелом, связанный с применением ингибиторов протеаз. Хотя замедлять прогрессирование ВИЧ-инфекции до клинических проявлений СПИДа могут и ингибиторы обратной транскриптазы, эффективность ингибиторов протеаз оказалась намного выше. Отчасти это объясняется различными механизмами действия препаратов этих 2 классов. Ингибиторы обратной транскриптазы подавляют активность ферментов вируса, что способствует транскрипции вирусной РНК на комплементарной цепочке ДНК, которая затем встраивается в геном человека. Дальше комплементарная цепочка ДНК транслируется на мессенджере РНК, кодирующем белки ВИЧ, которые впоследствии встраиваются в зрелые вирусы. Эффективность ингибиторов обратной транскриптазы ограничивается во-первых, когда встраивание комплементарной цепочки ДНК уже произошло, то ингибиторы обратной транскриптазы не влияют на продукцию вирусного белка. Во-вторых, обратная транскриптаза ВИЧ не всегда точно транслируется с мессенджера РНК, для нее характерен высокий уровень мутаций. Если учесть, что количество продуцируемых за сутки вирусов превышает 1010 , все это в совокупности способствует быстрому формированию устойчивости к ингибиторам обратной транскриптазы. В отличие от ингибиторов обратной транскриптазы ингибиторы протеаз действуют на этапе репликации вируса, подавляя активность кодируемой вирусом аспартатпротеазы, которая расщепляет крупные белки-предшественники на мелкие пептиды, необходимые для встраивания в вирус. Они предотвращают репликацию вируса после интеграции комплементарной цепочки ДНК в геном клетки и в отличие от ингибиторов обратной транскриптазы могут препятствовать размножению вируса в инфицированной клетке. проникая в инфицированные вирусом клетки Ингибиторы протеазы, , блокируют активность вирусного фермента протеазы, препятствуют распаду длинных цепей протеинов и энзимов на короткие звенья, необходимые ВИЧ для образования новых копий. Без них вирус дефектен и не можетинфицировать клетку. Ингибиторы протеазы более мощно тормозят репликацию вируса, чем ингибиторы обратной транскриптазы и за 1 мес. лечения снижают вирусную нагрузку на 99%, в силу чего наступает ремиссия болезни, повышается уровень CD4+ лимфоцитов. Действие ингибиторов протеазы осуществляетсяв лимфоидных клетках человека. Поскольку протеаза ВИЧ отличается от протеазы человека, ингибиторы вирусной протеазы действуют избирательно, не блокируя функцию фермента клеток человека.Но к этим препаратам ибыстрее формируются устойчивые клоны вирусов, особенно при использовании ингибиторов протеаз в виде монотерапии. Токсичность ингибиторов протеазы довольно выражена, у больных через 1-2 года терапии развивается липодистрофия и растет холестерин крови. Отрицательные метаболические эффектыингибиторов протеазы значительно снижают эффект терапии. Среди ингибиторов протеазы наиболее широкое распространение получили криксиван и инвираза в связи с низкой связываемостью с белками плазмы, а следовательно возможностью в активной форме в больших концентрациях накопиться в плазме, а также способностью проникать через гематоэнцефалический барьер. Криксиван (индинавира сульфат) обладает активностью против ВИЧ-1. Рекомендуется применять криксиван в следующих ситуациях: больным, ранее не получавшим антиретровирусной терапии назначают криксиван: а) в сочетании с аналогами нуклеозидов, б) или в виде монотерапии для начального лечения (есливключение аналогов нуклеозидов клинически не оправдано), больным, ранее лечившимся антиретровирусными средствами криксиван назначается: а) в сочетании с аналогами нуклеозидов, б) или в качестве монотерапии для лиц получавших или получающих аналоги нуклеозидов. R.M. Gulick et al. (1997) показали, что добавление ингибитора протеаз к двум ингибиторам обратной транскриптазы в значительной степени повышает способность препаратов снижать содержание ВИЧ в крови. Ни у одного больного, принимавшего два ингибитора обратной транскриптазы, содержание вируса не уменьшалось ниже уровня, поддающегося определению, тогда как на фоне трехкомпонентного лечения ингибитором протеаз и двумя ингибиторами обратной транскриптазы такой эффект наблюдался в 90% случаев. S.M. Hammer et al. (1997) продемонстрировали не только снижение содержания вируса в крови, но и существенное уменьшение комбинированного показателя частоты прогрессирования ВИЧ-инфекции до СПИДа или смерти. Надо отметить, что этот благоприятный эффект наблюдался у больных с тяжелым иммунодефицитом (число лимфоцитов СD4+ <50/мм3), чего трудно было бы достичь при моно- или комбинированной терапии ингибиторами обратной транскриптазы. Таким образом, результаты применения ингибиторов протеаз возродили надежду на успешность лечения даже при выраженных клинических проявлениях СПИДа. Схемы лечения антиретровирусными препаратами. Разработано свыше 200 возможных комбинаций антиретровирусной терапии, но нет ни одной, которая являлась бы наилучшей для всех больных. В каждом конкретном случае важно найти этот лучший вариант. Наиболее эффективна комбинация 3 препаратов: 2 нуклеозидных аналога - ингибитора обратной транскриптазы и 1 ингибитор протеазы, например, азидотимидин + ламивудин + ритонавир или другая комбинация: азидотимидин + диданозин + индинавир. Современная концепция применения антиретровирусных препаратов построена на комплексном применении лекарственных средств с различными точками приложения. Ингибиторы обратной транскриптазы не действуют на латентно-инфицированные клетки, в этих случаях противовирусный эффект оказывают только ингибиторы протеазы. Так, установлено, что для возникновения резистентности к ингибиторам обратной транскриптазы достаточно одной мутации,а к ингибиторам протезы – 3-4. Правда, как было выявлено, резистентность к одному из аналогов нуклеозидов не всегда носит перекресного характера, чувствительность вируса к нуклеозидам другой группы иногда сохраняется.Чаще всего прибегают к так называемой “тритерапии”, предложенной D.Hu (1995), включающей комбинацию двух ингибиторов обратной транскриптазы (обычно ретровир и эпивир) с одним из ингибиторов протеазы (криксиван или инвираза). Именно за счет применения этого “лекарственного коктейля” удалось снизить показатель смертности в 3 раза, а в стадии тяжелого иммунодефицита с 69,3 до 23,1 на 1000 больных (Montaner L. et al.,1996). В регионах с высоким уровнем инфицированных за счет приема инъекционных наркотических средств особенно целесообразно включение в “тритерапию” эпивира, ибо он обладает одновременно и эффектом против вируса гепатита В, а у больных ВИЧ-инфекциейинъекционных наркоманов в 70-90% одновременно обнаруживаются вирусы гепатитов В и С. Оценочным показателем лечения антиретровирусными препаратами являетсядлительность снижения числа копий РНК ВИЧ в плазме и увеличение количества клеток СД4+ клеток. В большинстве случаев эффект получают через 48 недель. Рекомендуется вирусную нагрузку на плазму определять каждые 3-4 мес., а число CD4+ клеток каждые 3-6 мес. Эти тесты обязательны перед началом терапии или ее изменением и 4-8 нед. спустя от начала терапии. При этом необходимо учитывать, что некоторые больные на новое лечение реагируют позже, чем впервые получающие терапию. В оценке комбинации лекарственных средств существенную роль играет количество таблеток/капсул, частота приема лекарств, наличие требований к диете и ее ограничений, удобство приема, потенциальную токсичность и сведения о взаимодействиях различных препаратов. Существенным тормозом к широкому применению “тритерапии” ВИЧ-инфекции относится ее дороговизна – около 1000 долл. США в месяц на 1 больного, 12 тыс. долларов в год. В 1996 году на СПИД в США тратилось менее 1% всех расходов на здравоохранение: 6,7 млрд. долларов или около 20 000 на одного больного в год.Так как активная антиретровирусная терапия весьма дорога, лишь 10-15% больных ВИЧ-инфекцией живут в странах, где экономика позволяет широко внедрить этот вид терапии. В России ею государство обеспечивает лишь детей. Математическая модель, разработанная доктором Д.Толсоном (1999), позволила получить очень интересные данные об экономических аспектах высоко активной антиретровирусной терапии.На примере больных только в одном крупном городе (Нью-Йорк) было показано, что переход с монотерапии на комбинированную антиретровирусную терапию приводит к увеличению прямых затрат на лекарства на 115%. Тем не менее, суммарные расходы на лекарства (в расчете на одного больного) сократятся, так как исчезнет необходимость осуществлять профилактический прием противогрибковых или антигерпетических препаратов, а также проводить лечение различных СПИД-ассоциированных суперинфекций, сократится потребность в госпитализациях и т.д. (CDC, 2000) На конец 1998 года получали активную антиретровирусную терапию 385 000 американцев, не лечились только больные ВИЧ-инфекцией с бессимптомным течением и те, у кого имелась ранняя стадия болезни. В 1 квартале 1998 года 80% больных получали по крайней мере 1 ингибитор протеазы или ненуклеозидные ингибиторы обратной транскриптазы, 70% получали тритерапию. По данным D.Butcher (1999) у принимавших комбинированную активную антиретровирусную терапиюАЗТ + криксиван + эпивирв течение 3 лет в 70% вирусная нагрузка на плазму не определялась самыми ультрасовременными методами (<50 копий/мл). Комбинация из 2 препаратов менее эффективна, хотя нередко используется сочетание азидотимидин + ламивудин или диданозин + ставудин.Когда применяется ингибитор протеазы, то из ингибиторов обратной транскриптазы лучше использовать препараты, которые больной ранее не принимал. Идут поиски препаратов, которые можно было бы применять 1-2 раза в день. Установлено, что прием два раза в день нельфинавира и саквинавира (фортовазе) дает такой же эффект, как трехразовый прием.Разработана схема приема двух ингибиторов протеазы один раз в сутки.Предложена удобная схема лечения двумя ингибиторами протеазы - комбинация криксиван (120 мг) + ритонавир (100 мг)один раз в сутки вне зависимости от приема пищи. Так как ингибиторы протеазы обладают выраженными побочными эффектами, идет поиск схем, которые бы не включали ингибиторы протеазы, а состояли из трех нуклеозидных аналогов, в частности начинают применять комбинации трех ингибиторов обратной транскриптазы, в каждую включается новыйсильный нуклеозидный аналог абакавир (зиаген). Другие схемы включают ненуклеозидные ингибиторы обратной транскриптазы ифавиренц и невирапин (вирамун). Имеется определенный опыт применения гидроксимочевины (Hydroxyurea), как антиретровирусного препарата. Она была синтезирована против рака, но стала также использоваться в комбинации с диданозином или другим антиретровирусным препаратом и может на длительное время снизить вирусную нагрузку на плазму. Но так как гидроксимочевина токсична для костного мозга, она не может быть использована в комбинации с азидотимидином. Некоторые нуклеозидные аналоги не должны применяться вместе, например, азидотимидин со ставудином или диданозин с зальцитабином. Нельзя в комбинацию включать одновременно лекарственные средства, имеющие одно основание, например ddC и 3ТС (совпадение по последнему знаку). Если вирус резистентен в одному лекарственному препарату определенного класса, то он резистентен и к другим препаратам этого класса - перекрестсная резистентность. Поэтому при необходимости изменения вида терапии из-за неэффективности применяемого комплекса заменяют все лекарственные препараты. Если больной не ответил положительным эффектом на 2-3 комбинации, возможности воздействия на патологический процесс можно считать исчерпанными. При внедрении активной антиретровирусной терапии (тритерапии) полагали. что понадобится 3 года, чтобы полностью очистить инфицированные ВИЧ клетки организма. Но последующие исследования показали, что процесс "полураспада"клеток значительно дольше, для полного очищения организма потребуется 60 лет. Поэтому при имеющихся средствах терапиивозможно только перевести процесс в хроническое течение, а полное излечение недоступно. Врачи медицинского факультета Университета Гете во Франкфурте при обследовании 60 больных ВИЧ/СПИДом установили, что через 36 недель после начала высоко активной антиретровирусной терапии у пациентов, ранее получавших противовирусные препараты, нередко отмечается увеличение показателей вирусной нагрузки. Это обусловлено все более широким распространением среди штаммов ВИЧ резистентности к антиретровирусным лекарствам. Устойчивость к ингибиторам протеазы была выявлена у 45% больных, начавших лечение этими препаратами, и почти у 90% больных, получавших невирапин. В целом резистентность к одному или нескольким противовирусным препаратам развилась в 75% случаев Активная антиретровирусная терапия требует не только значительных финансовых расходов, но определенный настрой больного, полное подчинение его жизни лечению, строгое соблюдение по часам режима приема лекарств без пропусков,пищевого и водного режима, полное исключение алкоголя и наркотиков. Поэтому врач лишь рекомендует больному активную антиретровирусную терапию, принимает окончательное решение сам больной, оценивая свои волевые качества. По данным американских специалистов около половины больных ВИЧ-инфекцией, находившихся на активной антиретровирусной терапии не смогли полностью реализовать схему лечения в течение одного года из-за ее сложности и огромного количества таблеток. Поэтому идут интенсивные поиски схем леченияс уменьшением числа приемов лекарственных средств. Так, созданкомбивир, содержащий половинную суточной дозы АЗТ и эпивира в одной таблетке (в России зарегистрирован в 1999 году). Активная антиретровирусная терапия не показана больным алкоголизмом, наркоманией, лицам с клиникой энцефалопатии, т.е. всем тем, кто не в состоянии контролировать свое поведение. При лечении активными антиретровирусными препаратами чаще придерживаются схемы: а) один из ингибиторов протеазы: индинавир нелфинавир ритонавир б) плюс одна из комбинаций следующих нуклеозидных аналогов: азидотимидин + диданозин ставудин + диданозин азидотимидин + зальцитабин азидотимидин + ламивудин ставудин + ламивудин Саквинавир сейчас не рекомендуется как лечение 1-й линии, так как он менее эффективен по сравнению с другими ингибиторами протеазы, поэтому CDC в 1997 году из 12 лекарственных средств активной антиретровирусной терапии рекомендовал к применению 11 препаратов. Вместо саквинавира входит в практику более эффективная версия саквинавира - фортоваза. Так как ингибиторы протеазы относятся к наиболее значимому компоненту терапии больных, большинство клиницистов не рекомендуют начинать терапию комбинацией, включающей лекарственные средства этой группы. Целесообразнее использовать комбинации: а) 2 нуклеозидных аналога и 1 ненуклеозидный ингибитор обратной транскриптазы; б) 3 нуклеозидных аналога. Только после неудачной попытки остановить патологический процесс этими комбинациями прибегают к третьему варианту: нуклеозидный ингибитор обратной транскриптазы + ненуклеозидный ингибитор обратной транскриптазы + ингибитор протеазы.Этим исчерпывается последний резерв терапии. Обобщенные данные по терапии ВИЧ-инфекции представлены в табл.7. Таблица 7
ПРИМЕЧАНИЕ: * k- метод определения уровня РНК ВИЧ с использованием разветвленной ДНК; ** - полимеразная цепная реакция с использованием обратной транскориптазы; НИ ОТ- нуклеозидные ингибиторы обратной транскриптазы; ННИ ОТ -ненуклеозидные ингибоиторы обратной транскриптазы; ИП -ингибиторы протеазы. Перед началом активной антиретровирусной терапии проводится полное клинико-лабораторное обследование больного, в том числе уровень вирусной нагрузки на плазму и + Т-лимфоцитов. Если нет клинических симптомов болезни, а количество CD4+ клеток > 500 в мкл, вирусная нагрузка на плазму менее 10 000 в bДНК или 20 000 в RT-PCR (полимеразная цепная реакция), то, по мнению одних клиницистов, от проводимой терапии надо воздержаться, по мнению других- приступить к лечению немедленно, пока иммунная система не подавлена или подавлена умеренно. В случае, если клинических проявлений болезни нет, но уровень CD4+ клеток < 500 в мкл или вирусная нагрузка на плазму выше 10 000 в bДНК или ОТ-ПЦР, необходимо серьезно думать о начале активной антиретровирусной терапии. В случае наличия клиники ВИЧ-инфекции необходимо приступить к терапии без учета количества CD4+ клеток и уровня вирусной нагрузки на плазму. Большинство клиницистов придерживается точки зрения, что антиретровирусную терапию необходимо начинать при уровне CD4-клеток менее 350 в 1 мм3. Но при этом необходимо учитывать динамику, т.е. предыдущий показатель CD4+ клеток ниже 350 – это одна ситуация (идет нарастание этих клеток), а выше 350 – другая (динамика угнетения иммунной системы). Могут быть расхождения между изменениями числа клеток CD4+ и уровней РНК ВИЧ в плазме, они выявлены у 20% больных, что может затруднить принятие решений в отношении антиретровирусной терапии. Это может быть связано с рядом факторов, влияющих на определение РНК ВИЧ в плазме. Вирусная нагрузка и ее изменения считаются более информативными при принятии решений об антиретровирусной терапии по сравнению с определением числа клеток CD4 +. Прирешении вопроса лечения активными антиретровирусными препаратами учитывается: желание больноголечиться, степень иммунодефицита, которую оценивают на основании числа CD4 Т-клеток, риск прогрессирования болезни, который определяют на основании измерения вирусной нагрузки, оценка потенциальной пользы и риска терапии у данного больного, особенно с бессимптомной инфекцией. Накопленный за эти годы опыт показал, что принцип подхода к лечению больных ВИЧ-инфекцией– как при сахарном диабете -пожизненное применение антиретровирусных препаратов. Правда в последнее время разрабатывается схема прерывистого приема лекарственных средств с тенденцией все возрастающих “окон” между циклами приема. Такимобразом, достигнуты отчетливые положительные эффекты у больных ВИЧ-инфекцией с момента внедрения активной антиретровирусной терапии, которая позволяет снизить уровень вирусной нагрузки на плазму до неопределяемого уровня, повысить уровень CD4+ клеток в крови, предотвратить присоединение суперинфекции, а в целом перевести заболевание в хроническое течение. Вместе с тем, добиться положительного эффекта удается только у 70-80% больных получивших полный курс лечения при отсутствии полного выздоровления, (при терапии различных бактериальных заболеваний антибиотиками положительный эффект с полным выздоровлением достигается в 99%), причем почти половина больных, начавших лечение вынуждена его прервать из-за побочных эффектов.Более чем у 90% больных, у которых удалось снизить вирусную нагрузку на плазму до неопределяемых уровней (<400 копий),достигается это через 12недель после начала терапии, а ниже 20-50 копий – еще на несколько недель позже. Если через 5 мес. от начала антиретровирусной терапии вирусная нагрузка на плазму выше 400 копий, эффект лечения расценивается как отрицательный. Даже при положительном эффекте не прекращается репликация вируса, ибо, как показали накопленный опыт и проведенные целенаправленные исследования, вирус сохраняется в лимфатических узлах. Эффект от терапии сравнительно не продолжителен. Даже при самом оптимальном варианте больной должен настроится на лечение в течение 20-30 лет. Многие вопросы еще надо решать, прежде чем будет достигнуто восстановление иммунитета у больного ВИЧ-инфекцией. Как полагает J. Laurence (1998), в лижайшем будующем будут внедрены новые эффективные препараты - цитокины. В перспективе выращивание новой ткани тимуса или трансформирование функции существующейлимфоидной тканив кишечнике и лимфатических узлах, чтобы помочь формированию Т-клеток. Сегодня идет интенсивный поиск новых препаратов с антиретровирусным эффектом. так, установлено. что сине-зеленые водоросли Nostoc ellipsosporum содержат белок циановирин-N, который может стать основой нового поколения лекарств против ВИЧ-инфекции. Лабораторные исследования показали, что этот протеин не только подавляет активность различных штаммов вируса иммунодефицита, но также препятствует его проникновению в клетки иммунной системы. Экспериментальные данные позволяют надеяться, что циановирин-N удастся использовать для изготовления фильтров, освобождающих кровь от возбудителя СПИДа. (Бойд М., 2000) Активная антиретровирусная терапия не полностью восстанавливает иммунную систему. Через 8 недель лечения клеточный иммунный ответ на некоторые, но не на все антигены восстанавливается, однако, совсем не восстанавливается иммунный ответ на ВИЧ. Это диктует необходимость внедрения принципиально новых методов терапии, направленной на усиление клеточно-опосредованного иммунитета. В частности проводятся исследования по иммунотерапии. Для этих целей предложен ремун - лишенная gp120 инактивированная вакцина из цельного вируса. У больных ВИЧ-инфекцией с CD4 > 350 в 1 мкл, лечившихся активной антиретровирусной терапией, а затем ВИЧ-иммуногеном значительно растет in vitro Т-хелперный ответ на вакцинный антиген, рекомбинантный р24 и цельную вирусную ВИЧ другого типа. Активная антиретровирусная терапия требует не только значительных финансовых расходов, но определенный настрой больного, полное подчинение его жизни лечению, строгое соблюдение по часам режима приема лекарств без пропусков,пищевого и водного режима, полное исключение алкоголя и наркотиков. Поэтому врач лишь рекомендует больному активную антиретровирусную терапию, принимает окончательное решение сам больной, оценивая свои волевые качества. По данным американских специалистов около половины больных ВИЧ-инфекцией, находившихся на активной антиретровирусной терапии не смогли полностью реализовать схему лечения в течение одного года из-за ее сложности и огромного количества таблеток. Поэтому идут интенсивные поиски схем леченияс уменьшением числа приемов лекарственных средств. Так, созданкомбивир, содержащий половинную суточной дозы АЗТ и эпивира в одной таблетке (в России зарегистрирован в 1999 году). Активная антиретровирусная терапия противопоказана больным алкоголизмом, наркоманией, лицам с клиникой энцефалопатии, т.е. всем тем, кто не в состоянии контролировать свое поведение. Терапия больных в бессимптомной фазе ВИЧ-инфекцией. Если вопрос о необходимости антиретровирусной терапии больных с клиническими проявлениями ВИЧ-инфекции дискуссий не вызывает и все решают финансовые возможности государства и больного человека, то лечебная тактика больных в бессимптомной фазе более сложен. Принято считать, что даже при отсутствии клинических проявлений ВИЧ-инфекции (в отличии от большинства других инфекционных заболеваний по внешнему виду больного ВИЧ-инфекцией нельзя определить состояние болезни) любому больному с содержанием клеток CD4+ <500/мм3 или содержанием в плазме копий РНК ВИЧ более 10 000 (при определении методом гибридизации с использовании разветвленных зондов - bДНК) или 20.000 (с помощью ОТ-ПЦР) в 1 мл должно быть предложено лечение антиретровирусными препаратами. Обоснованием этому является то обстоятельство, что четко прослеживается взаимосвязь между вирусной нагрузкой, количеством клеток CD4 + и скоростью прогрессирования ВИЧ-инфекции в СПИД (табл. 8). Таблица 8
На сегодня имеется два основных подхода к началу терапии у бессимптомных больных ВИЧ-инфекцией. Одни клиницисты, полагая, чтоВИЧ-инфекциявсегда носит прогрессирующий характер, придерживаются более агрессивного подхода с назначением лечения. Другие придерживаются более сдержанного подхода, лечение не назначают сразу, полагая, что больной нуждается в наблюдении врача, но лечение может быть назначено позднее. В этом плане интересна смена позиций одного из крупнейших специалистов по лечению больных, С.Велла(Италия): в 1998 году на наш вопрос, когда начинать активную антиретровирусную терапию, он ответил: “если бы мне поставили диагноз сейчас, то я сразу начал лечиться”, а через 2 года, в 200 году вопрос ему был повторен и ссылаясь на накопленный опыт, он уже считал, что с ранней терапией спешить не следует, необходимо наблюдать и контролировать уровень вирусной нагрузки и содержание CD4+ клеток. Сторонники агрессивного подхода обосновывают свое мнение на том, чтолечение должно начинаться до развития значительной иммуносупрессии, а целью лечения должно быть достижения неопределяемого уровня виремии. По их мнению всем больнымс числом клеток CD4+ <500/мм3 должна назначаться антиретровирусная терапия, так же как и больным с более высокими числами клеток CD4+, у которых вирусная нагрузка в плазме составляет более 10.000 (bДНК) или 20.000 (ОТ-ПЦР) в 1 мл. Сторонники более консервативного подхода к началу терапии у бессимптомных больных полагают, чтолечение не следует назначать лицам с содержанием клеток CD4+ <500/мм3 и низким уровнем виремии, у которых риск быстрого прогрессирования заболевания невелик, необходим лишь мониторинг лабораторных показателейза исключением тех, кто имеет значительный риск быстрого прогрессирования заболевания из-за высокой вирусной нагрузки. Если принято решение о необходимости терапии, у лиц, не получавшему раньше антиретровирусные препараты, должен быть назначен режим терапии, который может помочь достичь значительное снижение содержания РНК ВИЧ в плазме крови, значительное повышение числа клеток CD4+ замедление прогрессирования заболевания до стадии СПИДа и смерти. В 1999 году A.S.Fauchi с соавт. разработали схему приема антиретровирусных препаратов для больных ВИЧ-инфекцией. Схема (табл. 9 ) включает один выбор из колонки А и один из колонки В (препараты в колонках расположены не в порядке приоритетности):В качестве альтернативной терапии рекомендуется авторами схема приема комбинации: абакавир+АЗТ+эпивир. Не рекомендуется назначать больным варианты: любая монотерапия АЗТ+ставудин -зальцитабин+диданозин зальцитабин+ставудин -зальцитабин+эпивир. Таблица 9
Перед началом активной антиретровирусной терапии проводится полное клинико-лабораторное обследование больного, в том числе уровень вирусной нагрузки на плазму и количество CD4+ Т-лимфоцитов. Таким образом, согласно накопленному опыту, если нет клинических симптомов болезни, а количество CD4+ клеток > 500 в мкл, вирусная нагрузка на плазму менее 10 000 в bДНК или 20 000 в ОТ-ПЦР (полимеразная цепная реакция), то, по мнению одних клиницистов, от проводимой терапии надо воздержаться, по мнению других- приступить к лечению немедленно, пока иммунная система не подавлена или подавлена умеренно. В случае, если клинических проявлений болезни нет, но уровень CD4+ клеток < 500 в мкл (в последнее время все больше клиницисты склоняются к мысли, что рубежом служить показатель CD4 < 350 клеток/мм3 ) или вирусная нагрузка на плазму выше 10 000 в bДНК или ОТ-ПЦР, необходимо серьезно думать о начале активной антиретровирусной терапии. В случае наличия клиники ВИЧ-инфекции необходимо приступить к терапии без учета количества CD4+ клеток и уровня вирусной нагрузки на плазму. Существенным тормозом к широкому применению “тритерапии” ВИЧ-инфекции относится ее дороговизна – около 1000 долл. США в месяц на 1 больного, 12 тыс. долларов в год. В 1996 году на СПИД в США тратилось менее 1% всех расходов на здравоохранение: 6,7 млад. долларов или около 20 000 на одного больного в год. На конец 1998 года получали активную антиретровирусную терапию 385 000 американцев, не лечились только больные ВИЧ-инфекцией с бессимптомным течением и те, у кого имелась ранняя стадия болезни. В 1 квартале 1998 года 80% больных получали по крайней мере 1 ингибитор протеазы или ненуклеозидные ингибиторы обратной транскриптазы, 70% получали тритерапию. Лечение больных в фазе острой сероконверсии. Необходимость лечения больных в фазе синдрома острой сероконверсии (СОС) продиктована теми обстоятельствами, что нужно активное влияние на прогрессирование болезни, уменьшить вирусную диссеминацию, остановить процесс на новом устойчивом состоянии. В этом периоде болезни уровень вирусной репликации очень высок, но вирусная популяция наиболее гомогенна, а иммунная система остается относительно интактной. Вместе с тем,многие больные в этот период не попадают еще в поле зрения врача, поэтому опыт лечения больных не велик. В. Tindall. et al. (1991) провели лечение зидовудином (1,0 в день) в течение 56 дней 14 больных в стадии СОС и сравнили с показателями динамики CD4+ лимфоцитов и временем перехода в СПИД 28 больных этой же стадии, но не получивших антиретровирусную терапию. В группе леченных зидовудином у 1 из 14 за 12 мес. развился СПИД, а в группе не получивших лечение – у 7 из 28 больных. Не так выражено за период наблюдения и было падение СD4+ клеток у получавших зидовудин больных. S. Kinloch-de Loss et al.(1995,1997) двойным слепым методом изучили эффективность зидовудина при 6-месячной терапии в дозе 250 мг 39 больных в стадии клинический выраженного СОС и сравнили с динамикой болезни у 38 больных этой же стадии, но не получивших терапии. В группе получавших зидовудин были более высокие показатели CD4+, снижение вирусной нагрузки на плазму наблюдалось в обеих группах, но в группе получавших антиретровирусную терапию оно более выражно, хотя и без статистической значимости различий в группах. В последующие 15 мес. в значительно меньшей степени наблюдалось наслоение таких суперинфекций как оральный кандидоз, опоясывающий герпес, оральная волосатая лейкоплакия среди лиц, получивших лечение зидовудином. Но дальнейшие наблюдения в сроки до 28 мес. показали исчезновение разницы между группами, что дало авторам основание высказать мнение о необходимости проведения более массивной антиретровирусной терапии. L. Perrin et al. (1996) изучили влияние 6-месячной терапии зидовудином и невирапином на вирусемию, уровень провирусной ДНК, содержание CD4+ и CD8+ клеток с последующим наблюдением в течение 1,5 лет. Правда, в стадии СОС было всего 4 больных, но у 2 из них в результате лечения вирусемия исчезла (менее 200 копий/мл РНК ВИЧ) во время лечения, у 3 из 4 больных содержание CD4+ и CD8+ клеток находилось в пределах нормы в период лечения. A.Lafeullade et al. (1997) применили в сочетании зидовудин, диданозин и ламивудин у 10 больных в фазе острой сероконверсии, лечение начали через 5-28 дней после появления первых клинических проявлений болезни. При этом выявлено снижение РНК ВИЧ в плазме до уровня ниже 200 копий/мл у всех больных в среднем через 108±32 дня. У больных, лечение у которых началось до 15 дня от момента появления клиники, РКН ВИЧ в плазме нельзя было выявить к 54±18 дню против 162±55 дней у тех, лечение у которых начиналось позже. Терапия 3 препаратами приводила также к значительному повышению средних значений соотношения CD4/CD8 через 2 мес. терапии за счет повышения уровня CD4+ и снижения CD8+ клеток. В отличие от более ранних наблюдений авторов, когда терапия проводилась одним или двумя препаратами, терапия тремя антиретровирусными препаратами было значительно эффективней. К такому же выводу пришел F. Hecht et al. (1998), лечившие 13 больных нельфинавиром, зидовудином и ламивудином. В литературе описан случай, когда больному в фазе острой сероконверсии с яркими клиническими проявлениями было начало лечение зидовудином в комбинации с ламивудином и ритонавиром, но спустя 6 мес. больной прервал лечение. Через 35 дней после прекращения лечения у него вновь развилась клиника синдрома острой сероконверсии, в частности появились лихорадка, фарингит, сыпь, лейкопения, тромбоцитопения, уровень РНК ВИЧ повысился до 1 800 000 копий/мл. Наблюдение демонстрирует эффективность активной антиретровирусной терапии в подавлении клинических проявлений у больного в фазе острой сероконверсии. Активная антиретровирусная терапия и восстановление функции иммунной системы. Сегодня идет изучение пределов, до которых возможно восстановление поврежденной ВИЧ иммунной системы, хотя понятно, что полного восстановления у большинства больных, если не у всех, достичь невозможно, тем более в условиях хронической вирусной инфекции, обусловленной ВИЧ. Первичный дефицит иммунной системы при ВИЧ-инфекции проявляется снижением уровня CD4+ клеток, на фоне которого идет угнетение ГЗТ, уменьшение пролиферативного ответа, уменьшение продукции цитокинов, таких какИЛ-2, ИФН-γ, ИЛ-12. Неконтролируемая вирусная репликация реализуется хроническим активным состоянием иммунной системы. Снижение общего числа CD4+ клеток идет в том числе и за счет падения содержания клеток памяти. Первичное увеличение CD8+ клеток, главным образом CD38+ и HLA-DR+ клеток наблюдается на очень ранних этапах болезни, но с течением времени в конечномсчете происходит уменьшение клеток памяти CD8, как и пула в целом. Со времени широкого применения активной антиретровирусной терапии значительно уменьшилось у больных ВИЧ-инфекцией развитие суперинфекции и снизилась смертность, что является объективным показателем улучшения функции иммунной системы. У больных под влиянием терапии снижение вирусной нагрузки на плазму идет параллельно увеличению числа СD4+ клеток. Первоначальная быстрая фаза повышения в первые 4-12 недель CD8+ клеток, как оказалось, связана с перераспределением существующих CD4+ и CD8+ клеток. Быстрое увеличение фенотипа клеток памяти (CD45RO+) сопровождается более медленным, но более устойчивым увеличением общего фенотипа (CD45RA+, CD62L+). В целом характер изменения CD4+ и CD8+ клеток в динамике леченияотражен в табл. 10. Таблица 10
Улучшение функции Т-клеток хотя и наблюдается в динамике лечения, но нет полного восстановления их функций. Улучшение ГЗТ на некоторые антигены наступает примерно через 12 недель после терапии и может быть связано с увеличением клеток памяти CD4. Усиление лимфопролиферативного ответа нанекоторые антигены (цитомегаловирусы, Candida, микобактерии туберкулеза) также наблюдаются в течение первых 24-48 недель лечения, но не на все антигены. Никакого значительного усиления лимфопролиферативного ответа на ВИЧ-антигены не наблюдается даже через 2 года эффективной антиретровирусной терапии. ИсследованияWalker et al. (1996) показали, что ВИЧ-специфический Т-хелперный ответ, как определено с помощью лимфопролиферативного ответа на некоторые антигены ВИЧ, теряется почти немедленно после острой фазы ВИЧ-инфекции (сохраняется лишь у больных с вариантами длительного непрогрессирующего течения). Лечение в острой фазе болезни восстанавливает ВИЧ-специфический Т-хелперный ответ.Эти результаты поддерживают мнение о важности ВИЧ-специфического Т-хелперного иммунного ответа в поддержании вирусной супрессии и нормализации иммунного ответа на вирус. Исследованияпо изучению утраты Т-клеточных рецепторов у больных различными формами ВИЧ-инфекции дали возможность понять, почему развивается суперинфекция. Было показано, что хотя активная терапия способна резко уменьшить вирусную нагрузку на плазму и увеличить количество CD4+ клеток, уменьшить возникновение суперинфекции, но у больных, особенно с уже прогрессирующей ВИЧ-инфекцией на момент начала противовирусной терапии, сохраняется суперинфекция. Поэтому встал вопрос о качестве иммунного восстановления после терапии. Исследования показывают, что некоторые субпопуляции Т-клеток, потерянные во время ВИЧ-инфекции, могут не восстанавливаться после противовирусной терапии, оставляя таким образом дефект в Т-клеточном опосредованном иммунитете больных (Laurence J., 1998). Критическим аспектом иммунного восстановления является скорость восстановленияпростых субпопуляций клеток и клеток памяти, относящихся какк CD8+, так и CD4+Т-клеткам. CD45RA+ клетки являются медленно пролиферирующими, они распознают новый антиген и организуютряд других иммунных клеток, включая киллерные CD8+ Т-клетки и В-клетки, осуществляющие защиту от инфекций. После выздоровления от обычной инфекцииCD4+ Т-клетки памяти(CD45RO+) продолжаютциркулироватьи быстро пролиферируют при повторномконтакте с тем же антигеном. Принципиальным различиеммежду простыми (naive) клетками и клетками памятисубпопуляции CD4+ Т-клеток являетсявысокая зависимость простых клеток от тимуса, в то время какактивность клеток памяти носит периферический характер и не зависит от тимуса. Согласно существующей к настоящему времени информации, восстановление CD4+ Т-клеток после интенсивной антиретровирусной терапии не является следствием дополнительного избыткапродукции клеток после того, как падение уровняВИЧ-опосредованным киллингом клеток он был восстановлен, а, скорее, является следствием усиленной продукции Т-клеток, увеличенной миграциейТ-клеток из тканей в кровь и изменения путей миграции Т-клеток. J.A.Levy et al. (1996) сообщили данные о количестве CD4+ Т-клеток у врачей, которые получали зидовудин профилактически после нечаянно укола иглой. Проводился многократный подсчетCD4+ клеток и серологическое обследование на ВИЧ в течение нескольких месяцев, все они остались серонегативны, но количество CD4+клеток у них тем не менее удвоилось или утроилось. Наиболее вероятное объяснение этому – действие зидовудина. M. Connors et al. (1997) изучил динамику восстановления CD4+ Т-клеток у 39 больных ВИЧ-инфекцией, находившихся на лечении зидовудином или зидовудином+α-интерфероном, что сейчас расценивается какстандарт минимального лечения. Установлено, что больные с более низким количеством Т-клеток имели сравнительно более низкую пропорцию простых CD4+ Т-клеток, тогда какбольные с более высоким количествомТ-клетокимели относительноболее высокую пропорцию простых Т-клеток. Такимобразом, достигнуты отчетливые положительные эффекты у больных ВИЧ-инфекцией с момента внедрения активной антиретровирусной терапии, которая позволяет снизить уровень вирусной нагрузки на плазму до неопределяемого уровня, повысить уровень CD4+ клеток в крови, предотвратить присоединение суперинфекции, а в целом перевести заболевание в хроническое течение. Вместе с тем, добиться положительного эффекта удается только у 70-80% больных (при терапии различных бактериальных заболеваний антибиотиками положительный эффект достигается в 99%).Терапия требует высокой дисциплины от больного, это тяжелая нагрузка на больного. Она весьма дорога, лишь 10-15% больных живут в странах, где экономика позволяет широко внедрить этот вид терапии. В России ею государство обеспечивает лишь детей. Даже при положительном эффекте не прекращается репликация вируса. Эффект от терапии сравнительно не продолжителен. Даже при самом оптимальном варианте больной должен настроится на лечение в течение 20-30 лет. Минимальная антиретровирусная терапия Рекомендуемая СDС (1997) активная антиретровирусная терапия, включающая комплекс ингибиторов обратной транскриптазы и протеазы ("тритерапия") в силу высокой стоимости не может быть широко применена в странах с низким экономическим уровнем жизни. По оценкам специалистов лишь 10-15% нуждающихся в терапии больных живут в экономически развитых странах, из всех больных, кому показана высокоактивная антиретровирусная терапия в силу экономических проблем ее могут получить только 5%. В России бесплатной антиретровирусной терапией, включающей ингибиторы протеазы обеспечиваются в основном дети. Поэтому мы разработали принцип минимальной антиретровирусной терапии, обеспечивающий противовирусный, иммуномодулирующий и противоопухолевый эффект, а также оказывающей влияние на определенные звенья патогенеза ВИЧ-инфекции и повышающей неспецифические факторы защиты. Терапия включает: 1) азидотимидин, 2) индуктор эндогенного интерферона,низкомолекулярное производное акредона - циклоферон (фирма "Полисан", Санкт-Петербург), 3) системнуюэнзимотерапию вобэнзимом (МУКОС Фирма, Германия), 4) заместительная терапия дефицита комплемента - введение нативной плазмы доноров). Показана эффективность комплексного лечения больных ВИЧ-инфекцией, у больных, уровень CD4+ клеток у которых не ниже 200 в мкл, хорошая переносимость терапии, отсутствие побочных действий, ни у одного из больных не потребовалась отмена.Наряду с улучшением самочувствия больных, повышением уровня CD4+ клеток установлено повышение функциональнойактивности нейтрофилов, повышение показателей активности классического пути комплемента при одновременном снижении альтернативного, уменьшение уровня циркулирующих иммунных комплексов. Терапия также предупреждала развитие оппортунистической инфекции в первую очередь герпесвирусной группы. Стоимость терапии одного больного в год составила 800-950 долларов США в год против 12-35 тысяч долларов при использовании классического варианта "тритерапии". Активная антиретровирусная терапия и суперинфекций ВИЧ/СПИД. Со времени широкого применения активной антиретровирусной терапии значительно уменьшилось у больных ВИЧ-инфекцией развитие суперинфекции и снизилась смертность, что является объективным показателем улучшения функции иммунной системы. У больных под влиянием терапии снижение вирусной нагрузки на плазму идет параллельно увеличению числа СD4+ клеток. Первоначальная быстрая фаза повышения в первые 4-12 недель CD8+ клеток, как оказалось, связана с перераспределением существующих CD4+ и CD8+ клеток. Быстрое увеличение фенотипа клеток памяти сопровождается более медленным, но более устойчивым увеличением общего фенотипа. В целом характер изменения CD4+ и CD8+ клеток в динамике лечениядемонстрирует табл. 11. Таблица 11
Улучшение функции Т-клеток хотя и наблюдается в динамике лечения, но нет полного восстановления их функций. Улучшение ГЗТ на некоторые антигены наступает примерно через 12 недель после терапии и может быть связано с увеличением клеток памяти. Усиление лимфопролиферативного ответа нанекоторые антигены (цитомегаловирусы, Candida, микобактерии туберкулеза) также наблюдаются в течение первых 24-48 недель лечения, но не на все антигены. Никакого значительного усиления лимфопролиферативного ответа на ВИЧ-антигены не наблюдается даже через 2 года эффективной антиретровирусной терапии. ИсследованияWalker et al. (1996) показали, что ВИЧ-специфический Т-хелперный ответ, как определено с помощью лимфопролиферативного ответа на некоторые антигены ВИЧ, теряется почти немедленно после острой фазы ВИЧ-инфекции (сохраняется лишь у больных с вариантами длительного непрогрессирующего течения). Лечение в острой фазе болезни восстанавливает ВИЧ-специфический Т-хелперный ответ.Эти результаты поддерживают мнение о важности ВИЧ-специфического Т-хелперного иммунного ответа в поддержании вирусной супрессии и нормализации иммунного ответа на вирус. Исследованияпо изучению утраты Т-клеточных рецепторов у больных различными формами ВИЧ-инфекции дали возможность понять, почему развивается суперинфекция. Было показано, что хотя активная терапия способна резко уменьшить вирусную нагрузку на плазму и увеличить количество CD4+ клеток, уменьшить возникновение суперинфекции, но у больных, особенно с уже прогрессирующей ВИЧ-инфекцией на момент начала противовирусной терапии, сохраняется суперинфекция. Поэтому встал вопрос о качестве иммунного восстановления после терапии. Исследования показывают, что некоторые субпопуляции Т-клеток, потерянные во время ВИЧ-инфекции, могут не восстанавливаться после противовирусной терапии, оставляя таким образом дефект в Т-клеточном опосредованном иммунитете больных (Laurence J., 1998). Согласно существующей к настоящему времени информации, восстановление CD4+ Т-клеток после интенсивной антиретровирусной терапии не является следствием дополнительного избыткапродукции клеток после того, как падение уровняВИЧ-опосредованным киллингом клеток он был восстановлен, а, скорее, является следствием усиленной продукции Т-клеток, увеличенной миграциейТ-клеток из тканей в кровь и изменения путей миграции Т-клеток. J.A.Levy et al. (1996) сообщили данные о количестве CD4+ Т-клеток у врачей, которые получали зидовудин профилактически после нечаянно укола иглой. Проводился многократный подсчетCD4+ клеток и серологическое обследование на ВИЧ в течение нескольких месяцев, все они остались серонегативны, но количество CD4+клеток у них тем не менее удвоилось или утроилось. Наиболее вероятное объяснение этому – действие зидовудина. Накопленный клиницистами опыт показал , что активная антиретровирусная терапия, является одновременно как методом профилактики суперинфекций. В экономически развитых странах, особенно США и Канаде с 1994 года отмечается снижение суперинфекций и смертности среди наиболее иммуномсупрессированных больных ВИЧ-инфекцией. Прежде всего это касается пневмоцистной пневмонии, комплекса микобактериозов (МАС), цитомегаловирусной инфекции, бактериальной пневмонии, токсоплазмоза, криптококкоза и других инфекций. Значительно снизилась заболеваемость саркомой Капоши, отчасти – неходжкинской лимфомойи др.Это в первую очередь связано с внедрением комбинированной терапии антиретровирусными препаратами, ингибиторов протеаз. Активная терапия приводит к снижению вирусной нагрузки на плазму у значительной части больных с повышением уровня CD4+ клеток. Клинические исследования показали, что у 80-90% больных, получавших ингибиторы протеазы, на 6-12 мес. до границы чувствительности метода. В клинике Д. Гопкинса показано, что в 1996-97 г.г. применение комбинированной терапии с включением ингибиторов протеазы снижает на 61% риск развития оппортунистической инфекции. Многочисленные исследования показали, что ВИЧ четко влияет на клинические проявления суперинфекций, которые в свою очередь сказываются на репликации ВИЧ и ускоряют прогрессирование болезни. Установлено, что суперинфекция: активируютлатентно протекающуюинфекцию в СD4+ Т-клетках, повышая репликацию ВИЧ; активирует не инфицированные CD4+ Т-клетки, что ведет к повышению к повышению восприимчивости этих клеток к ВИЧ; повышает уровень провоспалительныхцитокинов, включая ФНО, ИЛ-6, ведущих к увеличению репликации ВИЧ; активирует тканевые макрофаги, инфицированные ВИЧ, что усиливает репликацию ВИЧ; эффективное лечение суперинфекции сопровождается снижением уровня плазменной РНК ВИЧ, но не до уровня, предшествовавшего наслоению суперинфекции. Следовательно, предупреждение суперинфекции у больных ВИЧ/СПИД может изменить естественное течение болезни. Но встает вопрос, какие тесты могут быть показателями начала профилактического лечения у больных, получающих активную комбинированную антиретровирусную терапию. Большинство авторов рекомендует базироваться на уровне CD4+ Т-лимфоцитов, при этом не обращать внимание напоследующее изменение уровня CD4+ клеток, продолжать терапию, направленную на профилактику суперинфекций. У больных, получающих активную антиретровирусную терапию может не наблюдаться связи между вирусологическими и иммунологическими показателями, может быть повышение уровня CD4+ клеток даже при если сохраняется высокая вирусная нагрузка на плазму. Даже у больных, получивших активную антиретровирусную терапию с отсутствием эффекта на вирусную нагрузку на плазму выявлен защитный эффект против условнопатогенных возбудителей. Возможно, что мутантный вариант ВИЧ, реплицирующегося в присутствии 3-4 мощных антиретровирусных препаратов, может быть менее патогенным и, таким образом, менее способным вызывать деструкцию CD4+ Т-клеток. Однако сомнительна прочность, продолжительность положительного эффекта CD4+ клеток в присутствии выраженной вирусной нагрузки на плазму. Сложным остается вопрос, когда отменить первичную или вторичную профилактическую терапию суперинфекций. Отсутствуют четкие клинические показатели, по которым можно было бы ориентироваться для прекращения профилактической терапии. Вместе с тем все больше накапливается данных, что у лиц, у которых повышение уровня CD4+ Т-клеток превышает показатели профилактического значения, не нуждаются в дальнейшем продолжении лечения. Прекращение первичной лекарственной профилактики может быть обоснованным для больных, у которых число CD4+ Т-клеток после терапии находится стабильно на 50% выше, чем порог для начала профилактики и держится на таком уровне по крайней мере 3 месяца. Вирусная нагрузка при этом может сохраниться на выявляемых ПЦР уровнях. Прекращение поддерживающей терапии несет с собой большой риск, если в организме больного имеется не диагностированная суперинфекция. Сегодня можно с уверенностью сказать. что активная антиретровирусная терапия -наиболее эффективный метод профилактики суперинфекций. Среди больных, у которых под влиянием лечения повышается уровень CD4+ Т-клеток, риск развития суперинфекций мал. В ходе лечения больных должны учитываться показатели и вирусной нагрузки на плазму и число CD4+ клеток. Внедрение активной антиретровирусной терапии существенно повлияло на развитие известных форм суперинфекций. Но вместе с тем эта терапия высветила новые проблемы, возникающие в первые 1-2 мес. лечения. Так, у больных стали регистрироваться локализованные формы микобактериальной инфекции (Chaisson R.E., 1998). Изменение комбинации активной антиретровирусной терапии. В ходе лечения больного ВИЧ/СПИД возникают ситуации, требующие решать вопрос об изменения схемы лечения больного, смены лекарственных препаратов. Критериями для изменения антиретровирусной терапии являются снижение вирусной нагрузки на плазму менее 0,5-0,75 log к 4 неделе или менее 1,0 log к 8 неделе от начала терапии отсутствие снижения вирусной нагрузки на плазму до неопределяемого уровня в течение 4-6 мес. снижающееся количество CD4+ клеток клиническое ухудшение Минимальным значимым изменением виремии считается 3-кратное или 0,5 log10 увеличение или уменьшение. Значительное снижение числа клеток CD4+ – это уменьшение абсолютного числа клеток более чем на 30% от исходного уровня и уменьшение процентного содержания клеток более чем на 3% от исходного уровня. Тактика изменения состава препаратов зависит от показаний к смене режима лечения. Так, если получен положительный эффект лечения в отношении антиретровирусного эффекта, но у больного развилась непереносимость или токсические эффекты, следует заменить препарат, который вызвал побочное действие, и предпочтение следует отдавать препаратам этого же класса, но с другим уровнем токсичности или профилем переносимости. Если же достигнут антиретровирусный эффект, но больной получает лечение по схеме, не отвечающей рекомендуемым стандартам, в частности находится на моно- или дитерапии, то можно выбора два. Первый -продолжить лечение, проводя мониторинг вирусной нагрузки и уровня CD4+ леток, или добавить к схеме лечения препараты таким образом, чтобы новый режим соответствовал рекомендуемым стандартам. Второй – перейти на стандартную схему лечения, так как следует учитывать, что режимы терапии, не включенные в категорию "настоятельно рекомендуемых", в конце концов приводят к неэффективности лечения, а, следовательно, предпочтительным является последний подход, то есть модификация режима. Более сложна задача смены терапииу больных, у которых оказались неэффективными режимы лечения из категории "настоятельно рекомендуемых". Тем не менее правило здесь одно – смена всего комплекса лекарственных препаратов новыми. При этом надо иметь в виду, что из-за большой скорости возникновения мутаций ВИЧ на фоне терапии часто возникают штаммы, имеющие резистентность к одному или более препаратов, особенно если не удавалось достичь максимальной супрессии вируса. Возможность развития широкой перекрестной резистентности между препаратами одного класса осложняет задачу смены лекарственных средств. Вирусные штаммы, у которых развивается резистентность к одному ингибитору протеазыили ненуклеозидному ингибитору обратной транскриптазы, часто имеют пониженную чувствительность к большинству или всем другим препаратов этих групп. В случаях возникновении лекарственных взаимодействий при использовании комбинации ингибиторов протеазы или ингибиторов протеазы в сочетании с ненуклеозидными ингибиторами обратной транскриптазы, может потребоваться модификации доз препаратов. У некоторых больных варианты лечения могут быть ограничены в связи с назначением антиретровирусных препаратов в прошлом, токсичности или непереносимости. Важной проблемой является необходимость временной отмены антиретровирусной терапии, например, при непереносимых побочных эффектах, лекарственных взаимодействиях, первый триместр беременности, а нередко и в связи с тем, что больной принимает решение об отмене терапии из-за финансовой невозможности приобретения лекарственных средств. Хотя отсутствует полное представление о том, какой промежуток дней, недель или месяцев допустим для отмены одного или более лекарств, составляющих схему лечения, в мире идет направленное изучение прерывистых циклов терапии, как запланированной схемы лечения. При этом первостепенное значение имеет риск формирования резистентности к препаратам за время отмены лечения.. У больных, которым приходится вынужденно отказаться от дальнейшего лечения антиретровирусными препаратами по полной схеме на длительное время, теоретически более целесообразно отменить все антиретровирусные препараты одновременно, нежели продолжать лечение одним или двумя препаратами, чтобы уменьшить вероятность возникновения резистентных штаммов вируса. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||